Содержание
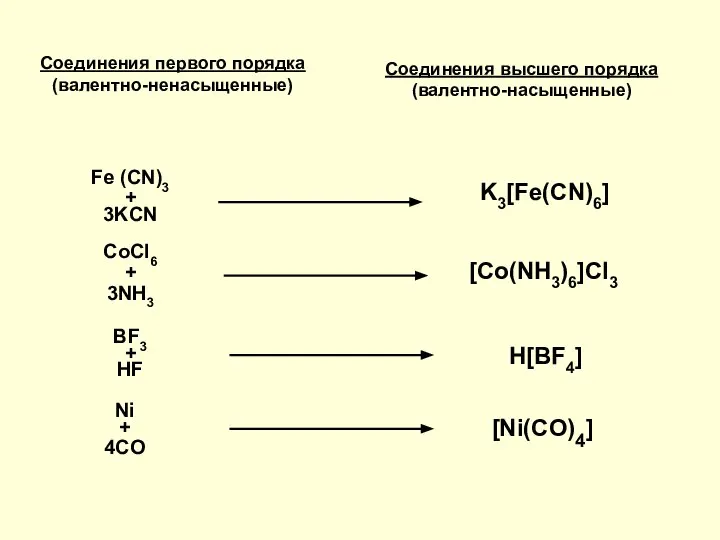
- 2. Соединения первого порядка (валентно-ненасыщенные) Соединения высшего порядка (валентно-насыщенные) Fe (CN)3 + 3KCN K3[Fe(CN)6] CoCl6 + 3NH3
- 3. Комплексные соединения – … … молекулярные соединения, не показывающие в растворе всех свойств исходных для них,
- 4. Теория А. Вернера (1893г.) Основные положения: Катионы могут проявлять не только основную валентность, но и дополнительную.
- 5. Теория А. Вернера (1893г.) Координированные ионы и молекулы называются лигандами, они образуют внутреннюю сферу координационного соединения.
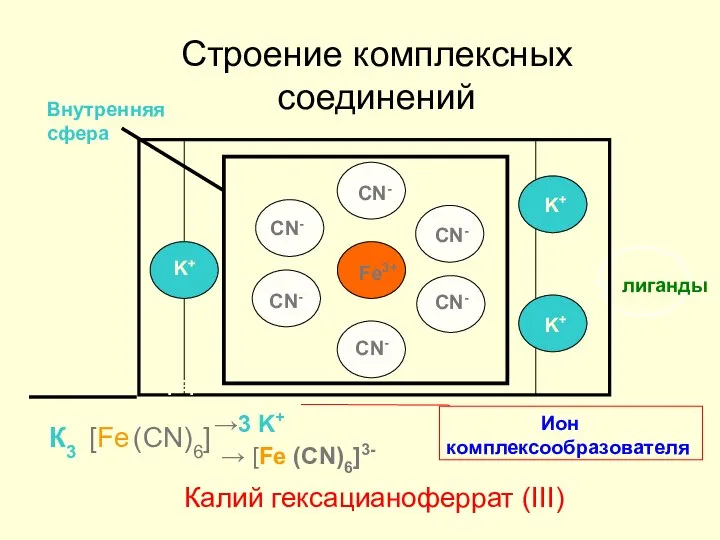
- 6. Строение комплексных соединений Калий гексацианоферрат (III) Fe3+ CN- CN- CN- CN- CN- CN- K+ K+ K+
- 7. Номенклатура комплексных соединений Первым называют анион, вторым – катион. В комплексном ионе или молекуле первым указывают
- 8. Номенклатура комплексных соединений Комплексообразователь (указывается его степень окисления римскими цифрами). В комплексном катионе названия русские, в
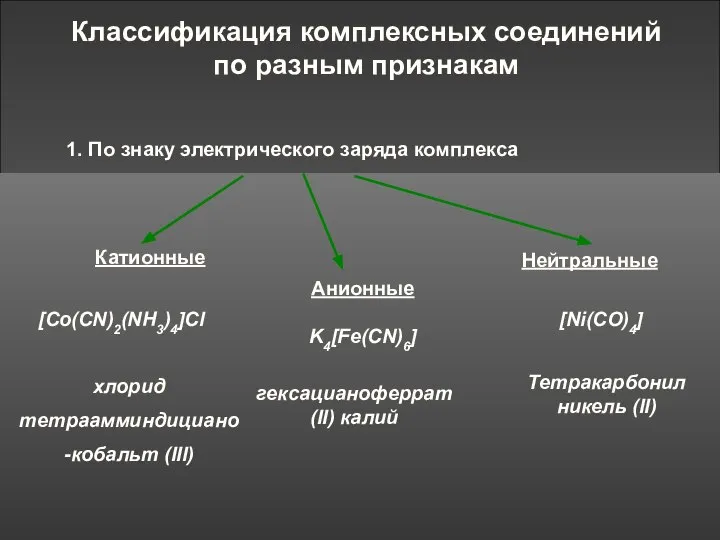
- 9. Классификация комплексных соединений по разным признакам 1. По знаку электрического заряда комплекса 2. Принадлежности к определённому
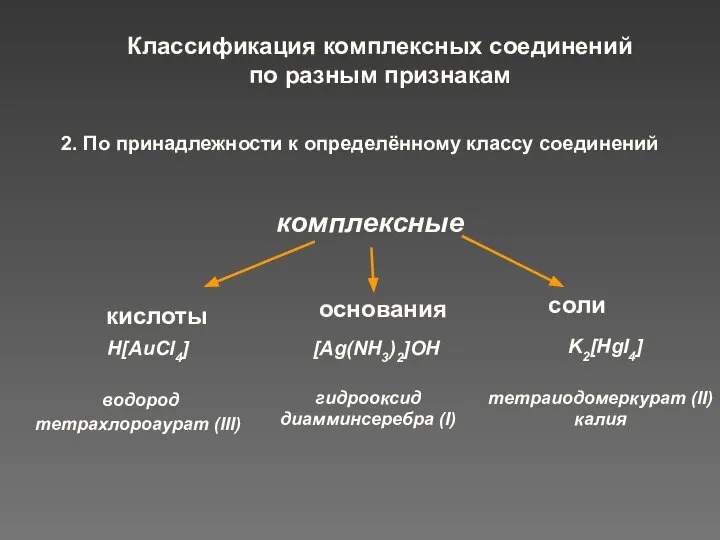
- 10. 2. По принадлежности к определённому классу соединений комплексные гидрооксид диамминсеребра (I) кислоты основания соли H[AuCl4] [Ag(NH3)2]OH
- 11. 3. По природе лигандов Аммиакаты [Ni(NH3)6]Cl2 Аквакомплексы [Co(H2O)6]SO4 Ацидокомплексы K[Cu(CN)2] Карбонилы [Fe(CO)5] Гидроксокомплексы K3[Al(OH)6 ] Цианидные
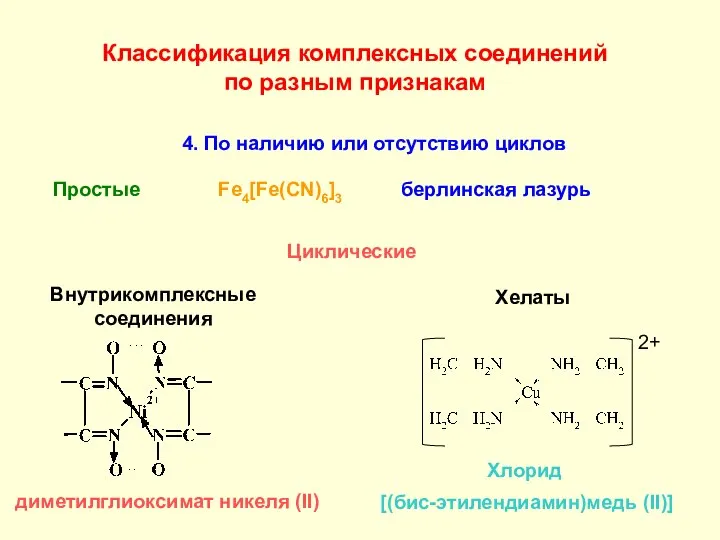
- 12. Классификация комплексных соединений по разным признакам 4. По наличию или отсутствию циклов Простые Fe4[Fe(CN)6]3 Циклические 2+
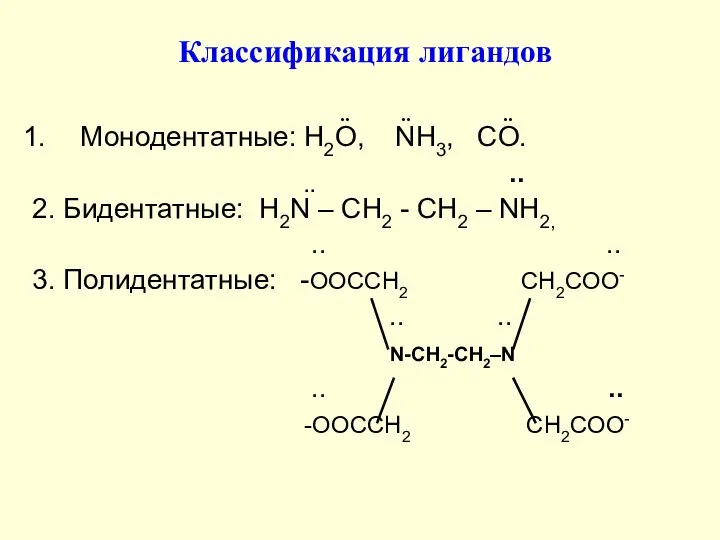
- 13. Классификация лигандов .. .. .. Монодентатные: Н2О, NH3, CO. .. .. 2. Бидентатные: H2N – CH2
- 14. Гибридизация – … … смешение и выравнивание по форме и энергии орбитали, принадлежащих разным уровням и
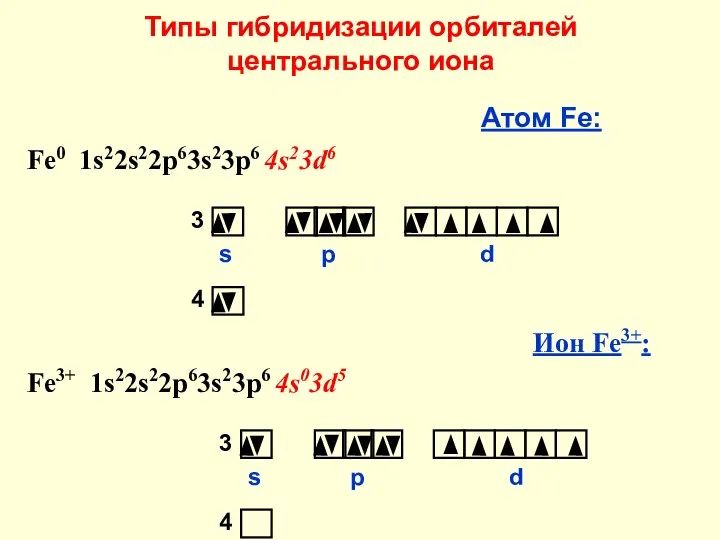
- 15. Типы гибридизации орбиталей центрального иона Атом Fe: Fe0 1s22s22p63s23p6 4s23d6 Fe3+ 1s22s22p63s23p6 4s03d5 Ион Fe3+:
- 16. Внутрисферный комплекс [FeCN6]3– С 1s22s22р2 Ион СN−: CN 2s22p5 N 1s22s22p3 s p d 3 4
- 17. Ион F−: F 1s22s22p5 [FeF6]3- Внешнесферный комплекс [FeF6]3– d2sp3
- 18. Спектрохимический ряд СO > CN– > NH3 > NO2– > H2O > OH− > F− >
- 19. [Co(H2O)6]2+ розовый [Co(CH3COO)2] ярко-розовый [Co(NO2)6]4- оранжевый [Co(NH3)6]2+ буро-розовый Усиление поля лигандов Влияние поля лигандов на окраску
- 20. K3[Fe(CN)6] 3K+ + [Fe(CN)6]3- [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- Диссоциация КС по внешней сфере (первичная диссоциация)
- 21. [Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)2]+ Ag+ + 2 NH3 Диссоциация КС по внутренней сфере (вторичная диссоциация)
- 22. Реакции комплексных соединений по внешней сфере 2K3[Fe(CN)6] + 3FeSO4 = Fe3[Fe(CN)6]2↓ + 3K2SO4 [CoCl2(NH3)4]Cl + AgNO3
- 23. Реакции комплексных соединений с разрушением комплекса 1.Образование более прочного комплекса Fe3+ + 6 SCN- = [Fe(SCN)6]3-
- 24. 3. Разбавление K[AgCl2] = KCl + AgCl↓ 5. Окислительно-восстановительные реакции 2K3[Cr(ОH)6] + 3Сl2 + 4KOH =
- 25. Комплексообразующая способность s, p, d элементов Типичные комплексообразователи – d элементы. Mn – комплексы с белками,
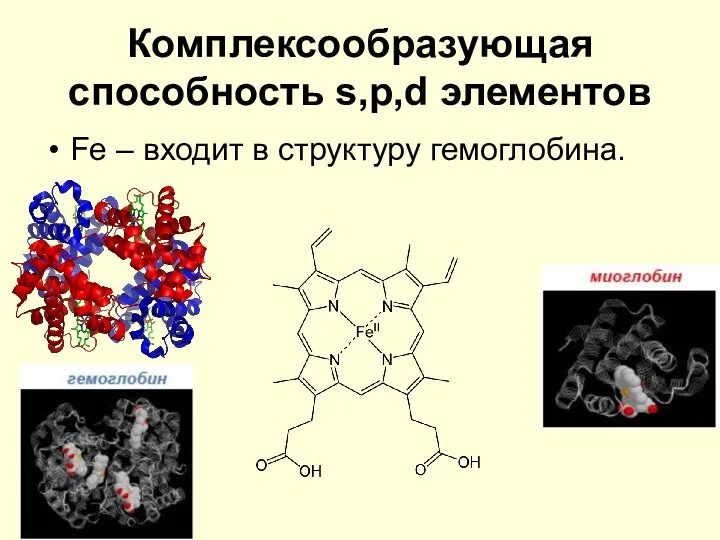
- 26. Комплексообразующая способность s,p,d элементов Fe – входит в структуру гемоглобина.
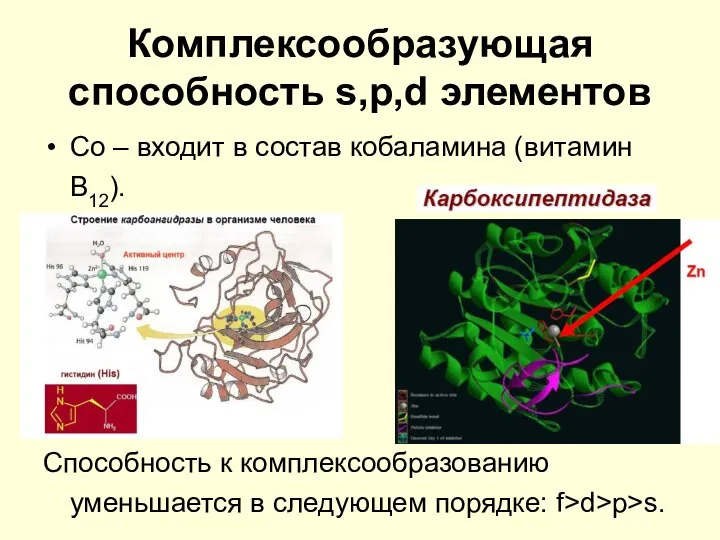
- 28. Комплексообразующая способность s,p,d элементов Со – входит в состав кобаламина (витамин В12). Способность к комплексообразованию уменьшается
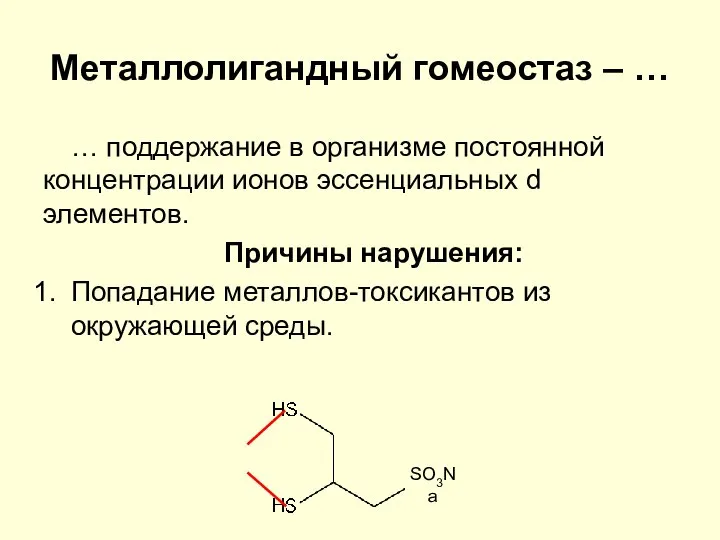
- 29. Металлолигандный гомеостаз – … … поддержание в организме постоянной концентрации ионов эссенциальных d элементов. Причины нарушения:
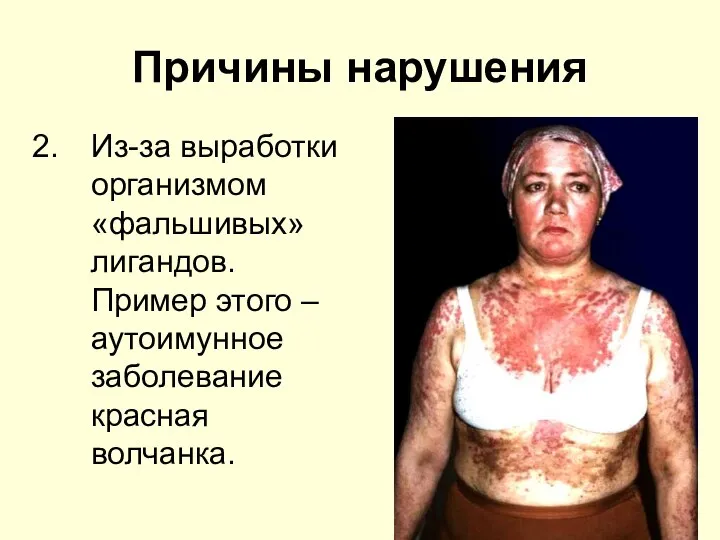
- 30. Причины нарушения Из-за выработки организмом «фальшивых» лигандов. Пример этого – аутоимунное заболевание красная волчанка.
- 31. Причины нарушения В состав чая, кофе и соевого белка входят полифенольные соединения, выполняющие роль лигандов и
- 32. Причины нарушения Высокая или низкая концентрация микроэлементов в продуктах питания. «Болезнь любителей пива».
- 33. Термодинамические принципы хелатотерапии I − биоКО, необходимый организму; Е − биоЛ, необходимый организму; Т − КО-токсикант
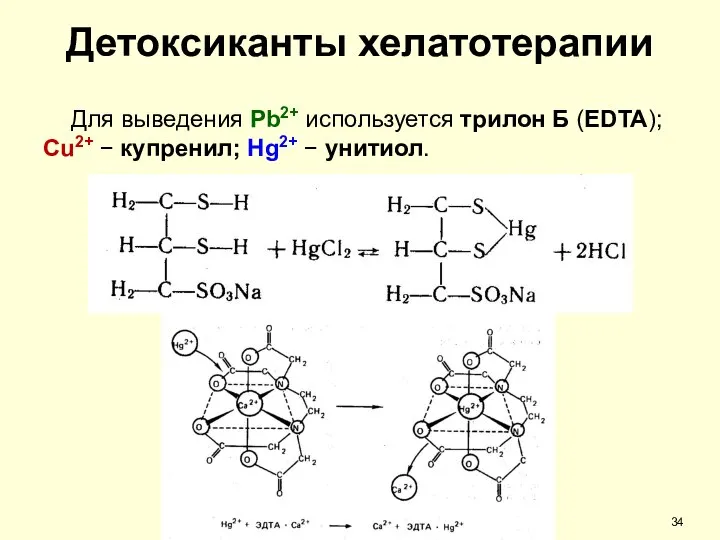
- 34. Детоксиканты хелатотерапии Для выведения Pb2+ используется трилон Б (EDTA); Cu2+ − купренил; Hg2+ − унитиол.
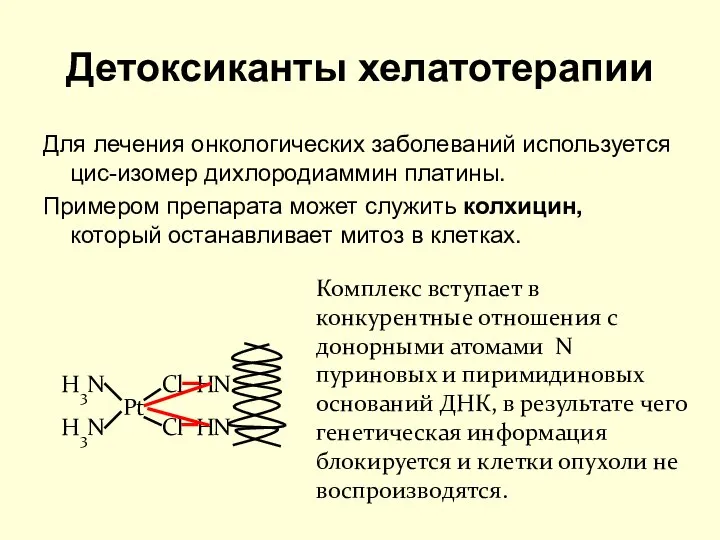
- 35. Детоксиканты хелатотерапии Для лечения онкологических заболеваний используется цис-изомер дихлородиаммин платины. Примером препарата может служить колхицин, который
- 37. Скачать презентацию





![3. По природе лигандов Аммиакаты [Ni(NH3)6]Cl2 Аквакомплексы [Co(H2O)6]SO4 Ацидокомплексы K[Cu(CN)2] Карбонилы](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1291546/slide-10.jpg)

![Внутрисферный комплекс [FeCN6]3– С 1s22s22р2 Ион СN−: CN 2s22p5 N 1s22s22p3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1291546/slide-15.jpg)
![Ион F−: F 1s22s22p5 [FeF6]3- Внешнесферный комплекс [FeF6]3– d2sp3](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1291546/slide-16.jpg)

![[Co(H2O)6]2+ розовый [Co(CH3COO)2] ярко-розовый [Co(NO2)6]4- оранжевый [Co(NH3)6]2+ буро-розовый Усиление поля лигандов](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1291546/slide-18.jpg)
![K3[Fe(CN)6] 3K+ + [Fe(CN)6]3- [Ag(NH3)2]Cl [Ag(NH3)2]+ + Cl- Диссоциация КС по внешней сфере (первичная диссоциация)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1291546/slide-19.jpg)
![[Ag(NH3)2]+ [Ag(NH3)]+ + NH3 [Ag(NH3)2]+ Ag+ + 2 NH3 Диссоциация КС](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1291546/slide-20.jpg)
![Реакции комплексных соединений по внешней сфере 2K3[Fe(CN)6] + 3FeSO4 = Fe3[Fe(CN)6]2↓](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1291546/slide-21.jpg)

![3. Разбавление K[AgCl2] = KCl + AgCl↓ 5. Окислительно-восстановительные реакции 2K3[Cr(ОH)6]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1291546/slide-23.jpg)





 Технология ремонта кузовов автомобиля
Технология ремонта кузовов автомобиля Вирусы гриппа Подготовила: Курганова Е., РЭ-2, 3 курс
Вирусы гриппа Подготовила: Курганова Е., РЭ-2, 3 курс Что делать в трудную минуту? Молодёжь Смоленской Центральной Церкви
Что делать в трудную минуту? Молодёжь Смоленской Центральной Церкви Домашняя мультимедиа-платформа с голосовым помощником Алисой
Домашняя мультимедиа-платформа с голосовым помощником Алисой Аналық тақша
Аналық тақша Basics of software development (continued)
Basics of software development (continued) Основы логики
Основы логики Электрические машины и электропривод. Введение
Электрические машины и электропривод. Введение Galileo galilei, February 15, 1564 - January 8, 1642
Galileo galilei, February 15, 1564 - January 8, 1642 Программирование. Экзамен
Программирование. Экзамен Устройства компьютера
Устройства компьютера Электрооборудование. Электроснабжение бортовой сети
Электрооборудование. Электроснабжение бортовой сети Весело колосится густая рожь.
Весело колосится густая рожь. Анималотерапия - презентация для начальной школы_
Анималотерапия - презентация для начальной школы_ Административное правонарушение Опрос
Административное правонарушение Опрос FORTRAN Название языка происходит от словосочетания FORmulae TRANslation — преобразование формул
FORTRAN Название языка происходит от словосочетания FORmulae TRANslation — преобразование формул Государственный Дарвиновский музей
Государственный Дарвиновский музей Типология и классификация политической культуры
Типология и классификация политической культуры Скульптурные шедевры Л.Бернини
Скульптурные шедевры Л.Бернини Ватто Антуан
Ватто Антуан Теория ландшафтной архитектуры и методология проектирования
Теория ландшафтной архитектуры и методология проектирования Презентацию выполнила студентка – заочница 2 курса филологического ф – та Купчихина Елена Николаевна Владимир, 2013 год
Презентацию выполнила студентка – заочница 2 курса филологического ф – та Купчихина Елена Николаевна Владимир, 2013 год Общая эндокринология
Общая эндокринология  Цивилизация и культура
Цивилизация и культура Political parties in Estonia
Political parties in Estonia Медный, бронзовый, железный века на Луганщине
Медный, бронзовый, железный века на Луганщине Методика работы Учителя физической культуры СОШ № 80 Чигилейчик Лады Юрьевны
Методика работы Учителя физической культуры СОШ № 80 Чигилейчик Лады Юрьевны Ноосфера . Эволюция представлений о месте человека в природе
Ноосфера . Эволюция представлений о месте человека в природе