Содержание
- 2. Сложные вещества, полученные взаимодействием соединений первого порядка, но не путем простого замещения в них одних компонентов
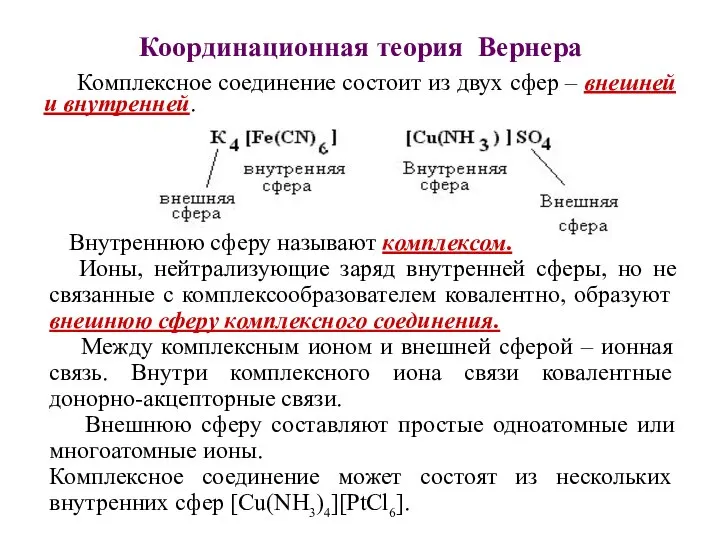
- 3. Координационная теория Вернера Комплексное соединение состоит из двух сфер – внешней и внутренней. Внутреннюю сферу называют
- 4. Виды комплексов Катионный - результат координации вокруг положительно заряженного иона нейтральных молекул (Н2О, NН3 и др.),
- 5. Внутренняя сфера состоит из центрального атома (комплексообразователя), а вокруг него находятся (координируются) лиганды. M + n
- 6. Характеристики центрального атома: 1)степень окисления (заряд атома) Степень окисления центрального атома - разность между зарядом комплекса
- 7. 2) Координационное число (КЧ) - количество химических связей, которые комплексообразователь образует с лигандами. Определяется строением электронной
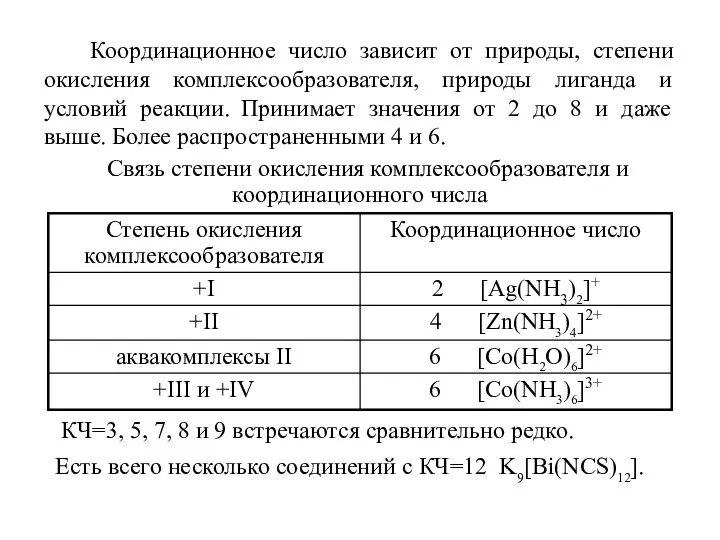
- 8. Координационное число зависит от природы, степени окисления комплексообразователя, природы лиганда и условий реакции. Принимает значения от
- 9. Лиганды не связаны друг с другом, и между ними действуют силы отталкивания. Лиганды различаются: 1) По
- 10. 3) По координационной емкости Координационная емкость лиганда – число мест, занимаемых каждым лигандом во внутренней сфере
- 11. В комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32- образует две связи с комплексообразователем – условным
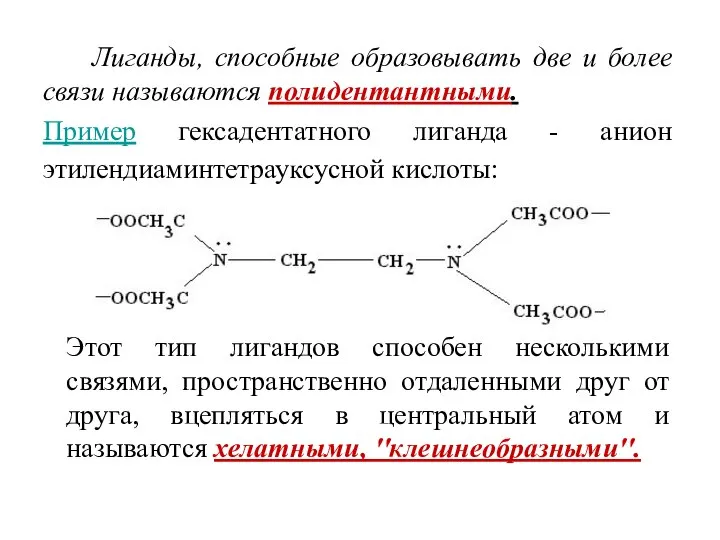
- 12. Лиганды, способные образовывать две и более связи называются полидентантными. Пример гексадентатного лиганда - анион этилендиаминтетрауксусной кислоты:
- 13. Если в комплексе содержатся два и более комплексообразователя, то этот комплекс называется многоядерным. Делятся на мостиковые,
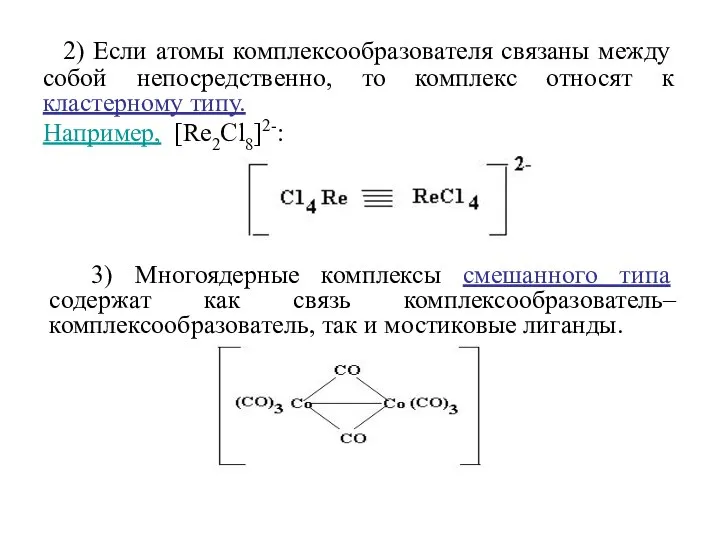
- 14. 2) Если атомы комплексообразователя связаны между собой непосредственно, то комплекс относят к кластерному типу. Например, [Re2Cl8]2-:
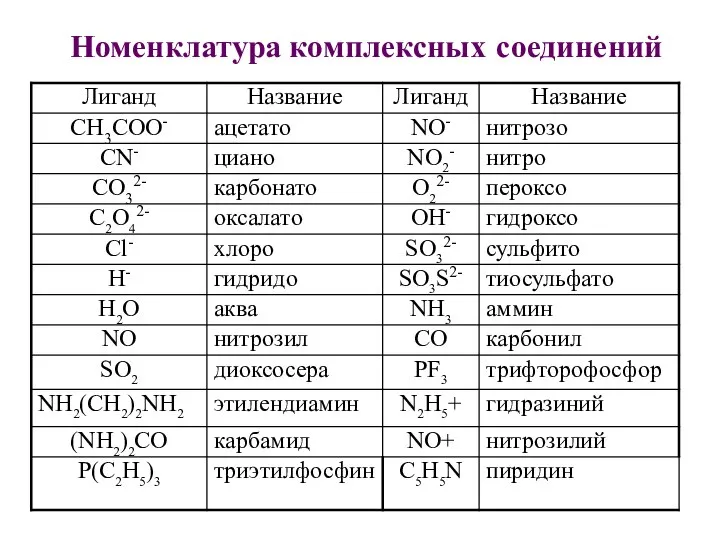
- 15. Номенклатура комплексных соединений
- 16. Комплексные соединения с комплексным анионом. Указывается число и название лиганда, комплексообразователь по латински с окончанием -ат
- 17. Комплексные соединения с комплексным катионом. Сначала указывается название аниона, затем число и названия лиганда и комплексообразователя
- 18. Нейтральные комплексы Названия состоят из одного слова. Указывается число и названия лигандов (для лигандов каждого вида
- 19. Многоядерные комплексы Названию мостиковых групп предшествует греческая буква μ, которая повторяется перед названием мостикового лиганда каждого
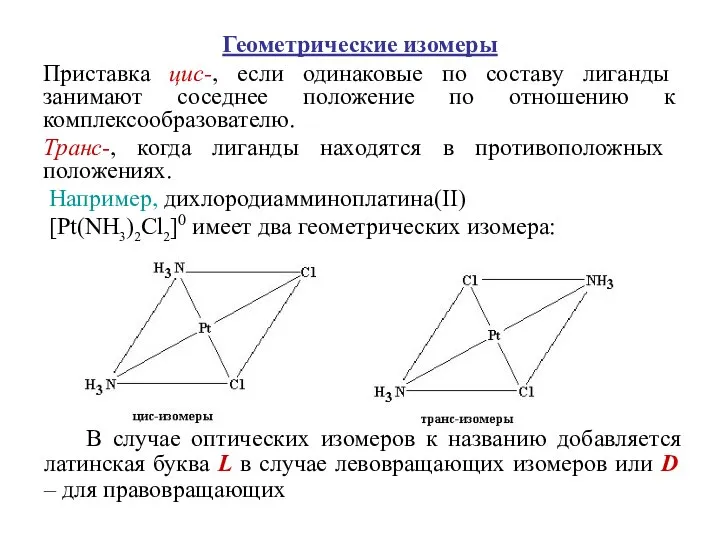
- 20. Геометрические изомеры Приставка цис-, если одинаковые по составу лиганды занимают соседнее положение по отношению к комплексообразователю.
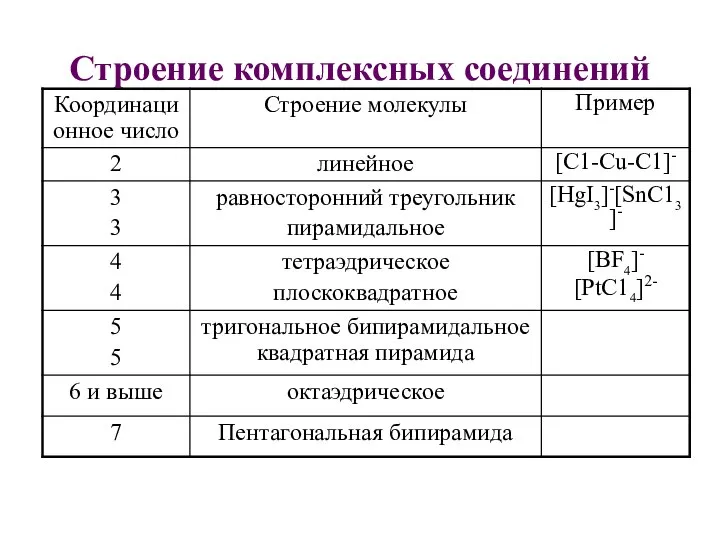
- 21. Строение комплексных соединений
- 22. Изомерия комплексных соединений Изомерия - способность веществ образовывать несколько соединений одинакового состава, отличающихся взаимным расположением атомов
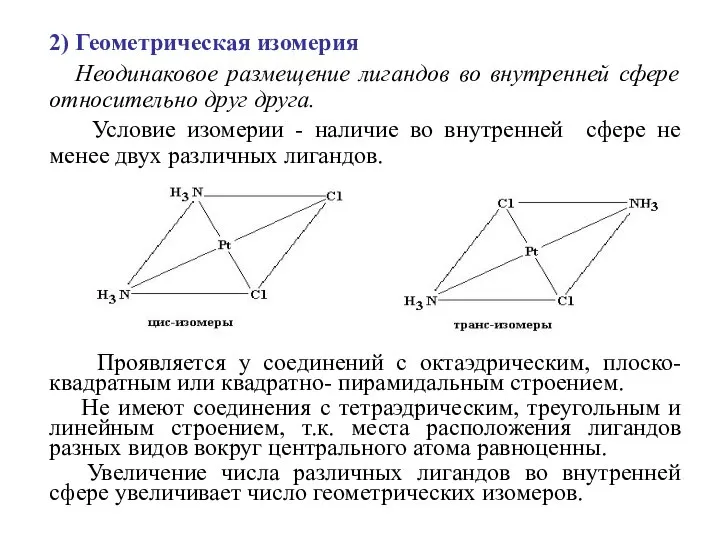
- 23. 2) Геометрическая изомерия Неодинаковое размещение лигандов во внутренней сфере относительно друг друга. Условие изомерии - наличие
- 24. 3) Оптическая изомерия (зеркальная изомерия). Способность комплексных соединений существовать в виде двух форм, не совмещаемых в
- 25. 4) Сольватная (гидратная) изомерия Различное распределение молекул растворителя между внутренней и внешней сферами комплексного соединения. Например,
- 26. 5) Ионная изомерия Различное распределение заряженных лигандов между внешней и внутренней сферами комплексного соединения. Ионные изомеры
- 27. Устойчивость комплексных соединений Делятся на электролиты и неэлектролиты. К неэлектролитам относят прежде всего внутрикомплексные соединения (хелаты),
- 28. Диссоциация имеет два этапа: 1) ведут себя как сильные электролиты, т.е. полностью диссоциируют на внутреннюю и
- 29. Процесс комплексообразования завершается, когда у комплексообразователя исчерпаны все валентные возможности. Присоединения лигандов происходит ступенчато. Полная константа
- 30. Процесс диссоциации характеризуется величиной константой нестойкости. Kn(обр)=1/Kn(нест) Константа нестойкости характеризует устойчивость комплексного иона в водной среде.
- 31. Примеры образования и разрушения комплексов 1) Желтый раствор FeCl3 обесцвечивается при добавлении КF из-за реакции: [Fe(H2O)6]3+
- 32. 3) Реакция: [Ag(NH3)2]Cl+2KCN+2H2O=K[Ag(CN)2]+KCl+2NH3*H2O необратима, т.к. Кнест[Ag(NH3)2]Cl>КнестK[Ag(CN)2] значит, что комплексный ион [Ag(CN)2]- прочнее, чем [Ag(NH3)2]+. Устойчивость комплексных
- 33. Теория валентных связей 1) Лиганд – донор электронов. 2)Комплексообразователь –акцептор электронов. 3) Пустые орбитали внешнего энергетического
- 34. Например, [Zn(NH3)4]2+ Электронная конфигурация Zn2+ 3d104s04p0 : Орбитали атомов азота, содержащие не поделенные пары электронов, перекрываются
- 35. Образуется тетраэдрический комплексный ион тетрааммионцинка(II) [Zn(NH3)4]2+: В ионе [Zn(NH3)4]2+ нет не спаренных электронов, то он проявляет
- 36. Ион [MnCl4]2- содержит пять не спаренных электронов на 3d-орбитали и вакантные 4s- и 4p-орбитали. Вакантные орбитали
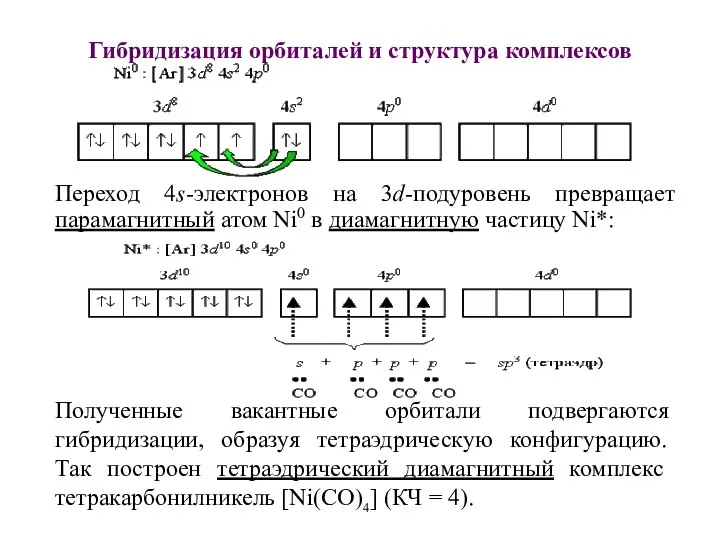
- 37. Гибридизация орбиталей и структура комплексов Переход 4s-электронов на 3d-подуровень превращает парамагнитный атом Ni0 в диамагнитную частицу
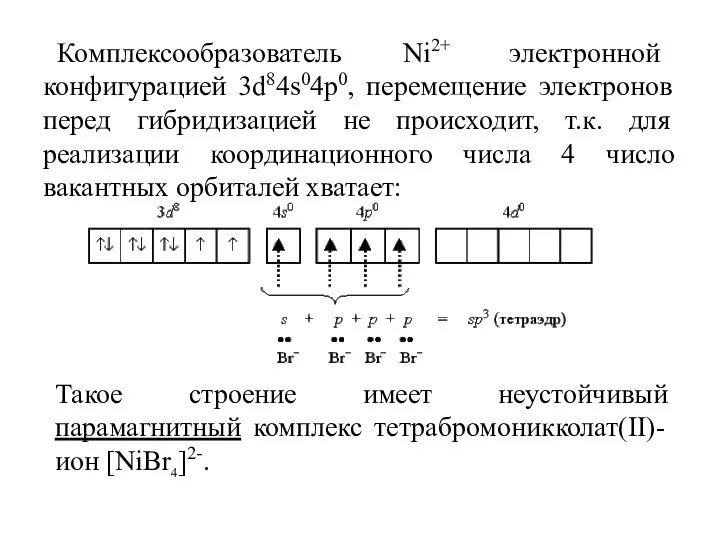
- 38. Комплексообразователь Ni2+ электронной конфигурацией 3d84s04p0, перемещение электронов перед гибридизацией не происходит, т.к. для реализации координационного числа
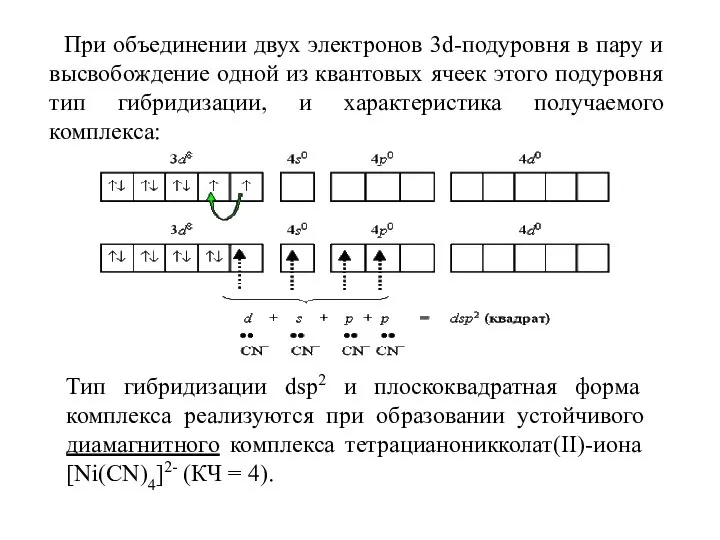
- 39. При объединении двух электронов 3d-подуровня в пару и высвобождение одной из квантовых ячеек этого подуровня тип
- 41. Если в гибридизации участвуют атомные орбитали внешнего d-подуровня, то комплекс парамагнитен и называется внешнеорбитальным и высокоспиновым.
- 42. Гексафтороферрат(II)-ион [FeF6]4- - парамагнитный высокоспиновый
- 43. Гексацианоферрат(II)-ион [Fe(CN)6]4- - диамагнитный низкоспиновый . Недостатки теории валентных связей: Не определяет вид комплекса в каждом
- 44. Теория кристаллического поля 1)Химическая связь комплексообразователь – лиганд считается электростатической. 2)Лиганды располагаются вокруг комплексообразователя в вершинах
- 45. Октаэдрическое расположение лигандов В центре октаэдра атом-комплексообразователь с электронами на d-атомных орбиталях. В его вершинах –
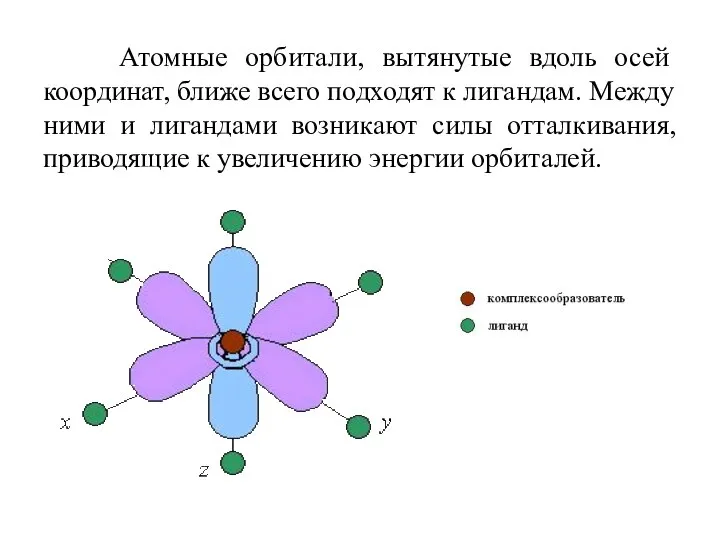
- 46. Атомные орбитали, вытянутые вдоль осей координат, ближе всего подходят к лигандам. Между ними и лигандами возникают
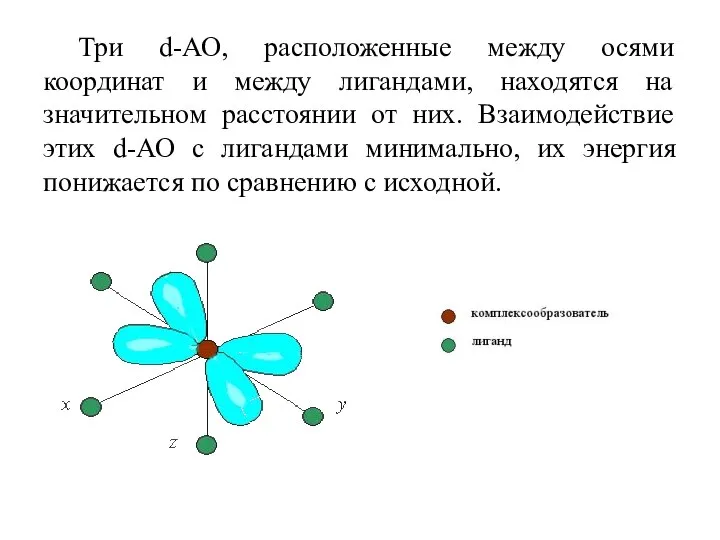
- 47. Три d-АО, расположенные между осями координат и между лигандами, находятся на значительном расстоянии от них. Взаимодействие
- 48. Пять одинаковых d-АО комплексообразователя, попадая в поле лигандов, подвергаются расщеплению на две группы новых орбиталей –
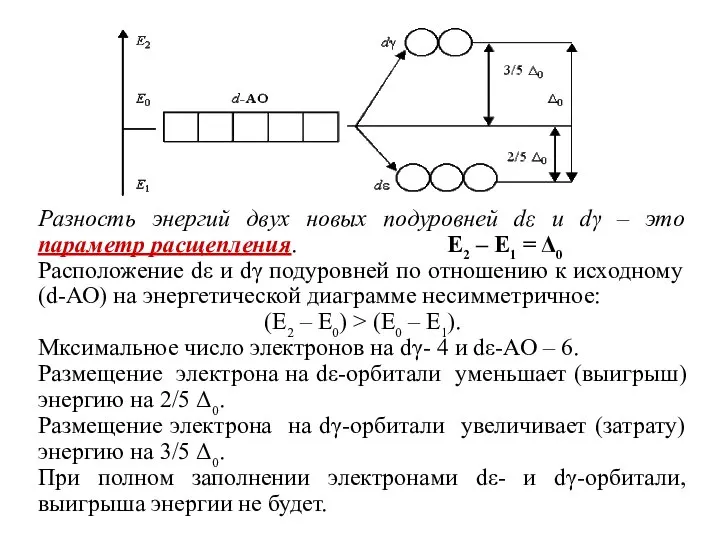
- 49. Разность энергий двух новых подуровней dε и dγ – это параметр расщепления. E2 – E1 =
- 50. Выигрыш энергии за счет заселения электронами dε-атомных орбиталей называют энергией стабилизации комплекса полем лигандов. Чем сильнее
- 51. Заселение dε- и dγ Независимо от значения параметра расщепления первые три электрона занимают квантовые ячейки dε-подуровня:
- 52. При низком значении параметра расщепления (слабое поле лигандов) электроны преодолевают энергетический барьер, разделяющий dε- и dγ-орбитали;
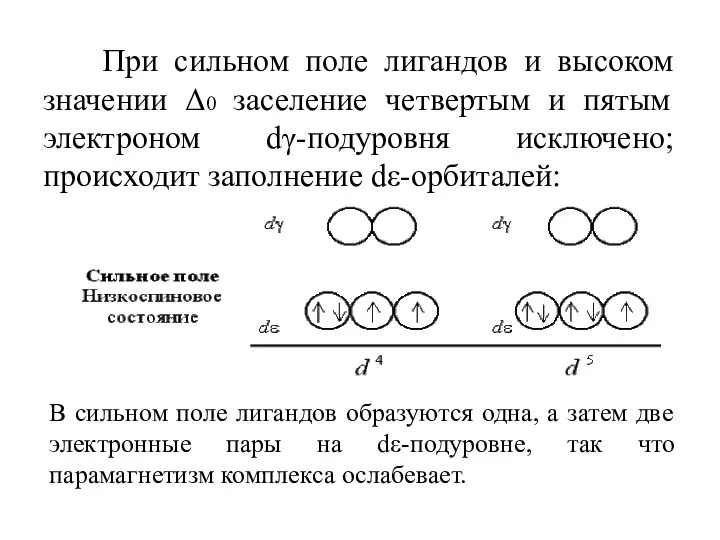
- 53. При сильном поле лигандов и высоком значении Δ0 заселение четвертым и пятым электроном dγ-подуровня исключено; происходит
- 54. Шестой, седьмой и восьмой электроны в случае слабого поля оказываются снова на dε-подуровне, дополняя конфигурации до
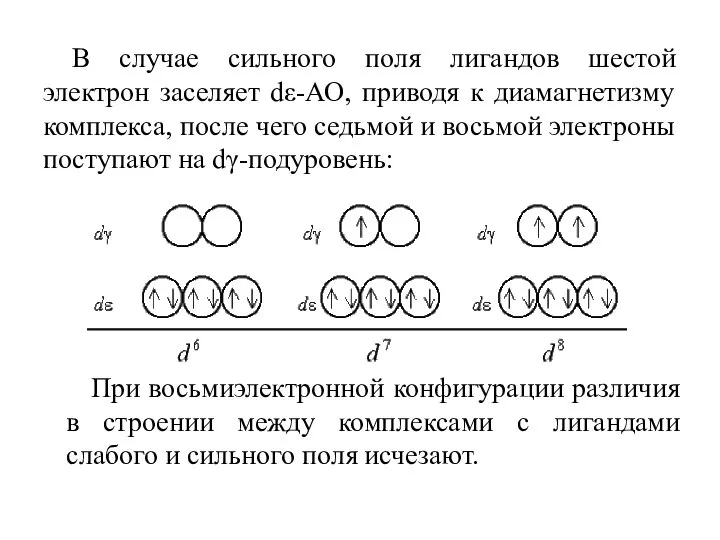
- 55. В случае сильного поля лигандов шестой электрон заселяет dε-АО, приводя к диамагнетизму комплекса, после чего седьмой
- 56. Заселение орбиталей девятым и десятым электроном также не различается для комплексов обоих типов:
- 57. Строение октаэдрического комплексного ионов [CoF6]3-. Фторид-ион F- – лиганд слабого поля. Комплексный ион является высокоспиновым и
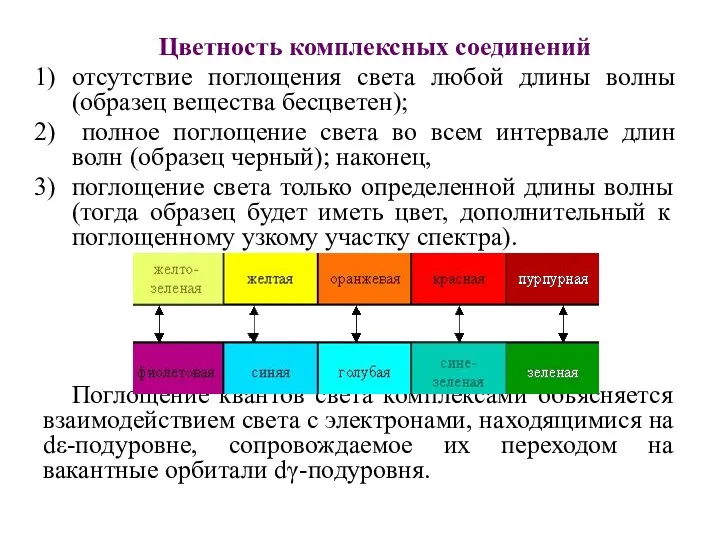
- 58. Цветность комплексных соединений отсутствие поглощения света любой длины волны (образец вещества бесцветен); полное поглощение света во
- 59. Например, при пропускании света через водный раствор, содержащий [Ti(H2O)6]3+, обнаруживается полоса поглощения света в желто-зеленой области
- 61. Скачать презентацию







![В комплексном соединении [Co(NH3)4CO3]NO3 бидентатный лиганд – ион CO32- образует две](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294705/slide-10.jpg)














![3) Реакция: [Ag(NH3)2]Cl+2KCN+2H2O=K[Ag(CN)2]+KCl+2NH3*H2O необратима, т.к. Кнест[Ag(NH3)2]Cl>КнестK[Ag(CN)2] значит, что комплексный ион [Ag(CN)2]-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294705/slide-31.jpg)

![Например, [Zn(NH3)4]2+ Электронная конфигурация Zn2+ 3d104s04p0 : Орбитали атомов азота, содержащие](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294705/slide-33.jpg)
![Образуется тетраэдрический комплексный ион тетрааммионцинка(II) [Zn(NH3)4]2+: В ионе [Zn(NH3)4]2+ нет не](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294705/slide-34.jpg)
![Ион [MnCl4]2- содержит пять не спаренных электронов на 3d-орбитали и вакантные](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294705/slide-35.jpg)


![Гексафтороферрат(II)-ион [FeF6]4- - парамагнитный высокоспиновый](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294705/slide-41.jpg)
![Гексацианоферрат(II)-ион [Fe(CN)6]4- - диамагнитный низкоспиновый . Недостатки теории валентных связей: Не](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294705/slide-42.jpg)








![Строение октаэдрического комплексного ионов [CoF6]3-. Фторид-ион F- – лиганд слабого поля.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294705/slide-56.jpg)
![Например, при пропускании света через водный раствор, содержащий [Ti(H2O)6]3+, обнаруживается полоса](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294705/slide-58.jpg)
 Инвестиционный проект «Комплексное развитие Нижнего Приангарья» О ХОДЕ РЕАЛИЗАЦИИ И ФИНАНСИРОВАНИИ
Инвестиционный проект «Комплексное развитие Нижнего Приангарья» О ХОДЕ РЕАЛИЗАЦИИ И ФИНАНСИРОВАНИИ Методические рекомендации по разработке раздела образовательной и учебной программы Задача методической разработки ра
Методические рекомендации по разработке раздела образовательной и учебной программы Задача методической разработки ра Ременные передачи
Ременные передачи Споры о правах на недвижимое имущество
Споры о правах на недвижимое имущество  Аттестационная работа. Проектная и исследовательская деятельностьн а уроках физической культуры
Аттестационная работа. Проектная и исследовательская деятельностьн а уроках физической культуры Средства фитнес-тренировки
Средства фитнес-тренировки Организация таможенного контроля за товарами подлежащие маркировке акцизными марками Выполнили Хропина Ольга и Фунтикова Викто
Организация таможенного контроля за товарами подлежащие маркировке акцизными марками Выполнили Хропина Ольга и Фунтикова Викто Классическое определение вероятности. Геометрическая вероятность.
Классическое определение вероятности. Геометрическая вероятность.  Курсовой проект по дисциплине «Образование взрослых» Тема: Учитель как субъект управления качеством образовательного процесса.
Курсовой проект по дисциплине «Образование взрослых» Тема: Учитель как субъект управления качеством образовательного процесса.  Духовно-нравственные основы государственной безопасности России
Духовно-нравственные основы государственной безопасности России Посттравматическое стрессовое расстройство Острые и затяжные реактивные психозы Психиатрия катастроф и стихийных бедствий
Посттравматическое стрессовое расстройство Острые и затяжные реактивные психозы Психиатрия катастроф и стихийных бедствий 5 ლექცია
5 ლექცია Учиться во Франции с Центром CNOUS Высшее образование во Франции Службы CNOUS и CROUS Стипендиальные программы в Казахстане Сеть по при
Учиться во Франции с Центром CNOUS Высшее образование во Франции Службы CNOUS и CROUS Стипендиальные программы в Казахстане Сеть по при Франция Подготовил: Студент группы ДЭН-202 Корнеев Алексей
Франция Подготовил: Студент группы ДЭН-202 Корнеев Алексей СТО с участком диагностики двигателя
СТО с участком диагностики двигателя Презентация "Крымская Ярмарка" - скачать презентации по Экономике
Презентация "Крымская Ярмарка" - скачать презентации по Экономике Сущность и содержание теории управления 1. Категориальный аппарат теории управления. 2. Цели теории управления. 3. Эволюция упр
Сущность и содержание теории управления 1. Категориальный аппарат теории управления. 2. Цели теории управления. 3. Эволюция упр Я і мае сябры. У доме. (Тэма 15)
Я і мае сябры. У доме. (Тэма 15) МОУ «Карымкарская СОШ»
МОУ «Карымкарская СОШ» Политическая деятельность
Политическая деятельность Процессор, системная плата. 10 класс
Процессор, системная плата. 10 класс a42ebe6a26ea41daade14685a3232588
a42ebe6a26ea41daade14685a3232588 Муниципальное дошкольное образовательное учреждение детский сад комбинированного вида №12 г. Сердобска
Муниципальное дошкольное образовательное учреждение детский сад комбинированного вида №12 г. Сердобска Эстетика Ренессанса
Эстетика Ренессанса ИГРА «ЛОТО» Выбирай правильный ответ, и у тебя получится красивая картинка… Начинаем…
ИГРА «ЛОТО» Выбирай правильный ответ, и у тебя получится красивая картинка… Начинаем… Презентация по МХК Французский классицизм 17 века
Презентация по МХК Французский классицизм 17 века Иілу деформациясы
Иілу деформациясы Санитарно-противоэпидемический режим процедурного кабинета. Перевязочная в стационаре и поликлинике Выполнили: Дембаев Е. Жора
Санитарно-противоэпидемический режим процедурного кабинета. Перевязочная в стационаре и поликлинике Выполнили: Дембаев Е. Жора