Содержание
- 2. Химическая коррозия характерна для сред не электролитов. Происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды,
- 3. Строение оксидной пленки.
- 4. Электрохимическая коррозия - характерна для сред, имеющих ионную проводимость. Протекает: а) в электролитах – в водных
- 5. Например, коррозия железа в среде: а) НС1 и б)КОН. А) схема коррозионного элемента: +2e А (-)
- 6. По характеру разрушения поверхности металла: а) Равномерная или общая коррозия – распределяется равномерно по всей поверхности
- 7. Скорость коррозии выражают: Массовый показатель - потеря массы (в граммах и килограммах) за единицу времени (сек,
- 8. ЗАЩИТА МЕТАЛЛА ОТ КОРРОЗИИ. А) Легирование – в сплав вводятся компоненты, вызывающие пассивность металла (Сr, Ni,
- 9. Б) Защитные покрытия – это слои искусственно создаваемые на поверхности металла изделий и сооружений для предохранения
- 10. Металлические покрытия получают: Металлизация: Расплавленный металл с помощью струи сжатого воздуха наносится на защищаемую поверхность. Преимущества
- 11. Неметаллические покрытия. Защитное действие сводится к изоляции металла от окружающей среды. 1) неорганические покрытия: А) Эмали.
- 12. В) Электрохимическая защита. Основана на торможении анодных или катодных реакций процесса коррозии. Осуществляется присоединением к защищаемой
- 14. Скачать презентацию
Химическая коррозия характерна для сред не электролитов. Происходит прямое гетерогенное взаимодействие
Химическая коррозия характерна для сред не электролитов. Происходит прямое гетерогенное взаимодействие
Различают:
а) газовая коррозия – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах,
Например: окисление металла в кислороде воздуха при Т>>>298К;
б) коррозия в неэлектролитах – агрессивных органических жидкостях, например: в сернистой нефти.
Например, коррозия алюминия в сухом воздухе:
4А1 + 3О2 = 2А12О3
А10 –3е = А13+|4
О20 +4е = 2О2-| 3
Продукт коррозии пленка оксида алюминия.
Образующаяся пленка препятствует диффузии окислителя к чистому металлу и замедляет или прекращает дальнейшую коррозию
Способность пленки защищать металл от дальнейшей коррозии оценивают по её сплошности.
Сплошность -это отношение объёма продуктов коррозии к объёму окисленного металла (фактор Пиллинга – Бэдвардса).
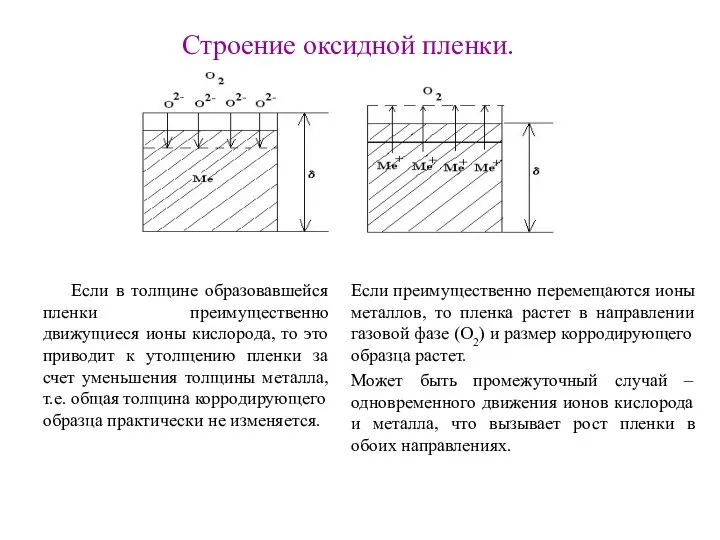
Строение оксидной пленки.
Строение оксидной пленки.
Электрохимическая коррозия - характерна для сред, имеющих ионную проводимость.
Протекает:
а) в
Электрохимическая коррозия - характерна для сред, имеющих ионную проводимость.
Протекает:
а) в
б) в атмосфере любого влажного газа;
в) в почве.
При электрохимической коррозии происходит анодное растворение металла и катодное восстановление окислителя.
Окислители снимают избыточный отрицательный заряд с поверхности катода, уменьшая его поляризацию, поэтому их называют деполяризаторами.
В кислой среде рН < 7 на катоде протекает:
2Н+ + 2е = Н2 - деполяризация водорода
В щелочной или нейтральной рН ≥ 7 на катоде протекает:
О2 + 2Н2О + 4е = 4ОН- деполяризация кислорода
Например, коррозия железа в среде: а) НС1 и б)КОН.
А) схема коррозионного
Например, коррозия железа в среде: а) НС1 и б)КОН.
А) схема коррозионного
+2e А (-) Fе0 –2е = Fе+2 |1
↓------------| К (+) 2Н+ + 2е = Н2, т.е. рН< 7среда кислая |1
(-) Fе │НС1│ Fе (+) ---------------------------------------------------------------
|__________↑ Fе0 + 2Н+= Fе+2 + Н2
-2e Fe +2НС1 = FеС12 + Н2
Б) схема коррозионного элемента:
+4e А (-) Fе0 –2е = Fе+2 |2
↓------------------| К (+)О2+2Н2О+4е= ОН-, рН >7 среда щелочная|1
(-) Fе│КОН+О2+Н2О│Fе (+) -----------------------------------------------------
|_________________↑ 2Fе0 + О2 + 2Н2О = 2Fе+2 + 4ОН-
-2e
О2 -Н2О
2Fе + О2 + 2Н2О = 2Fе(ОН)2 → Fе(ОН)3 → FеООН
Две последние стадии протекают только для железа.
По характеру разрушения поверхности металла:
а) Равномерная или общая коррозия – распределяется
По характеру разрушения поверхности металла:
а) Равномерная или общая коррозия – распределяется
б) Местная коррозия сосредоточена на отдельных участках и проявляется в виде точек, язв или пятен.
в) Межкристаллитная коррозия - по границам зерен.
Скорость коррозии выражают:
Массовый показатель - потеря массы (в граммах и
Скорость коррозии выражают:
Массовый показатель - потеря массы (в граммах и
υкорр=Δm/Δτ∙ΔS
Глубинный показатель - уменьшение толщины металлы в единицу времени
υкорр=Δl/Δτ
Скорость электрохимической коррозии – выражается величиной тока, приходящегося на единицу площади металла.
υкорр=I/ΔS
ЗАЩИТА МЕТАЛЛА ОТ КОРРОЗИИ.
А) Легирование – в сплав вводятся компоненты, вызывающие
ЗАЩИТА МЕТАЛЛА ОТ КОРРОЗИИ.
А) Легирование – в сплав вводятся компоненты, вызывающие
Жаростойкость – стойкость по отношению к газовой коррозии при высоких температурах.
Обеспечивается введением хрома, кремния, мышьяка.
Жаропрочность – свойства конструкционного материала сохранять высокую механическую прочность при значительном повышении температуры.
Жаропрочность увеличивается добавлением хрома, кремния.
Легирование используется:
А) с целью снижения скорости электрохимической коррозии, особенно коррозии с выделением водорода.
Б) для защиты от газовой коррозии.
Б) Защитные покрытия – это слои искусственно создаваемые на поверхности металла
Б) Защитные покрытия – это слои искусственно создаваемые на поверхности металла
Металлические покрытия Ими могут быть чистые металлы (цинк, кадмий, алюминий и др.) и их сплавы (латунь, бронза и др.).
Делят на катодные и анодные.
К катодным покрытиям относятся покрытия, потенциалы которых в данной среде имеют более положительное значение, чем потенциал основного металла (для железа – медь, никель, серебро).
При повреждении покрытия возникает коррозионный элемент:
А(-) Ме|среда|покрытие (+)К
Катодные покрытия защищают металлы от коррозии лишь в отсутствии пор и повреждений покрытия.
Анодные покрытия имеют более отрицательный потенциал, чем потенциал основного металла (для железа –цинк).
При повреждении покрытия возникает коррозионный элемент:
А(-) покрытие |среда| Ме(+)К
В этом случае основной металл будет катодом коррозионного элемента, поэтому он не корродирует.
Металлические покрытия получают:
Металлизация:
Расплавленный металл с помощью струи сжатого воздуха наносится на
Металлические покрытия получают:
Металлизация:
Расплавленный металл с помощью струи сжатого воздуха наносится на
2) Термодиффузионный – изделие помещают в смесь, содержащую порошок металлического покрытия.
При повышенной температуре происходит диффузия наносимого металла в основной металл. Используются для получения жаростойких покрытий.
3) Химический – заключается в восстановлении соединений металла с помощью восстановителя.
Неметаллические покрытия. Защитное действие сводится к изоляции металла от окружающей среды.
1)
Неметаллические покрытия. Защитное действие сводится к изоляции металла от окружающей среды.
1)
А) Эмали. Применяют для защиты от газовой коррозии. Недостаток – хрупкость и растрескивание при тепловом и механическом ударах.
Б) Оксиды металлов (оксидирование) Получаются при высокотемпературном окислении на воздухе или погружением в горячие концентрированные растворы щелочей, содержащих персульфаты, нитраты или хлораты металлов. Эти пленки достаточно стойки, но защитные свойства их не высоки. Защитные свойства оксидных пленок повышают пропиткой их маслом.
В) Фосфатные покрытия. Получают из растворов ортофосфорной кислоты и ортофосфатов марганца или цинка. Их используют как подложку под покраску, что повышает сцепление лакокрасочных покрытий со сталью и уменьшает коррозию в местах царапин.
2) органические покрытия:
Лакокрасочные покрытия. Должны быть сплошными, беспористыми, газо- и водонепроницаемыми, химически стойкими, эластичными, обладать высоким сцеплением с материалом, механической прочностью и твердостью.
В) Электрохимическая защита. Основана на торможении анодных или катодных реакций процесса
В) Электрохимическая защита. Основана на торможении анодных или катодных реакций процесса
В качестве протектора используется алюминий, цинк, магний
Катодная поляризация используется для защиты от коррозии подземных труб, кабелей и др.
Катодная защита – защищаемое изделие подсоединяют к отрицательному полюсу внешнего источника постоянного тока, и оно становится катодом, а анодом служит обычный вспомогательный электрод.










 PR-кампании основные виды pr мероприятии
PR-кампании основные виды pr мероприятии Хвильові властивості речовини
Хвильові властивості речовини Хирургическая стоматология
Хирургическая стоматология  Велосипедные походы и безопасность туристов
Велосипедные походы и безопасность туристов Проведение кадровой политики России в 90 годы Бобырь Алексей Группа Т-111
Проведение кадровой политики России в 90 годы Бобырь Алексей Группа Т-111 Керамические материалы и изделия. Тема 4
Керамические материалы и изделия. Тема 4 Комар Вася
Комар Вася Весенняя студенческая энергетическая школа. Кейс по РЗА
Весенняя студенческая энергетическая школа. Кейс по РЗА ХИРУРГИЧЕСКАЯ ИНФЕКЦИЯ
ХИРУРГИЧЕСКАЯ ИНФЕКЦИЯ  Футбол. Правила игры
Футбол. Правила игры Знакомство с теорией тестов
Знакомство с теорией тестов Презентация "Деньги как товар" - скачать презентации по Экономике
Презентация "Деньги как товар" - скачать презентации по Экономике Суды и правосудие
Суды и правосудие Библейские мотивы в живописи.
Библейские мотивы в живописи. Алгоритмы со структурой Выбор. Урок 31
Алгоритмы со структурой Выбор. Урок 31 Известные лыжники России
Известные лыжники России Презентация "Образ солнца в творчестве разных народов" - скачать презентации по МХК
Презентация "Образ солнца в творчестве разных народов" - скачать презентации по МХК Презентация "Акира Куросава: Жизнь и творчество" - скачать презентации по МХК
Презентация "Акира Куросава: Жизнь и творчество" - скачать презентации по МХК Медный, бронзовый, железный века на Луганщине
Медный, бронзовый, железный века на Луганщине Загадки про одежду Словарь 1 класс
Загадки про одежду Словарь 1 класс Аксонометрические проекции
Аксонометрические проекции Наука как социальный институт
Наука как социальный институт  Презентація уроку Повість " Климко " Григора Тютюнник." - презентация для начальной школы
Презентація уроку Повість " Климко " Григора Тютюнник." - презентация для начальной школы Рисуем божью коровку - презентация для начальной школы_
Рисуем божью коровку - презентация для начальной школы_ 6-ой Всероссийский фестиваль Культуры и Искусства имени Святого праведного воина Федора Ушакова
6-ой Всероссийский фестиваль Культуры и Искусства имени Святого праведного воина Федора Ушакова Политическая власть
Политическая власть ВЗАИМОДЕЙСТВИЕ ВУЗА И ПРОМПРЕДПРИЯТИЯ в инноватике
ВЗАИМОДЕЙСТВИЕ ВУЗА И ПРОМПРЕДПРИЯТИЯ в инноватике Презентация "Христианская семья и ее ценности" - скачать презентации по МХК
Презентация "Христианская семья и ее ценности" - скачать презентации по МХК