Лекция 7 ХИМИЧЕСКИЕ СВОЙСТВА АЛКАНОВ 1. Общая характеристика реакционной способности предельных углеводородов. 2. Реакции замещени
Содержание
- 2. 2. РЕАКЦИИ ЗАМЕЩЕНИЯ АЛКАНОВ. Механизм реакций 2.1 Галогенирование Общая cхема: R-H + X2 R-X + HX
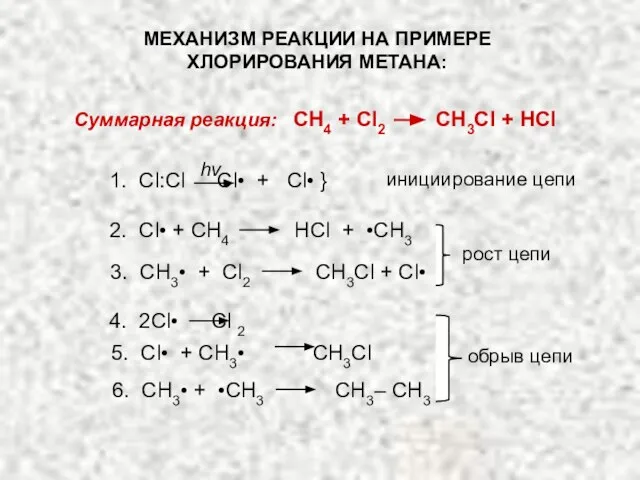
- 3. МЕХАНИЗМ РЕАКЦИИ НА ПРИМЕРЕ ХЛОРИРОВАНИЯ МЕТАНА: Суммарная реакция: CH4 + Cl2 CH3Cl + HCl 1. Cl:Cl
- 4. Хлорирование метана – цепная реакция, т.е. реакция, включающая ряд стадий, каждая из которых гене-рирует реакционноспособную частицу,
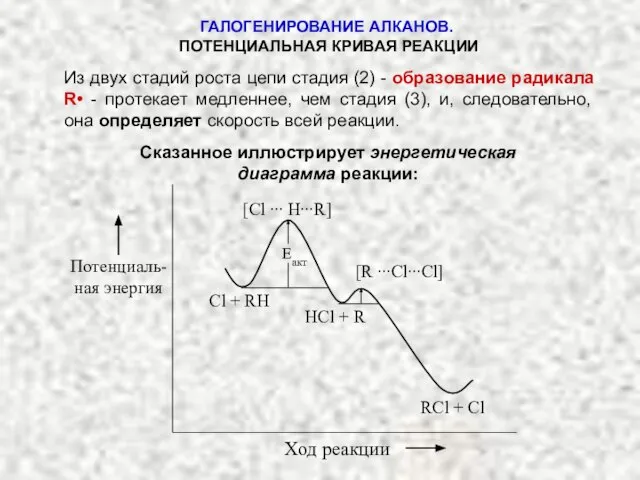
- 5. ГАЛОГЕНИРОВАНИЕ АЛКАНОВ. ПОТЕНЦИАЛЬНАЯ КРИВАЯ РЕАКЦИИ Из двух стадий роста цепи стадия (2) - образование радикала R•
- 6. ОРИЕНТАЦИЯ ПРИ ГАЛОГЕНИРОВАНИИ: Проблема ориентации возникает всякий раз, когда реагент может атаковать различные по реакционной способности
- 7. ОРИЕНТАЦИЯ ПРИ ГАЛОГЕНИРОВАНИИ: Поскольку скоростьопределяющей стадией является стадия образования промежуточного алкильного радикала R•, направление реакции, т.
- 8. Как общее правило можно принять: ОРИЕНТАЦИЯ ПРИ ГАЛОГЕНИРОВАНИИ: «Реакция идет тем легче, чем легче образуются характеризующие
- 9. Ряд изменения устойчивости радикалов: третичный > вторичный > первичный Отсюда следует, что легче всего замещение атомов
- 10. Примечание: Сказанное не означает, однако, что количество изо-пропилхлорида, образующегося в реакции хлорирования пропана будет в 3
- 11. 2. Нитрование алканов разб. HNO3 при нагревании ( Коновалов 1888г.) 1. HO-NO2 HO• + •NO2 t0
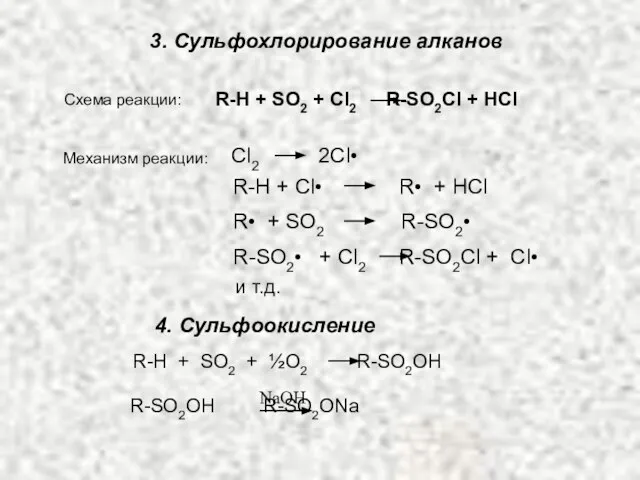
- 12. 3. Сульфохлорирование алканов Схема реакции: R-H + SO2 + Cl2 R-SO2Cl + HCl Сl2 2Cl• R-H
- 13. РЕАКЦИЯ СУЛЬФОХЛОРИРОВАНИЯ Реакция сульфохлорирования алканов впервые была использована в Германии в 1939-1940 гг. для получения заменителей
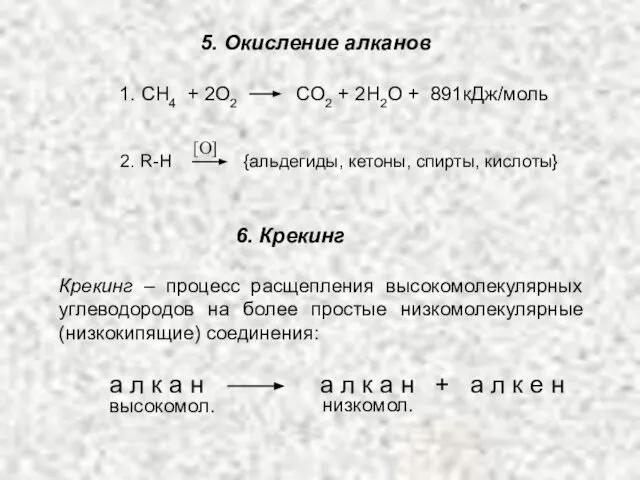
- 14. 5. Окисление алканов 1. СH4 + 2O2 CO2 + 2H2O + 891кДж/моль [O] 2. R-H {альдегиды,
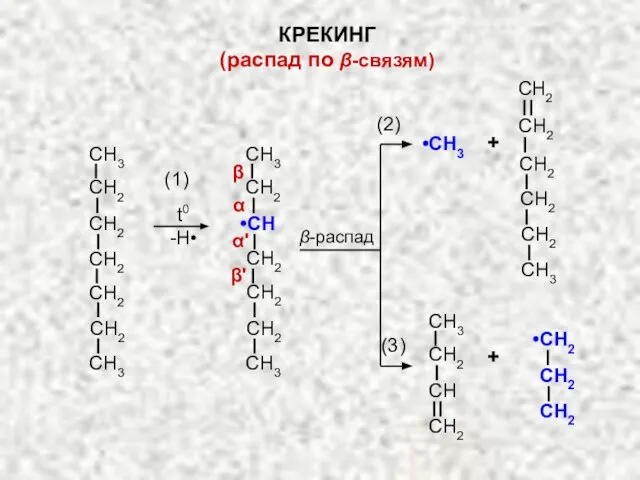
- 15. t0 -H• β-распад •CH3 + + (1) (2) (3) КРЕКИНГ (распад по β-связям)
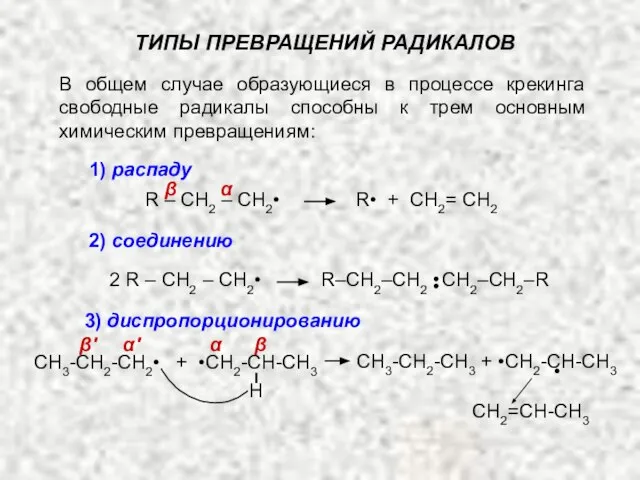
- 16. В общем случае образующиеся в процессе крекинга свободные радикалы способны к трем основным химическим превращениям: ТИПЫ
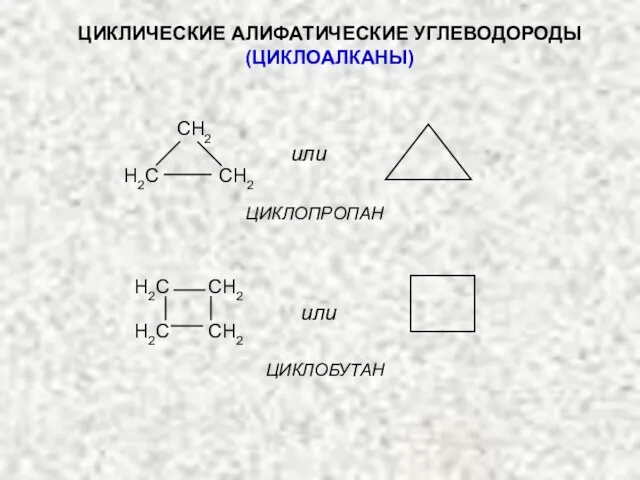
- 17. ЦИКЛИЧЕСКИЕ АЛИФАТИЧЕСКИЕ УГЛЕВОДОРОДЫ (ЦИКЛОАЛКАНЫ) или H2C CH2 H2C CH2 или ЦИКЛОПРОПАН ЦИКЛОБУТАН
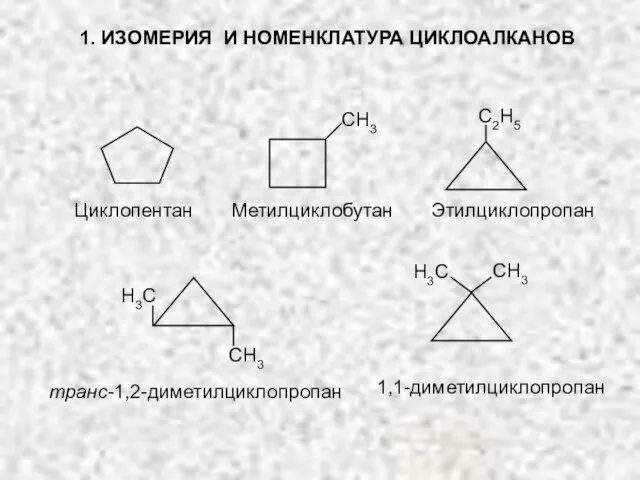
- 18. 1. ИЗОМЕРИЯ И НОМЕНКЛАТУРА ЦИКЛОАЛКАНОВ СH3 С2H5 Циклопентан Метилциклобутан Этилциклопропан СH3 H3С H3С СH3 транс-1,2-диметилциклопропан 1,1-диметилциклопропан
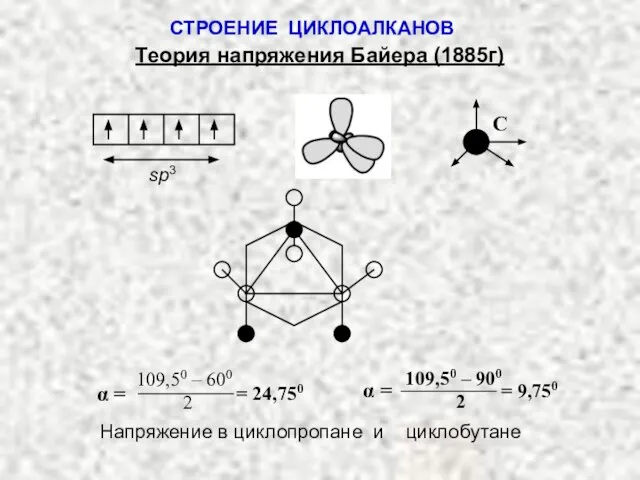
- 19. СТРОЕНИЕ ЦИКЛОАЛКАНОВ Теория напряжения Байера (1885г) sp3 C 109,50 – 600 2 α = = 24,750
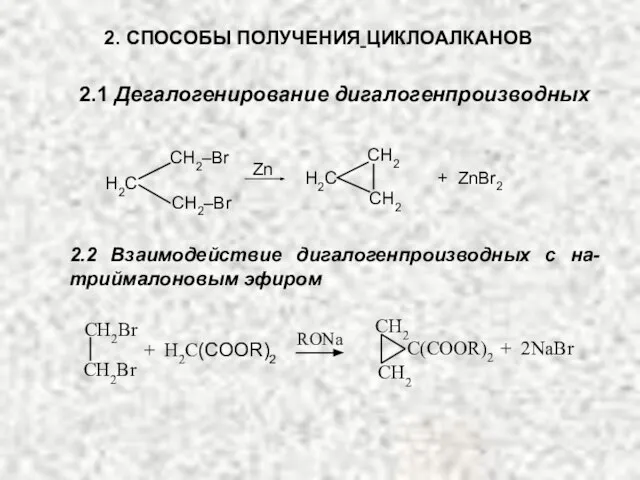
- 20. 2. СПОСОБЫ ПОЛУЧЕНИЯ ЦИКЛОАЛКАНОВ 2.1 Дегалогенирование дигалогенпроизводных H2С СH2–Br СH2–Br H2С СH2 СH2 Zn + ZnBr2
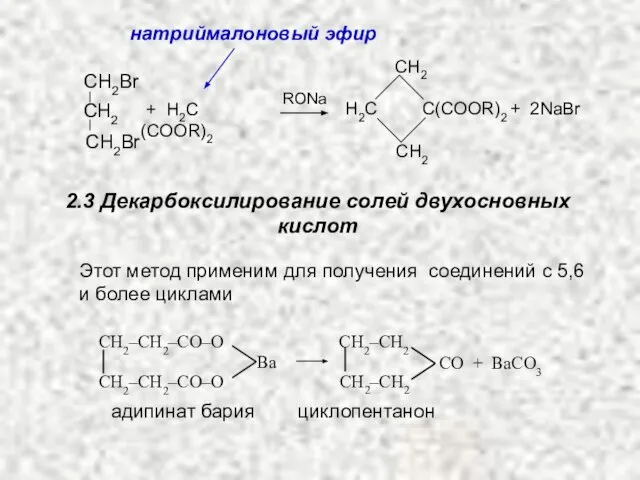
- 21. СH2 СH2 H2С С(COOR)2 + 2NaBr + H2С(COOR)2 RONa СH2Br СH2Br СH2 натриймалоновый эфир 2.3 Декарбоксилирование
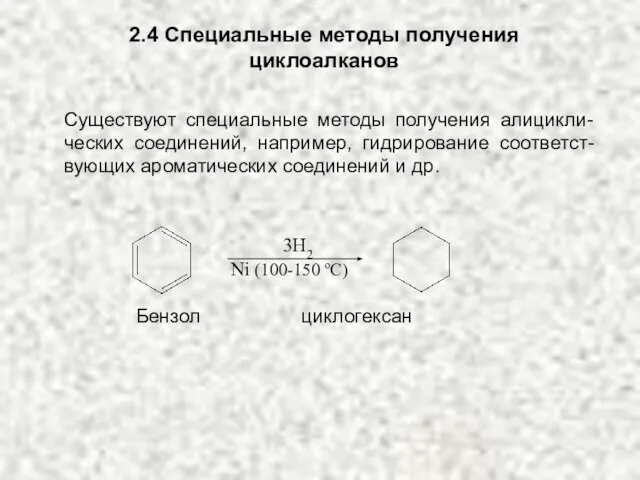
- 22. 2.4 Специальные методы получения циклоалканов 3H2 Ni (100-150 oC) Существуют специальные методы получения алицикли-ческих соединений, например,
- 23. 3. ФИЗИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ Циклические соединения обычно имеют более высокую температуру кипения и плавления и большую
- 24. 3. ХИМИЧЕСКИЕ СВОЙСТВА ЦИКЛОАЛКАНОВ Химические свойства циклоалканов зависят от величины цикла. Соединения с малым размером (3-,4-членные)
- 25. Гидрирование СH2–СН2 СH2–СН2 CH2 + H2 СН3–СН2–СН2-CH2–СН3 Pd 300 oC Пятичленный цикл разрывается только при высоких
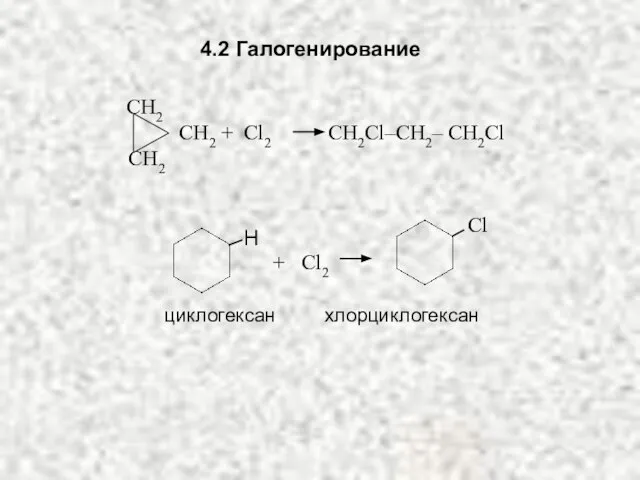
- 26. 4.2 Галогенирование СH2 СH2 СН2 + Cl2 CH2Cl–CH2– CH2Cl Сl H + Cl2 циклогексан хлорциклогексан
- 27. 4.3 Действие галогеноводородов СH2 СH2 СН–R + HBr R–CHBr–CH2– CH3 Циклопропан и его гомологи реагируют с
- 28. ОТДЕЛЬНЫЕ ПРЕДСТАВИТЕЛИ. ПРИМЕНЕНИЕ Циклопропан – газообразное вещество с т.кип. –34 оС получают в промышленном масштабе обработкой
- 30. Скачать презентацию














 Конструктивные решения производственных зданий. Основные конструктивные элементы производственных зданий. Покрытия и кровли
Конструктивные решения производственных зданий. Основные конструктивные элементы производственных зданий. Покрытия и кровли День Здоровья в 7 «А»
День Здоровья в 7 «А» Николай Алексеевич Некрасов 1821 -1878
Николай Алексеевич Некрасов 1821 -1878 Наиболее характерные неисправности магнитных пускателей
Наиболее характерные неисправности магнитных пускателей Наш город в творчестве художников
Наш город в творчестве художников Как жили земледельцы и ремесленники в Египте - презентация для начальной школы_
Как жили земледельцы и ремесленники в Египте - презентация для начальной школы_ Презентация на тему "Психолого-педагогическая характеристика детей, обучающихся по специальной (коррекционной) программе школ
Презентация на тему "Психолого-педагогическая характеристика детей, обучающихся по специальной (коррекционной) программе школ Презентация на тему "Духовно-нравственное воспитание в семье и школе" - скачать презентации по Педагогике
Презентация на тему "Духовно-нравственное воспитание в семье и школе" - скачать презентации по Педагогике Развитие института социальной защиты населения
Развитие института социальной защиты населения Валы и оси редуктора
Валы и оси редуктора образование мочи
образование мочи Давление грунта на подпорные стенки
Давление грунта на подпорные стенки Понятие о микропроцессорных системах (МПС) и микроконтроллерах
Понятие о микропроцессорных системах (МПС) и микроконтроллерах Переключение задач
Переключение задач Презентация Основные положения Таможенного кодекса по соблюдению запретов и ограничений по перемещаемым товарам через таможенн
Презентация Основные положения Таможенного кодекса по соблюдению запретов и ограничений по перемещаемым товарам через таможенн Зона психологической разгрузки
Зона психологической разгрузки Презентация на тему "Визуальная диагностика респираторного дистресс синдрома" - скачать презентации по Медицине
Презентация на тему "Визуальная диагностика респираторного дистресс синдрома" - скачать презентации по Медицине Как драгоценна жизнь твоя в глазах моих
Как драгоценна жизнь твоя в глазах моих Выполнение судовых работ. Рулевые устройства
Выполнение судовых работ. Рулевые устройства Собор Святого Павла в Лондоне
Собор Святого Павла в Лондоне География древних путешествий
География древних путешествий Организация занятий адаптивной физической культурой и спортом в общеобразовательных школах коррекционного типа
Организация занятий адаптивной физической культурой и спортом в общеобразовательных школах коррекционного типа Принципы физического воспитания. Условия здорового образа жизни
Принципы физического воспитания. Условия здорового образа жизни Герасимова Елена Владимировна МБОУ «Гимназия 1»
Герасимова Елена Владимировна МБОУ «Гимназия 1»  Я і мае сябры. Беларускія гульні. (Тэма 12)
Я і мае сябры. Беларускія гульні. (Тэма 12) Отдел кадров Филиал Приволжский
Отдел кадров Филиал Приволжский Context management
Context management Имипенем
Имипенем