Содержание
- 2. Актуальность темы Нуклеотиды и их производные выполняют многообразные функции в организме человека: участвуют в синтезе нуклеиновых
- 3. План лекции Образование фосфорибозилдифосфата (ФРДФ) – ключевой момент в синтезе нуклеотидов Синтез и катаболизм пуриновых нуклеотидов:
- 4. Цель лекции Знать: Основные метаболические пути превращения пуриновых и пиримидиновых нуклеотидов Химико-биологическую сущность процессов репликации, транскрипции,
- 5. Вспомните самостоятельно из курса химии, используя слайды 6-14 Пуриновые и пиримидиновые азотистые основания Структура пуриновых и
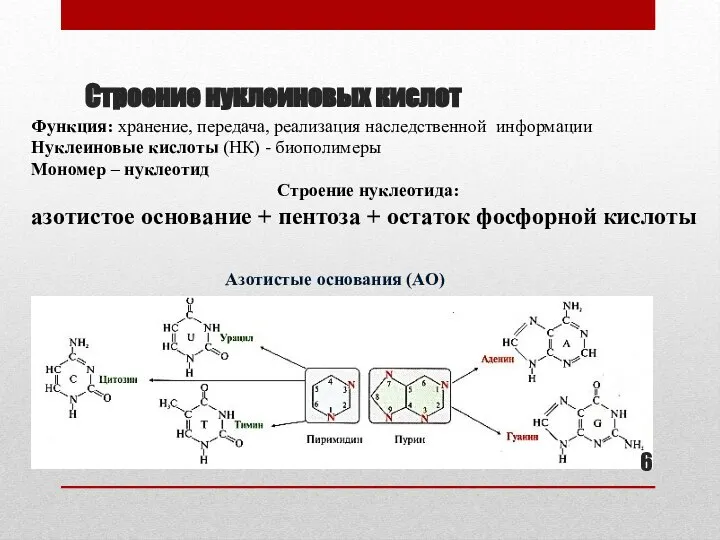
- 6. Строение нуклеиновых кислот Функция: хранение, передача, реализация наследственной информации Нуклеиновые кислоты (НК) - биополимеры Мономер –
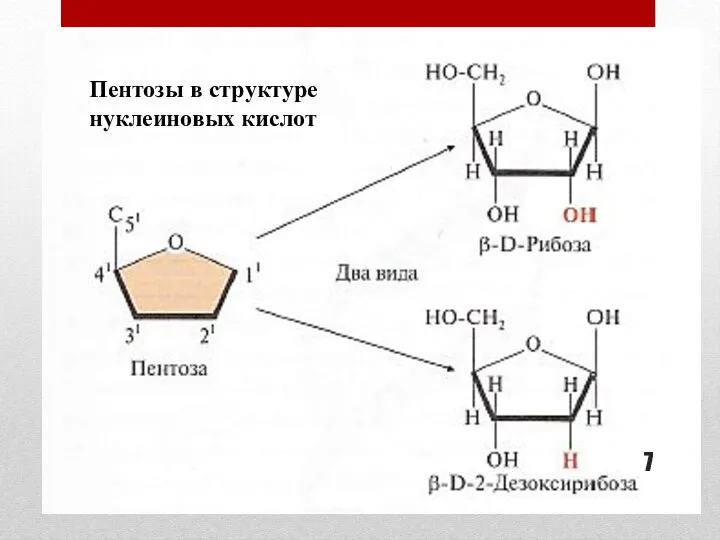
- 7. Пентозы в структуре нуклеиновых кислот
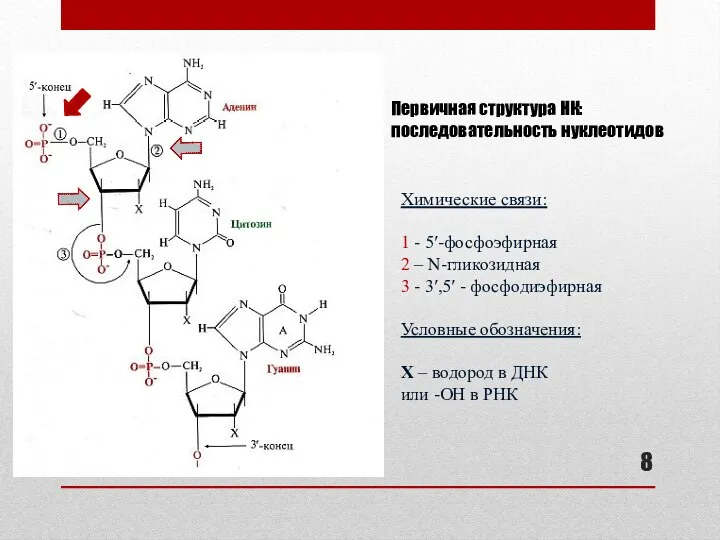
- 8. Первичная структура НК: последовательность нуклеотидов Химические связи: 1 - 5′-фосфоэфирная 2 – N-гликозидная 3 - 3′,5′
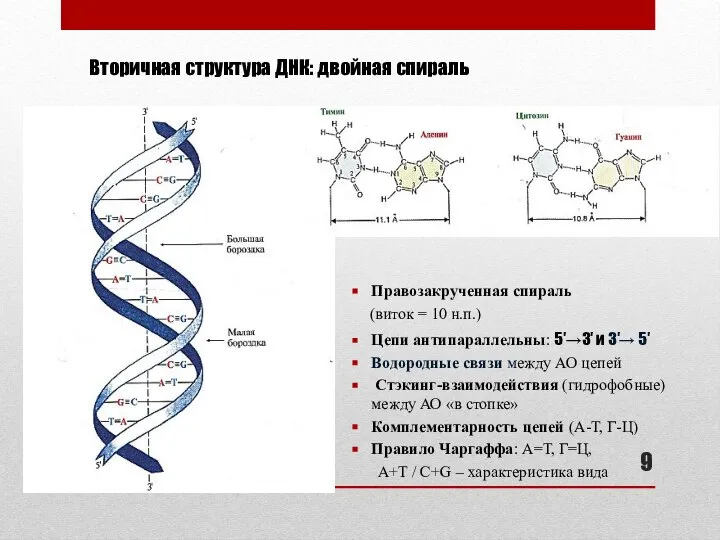
- 9. Вторичная структура ДНК: двойная спираль Правозакрученная спираль (виток = 10 н.п.) Цепи антипараллельны: 5′→3′ и 3′→
- 10. Третичная структура ДНК: нуклеопротеидные комплексы (хромосомы) Гистоновые белки: белки с высоким содержанием лиз и арг 5
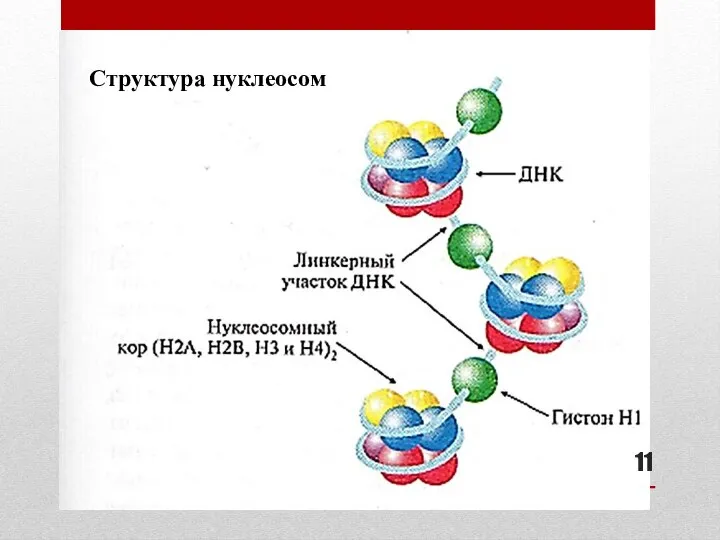
- 11. Структура нуклеосом
- 12. Пространственная структура РНК Одноцепочечная Шпильки – спирализованные участки (водородные связи) Не соблюдается правило Чаргаффа Виды РНК:
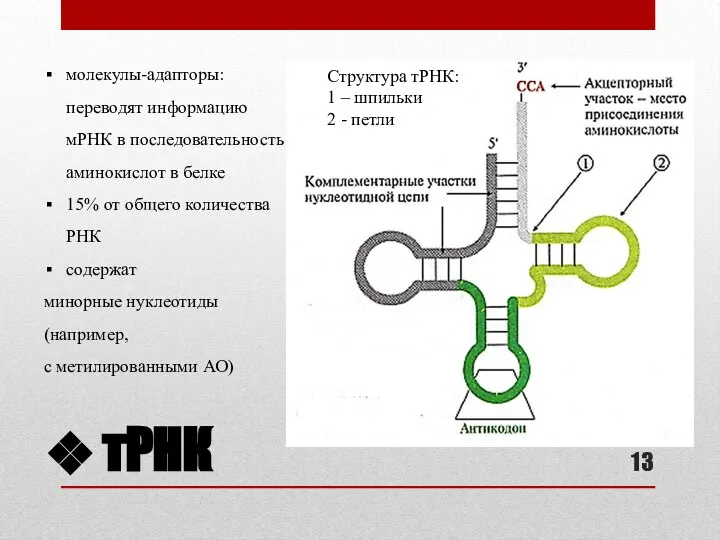
- 13. тРНК Структура тРНК: 1 – шпильки 2 - петли молекулы-адапторы: переводят информацию мРНК в последовательность аминокислот
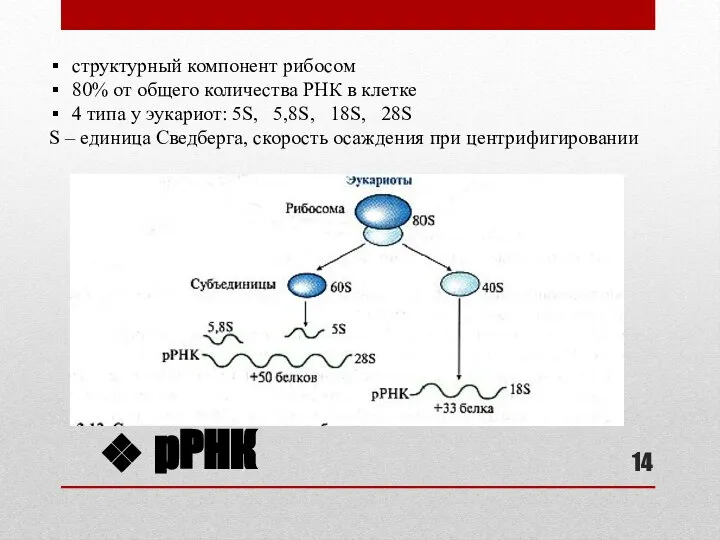
- 14. рРНК структурный компонент рибосом 80% от общего количества РНК в клетке 4 типа у эукариот: 5S,
- 15. Образование фосфорибозилдифосфата (ФРДФ) Продукты расщепления нуклеиновых кислот тканей и пищи используются повторно в незначительной степени. Почти
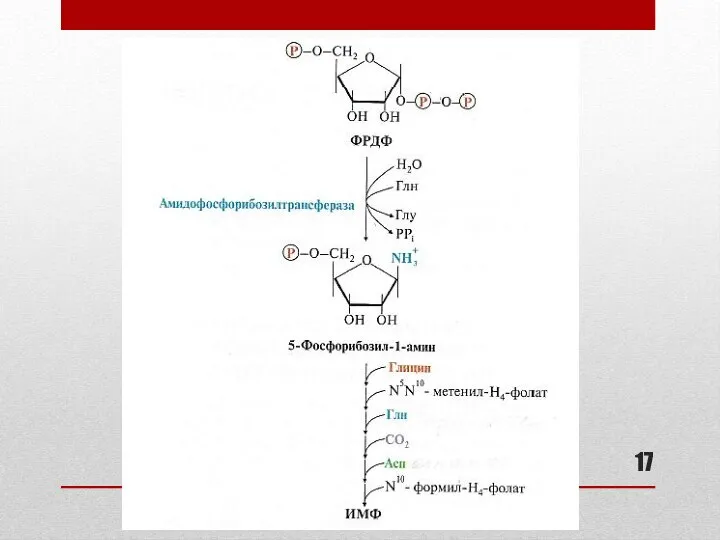
- 16. Синтез пуриновых нуклеотидов: основные этапы (см. схему реакций на слайде 17) Сборка пуринового гетероциклического основания осуществляется
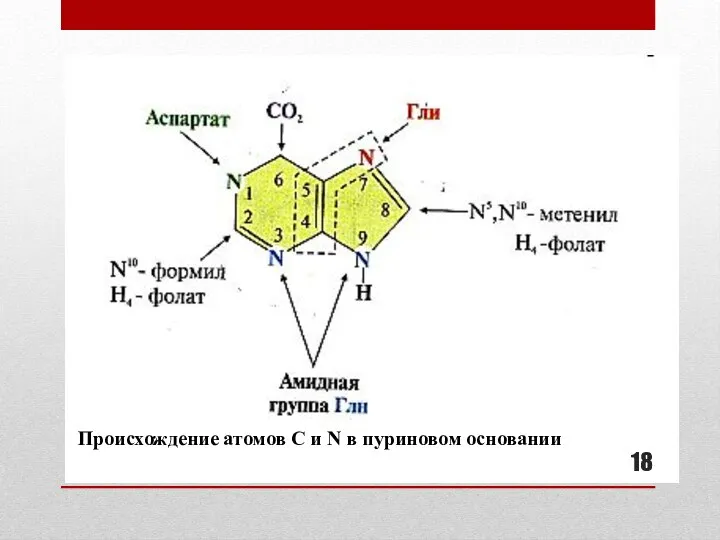
- 18. Происхождение атомов С и N в пуриновом основании
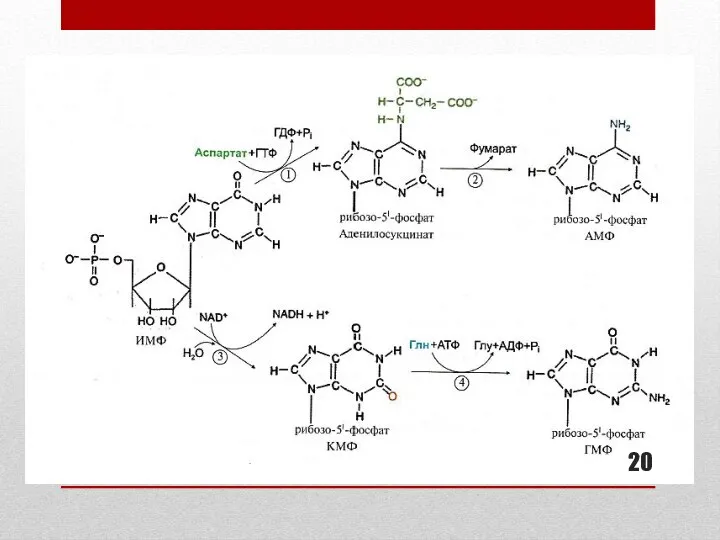
- 19. Образование АМФ и ГМФ из ИМФ Образование АДФ, ГДФ, ГТФ В образовании АМФ из ИМФ участвует
- 21. Ферменты синтеза АМФ И ГМФ: подписи к схеме слайда 20. В синтезе АМФ из ИМФ участвуют
- 22. Регуляция синтеза пуриновых нуклеотидов Аллостерические ферменты: ФРДФ-синтетаза амидофосфорибозилтрансфераза ИМФ-дегидрогеназа Аденилосукцинатсинтетаза Отрицательные эффекторы: АМФ, ГМФ
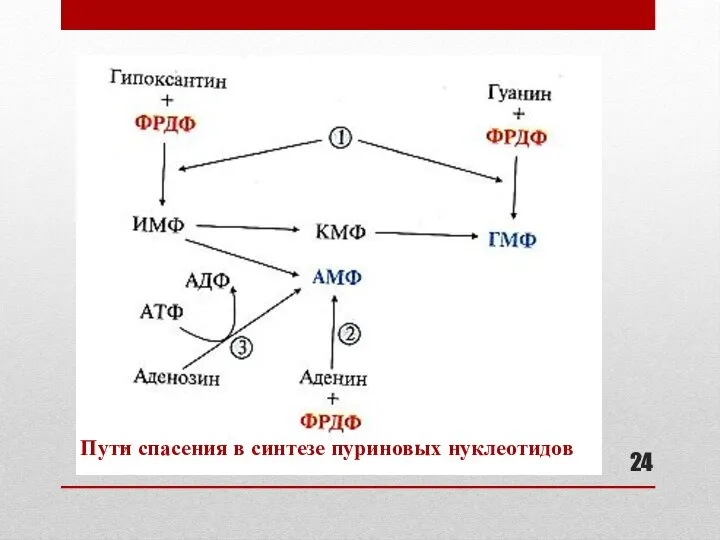
- 23. Запасные пути синтеза пуриновых нуклеотидов : роль «пути спасения» В период активного роста тканей синтез пуриновых
- 24. Пути спасения в синтезе пуриновых нуклеотидов
- 25. Ферменты «пути спасения» в синтезе пуриновых нуклеотидов К слайду 24: 1 – гипоксантин-гуанинфосфорибозилтрансфераза 2 – аденинфосфорибозилтрансфераза
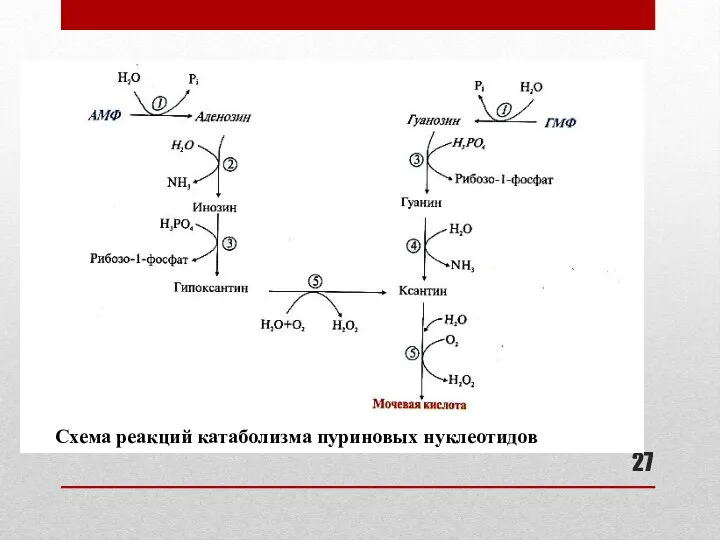
- 26. Катаболизм пуриновых нуклеотидов Отщепление фосфата, аминогруппы, рибозы с образованием азотистых оснований гипоксантина и ксантина (см. схему
- 27. Схема реакций катаболизма пуриновых нуклеотидов
- 28. Ферменты катаболизма пуриновых нуклеотидов К слайду 27: 1 – фосфатаза (нуклеотидаза) 2 – аденозиндезаминаза 3 –
- 29. Нарушения обмена пуриновых нуклеотидов Дефект генов ферментов гиперактивация или устойчивость ФРДФ-синтетазы к аллостерическим ингибиторам снижение активности
- 30. Синтез пиримидиновых нуклеотидов Основные этапы синтеза: Формирование пиримидинового кольца (оротата) из глутамина, аспартата, СО2 Взаимодействие оротата
- 31. Образование оротата и УМФ глутамин + СО2 + 2 АТФ + Н2О → карбамоилфосфат + 2
- 32. Нарушения образования оротата Мутация в гене УМФ-синтазы приводит к нарушению образования УМФ их оротата и вызывает
- 33. Фосфорилирование УМФ и образование ЦТФ Фосфорилирование УМФ: образование УТФ УМФ + АТФ → УДФ + АДФ
- 34. Регуляция синтеза пиримидиновых нуклеотидов Аллостерическая регуляция по механизму отрицательной обратной связи: УТФ ингибирует КФС II в
- 35. Катаболизм пиримидиновых нуклеотидов Отщепление остатков фосфорной кислоты и рибозы (аналогично катаболизму пуриновых нуклеотидов) Пиримидиновые основания разрушаются
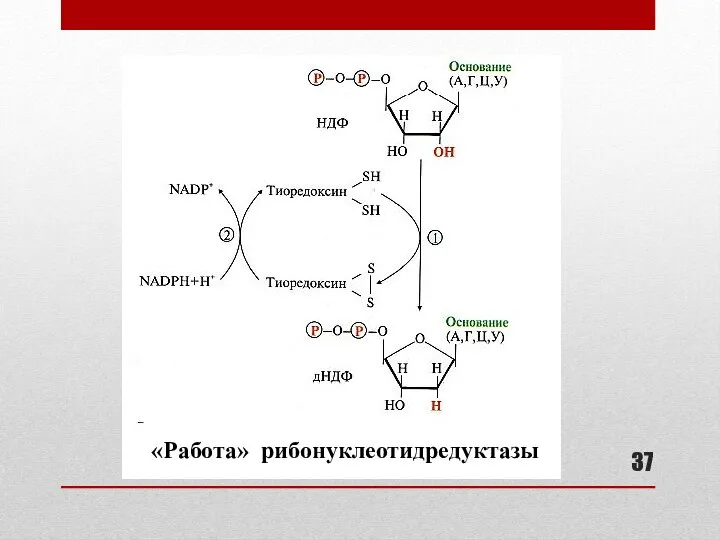
- 36. Образование дезоксирибонуклеотидов Образование дНДФ (А, Г, Ц, У) из НДФ Образование дТМФ из дУМФ Внутриклеточная концентрация
- 37. «Работа» рибонуклеотидредуктазы
- 38. Регуляция активности рибонуклеотидредуктазного комлпекса Аллостерический фермент Отрицательные эффекторы: дНТФ дАТФ – ингибитор восстановления всех рибонуклеотидов Иммунодефициты:
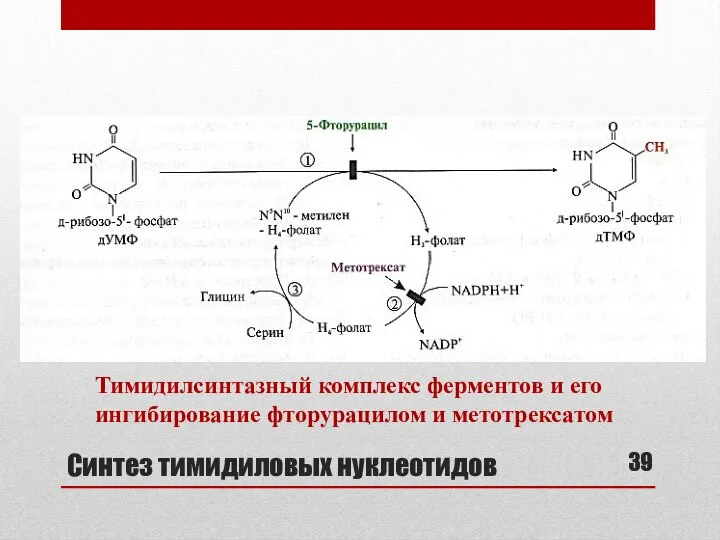
- 39. Синтез тимидиловых нуклеотидов Тимидилсинтазный комплекс ферментов и его ингибирование фторурацилом и метотрексатом
- 40. Тимидилсинтазный комплекс ферментов 1- Тимидилсинтаза (включение одноуглеродного радикала в дУМФ) 2- Дигидрофолатредуктаза 3- Сериноксиметилтрансфераза (перенос оксиметильной
- 41. Задание для самостоятельной работы Изучить информацию по теме: «Ферменты синтеза нуклеотидов – мишени действия противоопухолевых и
- 42. Заключение «Обмен нуклеотидов» Большая часть используемых в клетках нуклеотидов синтезируется de novo из простых предшественников (с
- 43. Литература по теме «Обмен нуклеотидов» 1. Биохимия с упражнениями и задачами: учебник для студентов ВУЗов /
- 44. Матричные биосинтезы Репликация Транскрипция Трансляция
- 45. РЕПЛИКАЦИЯ: синтез ДНК Протекает в ядре в S-фазу клеточного цикла перед митозом Стимулы: гормоны, ростовые факторы,
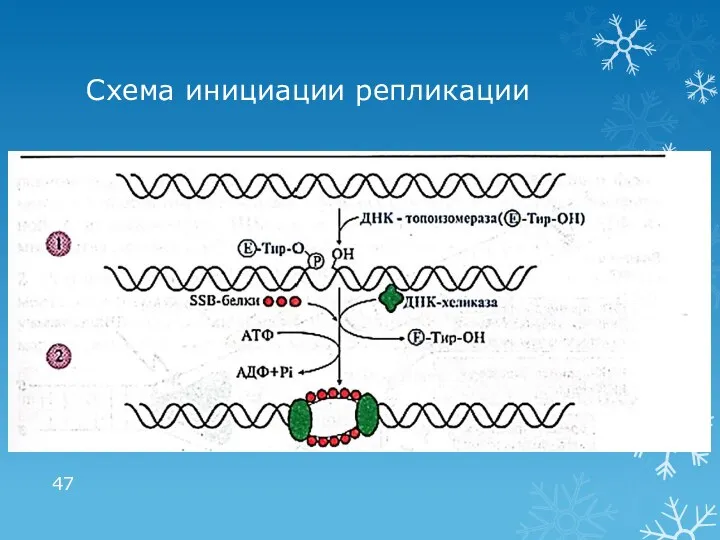
- 46. 1 этап репликации: инициация Формирование репликативной вилки: ДНК-топоизомераза гидролизует 3′,5′-фосфодиэфирную связь в одной из цепей ДНК
- 47. Схема инициации репликации
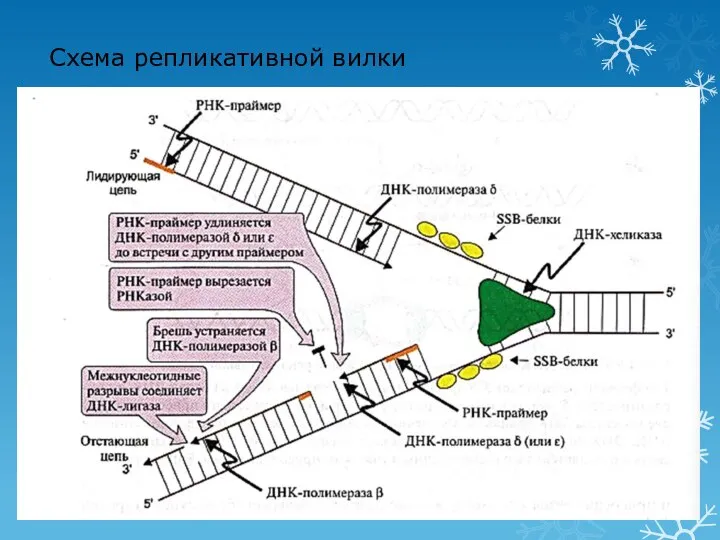
- 48. 2 этап репликации: элонгация Синтез новых цепей ДНК Лидирующая цепь: 3′ - 5′ (синтез непрерывный по
- 49. 3 этап репликации: терминация Исключение праймеров Завершение формирования отстающей цепи ДНК Эндонуклеаза (РНКаза) удаляет РНК-праймер ДНК-полимераза
- 50. Схема репликативной вилки
- 51. Репарация ошибок и повреждений ДНК Причина повреждений ДНК: действие факторов окружающей и внутренней среды Повреждение ДНК
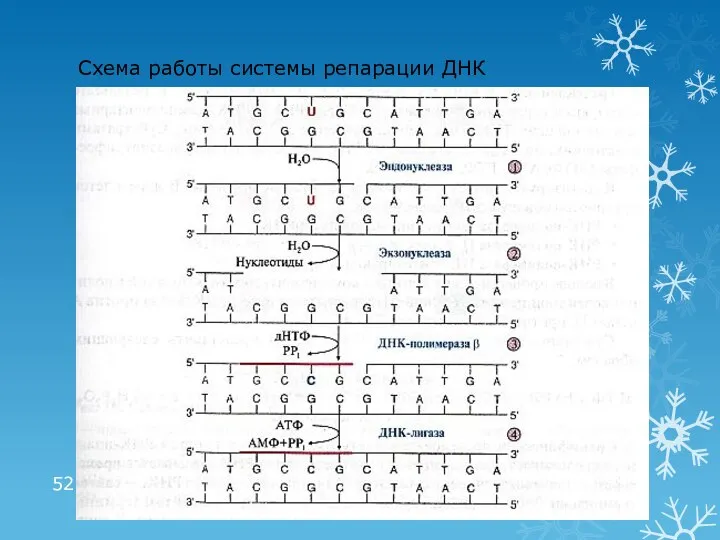
- 52. Схема работы системы репарации ДНК
- 53. Роль системы репарации Репарация необходима для сохранения генома и возможна благодаря существованию 2-х цепей ДНК Снижение
- 54. ТРАНСКРИПЦИЯ: синтез РНК Протекает в ядре вне зависимости от фаз клеточного цикла Матрица: нить ДНК 3′
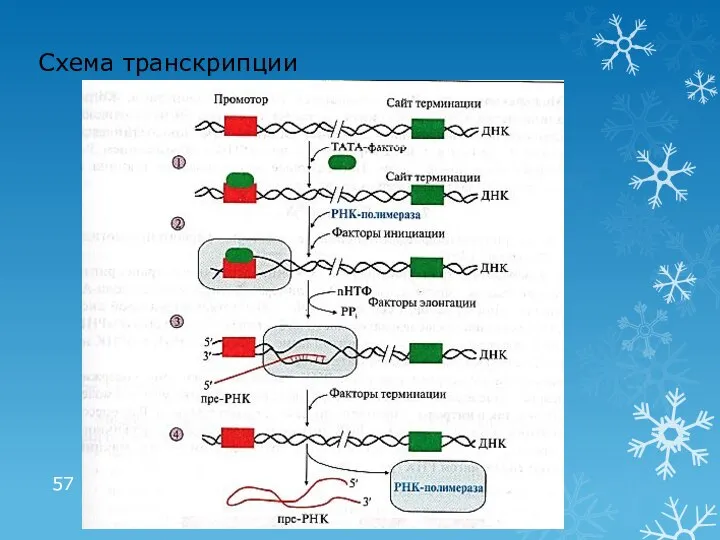
- 55. 1 этап транскрипции: инициация Промотор – последовательность ДНК (ТАТА), с которой связывается РНК-полимераза Сайт терминации –
- 56. 2 этап транскрипции: элонгация и терминация Элонгация: рост нити пре-РНК Факторы элонгации (E, H, F) повышают
- 57. Схема транскрипции
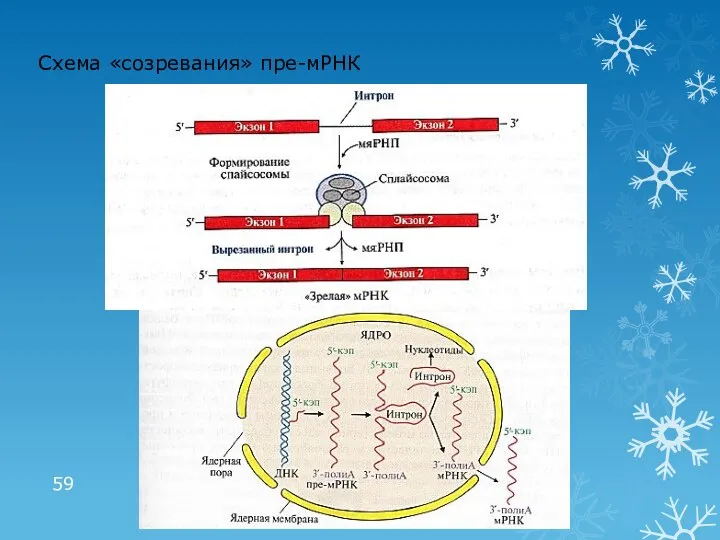
- 58. Посттранскрипционные модификации пре-РНК «Созревание» пре-мРНК «Кэпирование» на стадии элонгации Образование поли(А)- «хвоста» после транскрипции Сплайсинг –
- 59. Схема «созревания» пре-мРНК
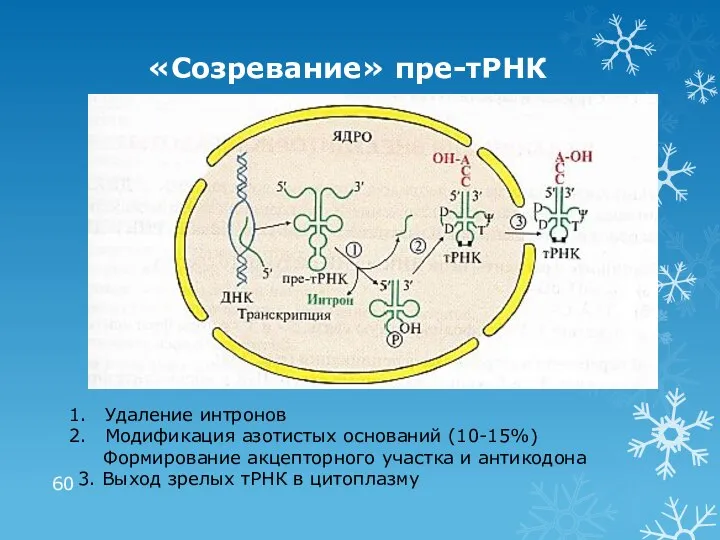
- 60. «Созревание» пре-тРНК Удаление интронов Модификация азотистых оснований (10-15%) Формирование акцепторного участка и антикодона 3. Выход зрелых
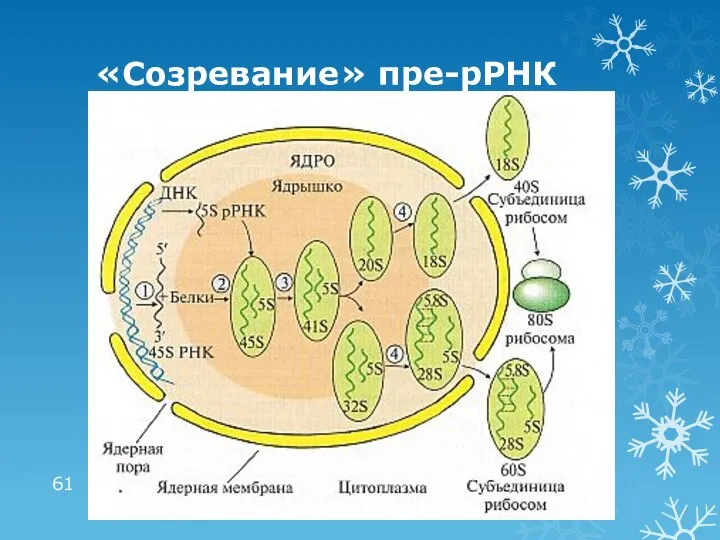
- 61. «Созревание» пре-рРНК
- 62. ТРАНСЛЯЦИЯ: синтез белка Место синтеза: рибосомы Матрица: мРНК Субстраты: аминокислоты (АК) Адапторы: тРНК Источники энергии: АТФ,
- 63. Свойства биологического кода Триплетность Наличие терминирующих кодонов (UAA, UAG, UGA) Специфичность Вырожденность Универсальность Однонаправленность Колинеарность
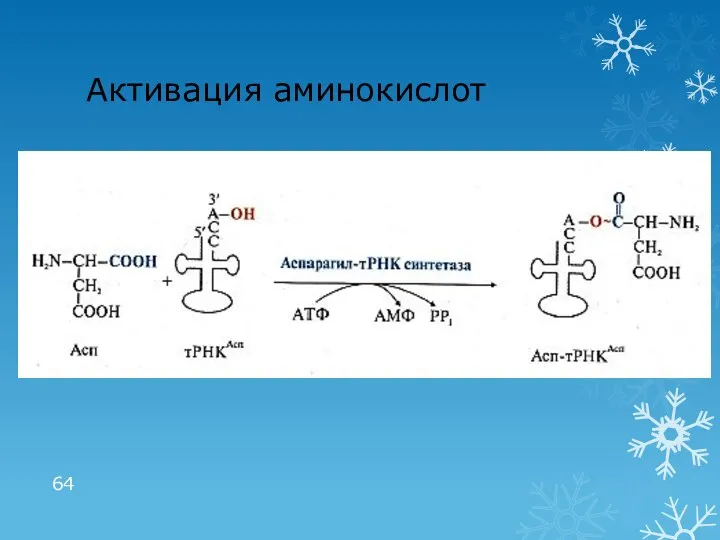
- 64. Активация аминокислот
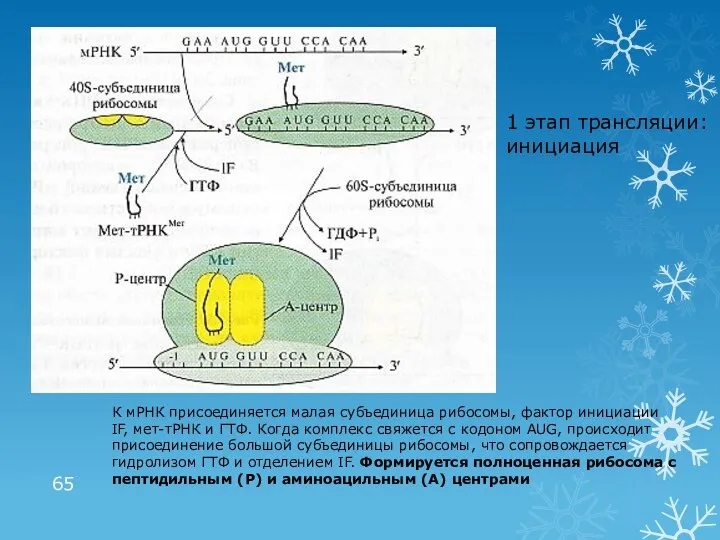
- 65. 1 этап трансляции: инициация К мРНК присоединяется малая субъединица рибосомы, фактор инициации IF, мет-тРНК и ГТФ.
- 66. 2 этап трансляции: элонгация (рост пептидной цепи) Стадии элонгации: Связывание аа-тРНК в А-центре при участии фактора
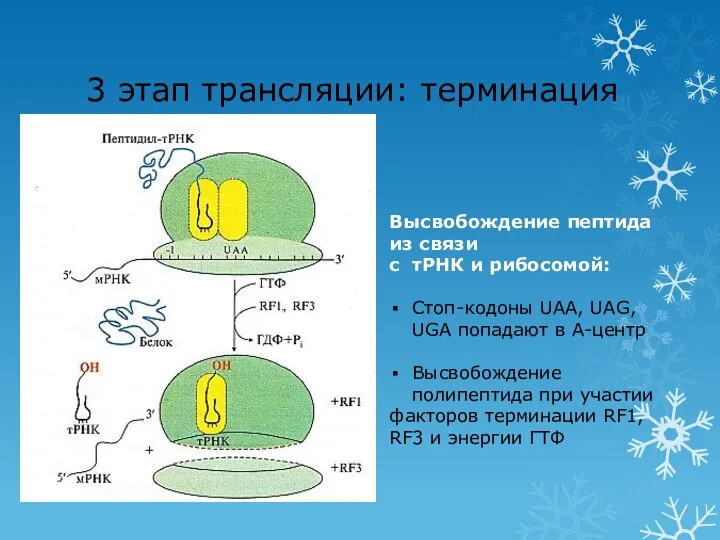
- 67. 3 этап трансляции: терминация Высвобождение пептида из связи с тРНК и рибосомой: Стоп-кодоны UAA, UAG, UGA
- 68. Посттрансляционные модификации белков – образование функционально активных белков Частичный протеолиз Фолдинг – формирование пространственной структуры (II,
- 69. Регуляция матричных биосинтезов Экспрессия генов — процесс, в ходе которого наследственная информация от гена (последовательности нуклеотидов
- 70. Адаптивная регуляция обеспечивает изменение скорости экспрессии генов в ответ на меняющиеся условия среды (индуцибельная экспрессия). Осуществляется
- 71. Примеры ингибиторов матричных биосинтезов Токсин белой поганки аманитин ингибирует РНК-полимеразу II (синтез мРНК) Энтеротоксин возбудителя дифтерии
- 72. Задание для самостоятельной работы Изучить информацию по теме: «Лекарственные препараты - ингибиторы синтеза нуклеиновых кислот и
- 73. Заключение «Матричные биосинтезы» Процессы репликации, транскрипции, трансляции (матричные биосинтезы) лежат в основе «производства» белков и ферментов,
- 75. Скачать презентацию
















































 Безработица инфляция
Безработица инфляция  Презентация «КОМИССИЯ»
Презентация «КОМИССИЯ» Т Е М А «ОСНОВАНИЯ ВОЗНИКНОВЕНИЯ, ИЗМЕНЕНИЯ И ПРЕКРАЩЕНИЯ ГРАЖДАНСКИХ ПРАВООТНОШЕНИЙ»
Т Е М А «ОСНОВАНИЯ ВОЗНИКНОВЕНИЯ, ИЗМЕНЕНИЯ И ПРЕКРАЩЕНИЯ ГРАЖДАНСКИХ ПРАВООТНОШЕНИЙ» Поход 50 км. Преодолей себя
Поход 50 км. Преодолей себя Роль исламского образования и духовного воспитания в формировании религиозной идентичности детей
Роль исламского образования и духовного воспитания в формировании религиозной идентичности детей Инженерная графика. Основы начертальной геометрии
Инженерная графика. Основы начертальной геометрии Стимулирование качества труда учителя и критерии оценки качества Методика расчета
Стимулирование качества труда учителя и критерии оценки качества Методика расчета КАЗИМИР СЕВЕРИНОВИЧ МАЛЕВИЧ (1878-1935)
КАЗИМИР СЕВЕРИНОВИЧ МАЛЕВИЧ (1878-1935) The British isles
The British isles Гибкие методологии разработки программного обеспечения
Гибкие методологии разработки программного обеспечения Топ 5 горячих точек мира
Топ 5 горячих точек мира Программирование. Практическое занятие
Программирование. Практическое занятие Музыкальные инструменты народов Урала
Музыкальные инструменты народов Урала Переключение задач
Переключение задач Презентация Жалоба и представление на приговор, определение, постановление суда
Презентация Жалоба и представление на приговор, определение, постановление суда Презентация Психология толпы. Гюстав Лебон
Презентация Психология толпы. Гюстав Лебон American pronunciation
American pronunciation Основы технологии текущего и капитального ремонта скважин
Основы технологии текущего и капитального ремонта скважин Внутрибольничные инфекции
Внутрибольничные инфекции Экономическое обоснование бизнес-проекта GreenLeaf
Экономическое обоснование бизнес-проекта GreenLeaf Камешковая декоративная штукатурка
Камешковая декоративная штукатурка Политические партии и движения
Политические партии и движения Лекция №26 Гнойные заболевания костей и суставов.
Лекция №26 Гнойные заболевания костей и суставов. Вера Мухина
Вера Мухина Широкая Масленица
Широкая Масленица Банковская система Фатеева Т.А., учитель истории МБОУ-гимназии №20 г.Тулы
Банковская система Фатеева Т.А., учитель истории МБОУ-гимназии №20 г.Тулы  Выполнила студентка 41 группы: Лукахина Яна
Выполнила студентка 41 группы: Лукахина Яна Тема: «Числа 1-5» Составила: учитель начальных классов МОУ «Бичуринская ООШ» Мариинско-Посадского района Чувашской Респуб
Тема: «Числа 1-5» Составила: учитель начальных классов МОУ «Бичуринская ООШ» Мариинско-Посадского района Чувашской Респуб