Содержание
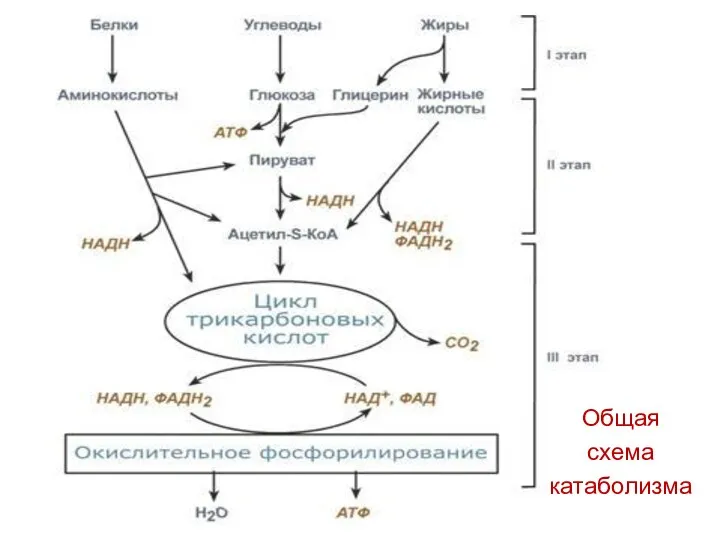
- 2. Общая схема катаболизма
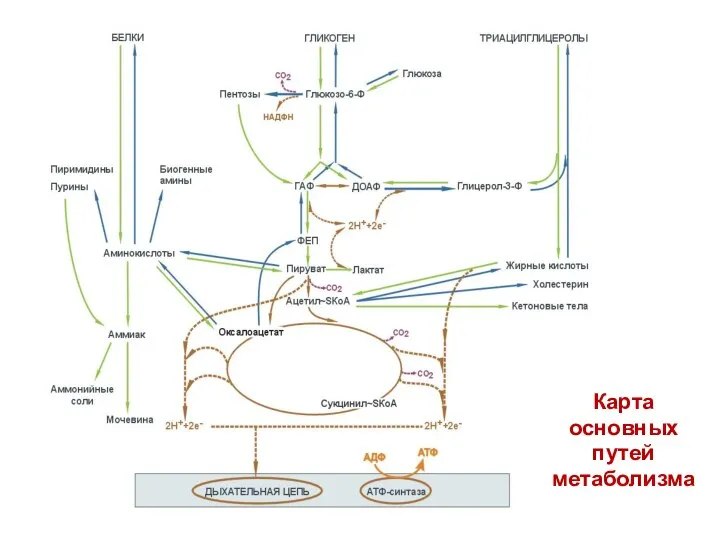
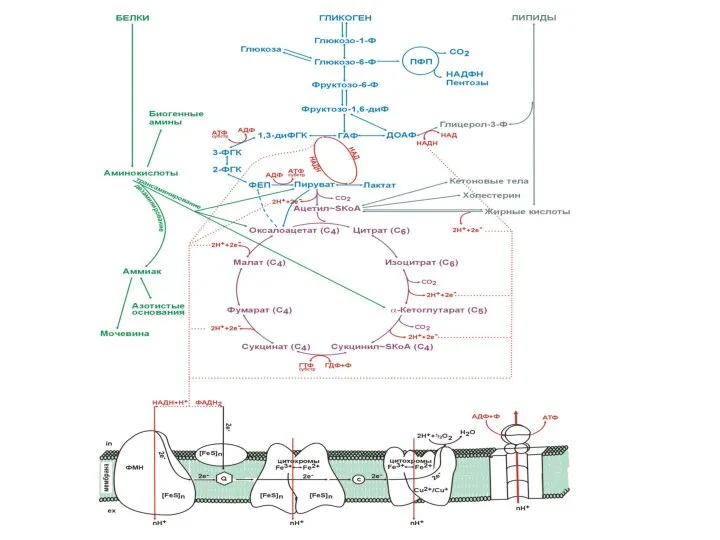
- 3. Карта основных путей метаболизма
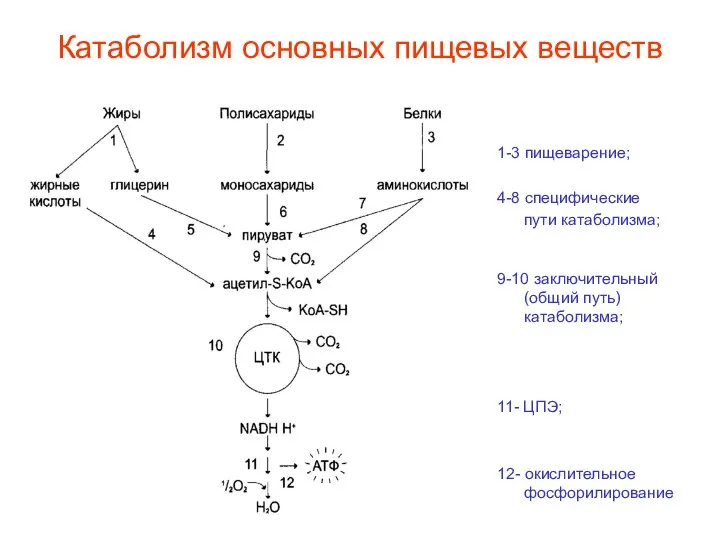
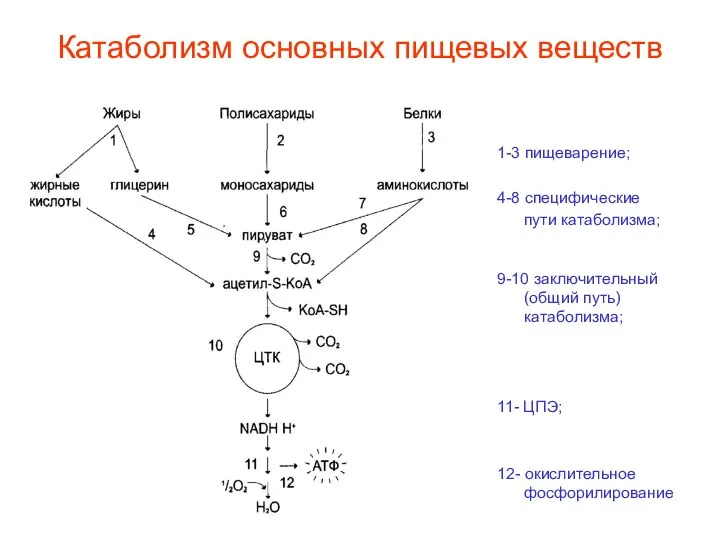
- 4. Катаболизм основных пищевых веществ 1-3 пищеварение; 4-8 специфические пути катаболизма; 9-10 заключительный (общий путь) катаболизма; 11-
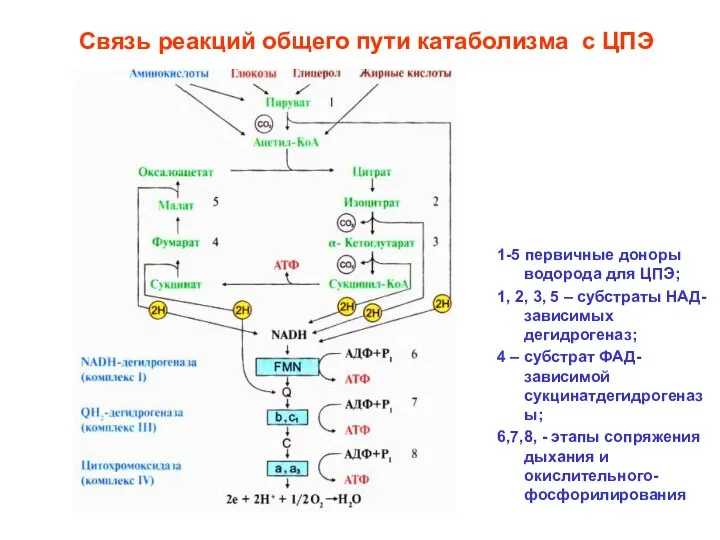
- 5. Связь реакций общего пути катаболизма с ЦПЭ 1-5 первичные доноры водорода для ЦПЭ; 1, 2, 3,
- 7. Катаболизм органических веществ в тканях сопровождается потреблением О2 и выделением СО2. Этот процесс называют тканевым дыханием.
- 8. Окисляемые различные органические вещества (S – субстраты), представляют собой метаболиты катаболизма, их дегидрирование является экзорганическим процессом.
- 9. Окислительное фосфорилирование – основная часть биологического окисления или тканевого дыхания, т.е. процессов, идущих в организме с
- 10. Впервые механизм окислительного фосфорилирования был предложен П.Митчеллом. Согласно этой гипотезе перенос электронов, происходящий на внутренней митохондриальной
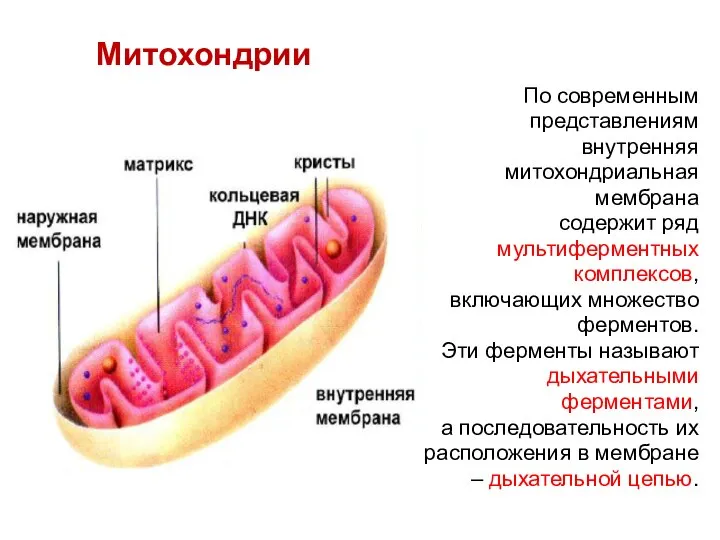
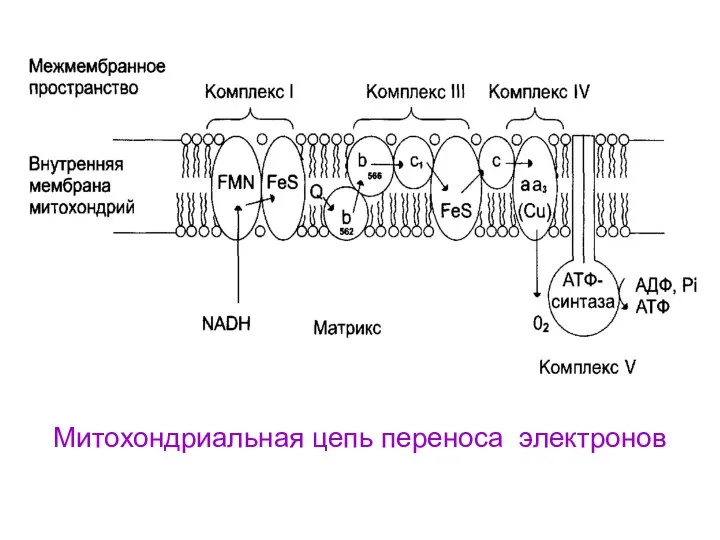
- 11. Митохондрии По современным представлениям внутренняя митохондриальная мембрана содержит ряд мультиферментных комплексов, включающих множество ферментов. Эти ферменты
- 12. По современным представлениям внутренняя митохондриальная мембрана содержит ряд мультиферментных комплексов, включающих множество ферментов. Эти ферменты называют
- 13. ПРИНЦИП РАБОТЫ ДЫХАТЕЛЬНОЙ ЦЕПИ В целом работа дыхательной цепи заключается в следующем: 1. Образующиеся в реакциях
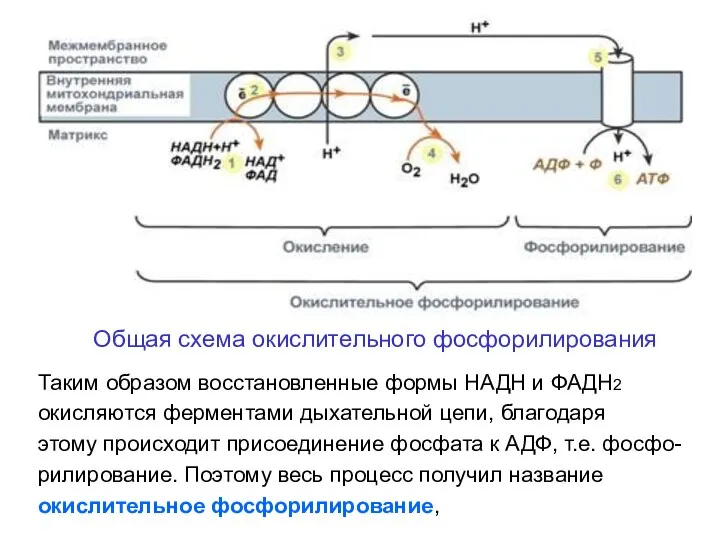
- 14. Общая схема окислительного фосфорилирования Таким образом восстановленные формы НАДН и ФАДН2 окисляются ферментами дыхательной цепи, благодаря
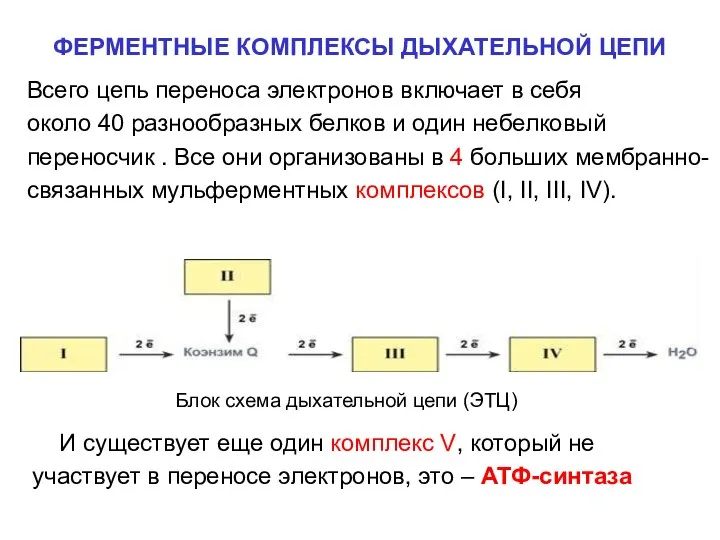
- 15. ФЕРМЕНТНЫЕ КОМПЛЕКСЫ ДЫХАТЕЛЬНОЙ ЦЕПИ Всего цепь переноса электронов включает в себя около 40 разнообразных белков и
- 16. Комплексы дыхательной цепи I комплекс - НАДН-дегидрогеназа, II комплекс - включает в себя ФАД-зависимые ферменты (как
- 17. Митохондриальная цепь переноса электронов
- 18. Функции комплексов дыхательной цепи I комплекс – 1. Принимает электроны от НАДН и передает их на
- 19. IV комплекс – 1. Принимает электроны от цитохрома с и передает их на кислород с образованием
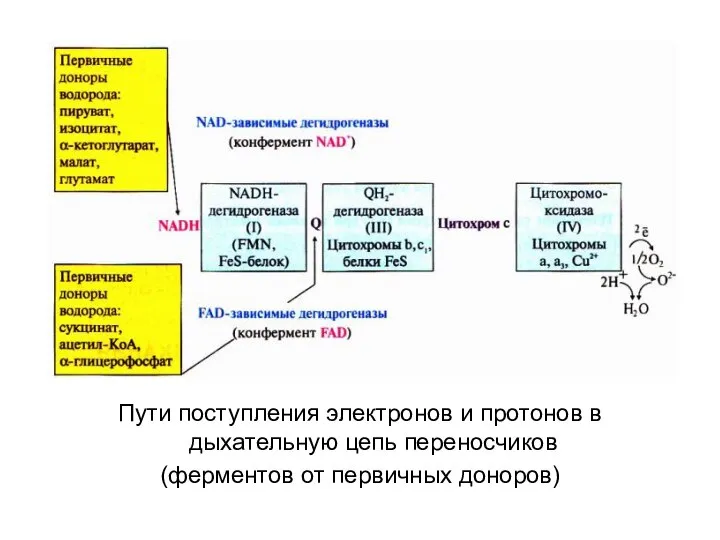
- 20. Пути поступления электронов и протонов в дыхательную цепь переносчиков (ферментов от первичных доноров)
- 21. Работа комплексов дыхательной цепи Ферменты дыхательной цепи расположены в строго определенной последовательности: каждый последующий белок обладает
- 22. Стандартные окислительно-восстановительные потенциалы некоторых сопряженных пар
- 23. 3. Здесь атомы водорода (от НАДН и ФАДН2) передают свои электроны в дыхательную ферментативную цепь, по
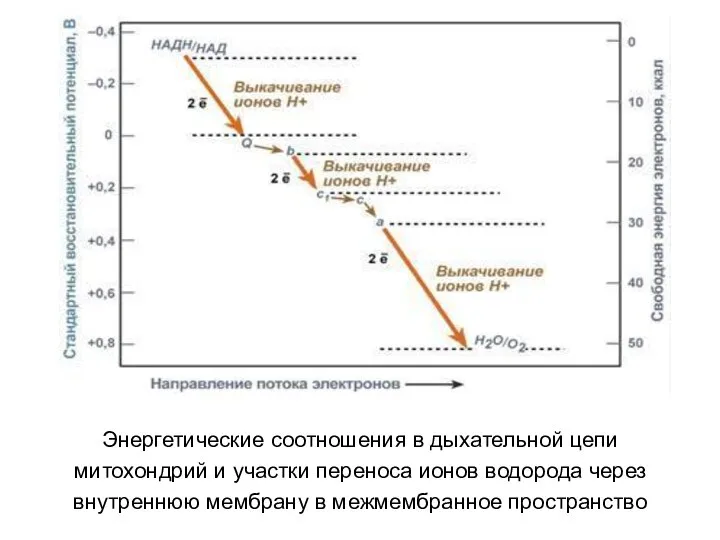
- 24. 5. Перенос ионов водорода через мембрану (выкачивание) происходит не случайно, а в строго определенных участках мембраны.
- 25. Энергетические соотношения в дыхательной цепи митохондрий и участки переноса ионов водорода через внутреннюю мембрану в межмембранное
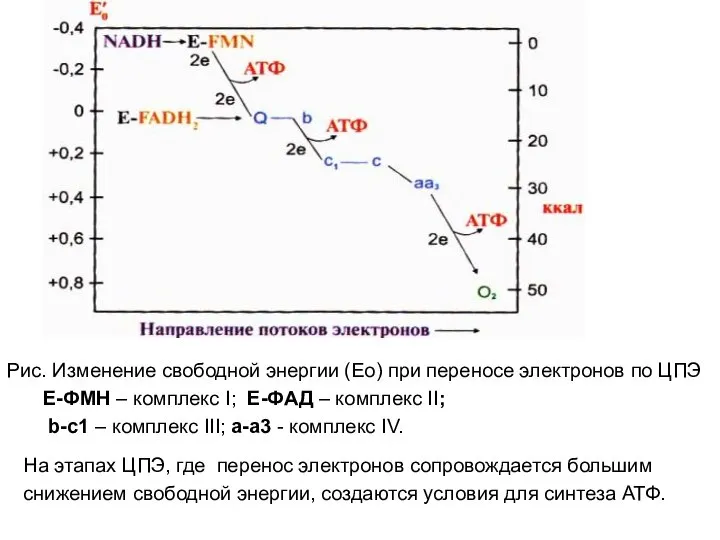
- 26. Рис. Изменение свободной энергии (Ео) при переносе электронов по ЦПЭ Е-ФМН – комплекс I; Е-ФАД –
- 27. 6. Как завершение всех предыдущих событий и необходимый их результат происходит наработка АТФ. Ионы водорода теряют
- 28. Сопряжение тканевого дыхания и синтеза АТФ 1. Перенос электронов по ЦПЭ при участии комплексов I, III
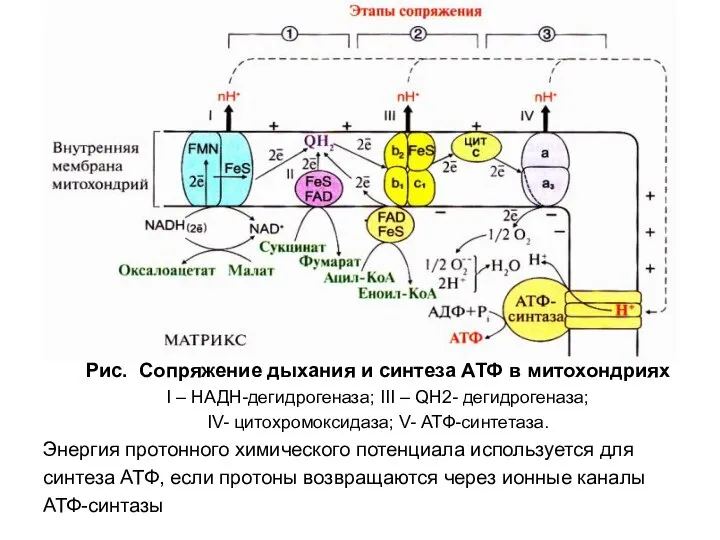
- 29. Рис. Сопряжение дыхания и синтеза АТФ в митохондриях I – НАДН-дегидрогеназа; III – QН2- дегидрогеназа; IV-
- 30. 3. Каждый из трех комплексов ЦПЭ (I, III и IV ) обеспечивает необходимый протонный градиент для
- 31. о Витамине С Вит С
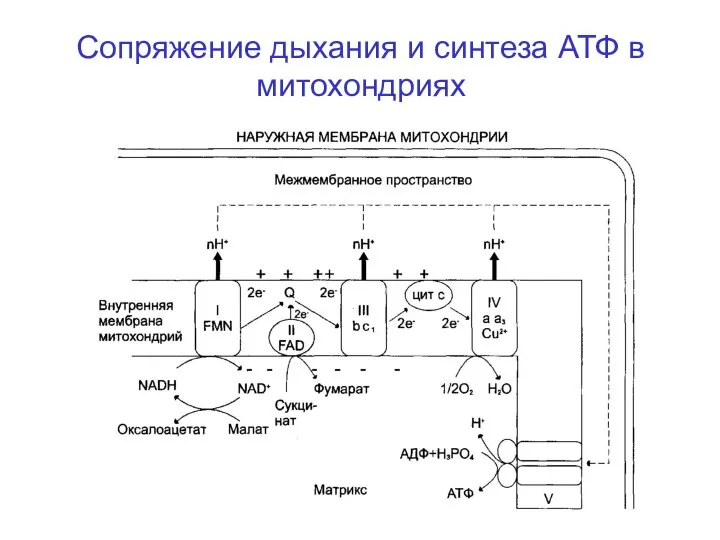
- 32. Сопряжение дыхания и синтеза АТФ в митохондриях
- 33. При участии АТФ-АДФ транслоказы, расположенной во внутренней мембране митохондрий, АТФ транспортируется в цитоплазму в обмен на
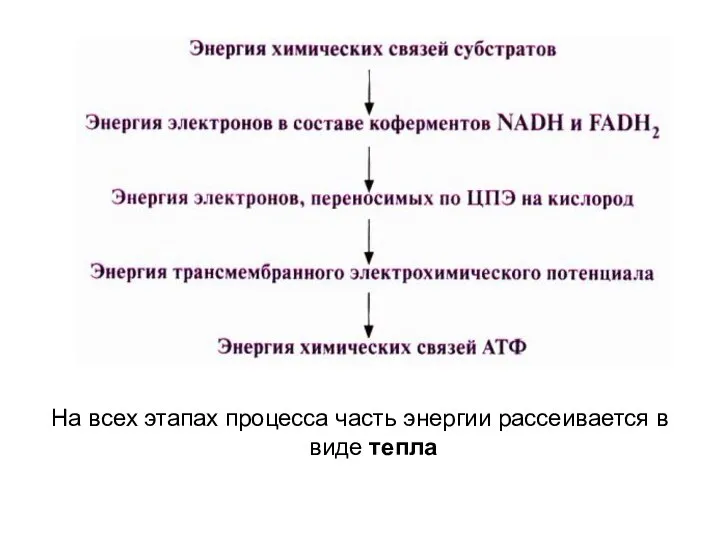
- 34. На всех этапах процесса часть энергии рассеивается в виде тепла
- 35. Аналоги АТФ: ГТФ ЦТФ УТФ
- 36. Дыхательный контроль Перенос электронов по ЦПЭ и синтез АТФ тесно сопряжены, т.е. могут происходить только одномоментно
- 37. Синтез АТФ регулируется Работа дыхательных ферментов регулируется с помощью эффекта, который получил название дыхательный контроль. Дыхательный
- 38. Возрастание протонного градиента возникает при исчерпании запасов АДФ и накоплении АТФ, т.е. когда АТФ-синтаза лишена своего
- 39. Таким образом скорость синтеза АТФ точно соответствует потребностям клетки в энергии. Ускорение тканевого дыхания и окислительного
- 40. Разобщение дыхания и синтеза АТФ Некоторые липофильные вещества (2,4-динитрофенол, некоторые жирные кислоты) могут переносить ионы водорода
- 41. Терморегуляторная функция дыхания При переносе электронов по ЦПЭ часть энергии рассеивается в виде теплоты, которая используется
- 42. Кроме того дополнительное образование теплоты может происходить путем разобщения дыхания и фосфорилирования в процессе адаптации к
- 43. У новорожденных и зимнеспящих животных разобщение связано с наличием разобщающего белка – термогенина (до 15% от
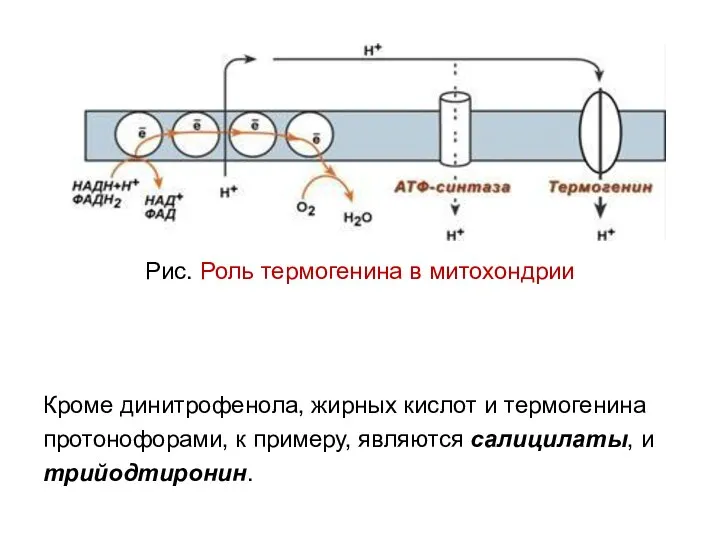
- 44. Рис. Роль термогенина в митохондрии Кроме динитрофенола, жирных кислот и термогенина протонофорами, к примеру, являются салицилаты,
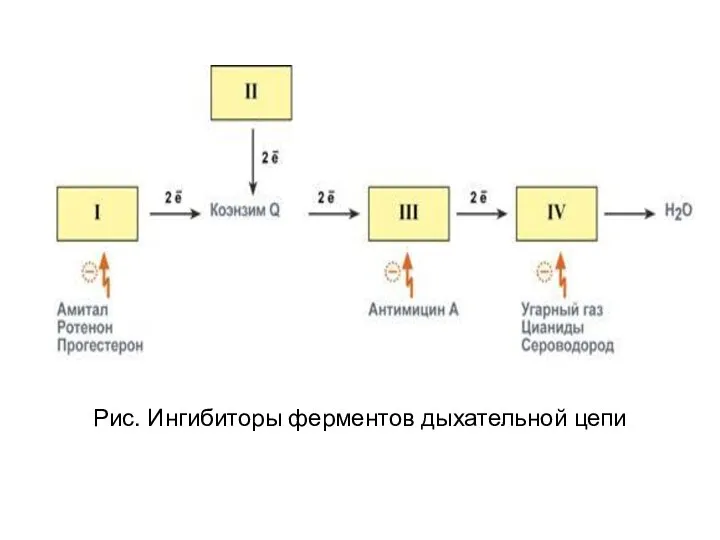
- 45. Ингибиторы дыхания Некоторые лекарственные вещества, химические агенты и антибиотики вызывают ингибирование ферментов, либо собственно дыхательной цепи:
- 46. Рис. Ингибиторы ферментов дыхательной цепи
- 47. Гипоэнергетические состояния Причинами гипоэнергетических состояний может быть следующее: 1. гиповитаминозы экзогенные и/или эндогенные – снижается скорость
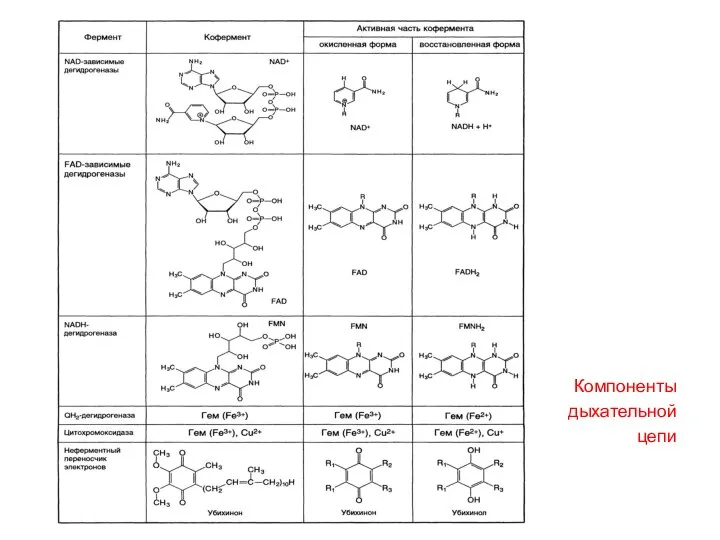
- 48. Состав компонентов дыхательной цепи НАД содержит витамин В3 или РР (никотиновая кислота) ФМН и ФАД –
- 49. Компоненты дыхательной цепи
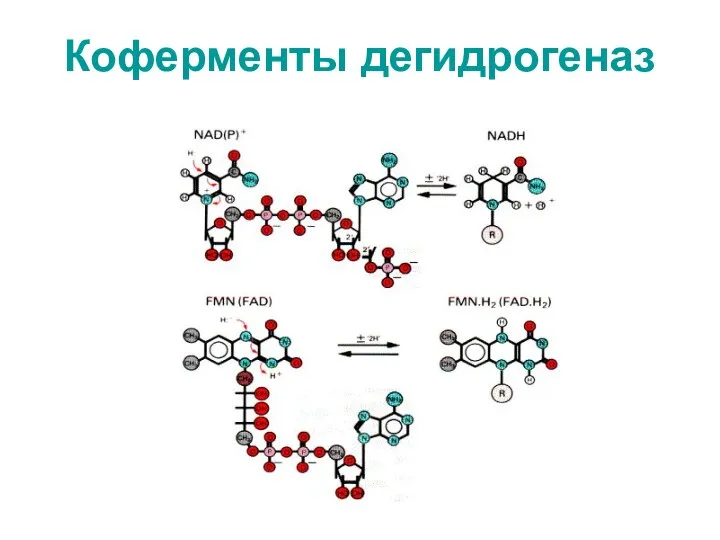
- 50. Коферменты дегидрогеназ
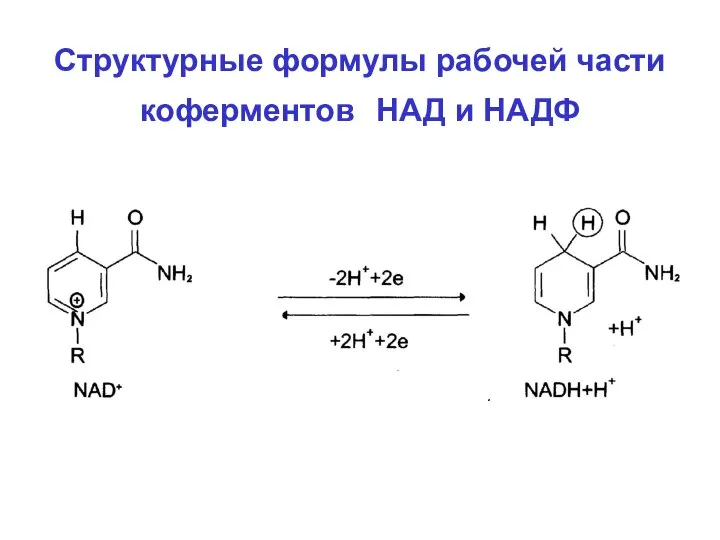
- 51. Структурные формулы рабочей части коферментов НАД и НАДФ
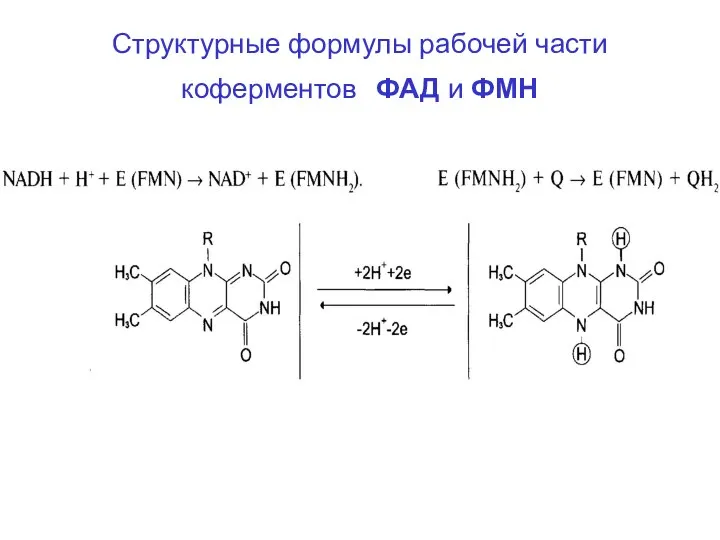
- 52. Структурные формулы рабочей части коферментов ФАД и ФМН
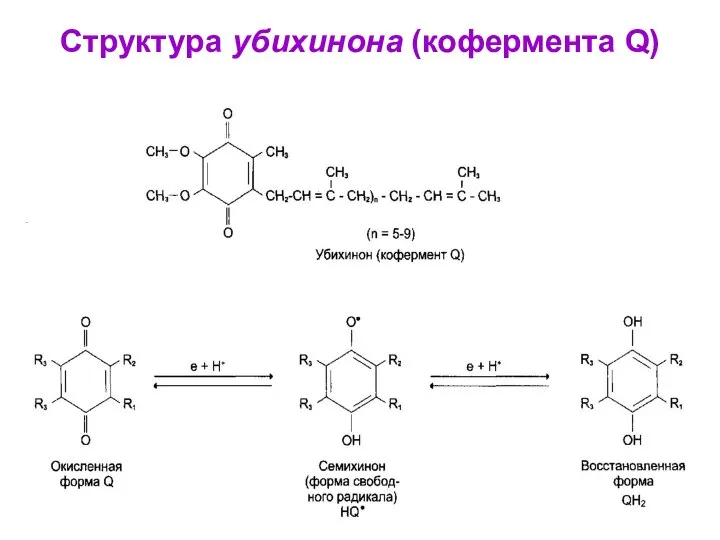
- 53. Структура убихинона (кофермента Q)
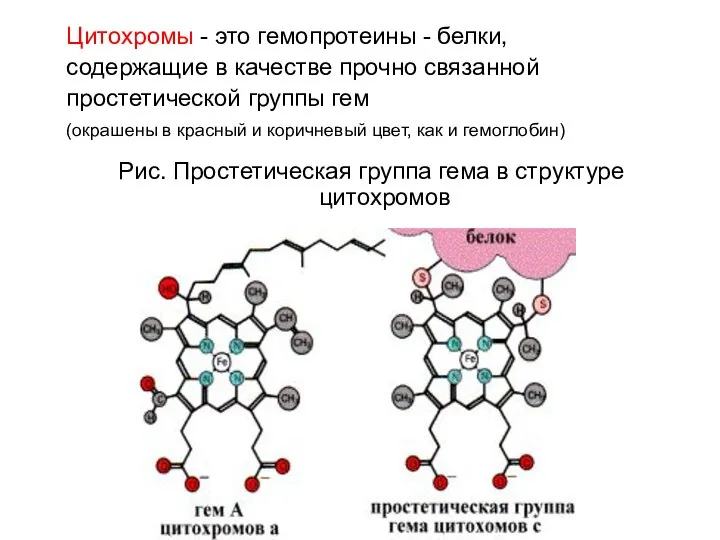
- 54. Цитохромы - это гемопротеины - белки, содержащие в качестве прочно связанной простетической группы гем (окрашены в
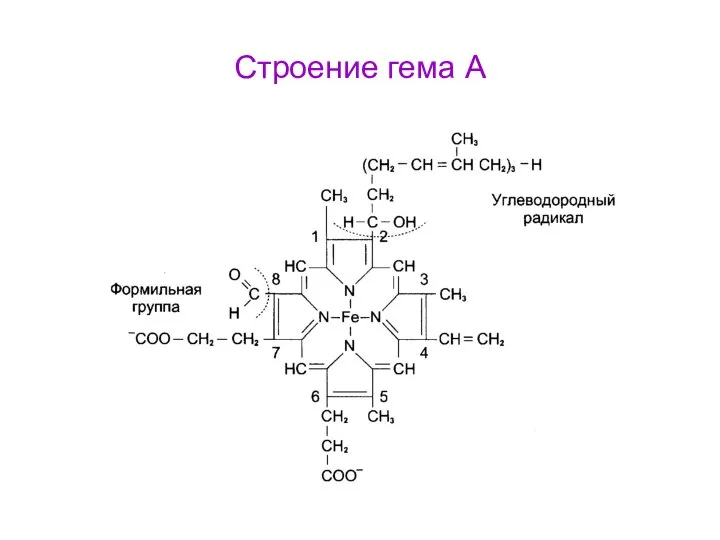
- 55. Строение гема А
- 56. Атом железа в геме может менять валентность, присоединяя или отдавая электроны: В дыхательной цепи цитохромы служат
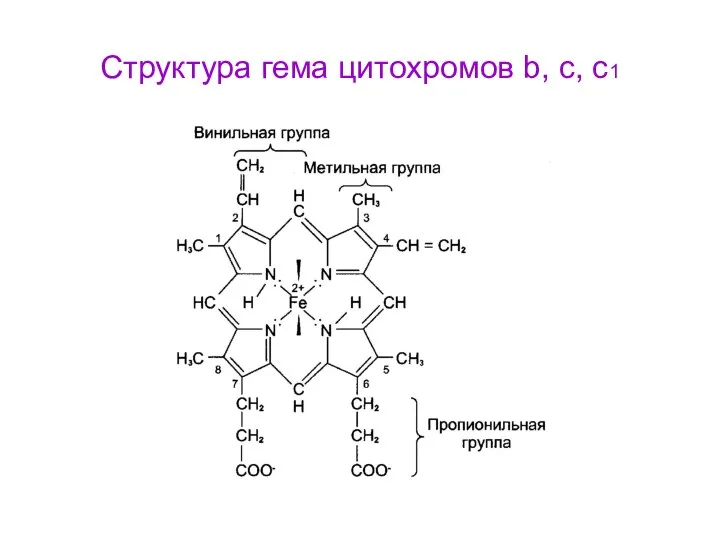
- 57. В цитохромах С и С1 дополнительные ковалентные связи формируются между тиогруппами цистеина и боковыми винильными группами
- 58. Цитохромоксидаза включает комплекс цитохромов а и а3 (комплекс IV). Цитохромоксидаза кроме гема (с Fe) содержит ионы
- 59. Структура гема цитохромов b, c, c1
- 60. Катаболизм основных пищевых веществ 1-3 пищеварение; 4-8 специфические пути катаболизма; 9-10 заключительный (общий путь) катаболизма; 11-
- 62. Скачать презентацию

































 Технология ремонта кузовов автомобиля
Технология ремонта кузовов автомобиля Вирусы гриппа Подготовила: Курганова Е., РЭ-2, 3 курс
Вирусы гриппа Подготовила: Курганова Е., РЭ-2, 3 курс Что делать в трудную минуту? Молодёжь Смоленской Центральной Церкви
Что делать в трудную минуту? Молодёжь Смоленской Центральной Церкви Домашняя мультимедиа-платформа с голосовым помощником Алисой
Домашняя мультимедиа-платформа с голосовым помощником Алисой Аналық тақша
Аналық тақша Basics of software development (continued)
Basics of software development (continued) Основы логики
Основы логики Электрические машины и электропривод. Введение
Электрические машины и электропривод. Введение Galileo galilei, February 15, 1564 - January 8, 1642
Galileo galilei, February 15, 1564 - January 8, 1642 Программирование. Экзамен
Программирование. Экзамен Устройства компьютера
Устройства компьютера Электрооборудование. Электроснабжение бортовой сети
Электрооборудование. Электроснабжение бортовой сети Весело колосится густая рожь.
Весело колосится густая рожь. Анималотерапия - презентация для начальной школы_
Анималотерапия - презентация для начальной школы_ Административное правонарушение Опрос
Административное правонарушение Опрос FORTRAN Название языка происходит от словосочетания FORmulae TRANslation — преобразование формул
FORTRAN Название языка происходит от словосочетания FORmulae TRANslation — преобразование формул Государственный Дарвиновский музей
Государственный Дарвиновский музей Типология и классификация политической культуры
Типология и классификация политической культуры Скульптурные шедевры Л.Бернини
Скульптурные шедевры Л.Бернини Ватто Антуан
Ватто Антуан Теория ландшафтной архитектуры и методология проектирования
Теория ландшафтной архитектуры и методология проектирования Презентацию выполнила студентка – заочница 2 курса филологического ф – та Купчихина Елена Николаевна Владимир, 2013 год
Презентацию выполнила студентка – заочница 2 курса филологического ф – та Купчихина Елена Николаевна Владимир, 2013 год Общая эндокринология
Общая эндокринология  Цивилизация и культура
Цивилизация и культура Political parties in Estonia
Political parties in Estonia Медный, бронзовый, железный века на Луганщине
Медный, бронзовый, железный века на Луганщине Методика работы Учителя физической культуры СОШ № 80 Чигилейчик Лады Юрьевны
Методика работы Учителя физической культуры СОШ № 80 Чигилейчик Лады Юрьевны Ноосфера . Эволюция представлений о месте человека в природе
Ноосфера . Эволюция представлений о месте человека в природе