Содержание
- 3. В 1865 году англ . Физик Дж. Максвелл рассчитал теоретически скорость элм волн в вакууме и
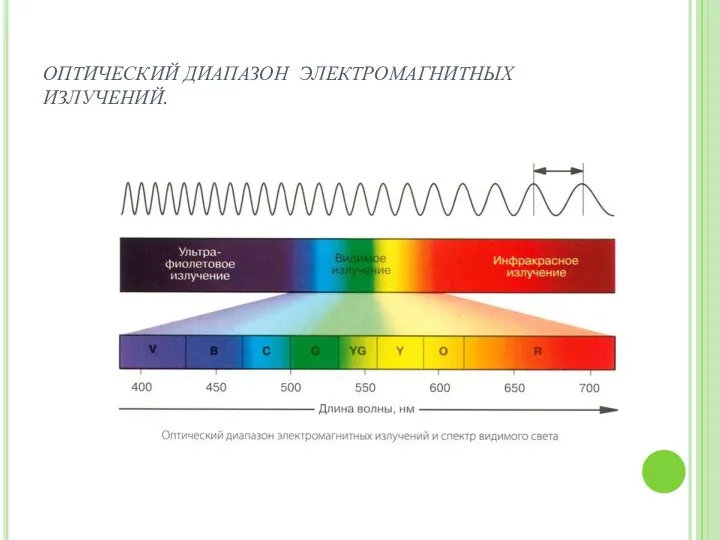
- 4. Ультрафиолетовое и ифракрасное излучение, с одной стороны он граничит с рентгеновским излучением с другой с микроволновым
- 5. ОПТИЧЕСКИЙ ДИАПАЗОН ЭЛЕКТРОМАГНИТНЫХ ИЗЛУЧЕНИЙ.
- 6. В 1913 г датский физик Нильс Бор предложил теорию атома водорода и водородоподобных атомов (постулаты Бора).
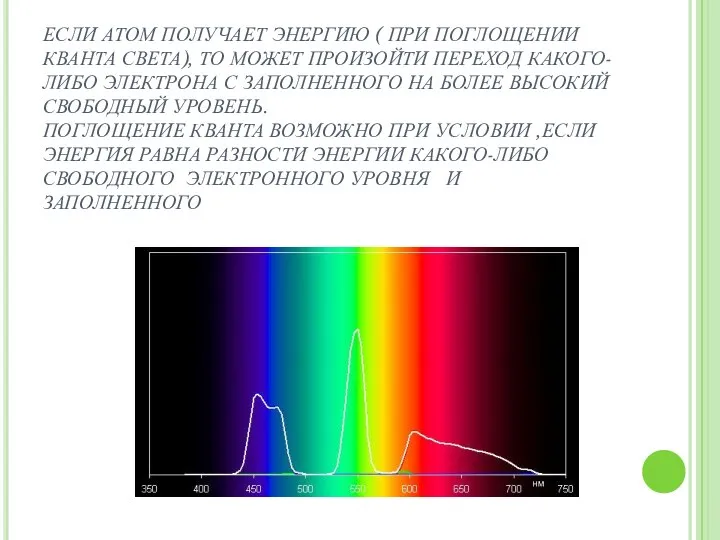
- 7. Фотон частоты (ню) ν ,энергия которого определяется разностью энергий Еi , Еk атомных состояний. h ν
- 8. Атомные спектры называют оптическими, если они лежат в ультрафиолетовом ( 100-400 нм), видимом (400-760нм) или инфракрасном
- 9. ЕСЛИ АТОМ ПОЛУЧАЕТ ЭНЕРГИЮ ( ПРИ ПОГЛОЩЕНИИ КВАНТА СВЕТА), ТО МОЖЕТ ПРОИЗОЙТИ ПЕРЕХОД КАКОГО-ЛИБО ЭЛЕКТРОНА С
- 10. Возбуждённые атомы стремятся перейти в состояние с наименьшей энергией. Поэтому происходят спонтанные квантовые переходы, с испусканием
- 11. Где i и k – порядковые номера уровней, между которыми происходит переход. Эта формула была получена
- 14. В видимой и близкой ультрафиолетовой областях спектра расположена серия Бальмера, которая возникает вследствие переходов с верхних
- 15. В инфракрасной области находится серия Пашена, которая возникает при переходах с верхних энергетических уровней на третий.
- 16. Атомные спектры называют оптическими, если они лежат в ультрафиолетовом ( 100-400 нм), видимом (400-760нм) или инфракрасном
- 17. Если атом получает энергию ( при поглощении кванта света), то может произойти переход какого-либо электрона с
- 18. Возбуждённые атомы стремятся перейти в состояние с наименьшей энергией. Поэтому происходят спонтанные квантовые переходы, с испусканием
- 19. ЛИНЕЙЧАТЫЕ АТОМАРНЫЕ СПЕКТРЫ. Атомные спектры, оптические спектры, получающиеся при испускании или поглощении элм излучения свободными или
- 20. Частоты спектральных линий выражают в с -1 (герц), длины волн - в нм и мкм, а
- 22. ЛИНЕЙЧАТЫЕ ,АТОМАРНЫЕ СПЕКТРЫ. Вид спектра зависит как от электронного строения данного атома, так и от внешних
- 23. Для атома Н волновые числа линий всех серий с большой точностью определяются формулой Бальмера: где пk
- 24. Спектры атомов щелочных металлов, имеющих один электрон на внешней эл оболочке, схожи со спектром Н, но
- 25. ПОГЛОЩЕНИЕ СВЕТА. Поглощение света—уменьшение интенсивности оптического излучения при прохождении через какую-либо среду,за счёт взаимодействия с ней,в
- 26. Не зависящий от интенсивности света коэфф. Кλ,называют показателем поглощения, причём Кλ различен для различных длин волн.
- 27. ЛЮМИНЕСЦЕНЦИЯ Люминесценцией называют излучение Света!! телами ,избыточное над тепловым при той же температуре и имеющее длительность
- 28. рентгеновским излучением, бомбардировкой вещества электронами, а также некоторыми хим . реакциями в веществе. Люм. излучение имеет
- 29. ЗАКОНЫ ЛЮМИНЕСЦЕНЦИИ. Свет фотолюминесценции, как правило , имеет большую длину волны, чем возбуждающий свет (правило Стокса)
- 31. Скачать презентацию























 «Души своей открою тайники…» Задачи: Учиться вести дневниковые записи Выражать свое душевное состояние с помощью изобразительных средств Учиться делать выводы Анализировать свои поступки
«Души своей открою тайники…» Задачи: Учиться вести дневниковые записи Выражать свое душевное состояние с помощью изобразительных средств Учиться делать выводы Анализировать свои поступки Директор з персоналу ELEKS Software
Директор з персоналу ELEKS Software Словосочетание
Словосочетание Достопримечательности города Пекина
Достопримечательности города Пекина Супрамолекулярная фотоника
Супрамолекулярная фотоника  Понятие и виды управленческих решений Подготовили: Крючкова Алена, Трошкина Алена МЭ-102
Понятие и виды управленческих решений Подготовили: Крючкова Алена, Трошкина Алена МЭ-102 История форм прошедшего времени простые формы: аорист и имперфект; сложные формы: перфект и плюсквамперфект
История форм прошедшего времени простые формы: аорист и имперфект; сложные формы: перфект и плюсквамперфект Членистоногие
Членистоногие Serialomania
Serialomania Конституционно-правовой статус человека и гражданина
Конституционно-правовой статус человека и гражданина  26,04.pptx
26,04.pptx День конституции РФ
День конституции РФ История отечественного хоккея
История отечественного хоккея Кружок по искусственному интеллекту. Семинар 2
Кружок по искусственному интеллекту. Семинар 2 Народ Якутии
Народ Якутии Современное Христианство и псевдохристианские секты
Современное Христианство и псевдохристианские секты Дифракция ЭМВ. Основы световой микроскопии
Дифракция ЭМВ. Основы световой микроскопии Арифметические операции
Арифметические операции Презентация корпорация Nokia
Презентация корпорация Nokia Виды грунтовок
Виды грунтовок Обобщенная структура процессора
Обобщенная структура процессора Циклы Кондратьева Подготовил Столяров Е.С. Харевич М.А. группа Э-1303
Циклы Кондратьева Подготовил Столяров Е.С. Харевич М.А. группа Э-1303  «Сохраним историческую память о ветеранах и защитниках нашего Отечества»
«Сохраним историческую память о ветеранах и защитниках нашего Отечества»  Объектно-ориентированное программирование. Языки C++ и C#
Объектно-ориентированное программирование. Языки C++ и C# Технические средства радиоэлектронной разведки
Технические средства радиоэлектронной разведки День Победы - презентация для начальной школы_
День Победы - презентация для начальной школы_ Коррупция: понятия, виды, последствия. Виды коррупционных правонарушений
Коррупция: понятия, виды, последствия. Виды коррупционных правонарушений Презентация Предмет, метод и принципы жилищного права
Презентация Предмет, метод и принципы жилищного права