Содержание
- 2. Главная функция белков - ферментативная (каталитическая). «Все ферменты – белки, но не все белки ферменты» Фундаментальное
- 3. Рибозимы (ribonucleic acid enzyme) = РНК фермент или каталитическая РНК В 1967 г. Карл Везе, Френсис
- 4. Реакции, катализируемые рибозимами: гидролиз фосфодиэфирных связей внутри самой молекулы РНК; гидролиз химических связей в других молекулах
- 5. Избранные факты из истории энзимологии В 17 веке Ван Гельмонт ввел термин «фермент» - от fermentum
- 6. Ферменты – биологические катализаторы, способные многократно изменять скорость метабо- лических реакций. Отличия ферментов от небиологических катализа-
- 7. 6. Скорость ферментативной реакции пропорцио- нальна количеству фермента. 7. Ферментативный катализ происходит в особых условиях: температура
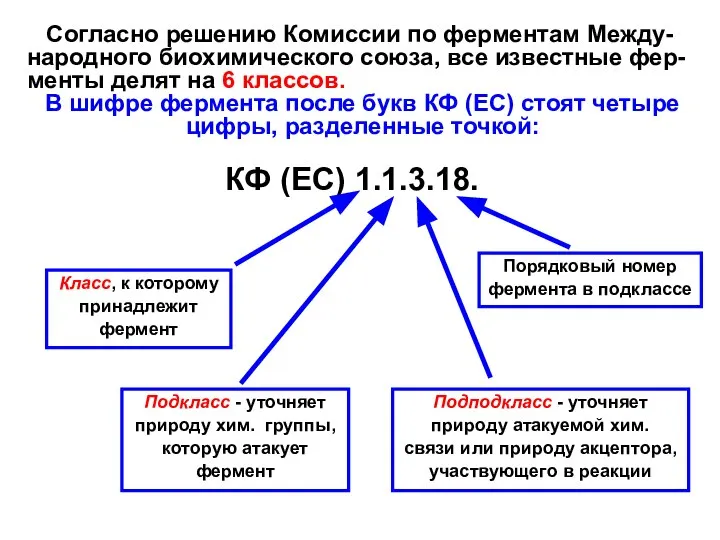
- 8. Согласно решению Комиссии по ферментам Между-народного биохимического союза, все известные фер-менты делят на 6 классов. В
- 9. 1 класс: ОКСИДОРЕДУКТАЗЫ Катализируют окислительно-восстановительные реакции. Содержит 17 подклассов (самый многочис-ленный класс ферментов): S1(red.) + S2(ox)
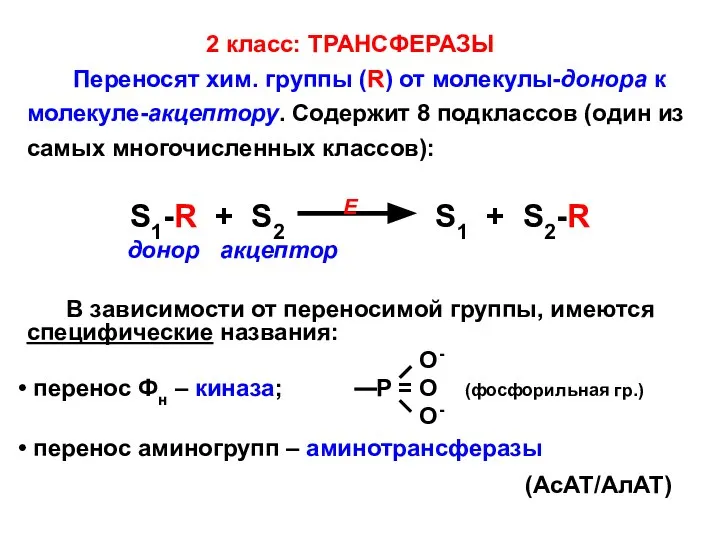
- 10. 2 класс: ТРАНСФЕРАЗЫ Переносят хим. группы (R) от молекулы-донора к молекуле-акцептору. Содержит 8 подклассов (один из
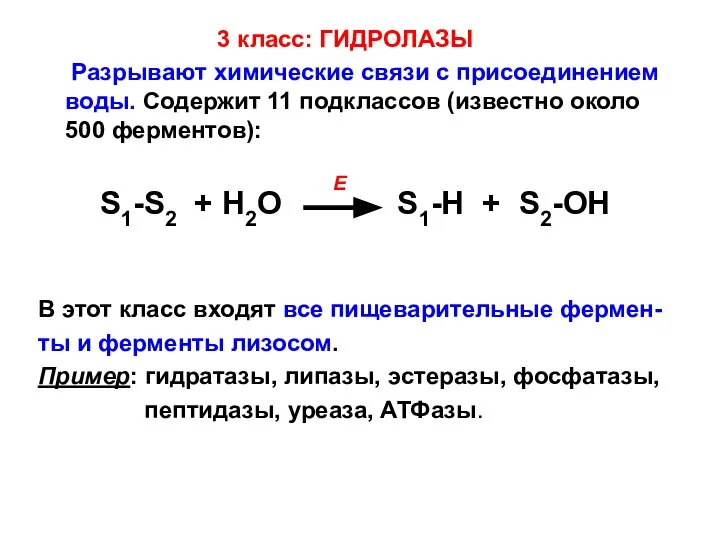
- 11. 3 класс: ГИДРОЛАЗЫ Разрывают химические связи с присоединением воды. Содержит 11 подклассов (известно около 500 ферментов):
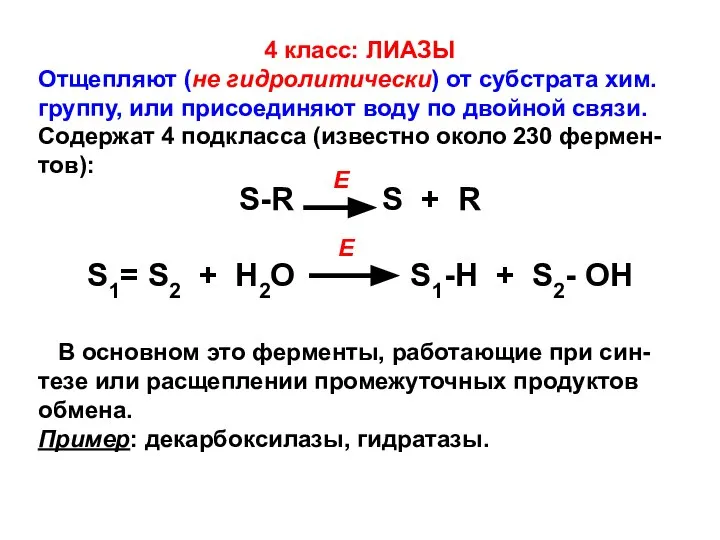
- 12. 4 класс: ЛИАЗЫ Отщепляют (не гидролитически) от субстрата хим. группу, или присоединяют воду по двойной связи.
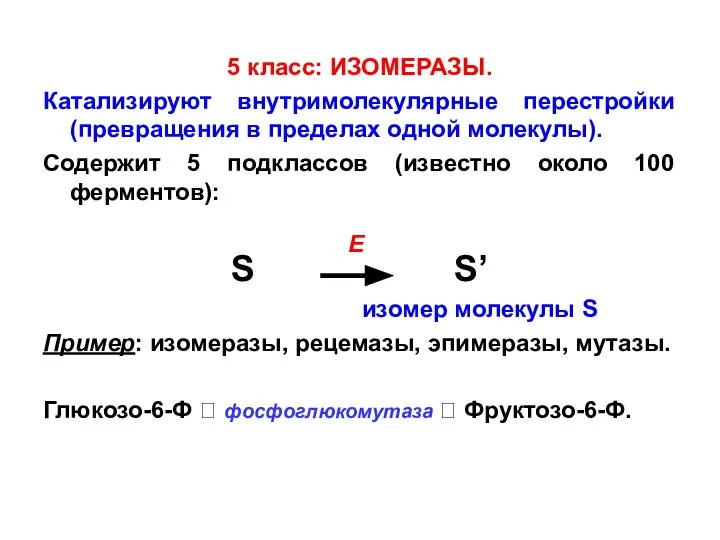
- 13. 5 класс: ИЗОМЕРАЗЫ. Катализируют внутримолекулярные перестройки (превращения в пределах одной молекулы). Содержит 5 подклассов (известно около
- 14. 6 класс: ЛИГАЗЫ Катализируют присоединение друг к другу двух разных молекул с образованием ковалентной связи. Процесс
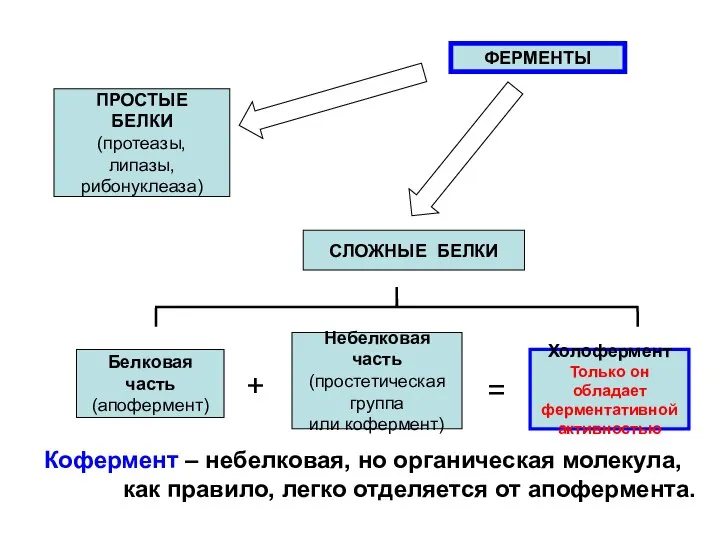
- 15. ФЕРМЕНТЫ ПРОСТЫЕ БЕЛКИ (протеазы, липазы, рибонуклеаза) СЛОЖНЫЕ БЕЛКИ Белковая часть (апофермент) Небелковая часть (простетическая группа или
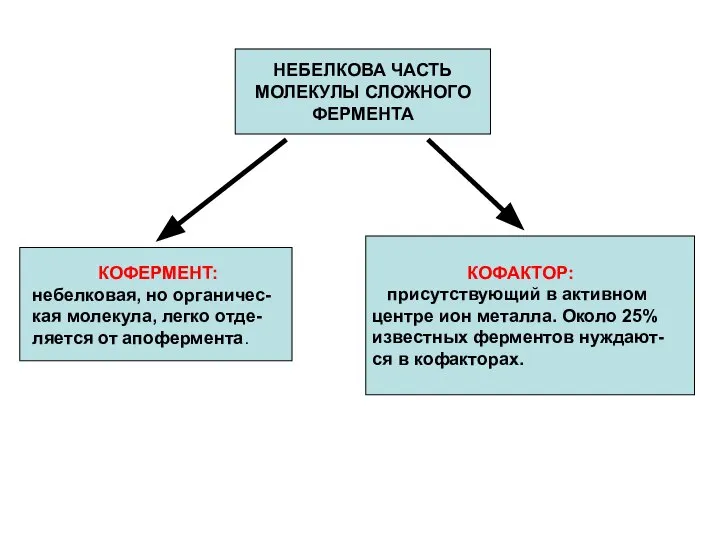
- 16. НЕБЕЛКОВА ЧАСТЬ МОЛЕКУЛЫ СЛОЖНОГО ФЕРМЕНТА КОФЕРМЕНТ: небелковая, но органичес-кая молекула, легко отде-ляется от апофермента. КОФАКТОР: присутствующий
- 17. Классификация коферментов: Витаминные коферменты НАД, НАДФ, ФМН, КоА и др., Их предшественниками явля-ются витамины. Невитаминные коферменты
- 18. Активный (каталитический) центр фермента В нём происходят два важнейших события: связывание молекулы субстрата превращение субстрата(ов) в
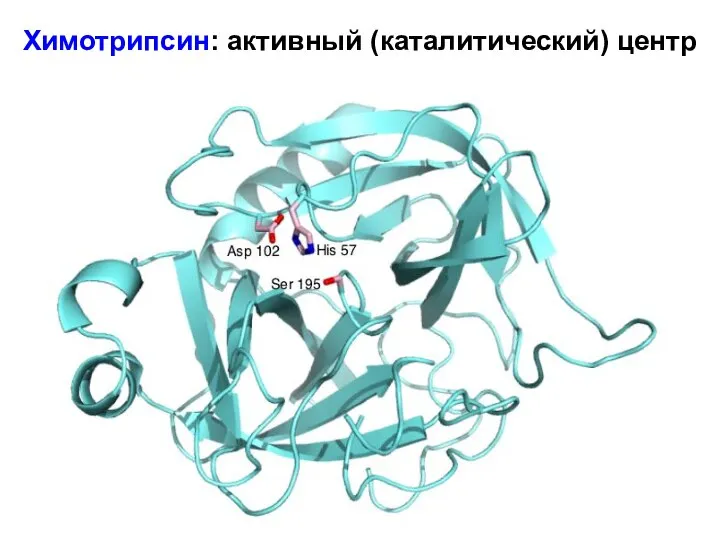
- 19. Химотрипсин: активный (каталитический) центр
- 20. Активный центр – трехмерное образование. Для некоторых ферментов активный центр имеет форму щели или углубления.
- 21. Структура активного центра фермента: Контактный (якорный) участок – служит для связывания молекулы субстрата, размещения её в
- 22. Функции аминокислотных остатков, которые не входят в состав активного центра Вспомогательные аминокислоты. Расположены в непосредственной близости
- 23. Механизмы ферментативного катализа Кислотно-основной катализ. В состав активного центра входят аминокислотные остатки, содержащие функциональные группы, которые
- 24. Механизмы ферментативного катализа 2. Ковалентный катализ. В активном центре между молекулой субстрата (S) и каталитическими функциональными
- 25. Помимо вышеупомянутых механизмов ферментативного катализа, важная роль принадлежит следующим явлениям, которые способствуют снижению энергии активации: 1.
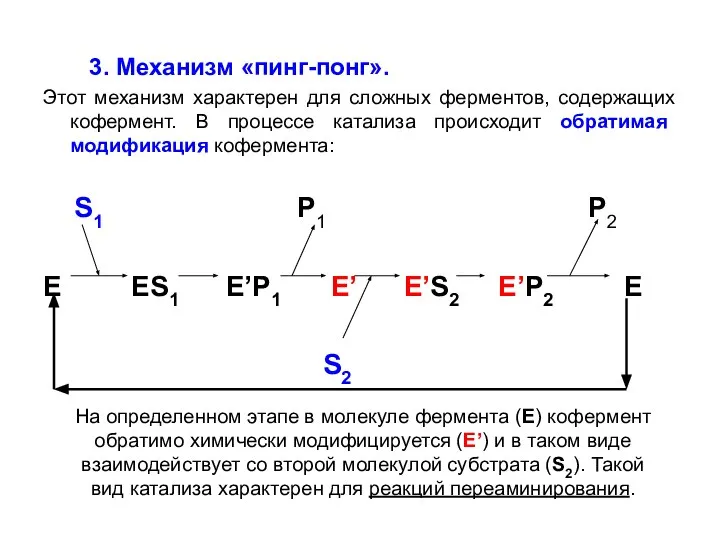
- 26. 3. Механизм «пинг-понг». Этот механизм характерен для сложных ферментов, содержащих кофермент. В процессе катализа происходит обратимая
- 27. Двухсубстратные-двухпродуктные ферментативные реакции Такие ферментативные реакции - самый распространённый тип биохимических реакций. Почти все двухсубстратные-двухпродуктные реак-
- 28. Двухсубстратные-двухпродуктные реакции протека- ют с образованием двух видов промежуточных комп- лексов. Причина - субстраты связываются с
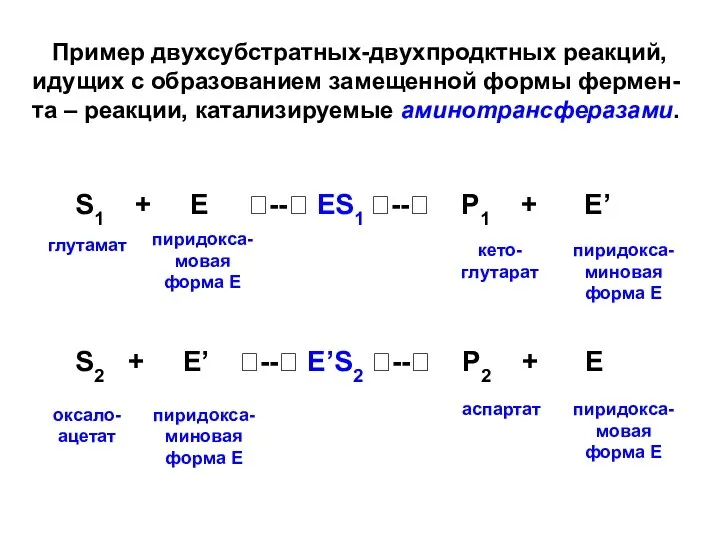
- 29. Пример двухсубстратных-двухпродктных реакций, идущих с образованием замещенной формы фермен-та – реакции, катализируемые аминотрансферазами. S1 + E
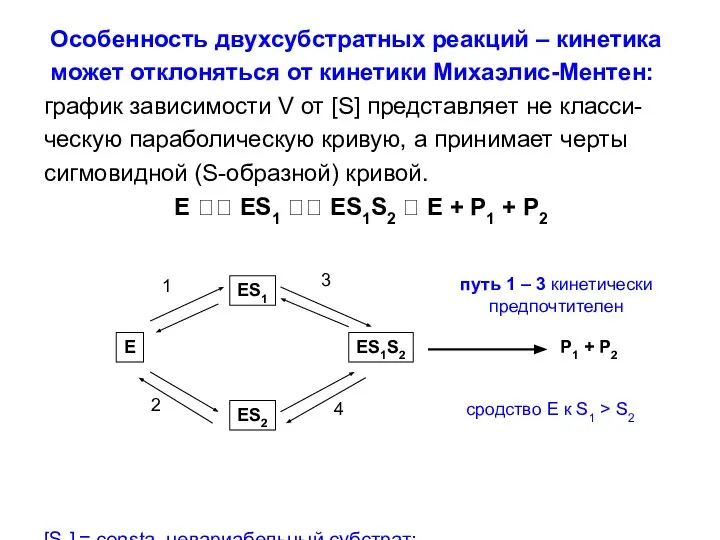
- 30. Особенность двухсубстратных реакций – кинетика может отклоняться от кинетики Михаэлис-Ментен: график зависимости V от [S] представляет
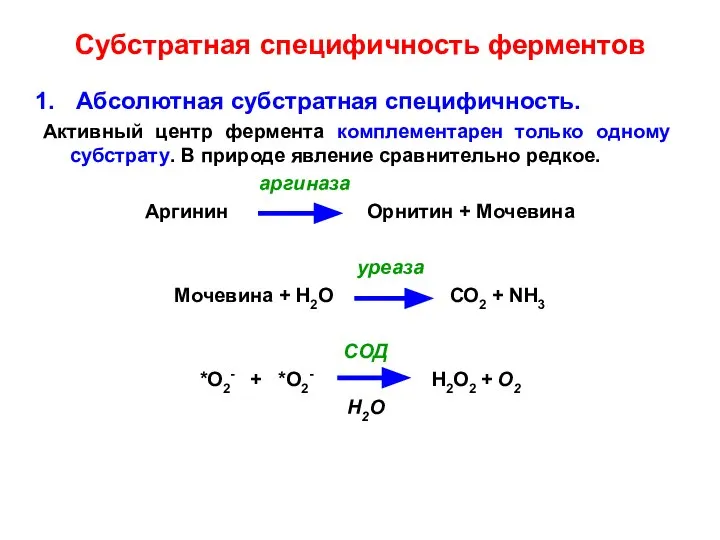
- 31. Субстратная специфичность ферментов Абсолютная субстратная специфичность. Активный центр фермента комплементарен только одному субстрату. В природе явление
- 32. 2. Групповая субстратная специфичность. Этот вид специфичности характерен для большей части ферментов. Фермент катализирует однотипные реакции
- 33. 3. Стереоспецифичность. Субстрат может иметь несколько стереоизомеров, но фермент взаимодействует только с каким-то одним определенным стереоизомером.
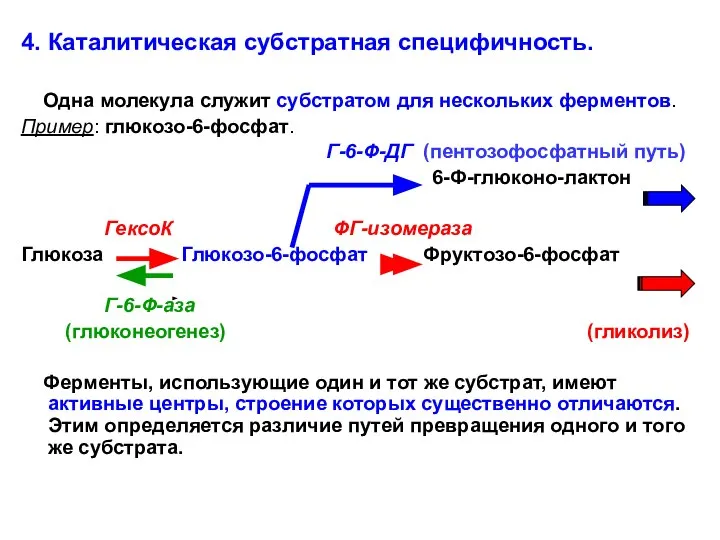
- 34. 4. Каталитическая субстратная специфичность. Одна молекула служит субстратом для нескольких ферментов. Пример: глюкозо-6-фосфат. Г-6-Ф-ДГ (пентозофосфатный путь)
- 35. Гипотезы, объясняющие механизм субстратной специфичности ферментативного катализа Гипотеза Э.Фишера «Ключ – замок» (1890 г.) Структура активного
- 36. 2. Гипотеза Кошланда «Вынужденное соответ-ствие» Структура активного центра не жесткая (способна деформи-роваться). Когда молекула субстрата присоединяется
- 37. В зависимости от рН среды, различные функциональные группы аминокислот фермента будут ионизированы в разной степени. Пути
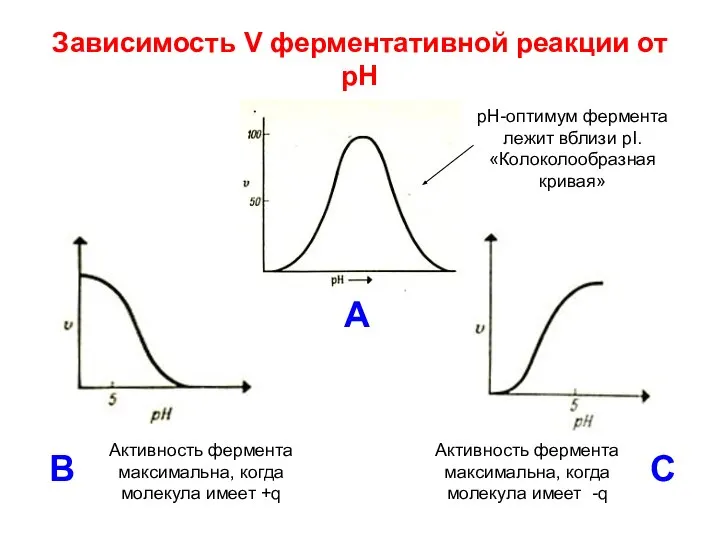
- 38. Зависимость V ферментативной реакции от рН А B C рН-оптимум фермента лежит вблизи рI. «Колоколообразная кривая»
- 39. Зависимость V ферментативной реакции от рН Для работы подавляющего большинства ферментов существует рН-оптимум. Даже незначительные отклонения
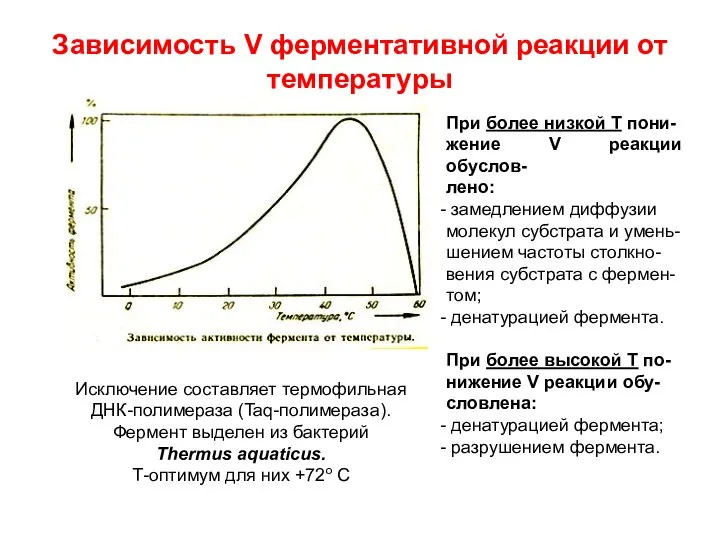
- 40. Зависимость V ферментативной реакции от температуры При более низкой Т пони- жение V реакции обуслов- лено:
- 41. Энергетика биохимических реакций Для протекания химической реакции требуется выполнение, по меньшей мере, трех условий: 1. Реакция
- 42. Энергетика биохимических реакций Энергия активации (Еа) – дополнительное коли- чество кинетической энергии, которое необходимо передать молекуле,
- 43. Энергетика биохимических реакций Взаимодействующие молекулы должны преода-леть энергетический барьер. Именно для этого им необходимо получить дополнительное
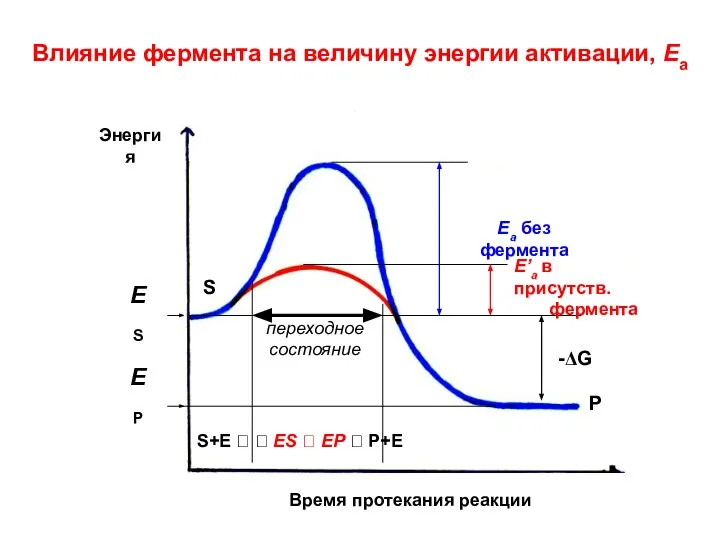
- 44. Влияние фермента на величину энергии активации, Еа Время протекания реакции Энергия S+E ? ? ES ?
- 45. Переходное состояние и фермент- субстратный комплекс (ES) S(субстрат) + Е(фермент) ?? ES ? EP ? E
- 46. Зависимость V реакции от Т Коэффициент Ван-Гоффа (Q10): VT+10 Q10 = VT Коэффициент показывает: во сколько
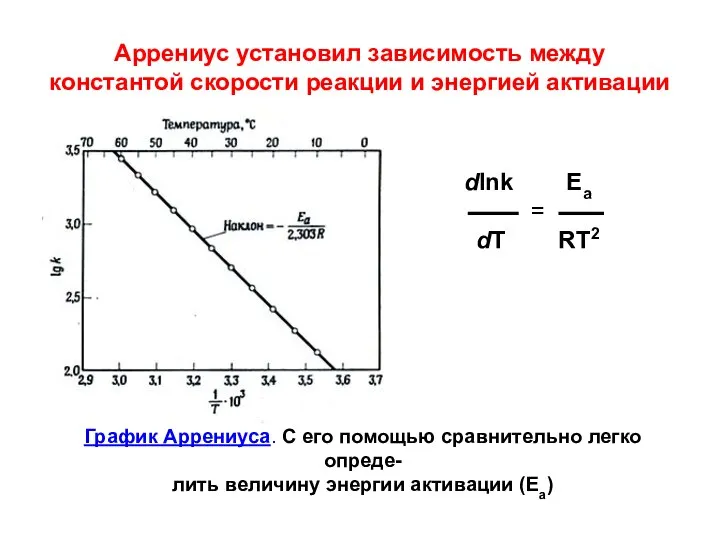
- 47. Аррениус установил зависимость между константой скорости реакции и энергией активации dlnk Ea = dT RT2 График
- 48. Ферментативная кинетика
- 49. E S P В общем виде скорость (V) ферментативной реакции можно описать уравнениями: Если выражать через
- 50. Одна из характеристик ферментативной реакции: Порядок реакции Порядок реакции определяется числом участников реакции, концентрации которых перемножаются
- 51. Константа скорости (био)химической реакции k чис-ленно равна скорости реакции при концентрации каждого из реагирующих веществ -
- 52. Реакция второго порядка: k A + B ? P k – константа реакции второго порядка, размерность:
- 53. В случае тримолекулярных реакций: A + В + С ? P Такие реакции нельзя относить к
- 54. Единицы активности фермента: Международная единица (МЕ, Е, U): Аактивность, при которой происходит утилизация 1 микромоля S
- 55. Законы ферментативной кинетики. Первые попытки. Первые попытки описания законов ферментативной кинетики были сделаны Брауном и Анри
- 56. Исследоания Л. Михаэлис и М. Ментен Leonor Michaelis 1875-1949 Maud Leonora Menten 1879-1960
- 57. В 1913 году Л. Михаэлис и М. Ментен вывели уравнение кинетики ферментативной реакции (уравнение Михаэлис -
- 58. V образования комплекса ES = k1[E][S] V диссоциации комплекса ES = k2+k3 [ES] k1[E][S] = k2+k3
- 59. Уравнение Михаэлис – Ментен: [S] v = Vmax. [S] + Km Реакция первого порядка Реакция смешанного
- 60. V [S] - Свободный фермент, Е Фермент-субстратный комплекс, ES Доля молекул фермента, образовавших фермент-субстратный комплекс
- 61. Из графика, построенного на основе уравнения Михаэлис – Ментен, следует: Eсли [S] [S] V = Vmax
- 62. При достижении определенной [S], скорость ферментативной реакции перестает зависить от [S] – достигается состояние «насыщения». При
- 63. Практика показала, что in vitro даже при [S] = 10Km, наблюдаемая скорость реакции может составлять 0,92
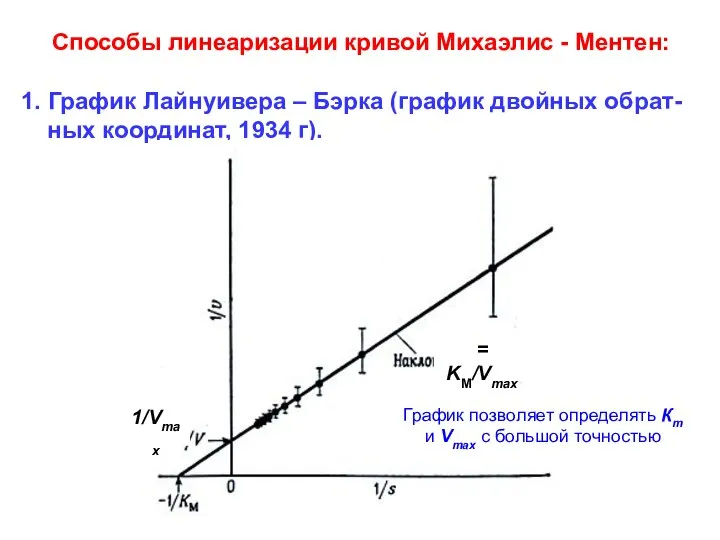
- 64. Способы линеаризации кривой Михаэлис - Ментен: 1. График Лайнуивера – Бэрка (график двойных обрат- ных координат,
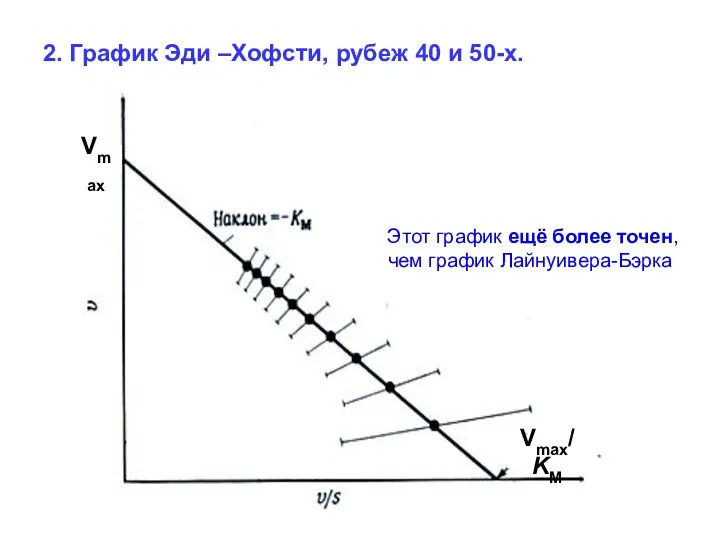
- 65. 2. График Эди –Хофсти, рубеж 40 и 50-х. Vmax Vmax/KM Этот график ещё более точен, чем
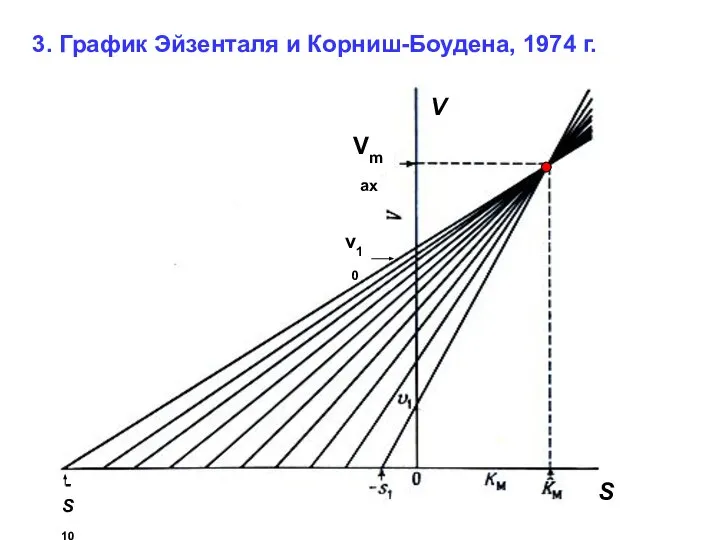
- 66. 3. График Эйзенталя и Корниш-Боудена, 1974 г. Vmax v10 -S10 S V
- 67. Для чего необходимо знать величины Km и Vmax Km Зависит от То; если фермент проявляет относительную
- 68. Vmax Зависит от концентрации фермента: чем больше фер- мента, тем выше скорость. Vmax – отражает важную
- 69. Регуляция неаллостерических ферментов Неаллостерические ферменты активируются с участием кофакторов и коферментов, а снижают активность под влиянием
- 70. ИНГИБИРОВАНИЕ ФЕРМЕНТОВ Ингибирование Инактивация Ингибитор – соединение, специфи-чески снижающее активность Е, путём прямого или косвенного влияния
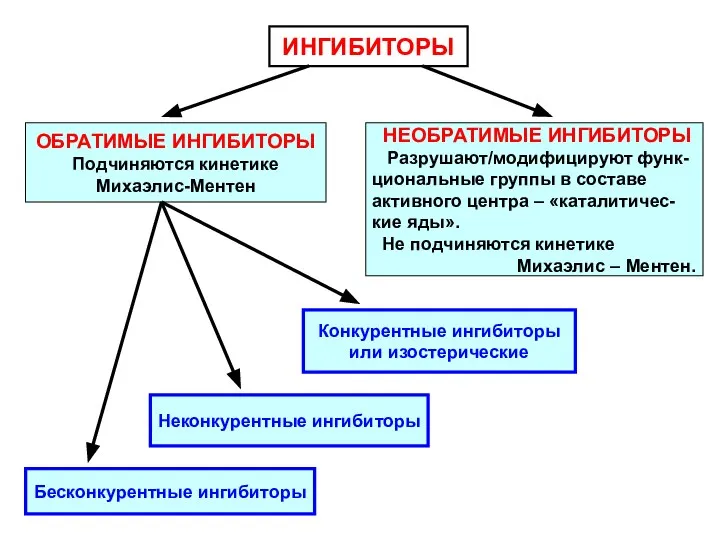
- 71. ИНГИБИТОРЫ НЕОБРАТИМЫЕ ИНГИБИТОРЫ Разрушают/модифицируют функ- циональные группы в составе активного центра – «каталитичес- кие яды». Не
- 72. Инактиваторы – комплекс химических, биологических, физических факторов, которые способны деструктурировать молекулу фермента. Под влиянием инактиваторов активность
- 73. Конкурентные (изостерические) ингибиторы, Iк Связываются с активным центром фермента, конкурируя за активный центр с субстратом (S),
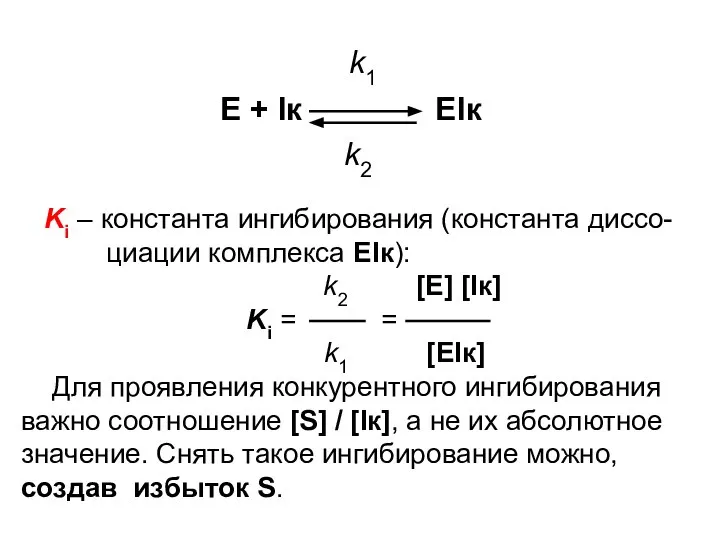
- 74. k1 E + Iк EIк k2 Ki – константа ингибирования (константа диссо- циации комплекса EIк): k2
- 75. Физический смысл константы ингибирования Ki: это концентрация конкурентного ингибитора, при которой он связывается с половиной активных
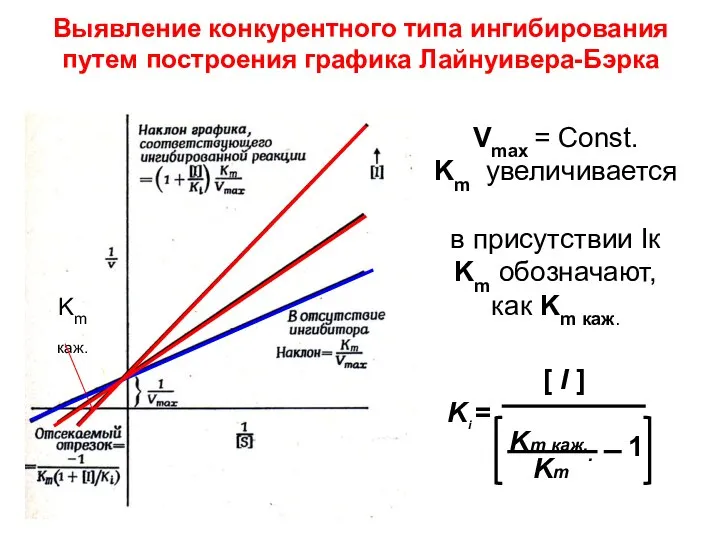
- 76. Выявление конкурентного типа ингибирования путем построения графика Лайнуивера-Бэрка Vmax = Const. Km увеличивается в присутствии Iк
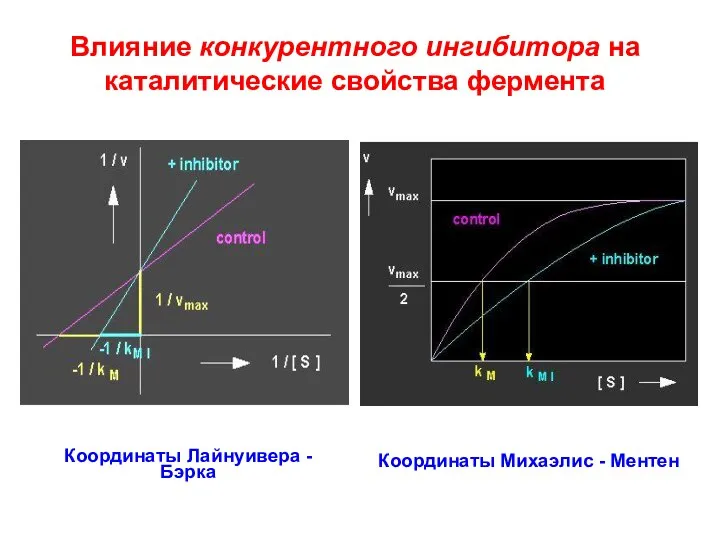
- 77. Влияние конкурентного ингибитора на каталитические свойства фермента Координаты Лайнуивера - Бэрка Координаты Михаэлис - Ментен
- 78. Неконкурентные ингибиторы, Iнк Связываются не с активным центром фермента, а с другим участком молекулы фермента (за
- 79. Iнк не уменьшает доли Е, связавшегося с S, но снижает число оборотов фермента. Этот вид ингибирования
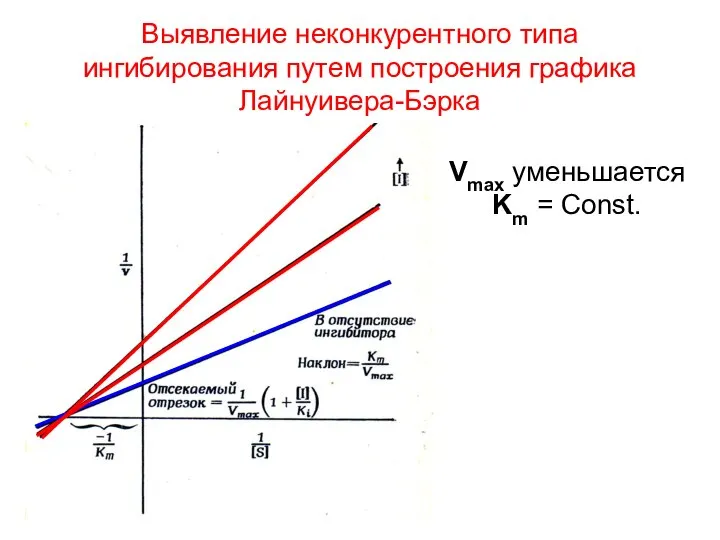
- 80. Выявление неконкурентного типа ингибирования путем построения графика Лайнуивера-Бэрка Vmax уменьшается Km = Const.
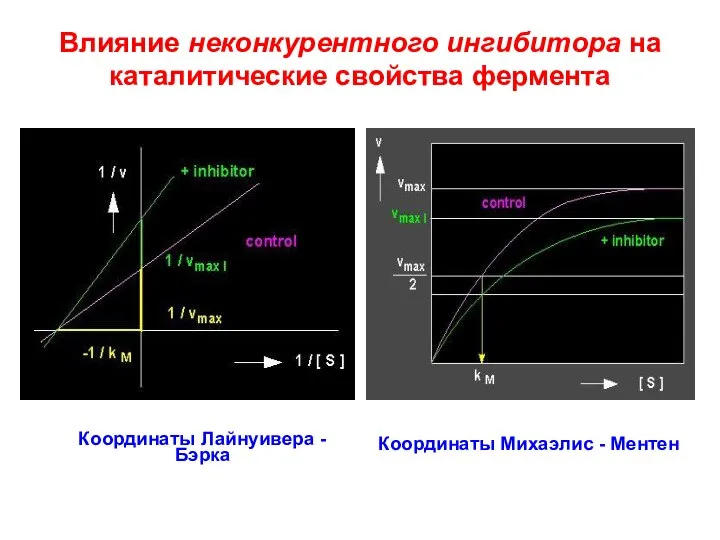
- 81. Влияние неконкурентного ингибитора на каталитические свойства фермента Координаты Лайнуивера - Бэрка Координаты Михаэлис - Ментен
- 82. Выявление смешанного типа ингибирования путем построения графика Лайнуивера-Бэрка 1/ V 1/ S [I] -1/Km
- 83. Бесконкурентные ингибиторы, Iбк Такой ингибитор присоединяется только к уже существующему комплексу ES. В отсутствие S, ингибитор
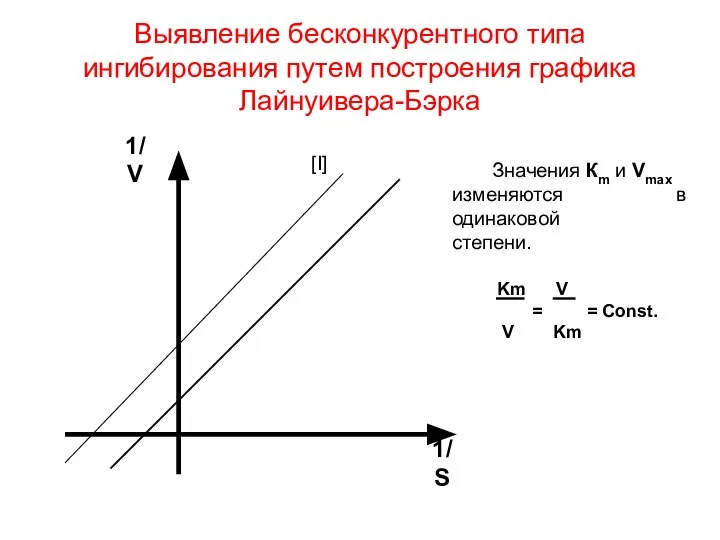
- 84. Выявление бесконкурентного типа ингибирования путем построения графика Лайнуивера-Бэрка 1/ V 1/S [I] Значения Кm и Vmax
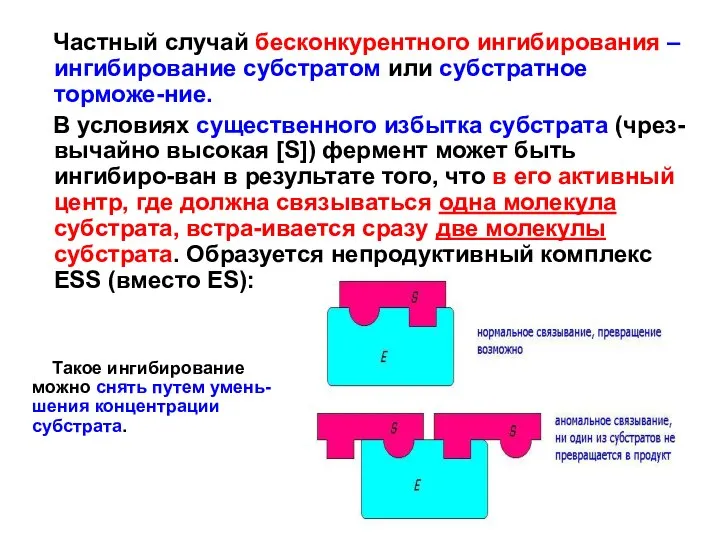
- 85. Частный случай бесконкурентного ингибирования – ингибирование субстратом или субстратное торможе-ние. В условиях существенного избытка субстрата (чрез-вычайно
- 87. Скачать презентацию







































![V образования комплекса ES = k1[E][S] V диссоциации комплекса ES =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302966/slide-57.jpg)
![Уравнение Михаэлис – Ментен: [S] v = Vmax. [S] + Km](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302966/slide-58.jpg)
![V [S] - Свободный фермент, Е Фермент-субстратный комплекс, ES Доля молекул фермента, образовавших фермент-субстратный комплекс](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302966/slide-59.jpg)

![При достижении определенной [S], скорость ферментативной реакции перестает зависить от [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302966/slide-61.jpg)
![Практика показала, что in vitro даже при [S] = 10Km, наблюдаемая](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302966/slide-62.jpg)









![Выявление смешанного типа ингибирования путем построения графика Лайнуивера-Бэрка 1/ V 1/ S [I] -1/Km](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302966/slide-81.jpg)

 Tipos de Alumbrado
Tipos de Alumbrado Диоды с переменной емкостью
Диоды с переменной емкостью Материалы для приготовления и регулирования свойств буровых растворов
Материалы для приготовления и регулирования свойств буровых растворов  эко
эко Презентация по алгебре Решение систем неравенств.
Презентация по алгебре Решение систем неравенств.  Построение брака на скале
Построение брака на скале C++ լեզուն լռելյայն վերահսկում է նախաարժեքավորումը, բայց ոչ թե մուտքագրումը
C++ լեզուն լռելյայն վերահսկում է նախաարժեքավորումը, բայց ոչ թե մուտքագրումը Психологическое сопровождение внеурочной деятельности. Калугина Наталья Андреевна, зав.кафедрой ПиП ХК ИРО, к.псх.н.
Психологическое сопровождение внеурочной деятельности. Калугина Наталья Андреевна, зав.кафедрой ПиП ХК ИРО, к.псх.н. Туристический сервис
Туристический сервис  НЕРАВЕНСТВО ДОХОДОВ В ОБЩЕСТВЕ
НЕРАВЕНСТВО ДОХОДОВ В ОБЩЕСТВЕ  Презентация Причины смертности в РФ
Презентация Причины смертности в РФ Буддизм
Буддизм Комплекс упражнений для развития мышц рук и груди
Комплекс упражнений для развития мышц рук и груди Гр. заняття Т-1.2.ppt
Гр. заняття Т-1.2.ppt Кабельный тестер Mastech MS6810
Кабельный тестер Mastech MS6810 Построение диаграмм и графиков
Построение диаграмм и графиков Развитие технического творчества обучающихся средствами образовательной робототехники
Развитие технического творчества обучающихся средствами образовательной робототехники Изобретения радио А. С. Поповым
Изобретения радио А. С. Поповым Организация производства натуральной композиции и ряда продуктов на ее основе для дезодорации, дезинфекции, ароматизации
Организация производства натуральной композиции и ряда продуктов на ее основе для дезодорации, дезинфекции, ароматизации Правоохранительные органы
Правоохранительные органы Алгоритмические языки и программирование
Алгоритмические языки и программирование Клещевой энцефалит ( таёжный энцефалит)
Клещевой энцефалит ( таёжный энцефалит) Диагностические приборы и системы для исследования биоэлектрической активности организма
Диагностические приборы и системы для исследования биоэлектрической активности организма Макияж тигра - презентация для начальной школы_
Макияж тигра - презентация для начальной школы_ Презентация на тему Творческий проект. Фартук.
Презентация на тему Творческий проект. Фартук.  Расчет статически неопределимых стержневых систем по методу сил
Расчет статически неопределимых стержневых систем по методу сил Всяк не на своём месте – вот общая беда… Ст. Рассадин
Всяк не на своём месте – вот общая беда… Ст. Рассадин Средства и методы физического воспитания
Средства и методы физического воспитания