Содержание
- 2. АЛЛОСТЕРИЧЕСКИЕ ФЕРМЕНТЫ «аллос» (греч.) – другой, «стерео» (греч.) – пространственный. Аллостерические ферменты – особая категория ферментов,
- 3. Особенности строения и функционирования: состоят из нескольких субъединиц (оли- гомерные белки); содержат два типа пространственно раз-
- 4. аллостерические регуляторы не обладают структурным сходством с субстратом (это послужило основанием для появления термина аллостерический); не
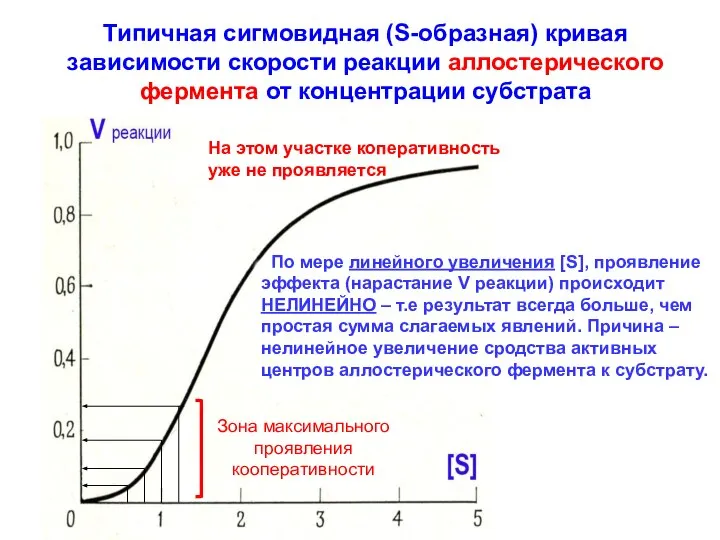
- 5. сигмовидная форма кривой обусловлена тем, что связывание субстрата в одном каталитическом центре всегда приводит к увеличению
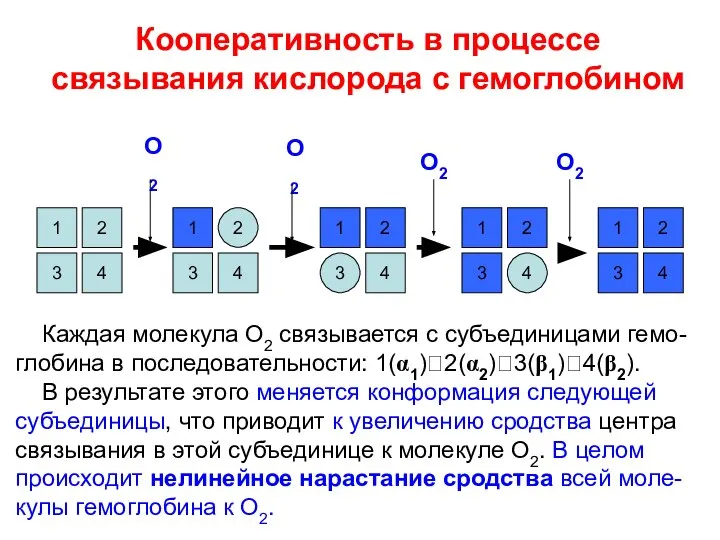
- 6. Гемоглобин – первый белок, на примере которого было открыто явление кооператив-ности во взаимодействии связывающих О2 центров.
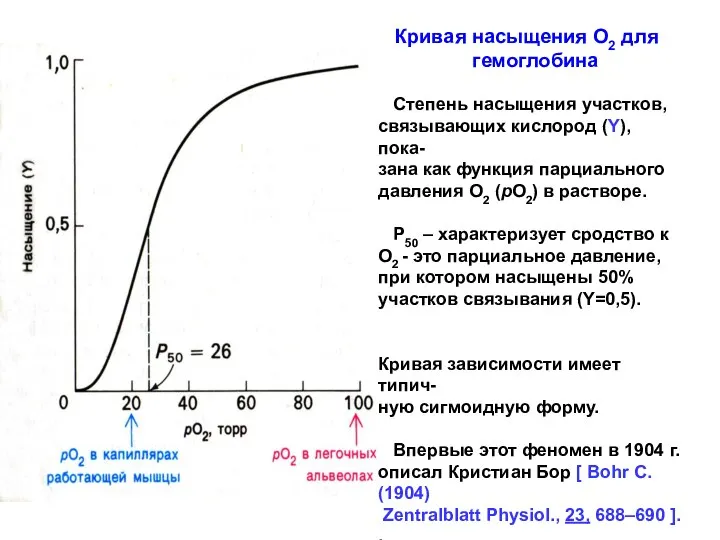
- 7. Кривая насыщения О2 для гемоглобина Степень насыщения участков, связывающих кислород (Y), пока- зана как функция парциального
- 8. 1 3 2 2 4 1 4 3 Кооперативность в процессе связывания кислорода с гемоглобином 4
- 9. Типичная сигмовидная (S-образная) кривая зависимости скорости реакции аллостерического фермента от концентрации субстрата Зона максимального проявления кооперативности
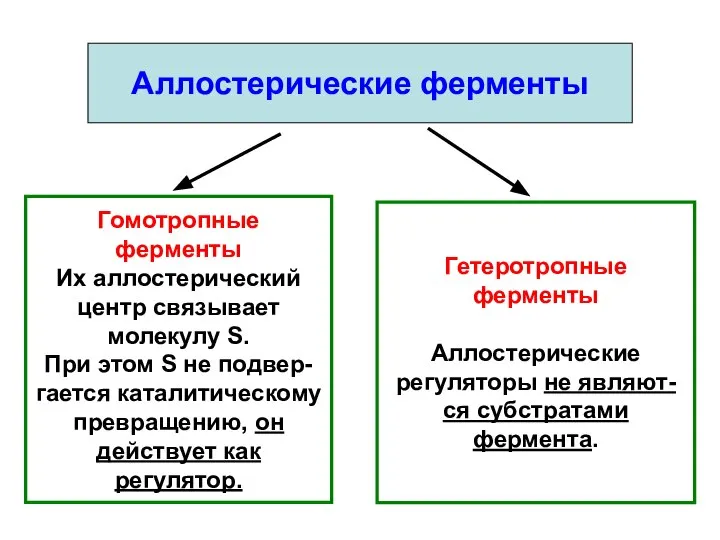
- 10. Аллостерические ферменты Гомотропные ферменты Их аллостерический центр связывает молекулу S. При этом S не подвер- гается
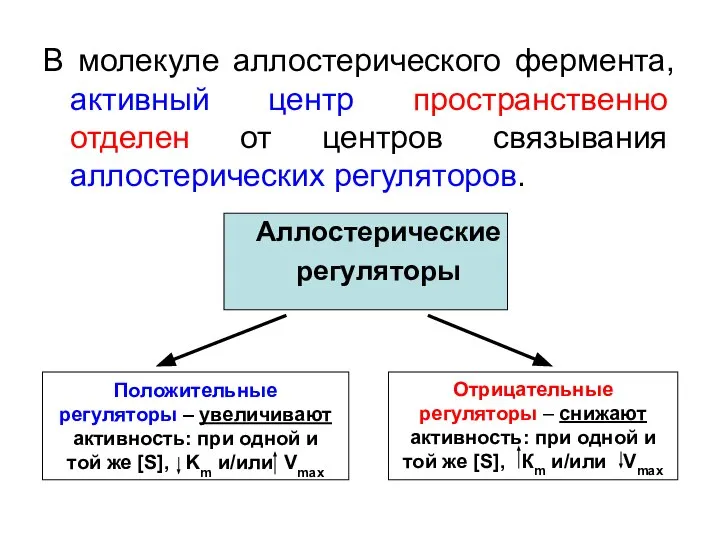
- 11. В молекуле аллостерического фермента, активный центр пространственно отделен от центров связывания аллостерических регуляторов. Аллостерические регуляторы Положительные
- 12. Аллостерические регуляторы, связавшись со своими центрами, вызывают конформационные перестройки всей молекулы фермента, в первую очередь –
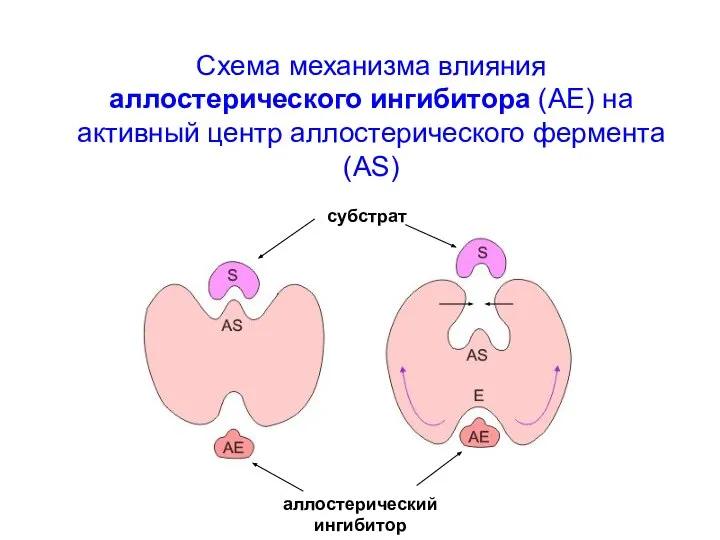
- 13. Схема механизма влияния аллостерического ингибитора (АЕ) на активный центр аллостерического фермента (AS) субстрат аллостерический ингибитор
- 14. В случае аллостерического фермента, незначительные сдвиги [S] приводят к существенным изменениям скорости ферментативной реакции – основное
- 15. У аллостерических ферментов, сигмо-видная форма кривой зависимости скорости реакции от концентрации субстрата – отра-жает явление кооперативного
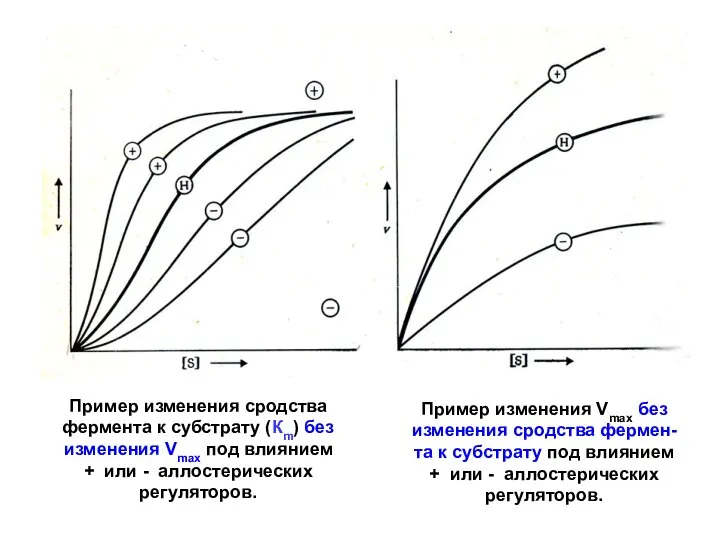
- 16. Пример изменения сродства фермента к субстрату (Кm) без изменения Vmax под влиянием + или - аллостерических
- 17. Характерные примеры регуляции активности аллостерических ферментов Активация протеинкиназы А (ПКА) с помощью цАМФ. Неактивная ПКА –
- 18. В 1910-1913 гг. Арчибальд Хилл разработал матема-тический аппарат, позволяющий количественно оха-рактеризовать степень проявления кооперативности [Hill A.V.
- 19. Уравнение Хилла k1 E + nS E(S)n k2 n – число центров, связывающих S k1 [E][S]n
- 20. Для того, чтобы учесть процесс постепенного заполнения участков связывания молекулами субстрата, Хилл предложил эмпирическое уравнение: K
- 21. y поскольку Y = 1-y y = K [S]n 1-y y lg = lg K +
- 22. График Хилла lg [S] y lg 1-y наклон = n (tgα) Чем больше величина n, тем
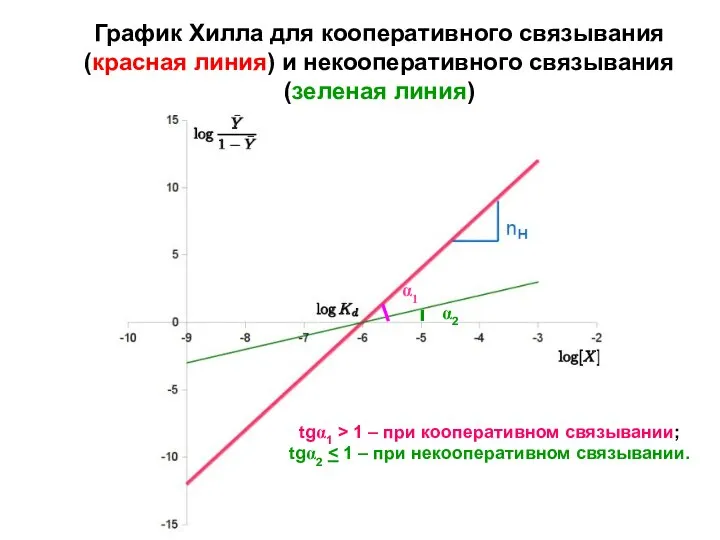
- 23. График Хилла для кооперативного связывания (красная линия) и некооперативного связывания (зеленая линия) tgα1 > 1 –
- 24. Если рассматривать скорость ферментативной реакции, то уравнение Хилла будет иметь вид: v lg = lg K
- 25. Основы современных представлений о структуре и механизме функционирова-ния аллостерических ферментов были заложены работами ряда исследовате-лей в
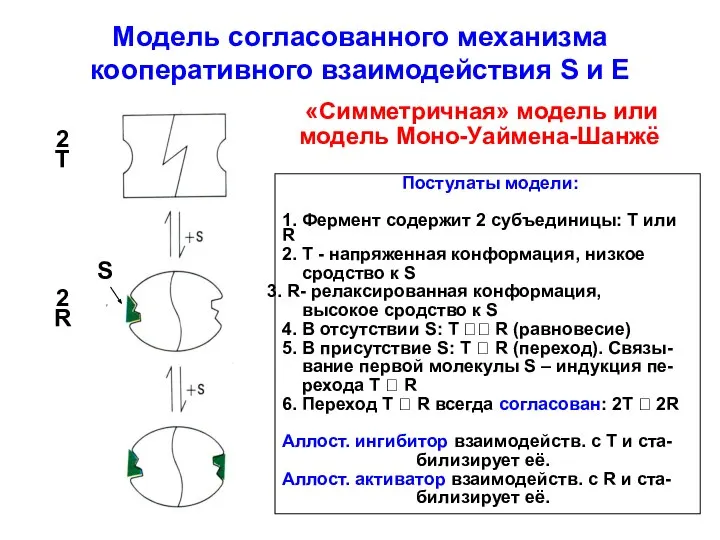
- 26. Модель согласованного механизма кооперативного взаимодействия S и E «Симметричная» модель или модель Моно-Уаймена-Шанжё Постулаты модели: 1.
- 28. Скачать презентацию






![В случае аллостерического фермента, незначительные сдвиги [S] приводят к существенным изменениям](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302967/slide-13.jpg)





![y поскольку Y = 1-y y = K [S]n 1-y y](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302967/slide-20.jpg)
![График Хилла lg [S] y lg 1-y наклон = n (tgα)](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1302967/slide-21.jpg)


 Дипломный проект на тему «Расчет стоимости ограждающих конструкций»
Дипломный проект на тему «Расчет стоимости ограждающих конструкций» Илья Ефимович Репин (1844-1930 гг.)
Илья Ефимович Репин (1844-1930 гг.) Сигнализация на ССОП
Сигнализация на ССОП Микропроцессорная система централизации стрелок и сигналов EBILOCK 950
Микропроцессорная система централизации стрелок и сигналов EBILOCK 950 Фестиваль профессий – 2016. Переводчик
Фестиваль профессий – 2016. Переводчик Презентация на тему "Реализация современных педагогических технологий в образовательном процессе" - скачать презентации по
Презентация на тему "Реализация современных педагогических технологий в образовательном процессе" - скачать презентации по  Памятники Г.-Х. Андерсену и его героям
Памятники Г.-Х. Андерсену и его героям  Искусство Древней Греции
Искусство Древней Греции НА ноу
НА ноу Презентация "Храмы Древней Греции" - скачать презентации по МХК
Презентация "Храмы Древней Греции" - скачать презентации по МХК Сочиняем сказку о звуках Учитель-логопед 1-ой квалификационной категории МДОУ №2 п. Африканда
Сочиняем сказку о звуках Учитель-логопед 1-ой квалификационной категории МДОУ №2 п. Африканда Инновации и организационные структуры инновационного менеджмента
Инновации и организационные структуры инновационного менеджмента Презентация "Статистика уровня жизни населения" - скачать презентации по Экономике
Презентация "Статистика уровня жизни населения" - скачать презентации по Экономике Лабораторна установка по дослідженню вбудованих систем керування на базі контролера Segnetics
Лабораторна установка по дослідженню вбудованих систем керування на базі контролера Segnetics Ремонт столовых у буфетов ДЦ-1 КХЦ
Ремонт столовых у буфетов ДЦ-1 КХЦ Визначення особливостей діагностування блоків керування автомобілів
Визначення особливостей діагностування блоків керування автомобілів Эльбрус Нигматуллин
Эльбрус Нигматуллин Кочевники
Кочевники Татарский орнамент
Татарский орнамент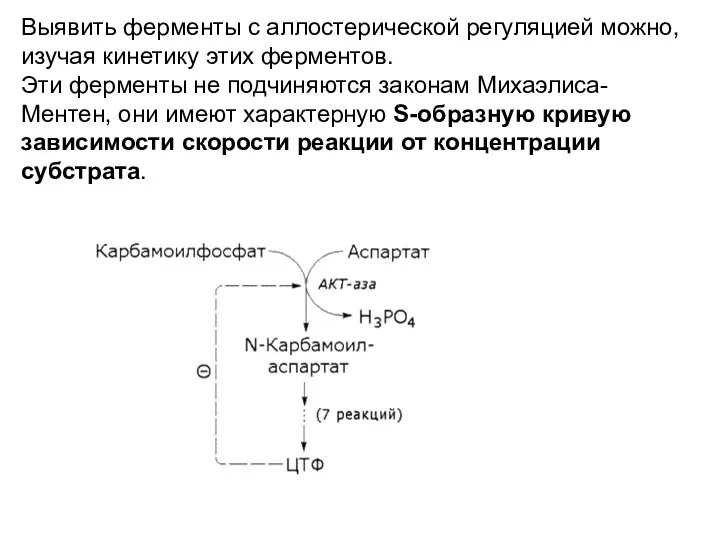 S-образная кривая зависимости скорости реакции от концентрации субстрата
S-образная кривая зависимости скорости реакции от концентрации субстрата АО Авиакомпания «Россия». ЭЛТ "КАННАД 406 АС"
АО Авиакомпания «Россия». ЭЛТ "КАННАД 406 АС" Уголовная ответственность медицинских работников
Уголовная ответственность медицинских работников Нахождение общего количества единиц определённого разряда в данном числе. 2 класс Учитель:Чаговец Людмила Николаевна
Нахождение общего количества единиц определённого разряда в данном числе. 2 класс Учитель:Чаговец Людмила Николаевна Smalltalk
Smalltalk Презентация "Упрощенная система налогообложения" - скачать презентации по Экономике
Презентация "Упрощенная система налогообложения" - скачать презентации по Экономике Вебинар «Негатив – не приговор» Работа с негативом в социальных сетях и на тематических форумах
Вебинар «Негатив – не приговор» Работа с негативом в социальных сетях и на тематических форумах Хорошие манеры. Обучающая игра – практикум для школьников
Хорошие манеры. Обучающая игра – практикум для школьников Авторская шахматная игра «МАКСИТ»
Авторская шахматная игра «МАКСИТ»