Содержание
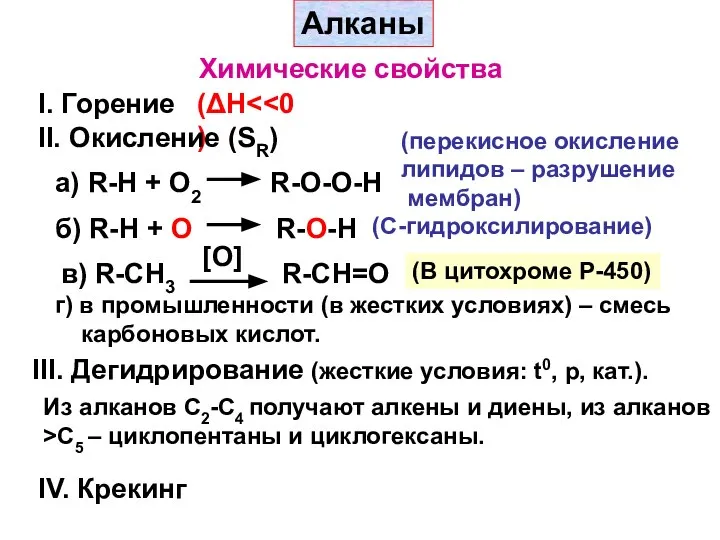
- 2. Алканы Химические свойства I. Горение (ΔH II. Окисление (SR) а) R-H + O2 R-O-O-Н (перекисное окисление
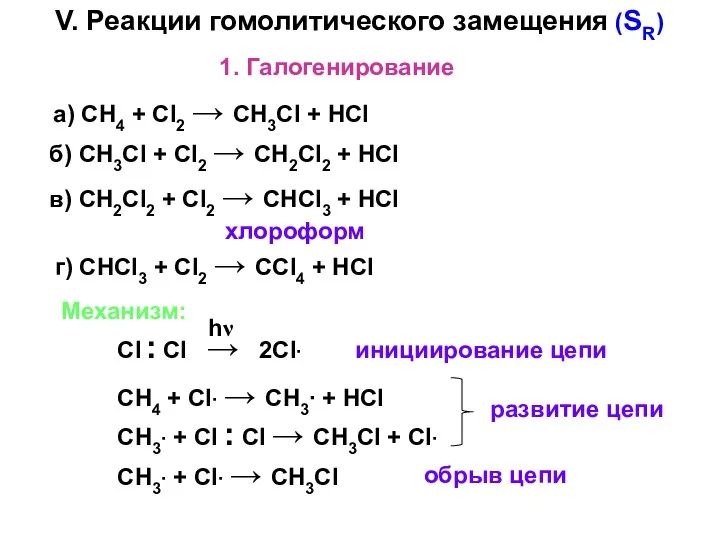
- 3. V. Реакции гомолитического замещения (SR) 1. Галогенирование а) CH4 + Cl2 → CH3Cl + HCl б)
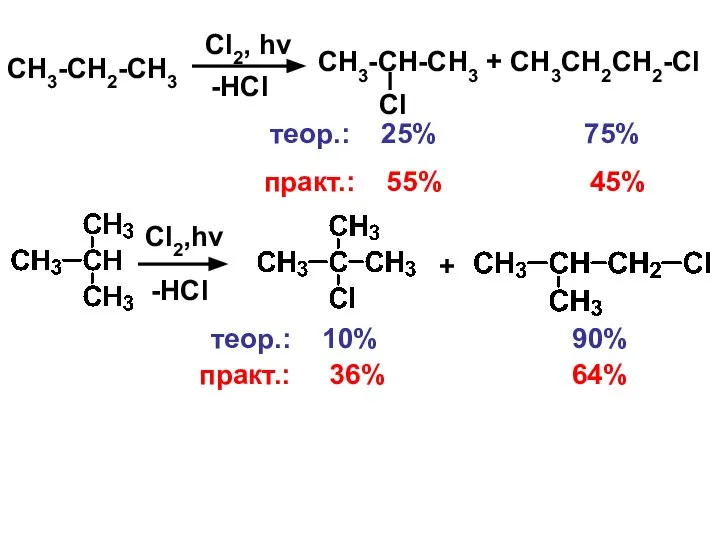
- 4. CH3-CH2-CH3 Cl2, hν -HCl CH3-CH-CH3 + CH3CH2CH2-Cl Cl теор.: 25% 75% практ.: 55% 45% Cl2,hν -НCl
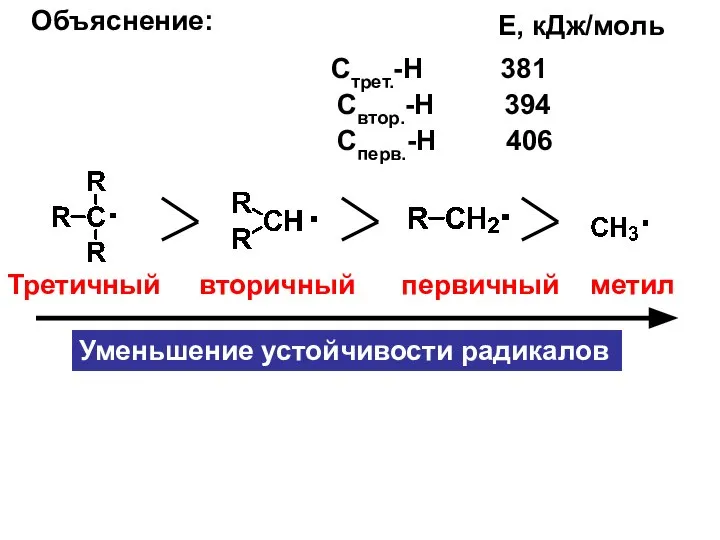
- 5. Объяснение: Стрет.-Н 381 Е, кДж/моль Свтор.-Н 394 Сперв.-Н 406 Третичный вторичный первичный метил Уменьшение устойчивости радикалов
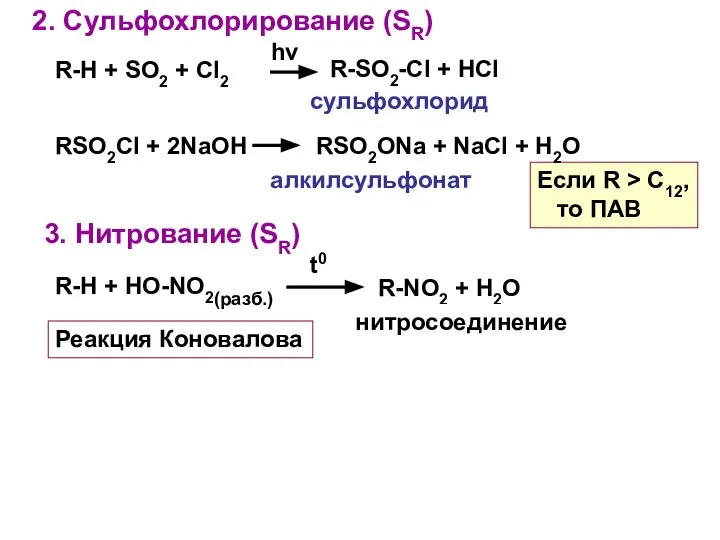
- 6. 2. Сульфохлорирование (SR) R-H + SO2 + Cl2 hν R-SO2-Cl + HCl сульфохлорид Если R >
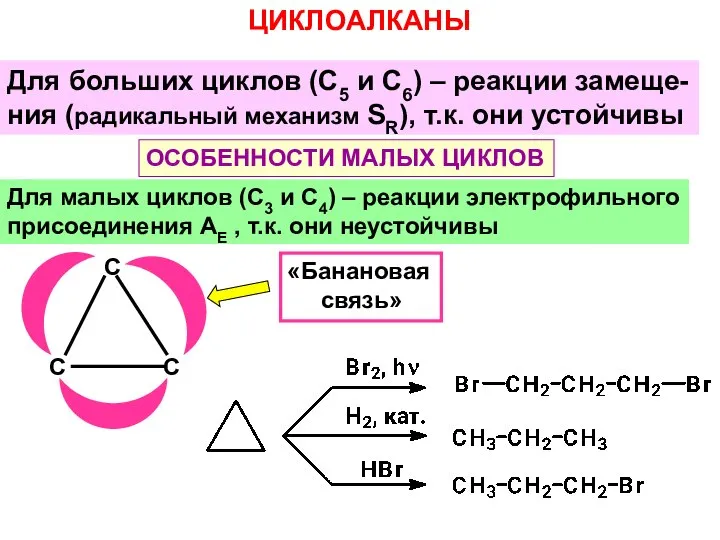
- 7. Для малых циклов (С3 и С4) – реакции электрофильного присоединения AE , т.к. они неустойчивы Для
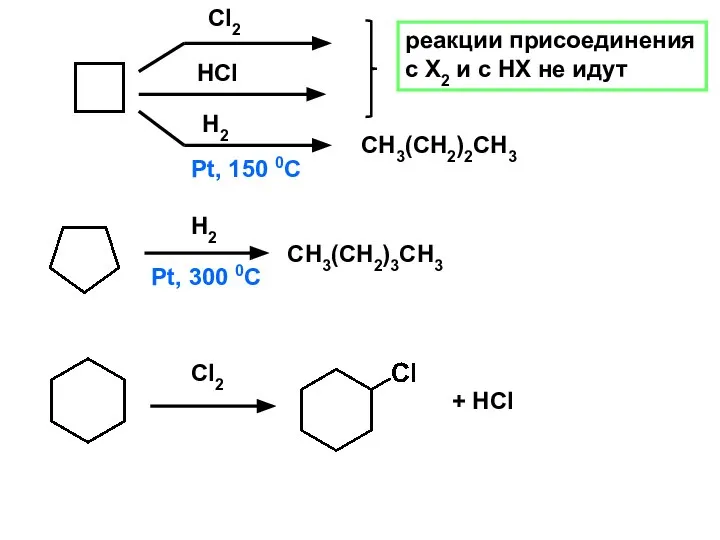
- 8. Cl2 НCl Н2 Pt, 150 0C CH3(CH2)2CH3 Pt, 300 0C Н2 CH3(CH2)3CH3 Cl2 + HCl реакции
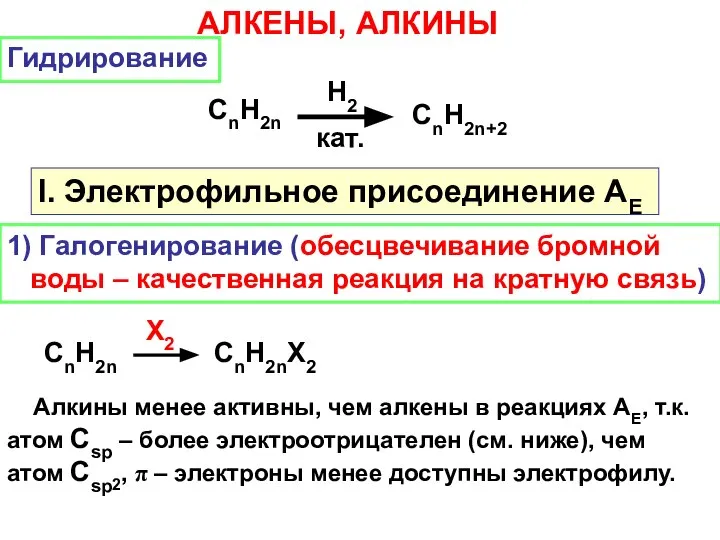
- 9. АЛКЕНЫ, АЛКИНЫ I. Электрофильное присоединение АЕ Гидрирование СnH2n H2 кат. СnH2n+2 1) Галогенирование (обесцвечивание бромной воды
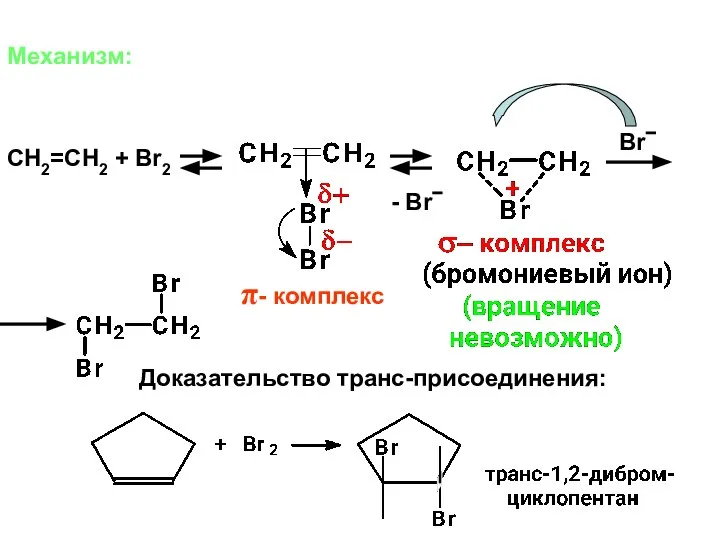
- 10. Механизм: CH2=CH2 + Br2 π- комплекс - Br− Br− Доказательство транс-присоединения:
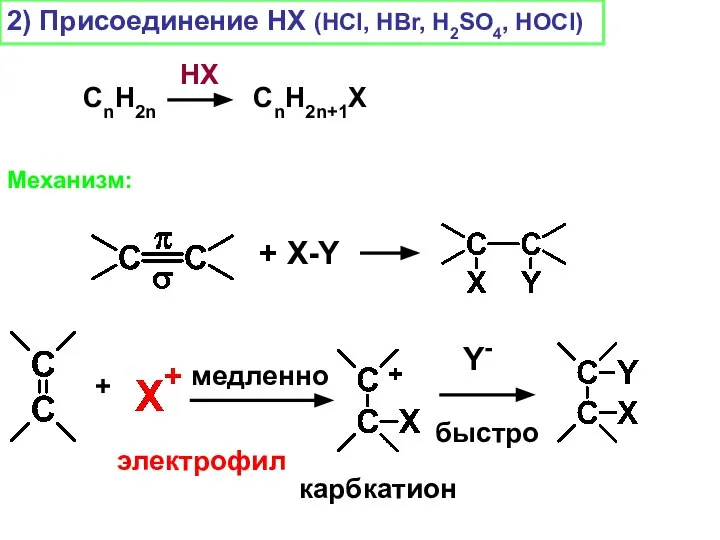
- 11. + X-Y + электрофил медленно карбкатион Y- быстро 2) Присоединение НХ (HCl, HBr, H2SO4, HOCl) СnH2n
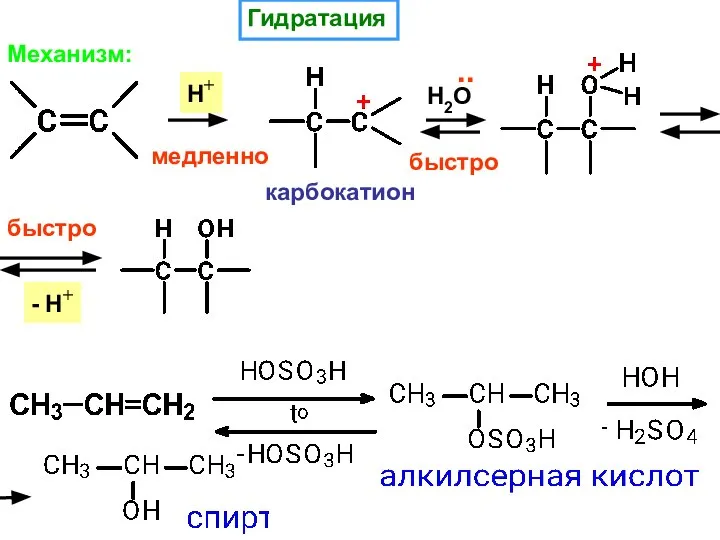
- 12. Гидратация Механизм: Н+ медленно Н2О быстро .. карбокатион - Н+ быстро
- 13. Правило Марковникова При взаимодействии реа- гентов типа НХ с несиммет- ричными алкенами (диена- ми, алкинами) водород
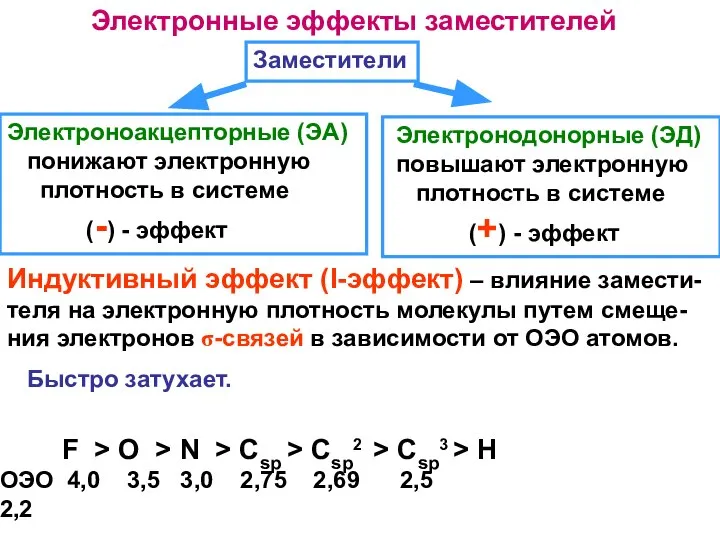
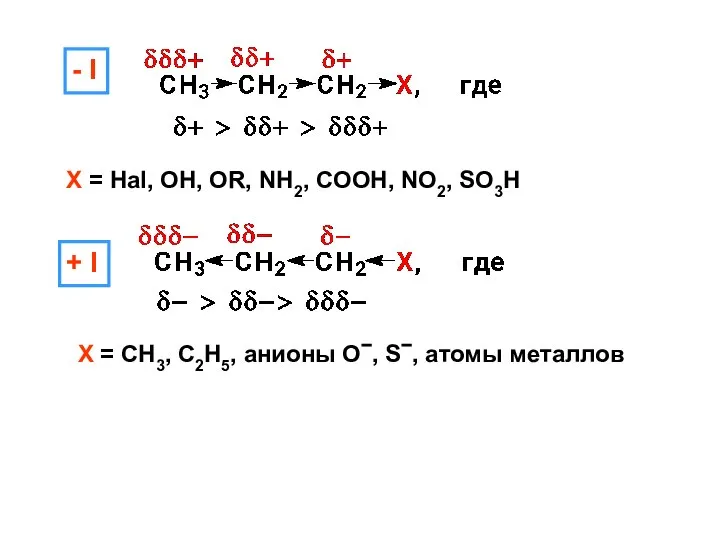
- 14. Электронные эффекты заместителей Заместители Электроноакцепторные (ЭА) понижают электронную плотность в системе (-) - эффект Электронодонорные (ЭД)
- 15. - I X = Hal, OH, OR, NH2, COOH, NO2, SO3H + I X = CH3,
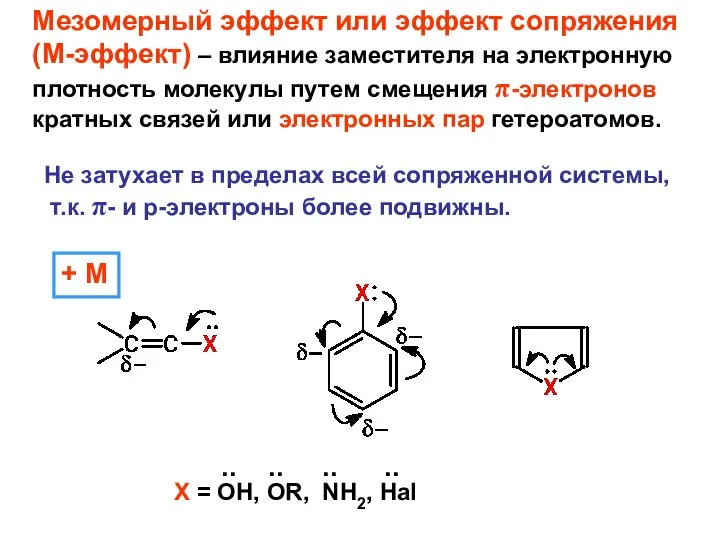
- 16. Мезомерный эффект или эффект сопряжения (М-эффект) – влияние заместителя на электронную плотность молекулы путем смещения π-электронов
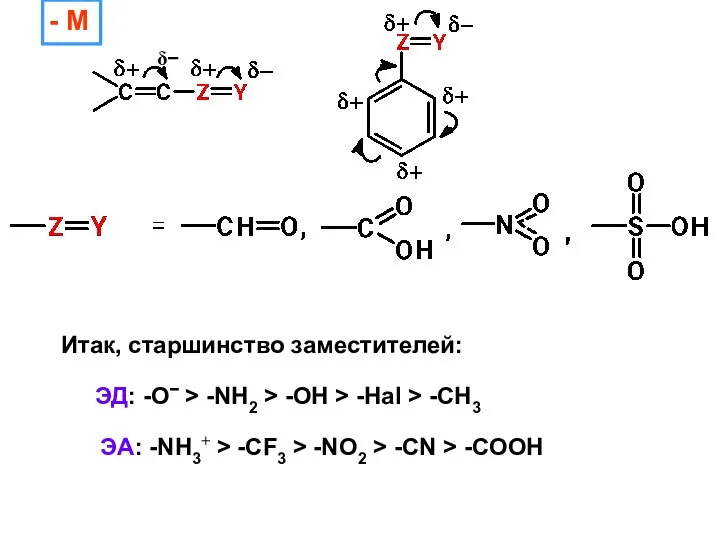
- 17. - М δ− Итак, старшинство заместителей: ЭД: -O− > -NH2 > -OH > -Hal > -CH3
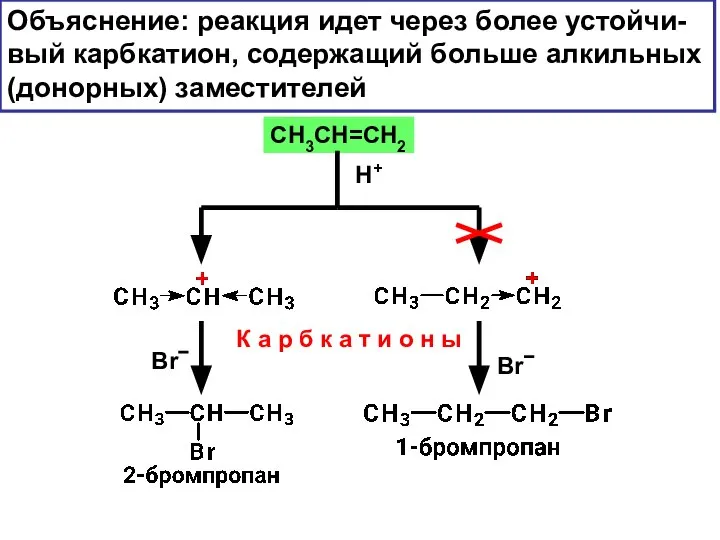
- 18. Объяснение: реакция идет через более устойчи- вый карбкатион, содержащий больше алкильных (донорных) заместителей CH3CH=CH2 H+ К
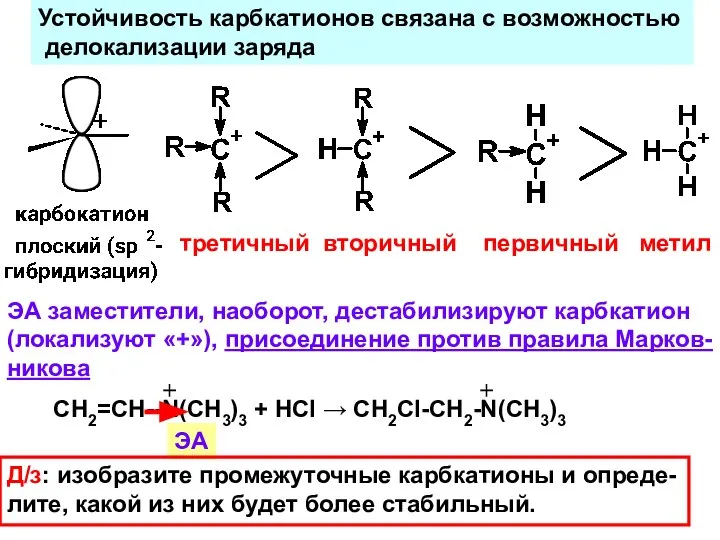
- 19. Устойчивость карбкатионов связана с возможностью делокализации заряда третичный вторичный первичный метил ЭА заместители, наоборот, дестабилизируют карбкатион
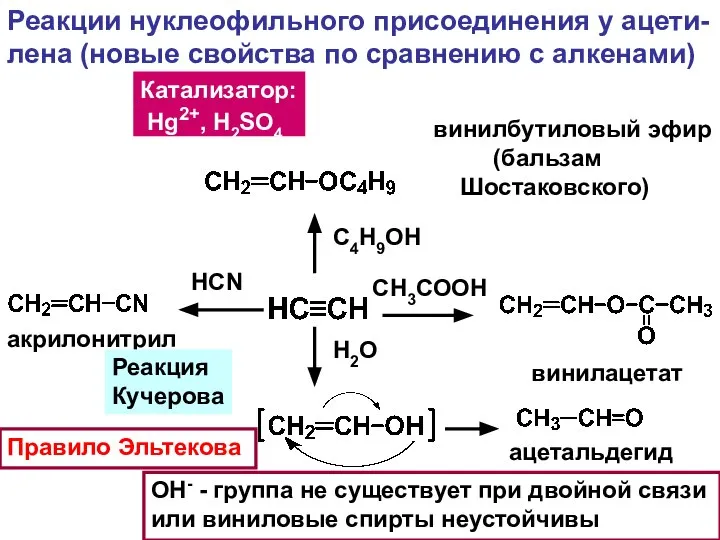
- 20. Реакции нуклеофильного присоединения у ацети- лена (новые свойства по сравнению с алкенами) HCN акрилонитрил С4Н9ОН винилбутиловый
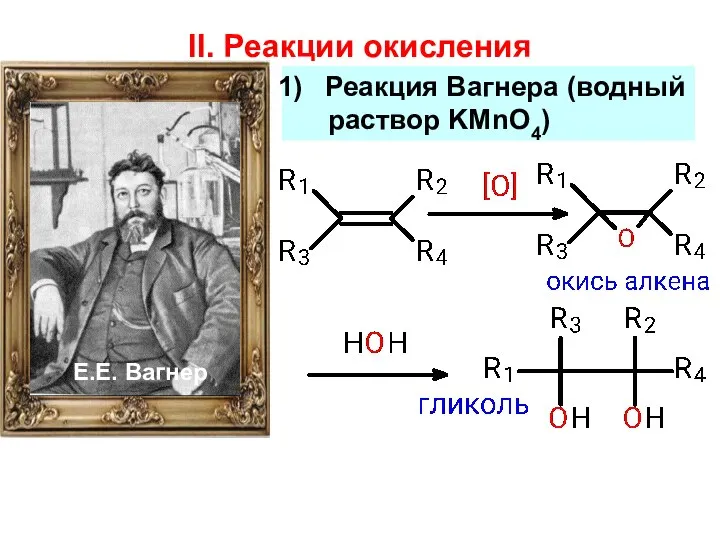
- 21. II. Реакции окисления Е.Е. Вагнер Реакция Вагнера (водный раствор KMnO4)
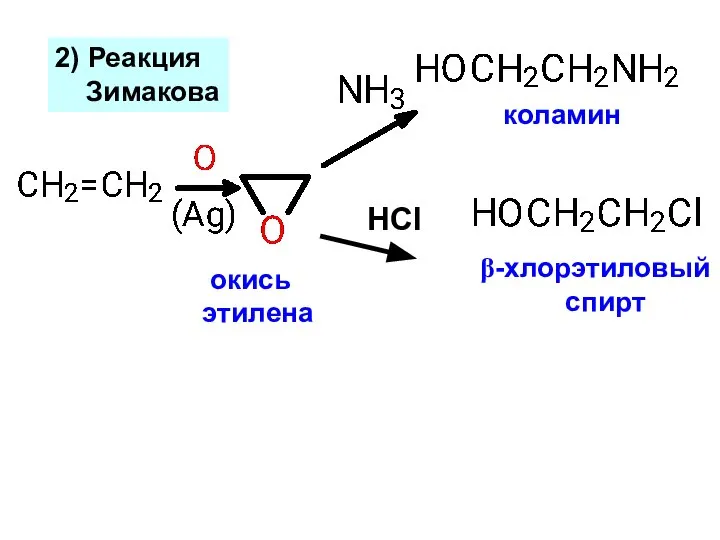
- 22. HCl 2) Реакция Зимакова окись этилена коламин β-хлорэтиловый спирт
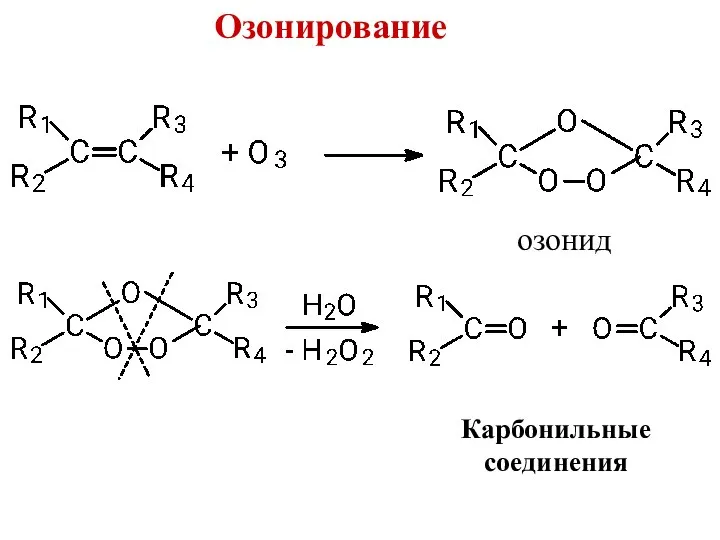
- 23. Озонирование Карбонильные соединения озонид
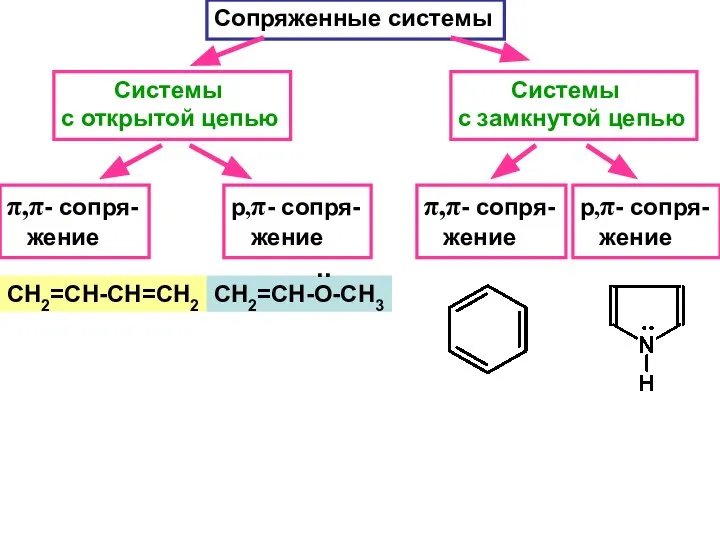
- 24. АЛКАДИЕНЫ Сопряженные системы с открытой цепью сопряжения СОПРЯЖЕНИЕ – это образование в молекуле единого электронного облака
- 25. Сопряженные системы Системы с открытой цепью Системы с замкнутой цепью π,π- cопря- жение π,π- cопря- жение
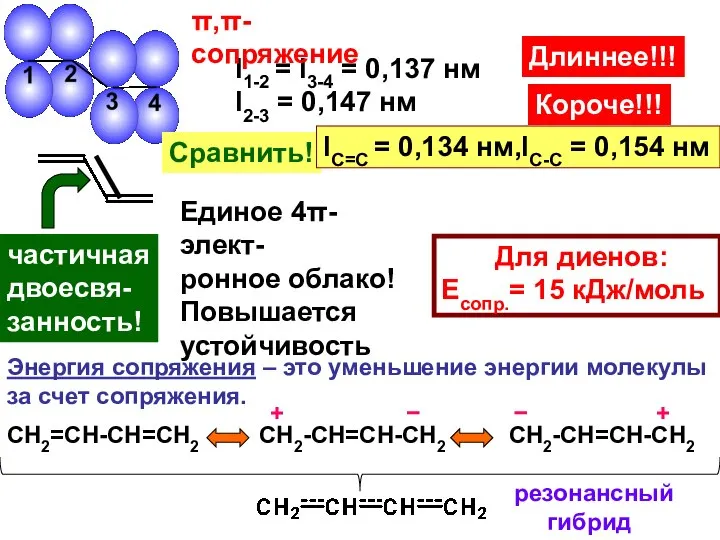
- 26. l1-2 = l3-4 = 0,137 нм l2-3 = 0,147 нм Сравнить! lC=C = 0,134 нм,lС-С =
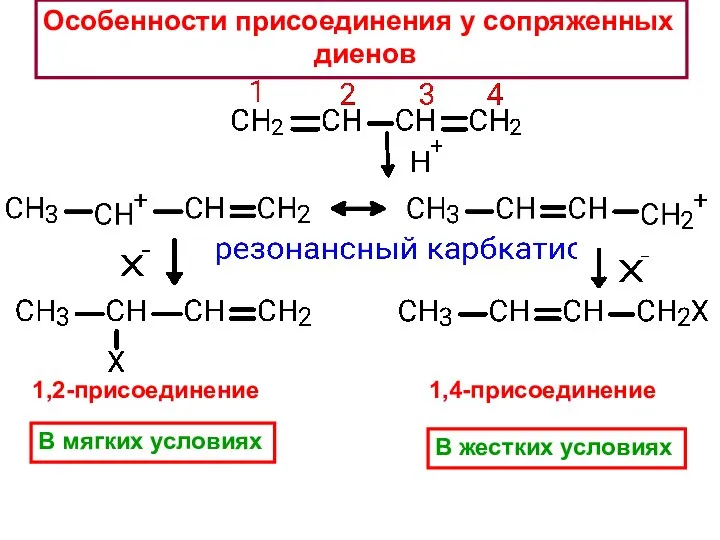
- 27. 1,4-присоединение 1,2-присоединение Особенности присоединения у сопряженных диенов В мягких условиях В жестких условиях
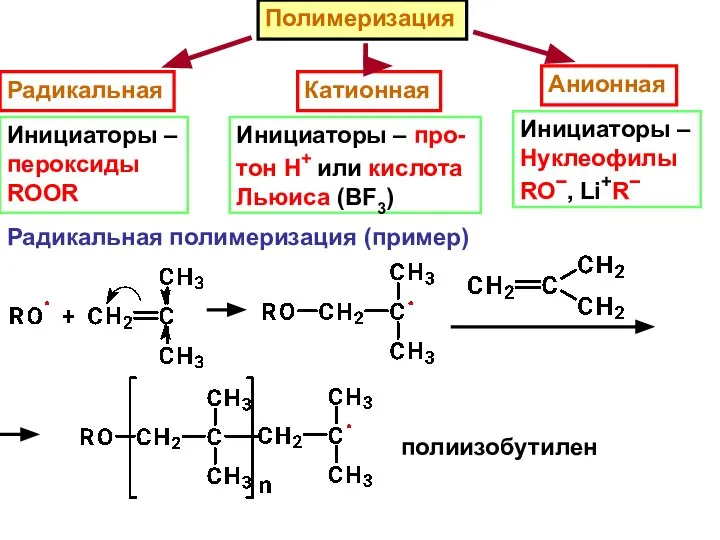
- 28. Полимеризация Радикальная Катионная Анионная Радикальная полимеризация (пример) Инициаторы – пероксиды ROOR полиизобутилен Инициаторы – про- тон
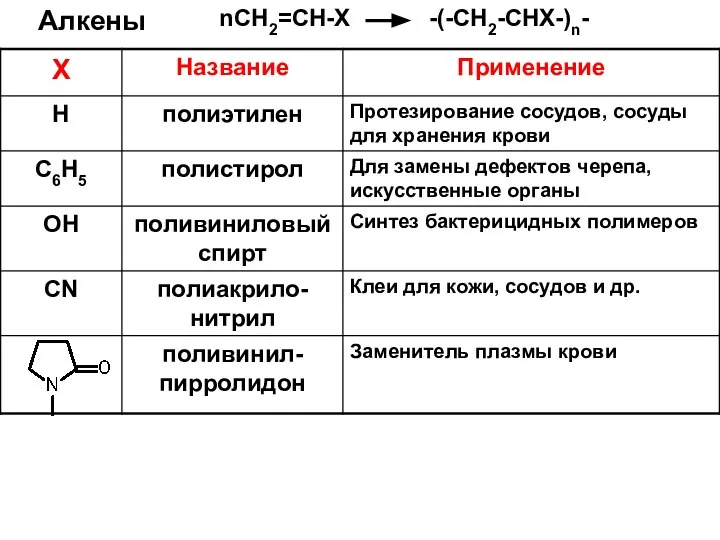
- 29. Алкены nCH2=CH-X -(-CH2-CHX-)n-
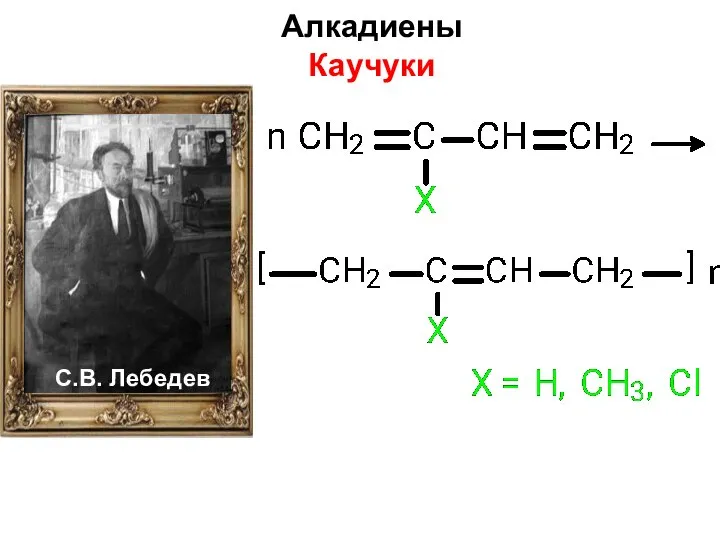
- 30. Алкадиены Каучуки С.В. Лебедев
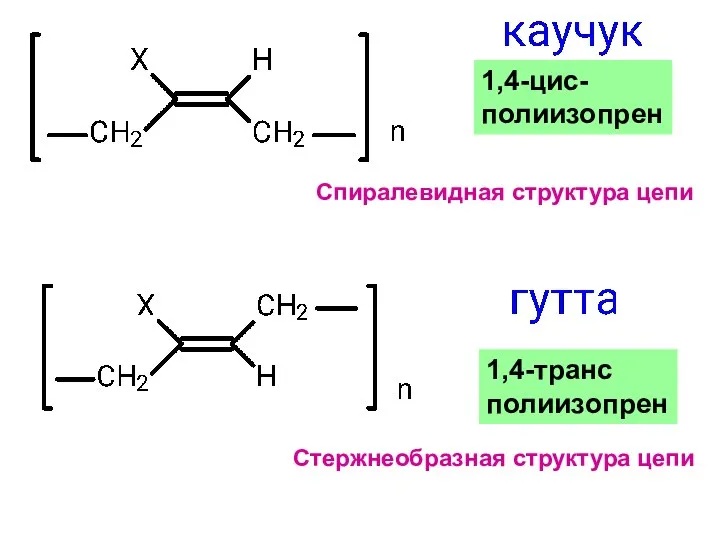
- 31. 1,4-цис- полиизопрен 1,4-транс полиизопрен Спиралевидная структура цепи Стержнеобразная структура цепи
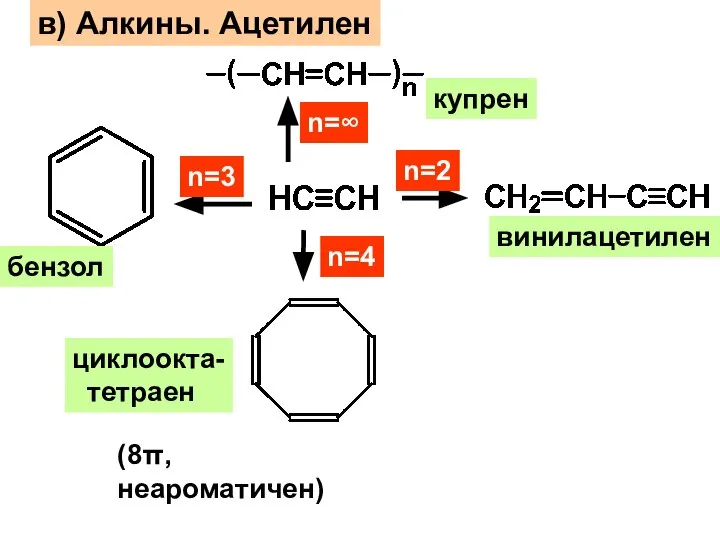
- 32. в) Алкины. Ацетилен n=2 винилацетилен n=3 бензол n=4 циклоокта- тетраен (8π, неароматичен) n=∞ купрен
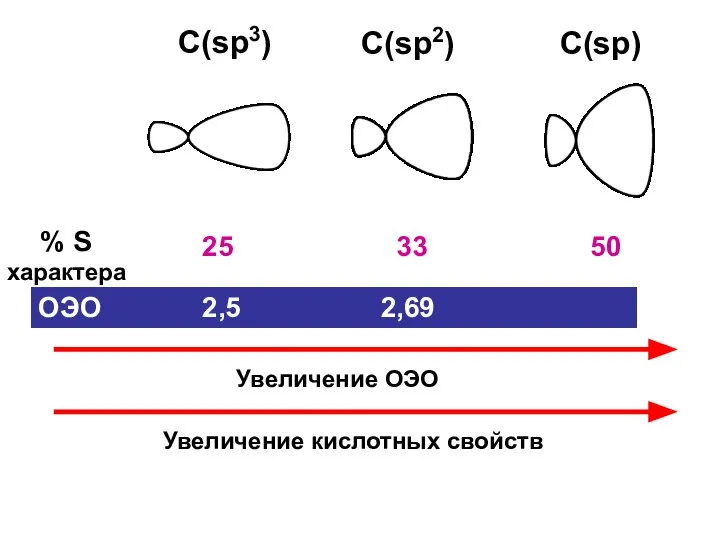
- 33. С(sp3) С(sp2) С(sp) % S характера 25 33 50 ОЭО 2,5 2,69 2,75 Увеличение ОЭО Увеличение
- 35. Скачать презентацию


 Water in the atmosphere
Water in the atmosphere  Дихотомическая модель Вебера – Вильсона
Дихотомическая модель Вебера – Вильсона  Технологический процесс механической обработки детали полумуфта кулачковая
Технологический процесс механической обработки детали полумуфта кулачковая Цифровые системы управления
Цифровые системы управления Федеральные государственные образовательные стандарты дошкольного образования .
Федеральные государственные образовательные стандарты дошкольного образования .  Shablony_dlya_urokov_Russkiy_yazyk_i_literatura_Le
Shablony_dlya_urokov_Russkiy_yazyk_i_literatura_Le Синтоизм
Синтоизм Модель соціальної політики Сполучених Штатів Америки
Модель соціальної політики Сполучених Штатів Америки Чиркова Е.В
Чиркова Е.В Фитнес-аэробика
Фитнес-аэробика Введение в программирование (часть 2). Переменные и константы
Введение в программирование (часть 2). Переменные и константы Народные промыслы России - Карточки с элементами хохл. росписи
Народные промыслы России - Карточки с элементами хохл. росписи Мой папа - презентация для начальной школы
Мой папа - презентация для начальной школы 7 апреля
7 апреля Презентация Философия. Монтескьё, Шарль-Луи де Секонда
Презентация Философия. Монтескьё, Шарль-Луи де Секонда Элементы алгебры
Элементы алгебры Презентация1
Презентация1 Праздник Рождества в России: традиции, с ним связанные
Праздник Рождества в России: традиции, с ним связанные ВНУТРЕННИЯ И ВНЕШНЯЯ ПОЛИТИКА НИКОЛАЯ I Подготовили: Майстренко Денис Медведев Вадим Группа Т-115 ФТД
ВНУТРЕННИЯ И ВНЕШНЯЯ ПОЛИТИКА НИКОЛАЯ I Подготовили: Майстренко Денис Медведев Вадим Группа Т-115 ФТД STSC_3
STSC_3 Презентация на тему "«Безопасный»вес портфеля" - скачать презентации по Педагогике
Презентация на тему "«Безопасный»вес портфеля" - скачать презентации по Педагогике Устройство, с помощью которого человек выполняет физическую работу, или подвижная часть более сложного устройства
Устройство, с помощью которого человек выполняет физическую работу, или подвижная часть более сложного устройства Задачи физического воспитания студентов их краткая характеристика
Задачи физического воспитания студентов их краткая характеристика Электроника и схемотехника
Электроника и схемотехника Геополитика, как наука
Геополитика, как наука  Изображение фигуры человека в истории искусства Человек – мера всех вещей.
Изображение фигуры человека в истории искусства Человек – мера всех вещей.  Этикет. Виды, принципы, правила
Этикет. Виды, принципы, правила Календарные песни
Календарные песни