Содержание
- 2. I. Определение понятий «кислота» и «основание» Кислотность и основность по Бренстеду-Лоури Кислоты – нейтральные молекулы или
- 3. В общем виде: А-Н + : В А− + ВН+ кислота основание сопряженное основание сопряженная кислота
- 4. II. Кислоты и основания в биологии и медицине рКа используются: - для установления структуры природных и
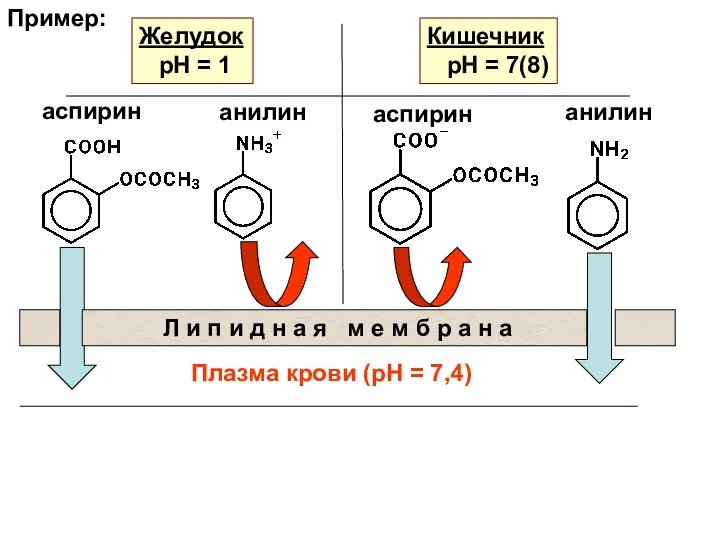
- 5. Пример: Желудок рН = 1 Кишечник рН = 7(8) аспирин аспирин анилин анилин Л и п
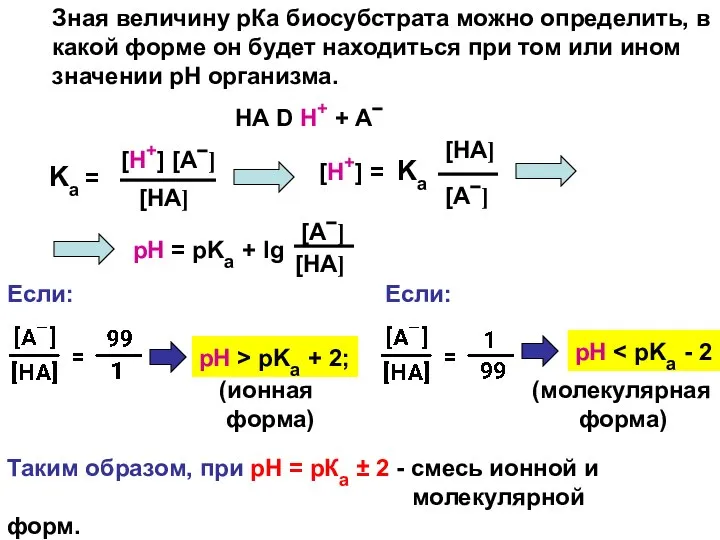
- 6. Зная величину рКа биосубстрата можно определить, в какой форме он будет находиться при том или ином
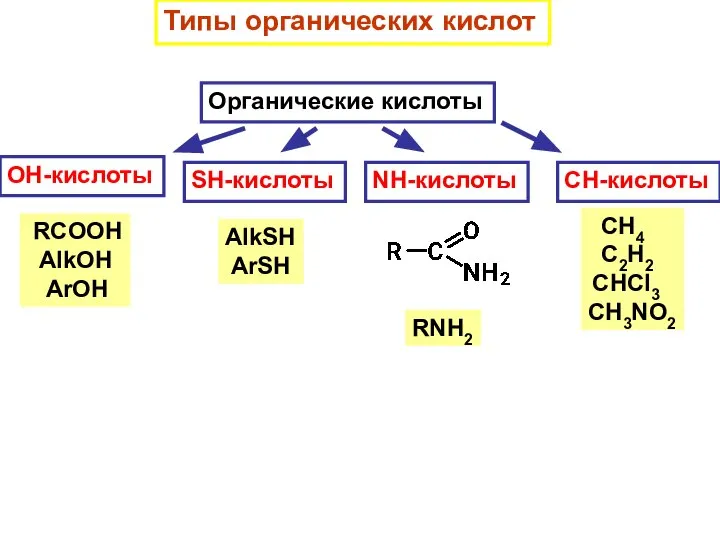
- 7. Типы органических кислот Органические кислоты OH-кислоты RCOOH AlkOH ArOH SH-кислоты AlkSH ArSH NH-кислоты RNH2 CH-кислоты CH4
- 8. При оценке кислотности органических соединений прогнозируют стабильность аниона, образующегося при диссоциации кислоты (А−). Факторы, влияющие на
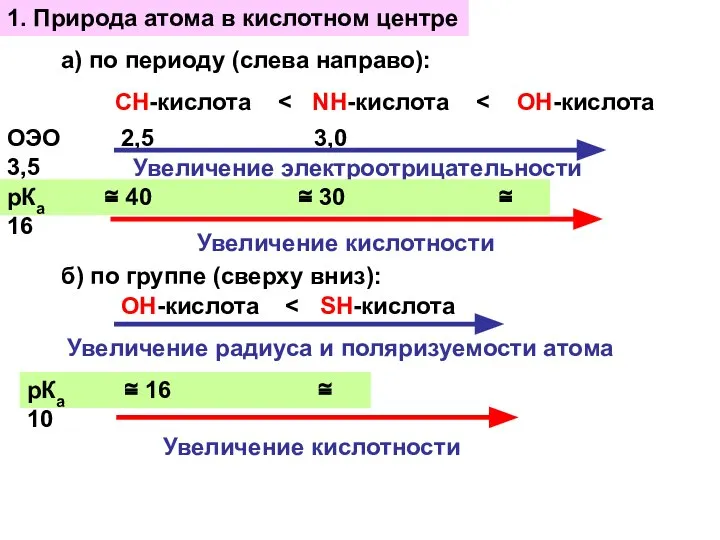
- 9. 1. Природа атома в кислотном центре а) по периоду (слева направо): СН-кислота ОЭО 2,5 3,0 3,5
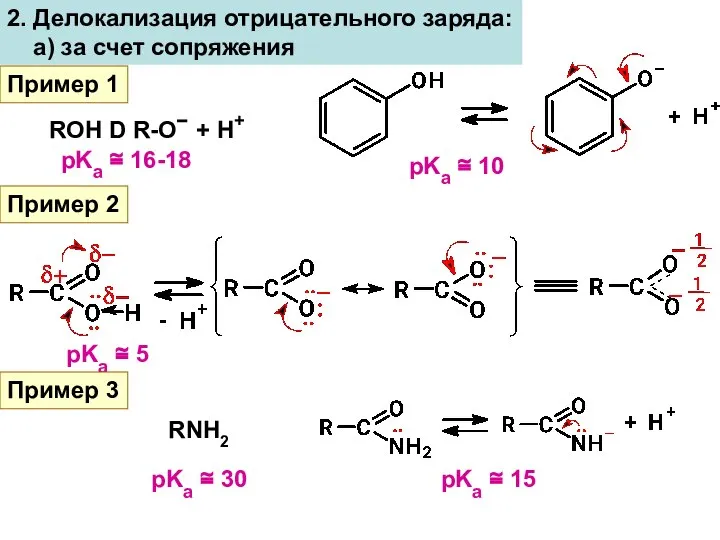
- 10. 2. Делокализация отрицательного заряда: а) за счет сопряжения Пример 1 ROH D R-O− + H+ pKa
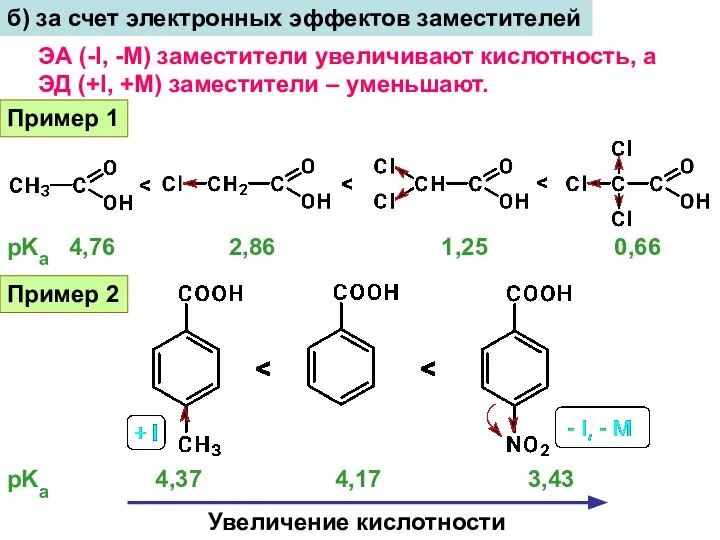
- 11. Пример 2 pKa 4,37 4,17 3,43 Увеличение кислотности б) за счет электронных эффектов заместителей ЭА (-I,
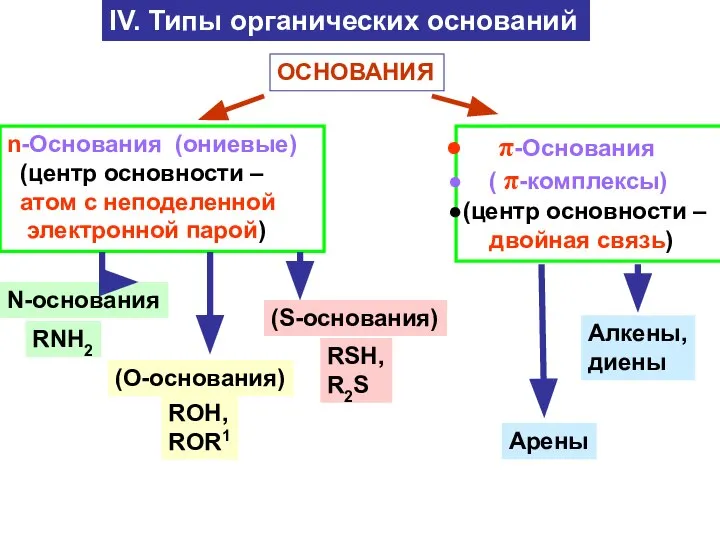
- 12. IV. Типы органических оснований ОСНОВАНИЯ n-Основания (ониевые) (центр основности – атом с неподеленной электронной парой) π-Основания
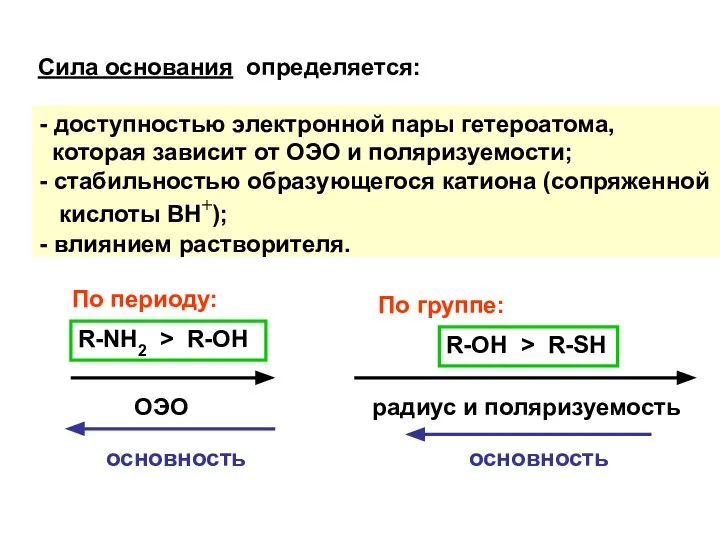
- 13. Сила основания определяется: - доступностью электронной пары гетероатома, которая зависит от ОЭО и поляризуемости; - стабильностью
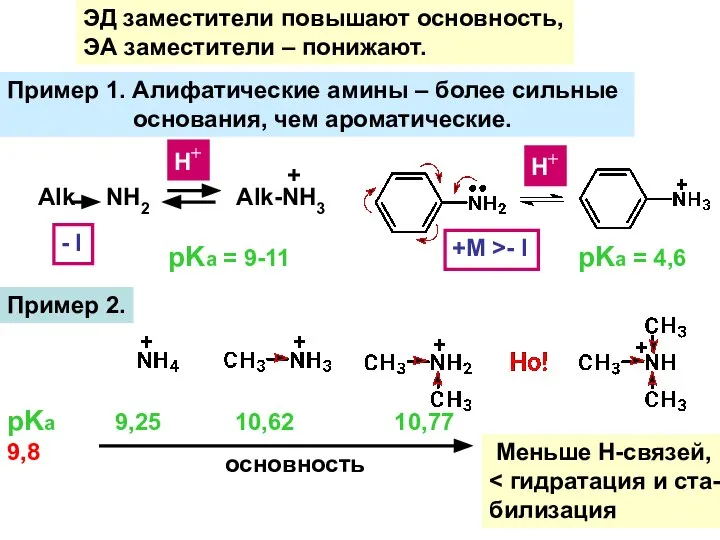
- 14. ЭД заместители повышают основность, ЭА заместители – понижают. Пример 1. Алифатические амины – более сильные основания,
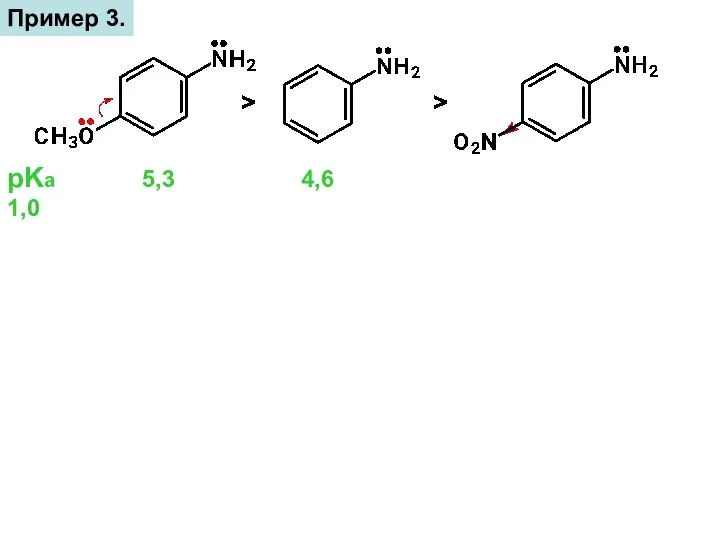
- 15. Пример 3. pKа 5,3 4,6 1,0
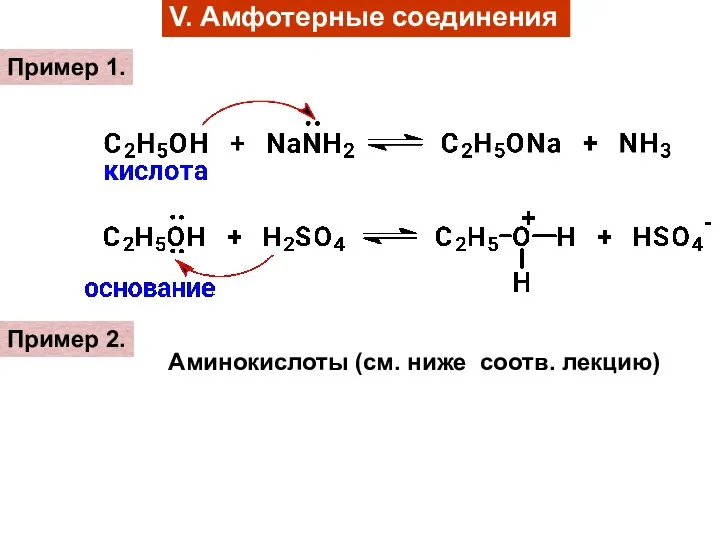
- 16. V. Амфотерные соединения Пример 1. Пример 2. Аминокислоты (см. ниже соотв. лекцию)
- 17. VI. Кислоты и основания Льюиса (более общая теория) Кислоты Льюиса – акцепторы пары электронов, любые электронодефицитные
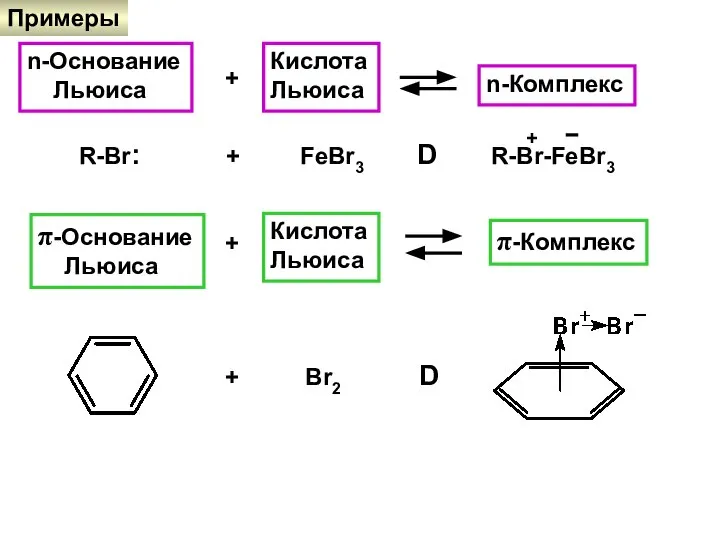
- 18. Примеры n-Основание Льюиса + Кислота Льюиса n-Комплекс R-Br: + FeBr3 D R-Br-FeBr3 + − π-Основание Льюиса
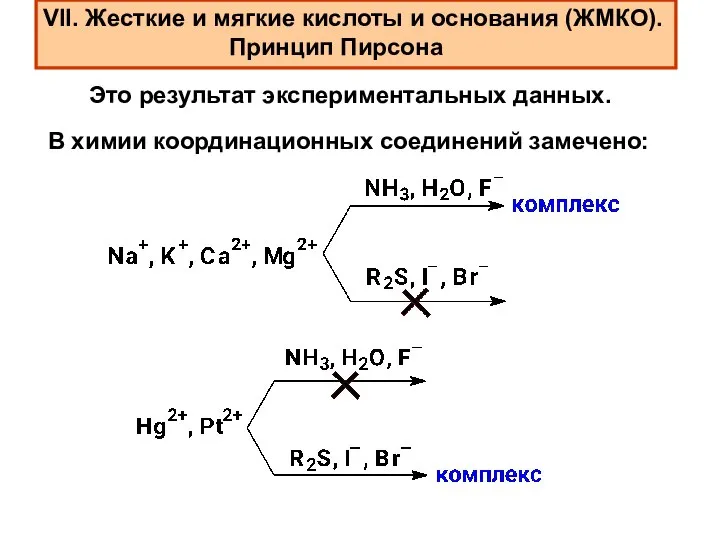
- 19. VII. Жесткие и мягкие кислоты и основания (ЖМКО). Принцип Пирсона Это результат экспериментальных данных. В химии
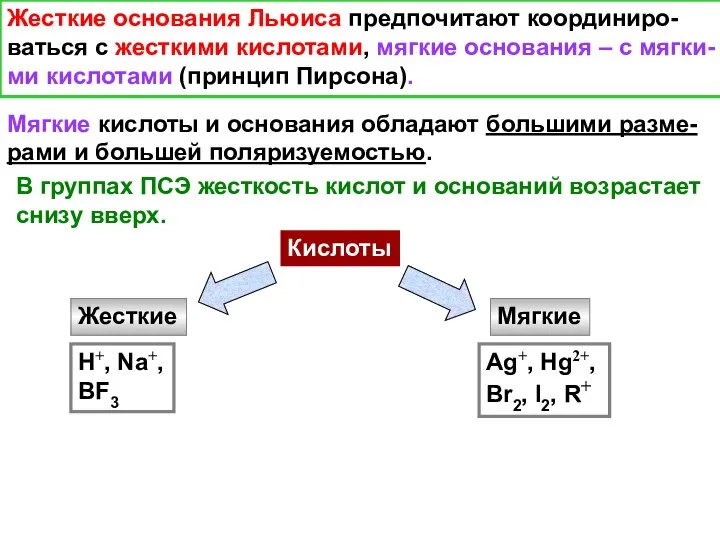
- 20. Жесткие основания Льюиса предпочитают координиро- ваться с жесткими кислотами, мягкие основания – с мягки- ми кислотами
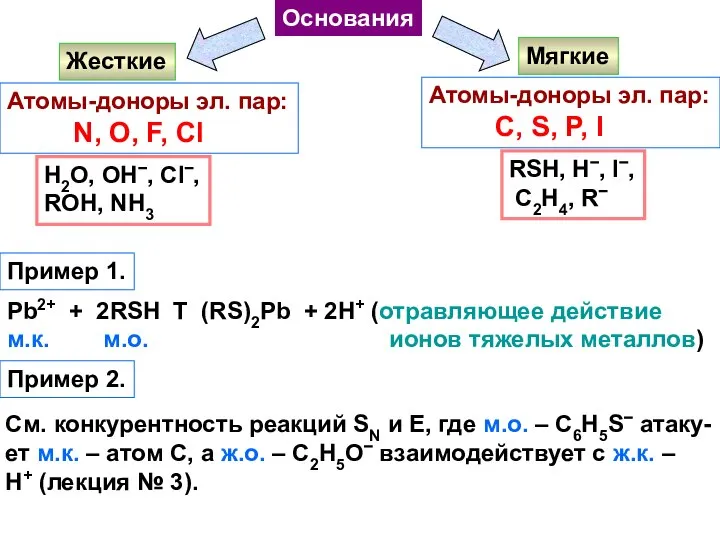
- 21. Основания Жесткие Мягкие Атомы-доноры эл. пар: N, O, F, Cl Атомы-доноры эл. пар: C, S, P,
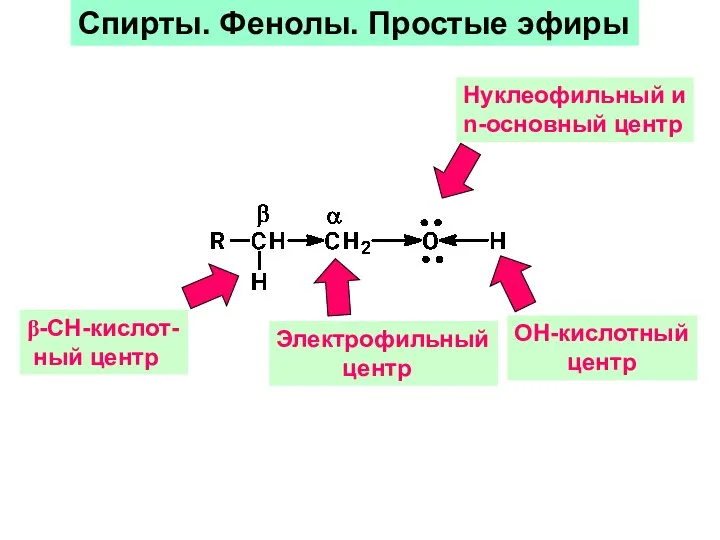
- 22. ОН-кислотный центр Нуклеофильный и n-основный центр Электрофильный центр β-CH-кислот- ный центр Спирты. Фенолы. Простые эфиры
- 23. Медико-биологическое значение спиртов Метанол – яд Этанол – экстракты, настои, дезинфекция рук, консервирование препаратов Фенол –
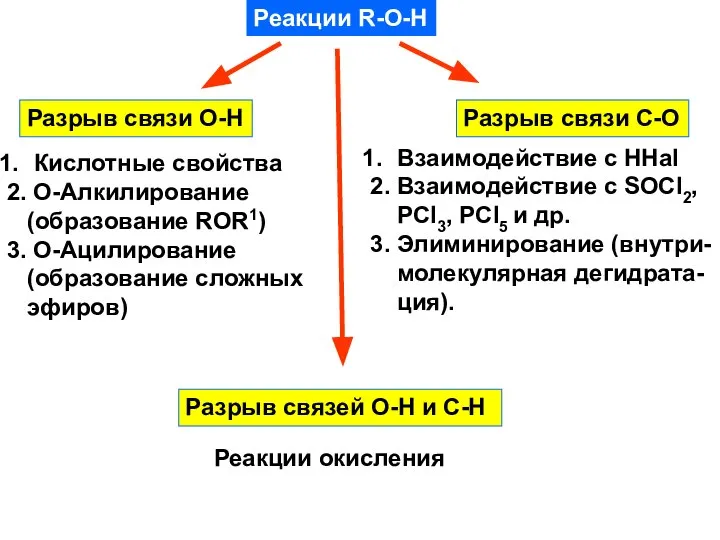
- 24. Реакции R-O-H Разрыв связи О-Н Разрыв связи C-O Кислотные свойства 2. О-Алкилирование (образование ROR1) 3. О-Ацилирование
- 25. I. Реакции с участием нуклеофильного центра О-Алкилирование ROH + R1X T R-O-R1 + HX Обычно –
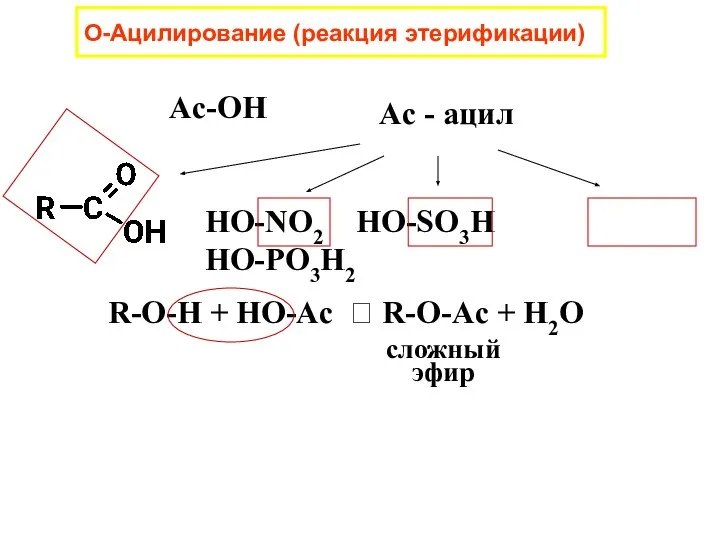
- 26. О-Ацилирование (реакция этерификации) Ac-OH Ac - ацил HO-NO2 HO-SO3H HO-PO3H2 R-O-H + HO-Ac R-O-Ac +
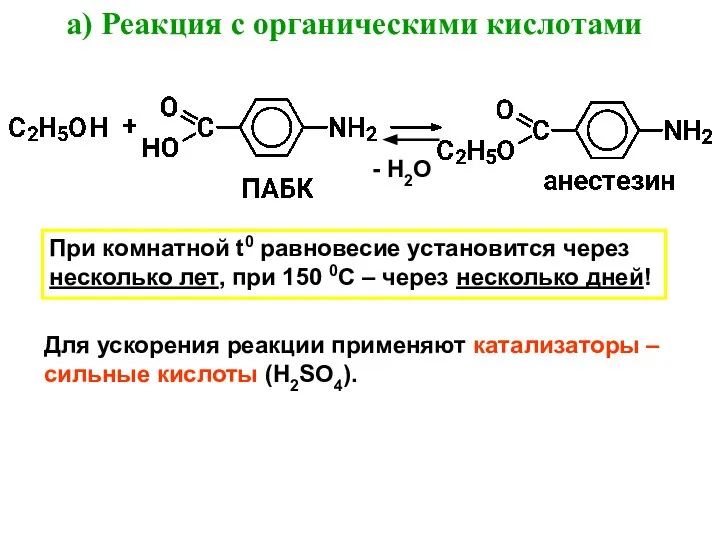
- 27. а) Реакция с органическими кислотами - Н2О При комнатной t0 равновесие установится через несколько лет, при
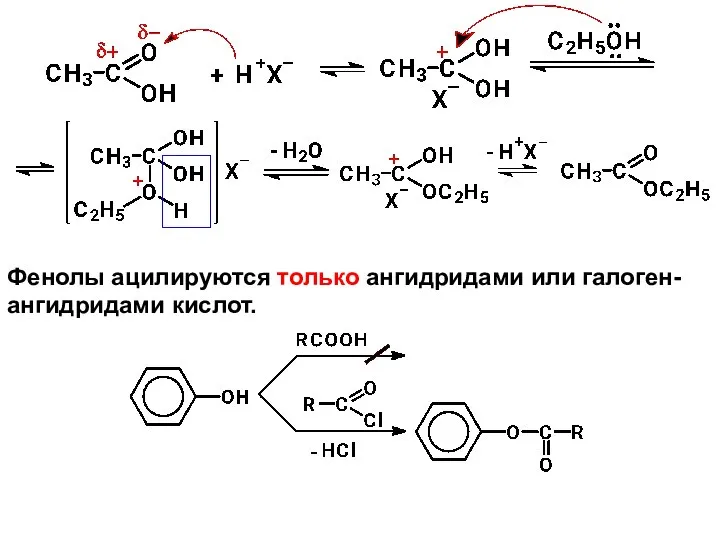
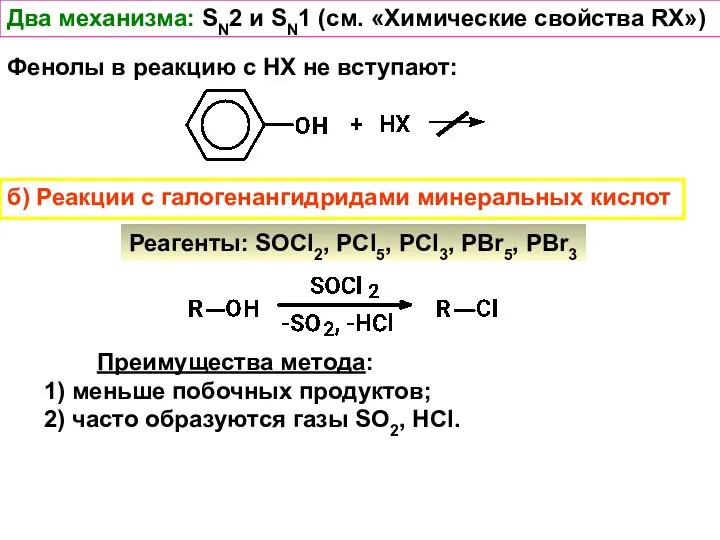
- 28. Фенолы ацилируются только ангидридами или галоген- ангидридами кислот.
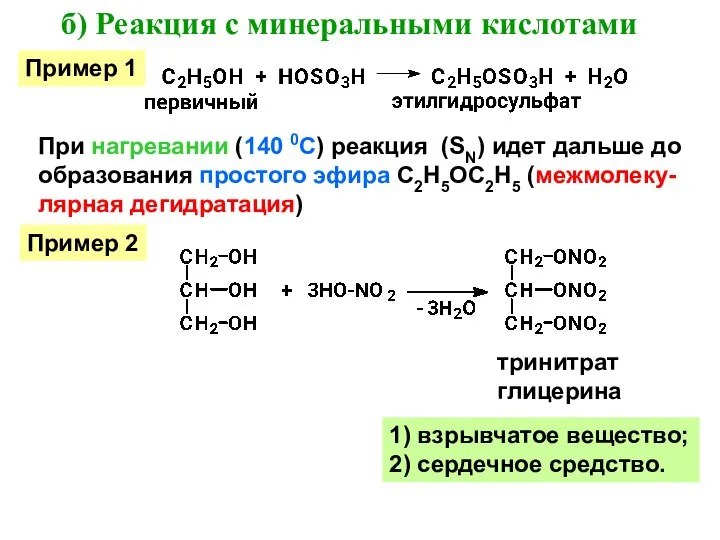
- 29. При нагревании (140 0С) реакция (SN) идет дальше до образования простого эфира С2Н5ОС2Н5 (межмолеку- лярная дегидратация)
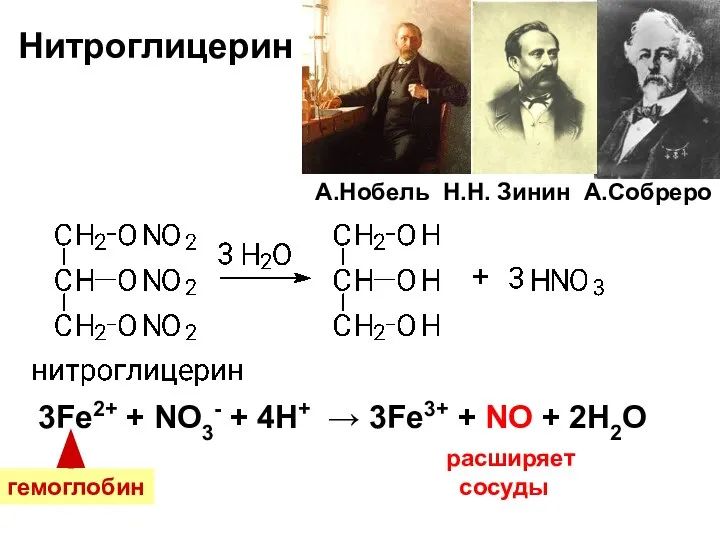
- 30. Нитроглицерин 3Fe2+ + NO3- + 4H+ → 3Fe3+ + NO + 2H2O А.Нобель Н.Н. Зинин А.Собреро
- 31. 1846 г. – два взрывчатых нитроэфира: 1. Пироксилин (нитроклетчатка), Х. Шенбайн, 2. Нитроглицерин, А. Собреро. 1854
- 32. «Нитроглицерин для взрывчатого дела был в первый раз применен известным химиком Н.Н.Зининым во время Крымской войны,
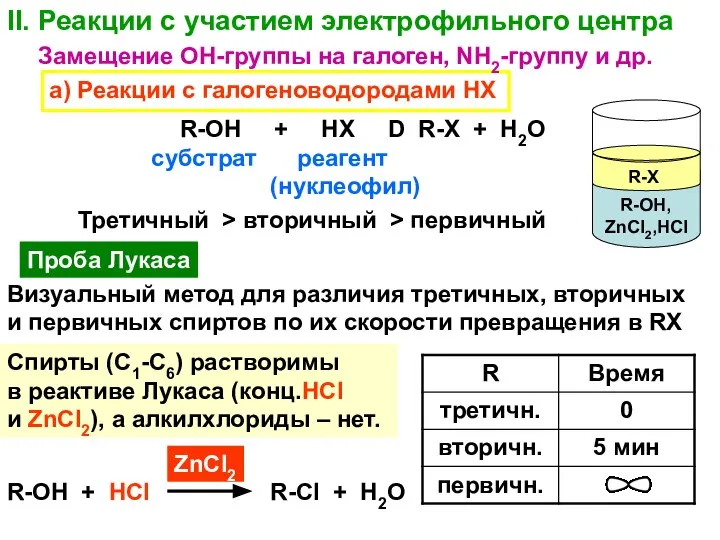
- 33. II. Реакции с участием электрофильного центра а) Реакции с галогеноводородами НХ Замещение ОН-группы на галоген, NH2-группу
- 34. Два механизма: SN2 и SN1 (см. «Химические свойства RX») Фенолы в реакцию с НХ не вступают:
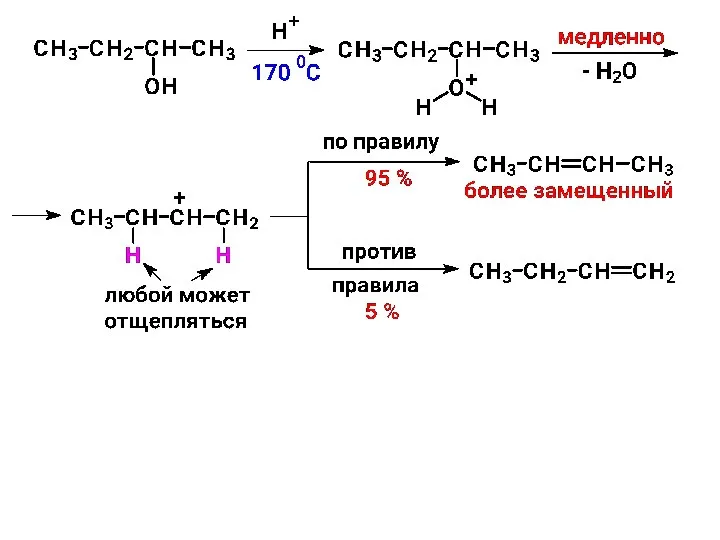
- 35. III. Реакции элиминирования В растворе: катализаторы – минеральные кислоты или кислоты Льюиса Реакции с участием СН-кислотного
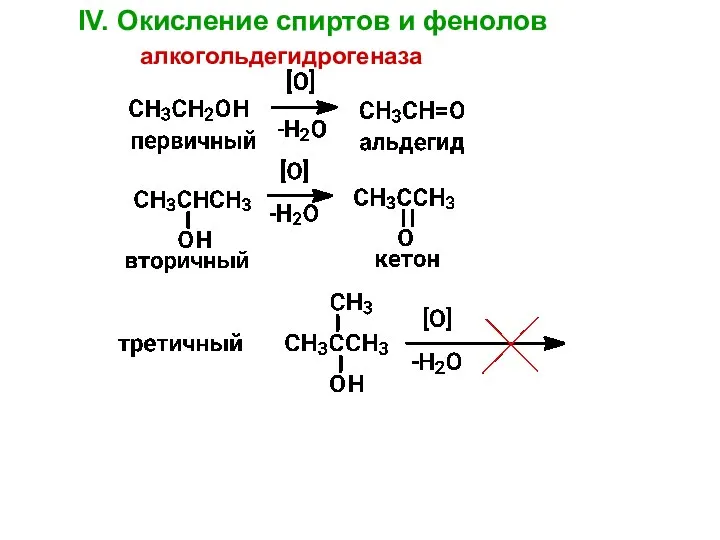
- 37. IV. Окисление спиртов и фенолов алкогольдегидрогеназа
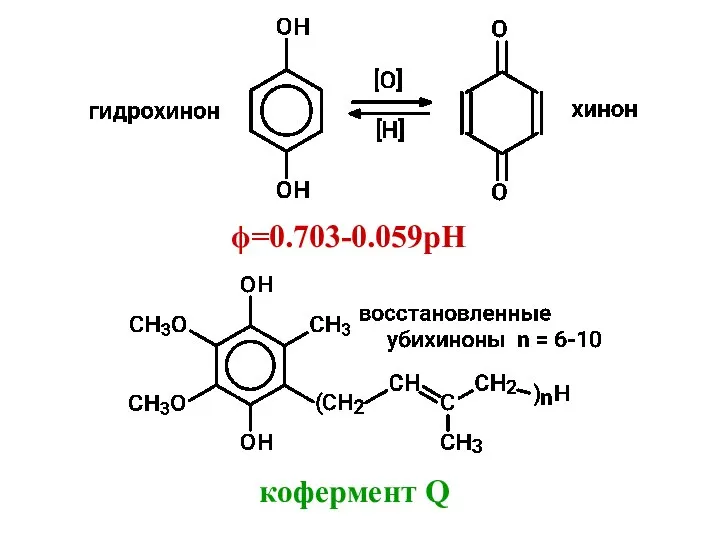
- 38. ϕ=0.703-0.059рН кофермент Q
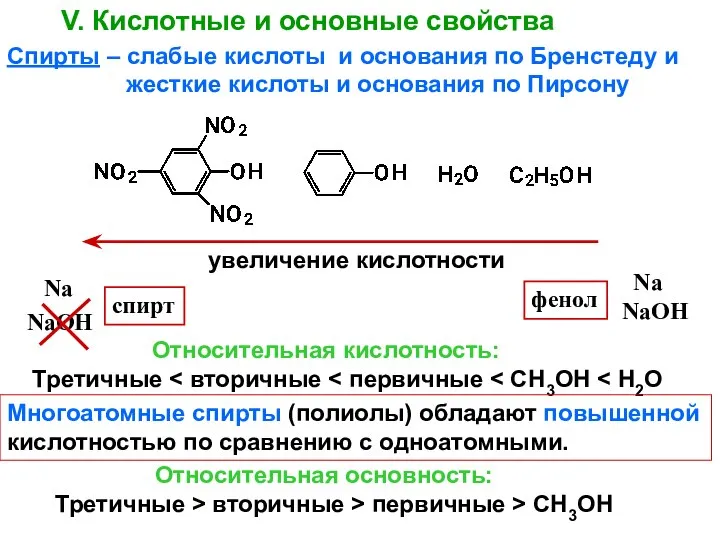
- 39. увеличение кислотности спирт фенол Na NaOH Na NaOH V. Кислотные и основные свойства Спирты – слабые
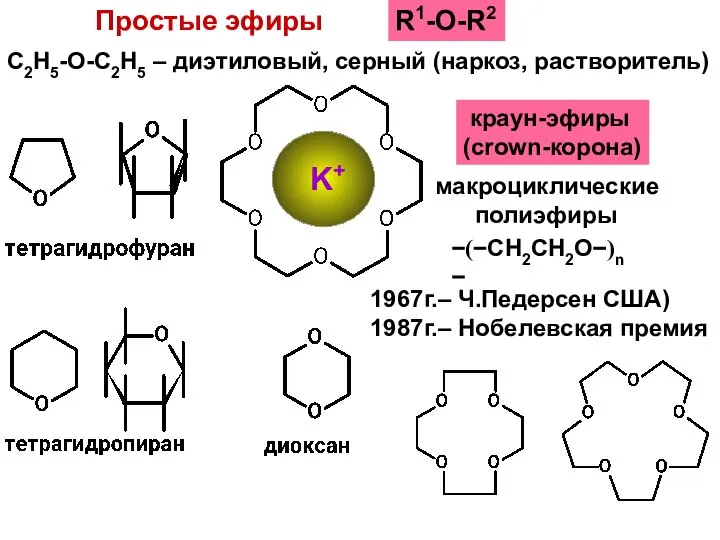
- 40. Простые эфиры R1-O-R2 C2H5-O-C2H5 – диэтиловый, серный (наркоз, растворитель) краун-эфиры (crown-корона) −(−СН2СН2О−)n − макроциклические полиэфиры 1967г.–
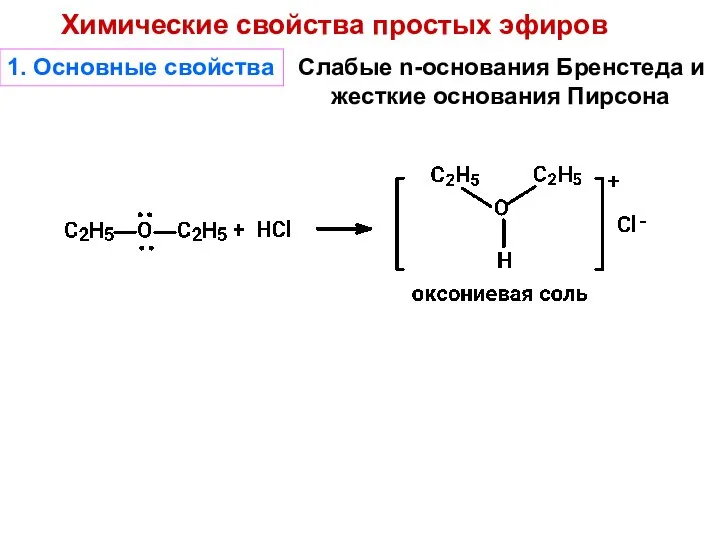
- 41. 1. Основные свойства Слабые n-основания Бренстеда и жесткие основания Пирсона Химические свойства простых эфиров
- 43. Скачать презентацию










 Лаборатория декора «LD»
Лаборатория декора «LD» Принцип работы асинхронных вентильных каскадов
Принцип работы асинхронных вентильных каскадов Чертежные инструменты
Чертежные инструменты Программирование игр на Python
Программирование игр на Python Презентация РАСОВО-АНТРОПОЛОГИЧЕСКАЯ ШКОЛА в культурологии. Биологический подход к пониманию культуры.
Презентация РАСОВО-АНТРОПОЛОГИЧЕСКАЯ ШКОЛА в культурологии. Биологический подход к пониманию культуры. Лыжная подготовка в начальной школе
Лыжная подготовка в начальной школе КНДР. Социально-политическая система
КНДР. Социально-политическая система Презентация Владелец магазина беспошлинной торговли
Презентация Владелец магазина беспошлинной торговли  Андрей Рублев
Андрей Рублев Глобальные риски и новые медицинские технологии
Глобальные риски и новые медицинские технологии Презентация Договор кредитования
Презентация Договор кредитования Каждый день на устах моих Это сладкое имя Иисус
Каждый день на устах моих Это сладкое имя Иисус НАЛОГОВЫЙ КОДЕКС: для транспортных предприятий
НАЛОГОВЫЙ КОДЕКС: для транспортных предприятий  Россия в 17 веке. Новые явления в экономике. Работу выполнила ученица 7 «А» класса МОУ Брединской сош №1 Челябинской области Ан
Россия в 17 веке. Новые явления в экономике. Работу выполнила ученица 7 «А» класса МОУ Брединской сош №1 Челябинской области Ан Создание программы. Пример работы программы
Создание программы. Пример работы программы Гжель
Гжель Железобетонные бункера
Железобетонные бункера Архитектура. Живопись.
Архитектура. Живопись. И. С. Тургенев (1818-1883)
И. С. Тургенев (1818-1883) Врачебно-педагогический контроль занимаюшихся баскетболом
Врачебно-педагогический контроль занимаюшихся баскетболом Программирование линейных алгоритмов. Начала программирования
Программирование линейных алгоритмов. Начала программирования Темп роста радужной форели на различных кормах
Темп роста радужной форели на различных кормах Kappa (κ) Engine
Kappa (κ) Engine проверочный тест на тему Древняя Русь
проверочный тест на тему Древняя Русь Святые Вера, Надежда, Любовь и их мать София
Святые Вера, Надежда, Любовь и их мать София ФАРМАКОЛОГИЯ ЦНС Ноотропы Адаптогены Антидепрессанты
ФАРМАКОЛОГИЯ ЦНС Ноотропы Адаптогены Антидепрессанты Принципы ООП в Unity
Принципы ООП в Unity Discover Ukraine – проект, который занимается организацией путешествий по Харьковской области и другим городам Украины
Discover Ukraine – проект, который занимается организацией путешествий по Харьковской области и другим городам Украины