Содержание
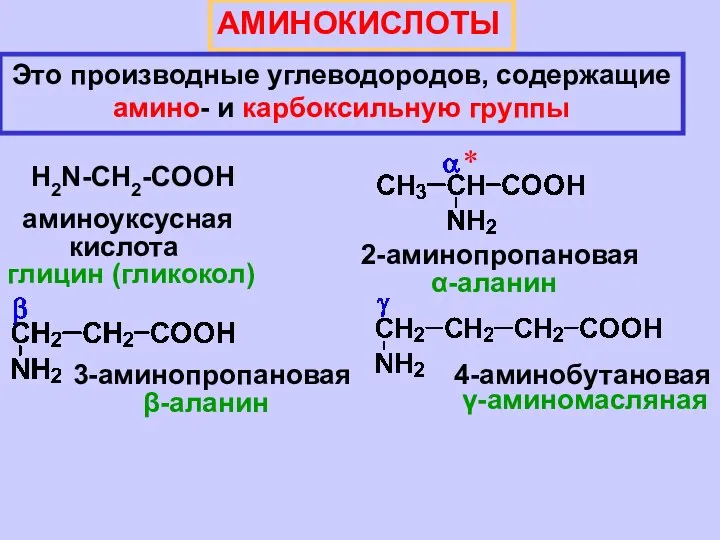
- 2. АМИНОКИСЛОТЫ Это производные углеводородов, содержащие амино- и карбоксильную группы H2N-CH2-COOH аминоуксусная кислота глицин (гликокол) * 2-аминопропановая
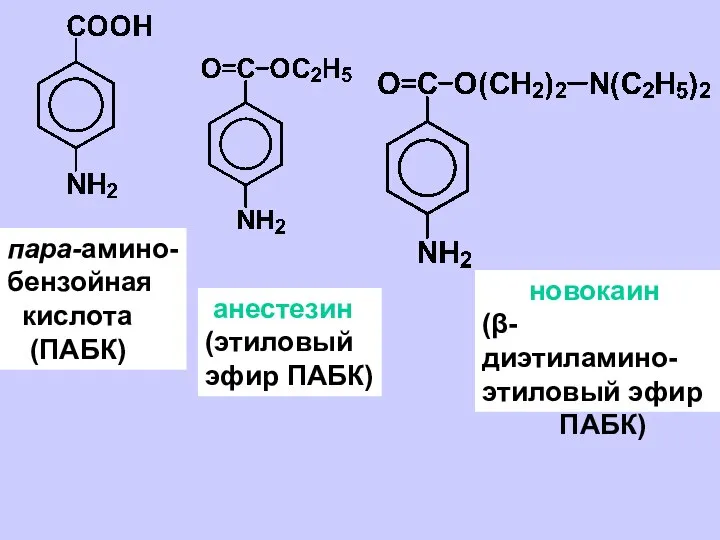
- 3. пара-амино- бензойная кислота (ПАБК) анестезин (этиловый эфир ПАБК) новокаин (β-диэтиламино- этиловый эфир ПАБК)
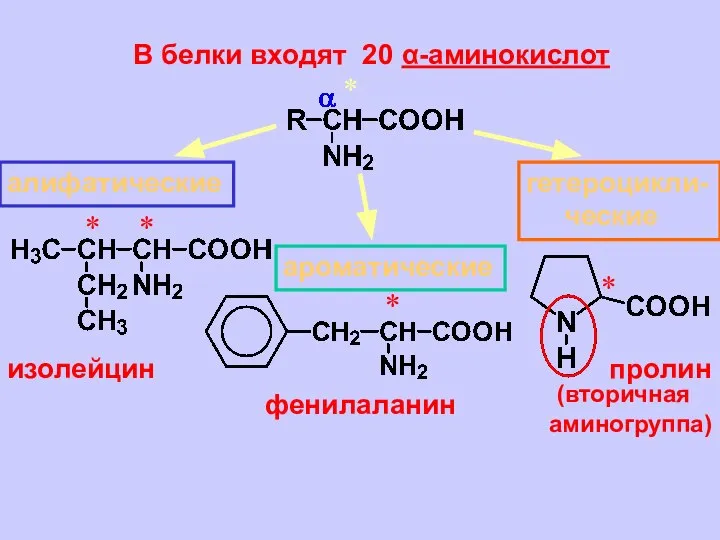
- 4. В белки входят 20 α-аминокислот * алифатические ароматические гетероцикли- ческие изолейцин * * * фенилаланин пролин
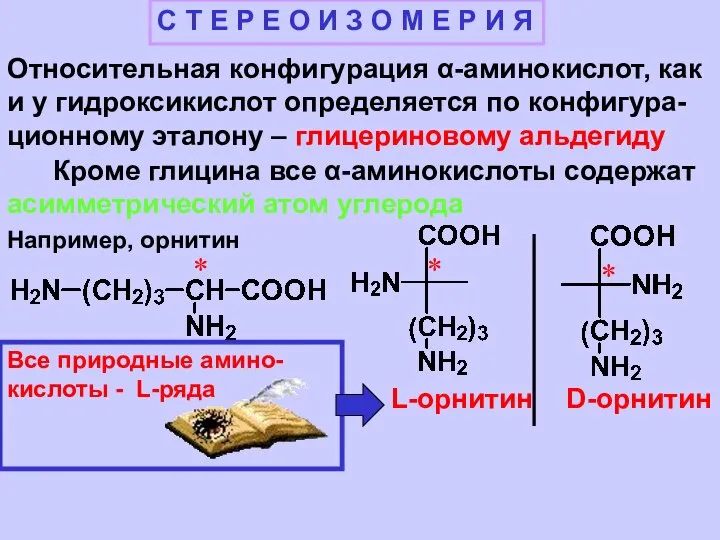
- 5. С Т Е Р Е О И З О М Е Р И Я Относительная конфигурация
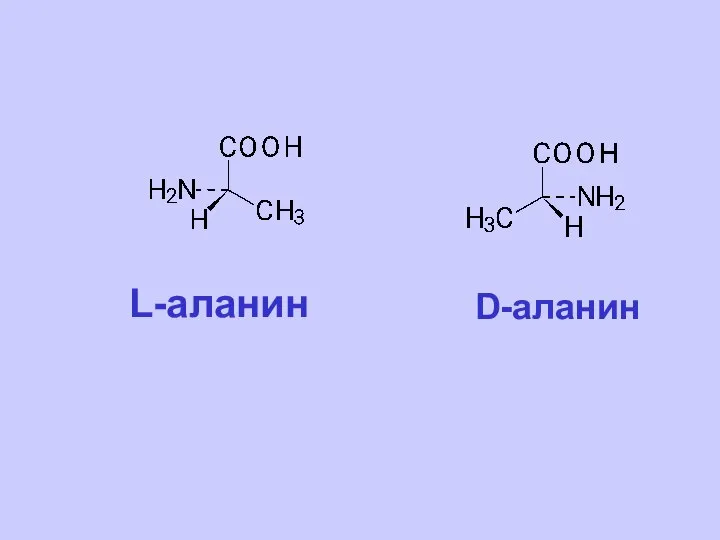
- 6. D-аланин L-аланин
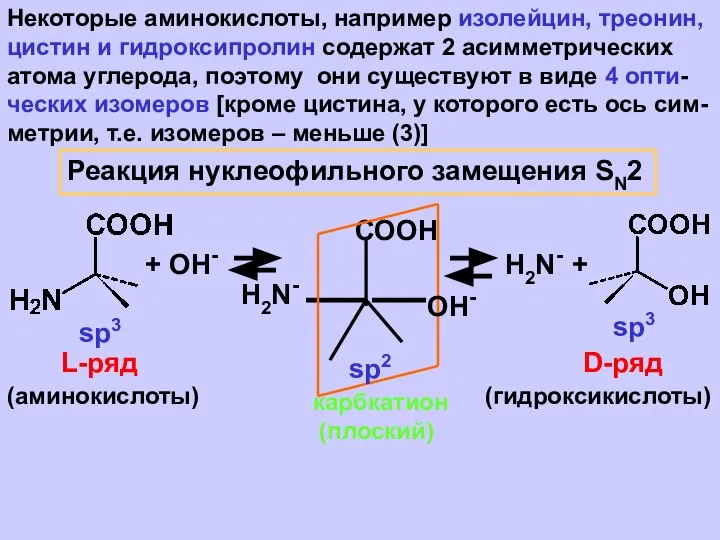
- 7. Некоторые аминокислоты, например изолейцин, треонин, цистин и гидроксипролин содержат 2 асимметрических атома углерода, поэтому они существуют
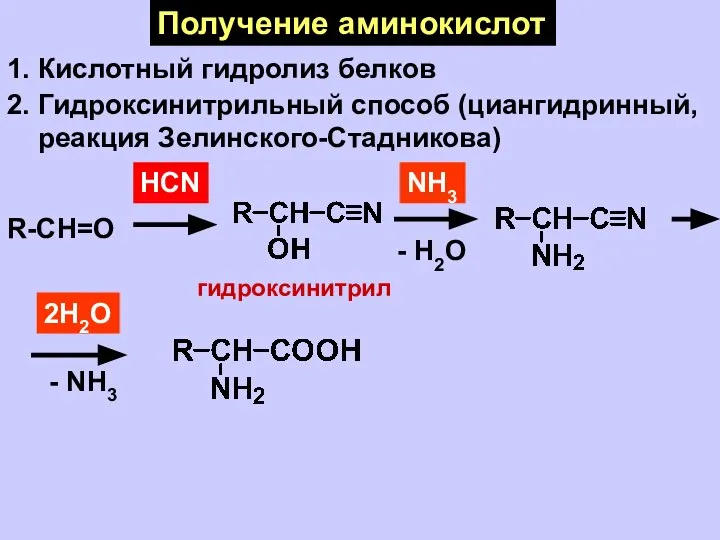
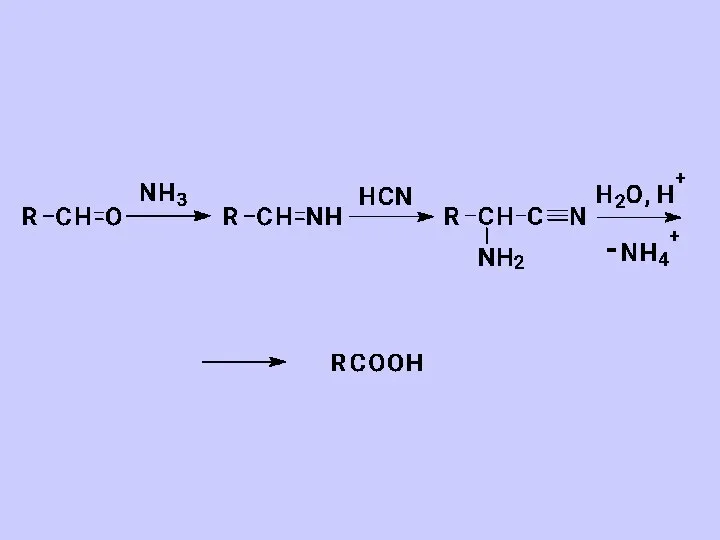
- 9. Получение аминокислот 1. Кислотный гидролиз белков 2. Гидроксинитрильный способ (циангидринный, реакция Зелинского-Стадникова) R-CH=O HCN гидроксинитрил NН3
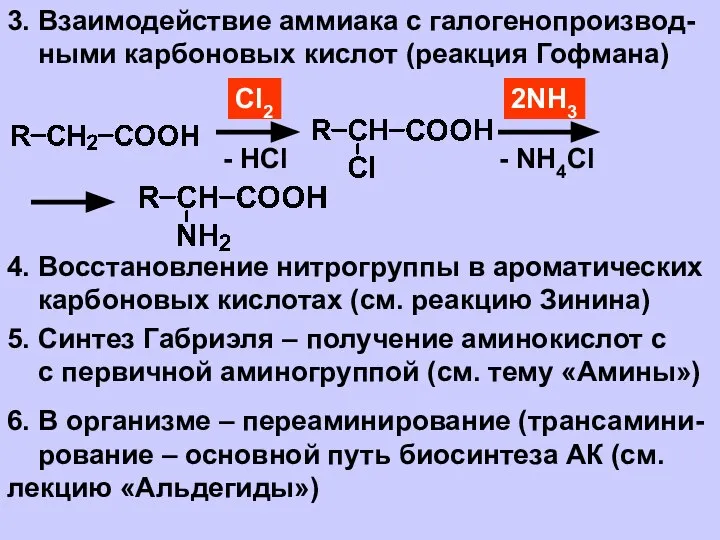
- 11. 3. Взаимодействие аммиака с галогенопроизвод- ными карбоновых кислот (реакция Гофмана) Сl2 - HCl 2NН3 - NH4Cl
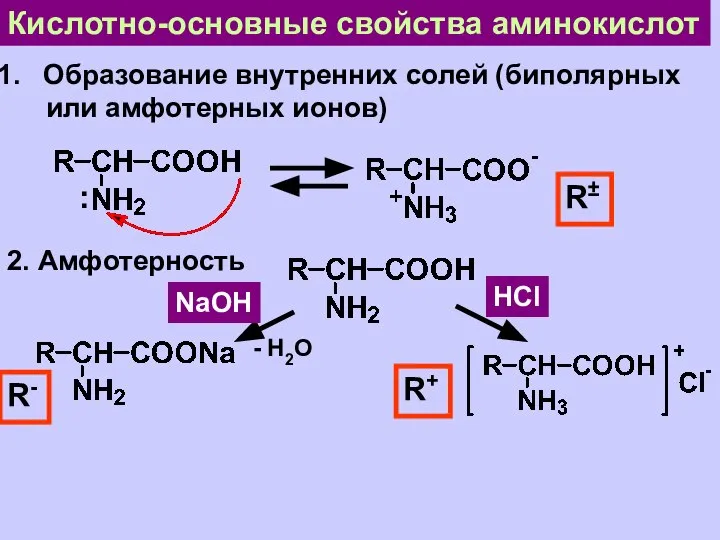
- 12. Кислотно-основные свойства аминокислот Образование внутренних солей (биполярных или амфотерных ионов) : R± 2. Амфотерность HCl NaOH
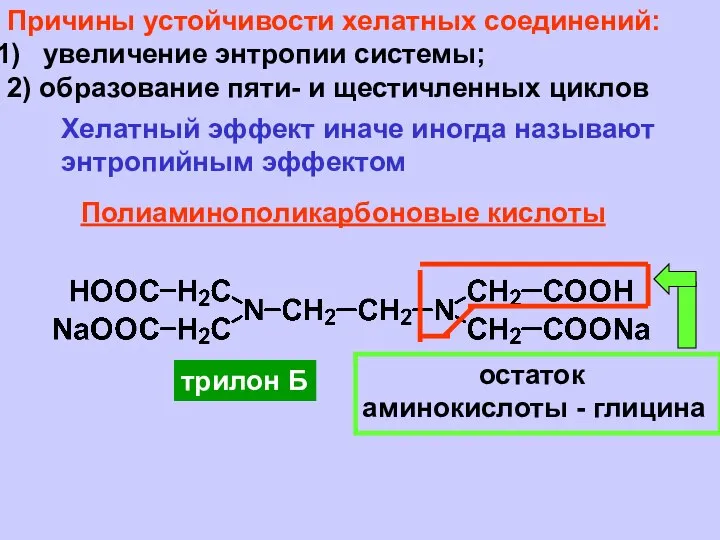
- 13. 3. Аминокислоты - комплексоны Хелатный эффект [Ni(NH3)6]2+ Кнест. ≈ 10-8 Кнест. ≈ 10-18 Хелатный эффект заклю-
- 14. Причины устойчивости хелатных соединений: увеличение энтропии системы; 2) образование пяти- и щестичленных циклов Хелатный эффект иначе
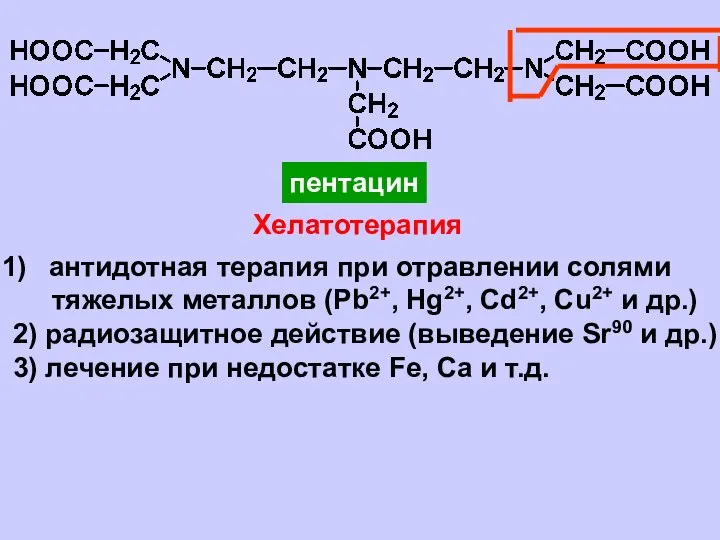
- 15. пентацин Хелатотерапия антидотная терапия при отравлении солями тяжелых металлов (Pb2+, Hg2+, Cd2+, Cu2+ и др.) 2)
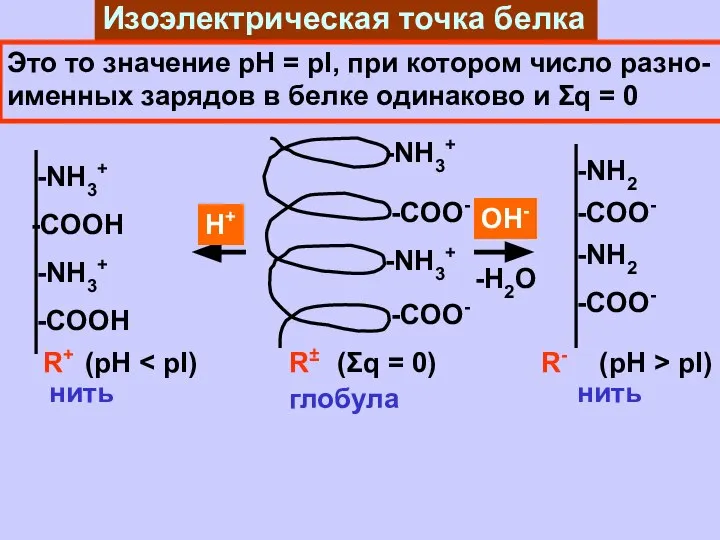
- 16. Изоэлектрическая точка белка Это то значение рН = рI, при котором число разно- именных зарядов в
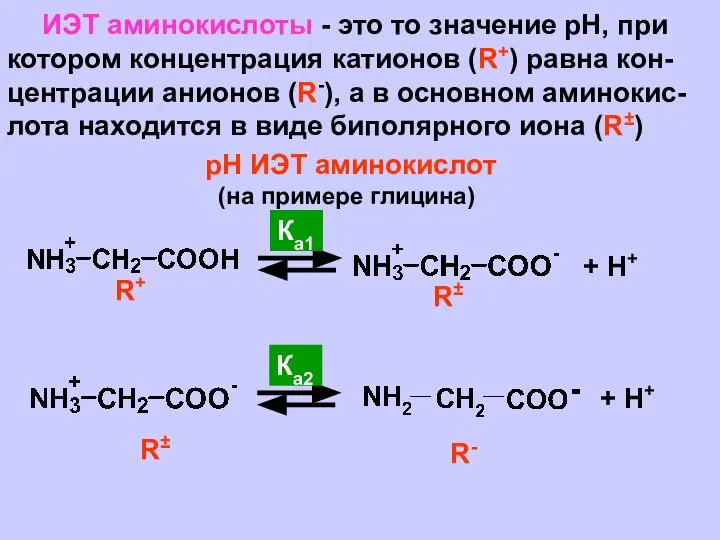
- 17. ИЭТ аминокислоты - это то значение рН, при котором концентрация катионов (R+) равна кон- центрации анионов
- 18. [Н+] = Ка1 . Ка2 ; рН = рI = pКа1 + pКа2 2 Для глицина:
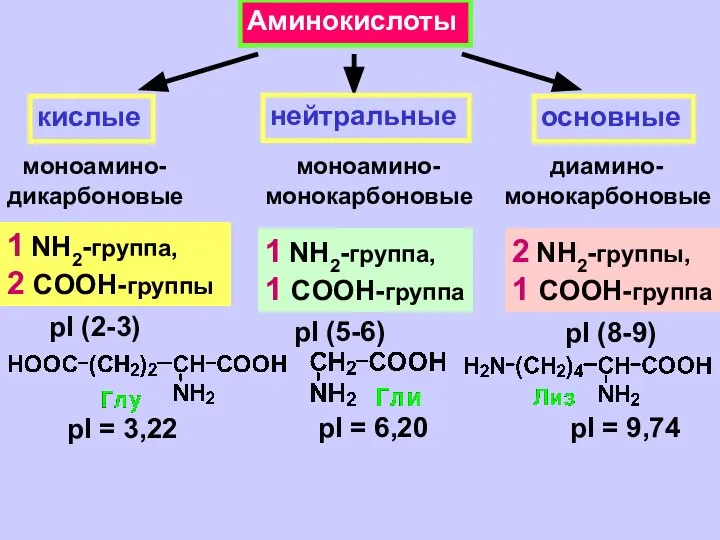
- 19. Аминокислоты кислые нейтральные основные моноамино- дикарбоновые моноамино- монокарбоновые диамино- монокарбоновые 1 NH2-группа, 2 COOН-группы 1 NH2-группа,
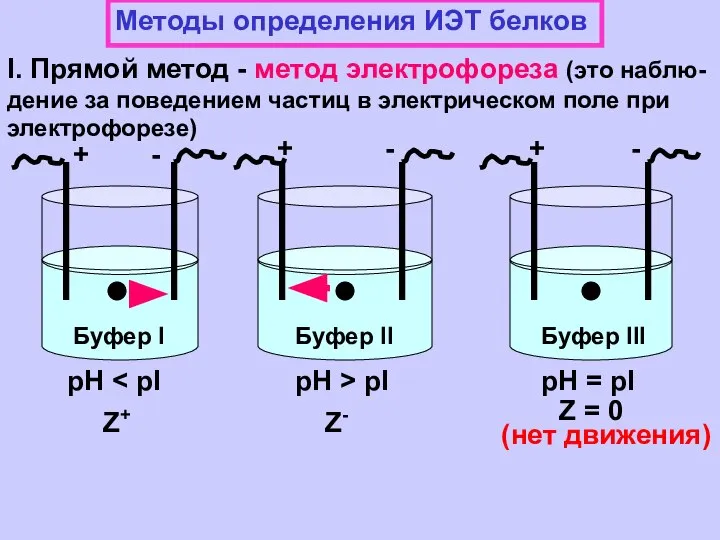
- 20. Методы определения ИЭТ белков I. Прямой метод - метод электрофореза (это наблю- дение за поведением чaстиц
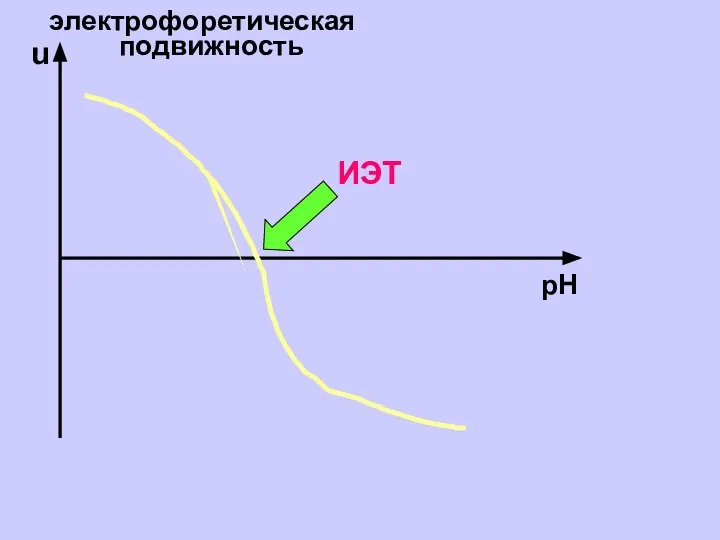
- 21. u электрофоретическая подвижность рН ИЭТ
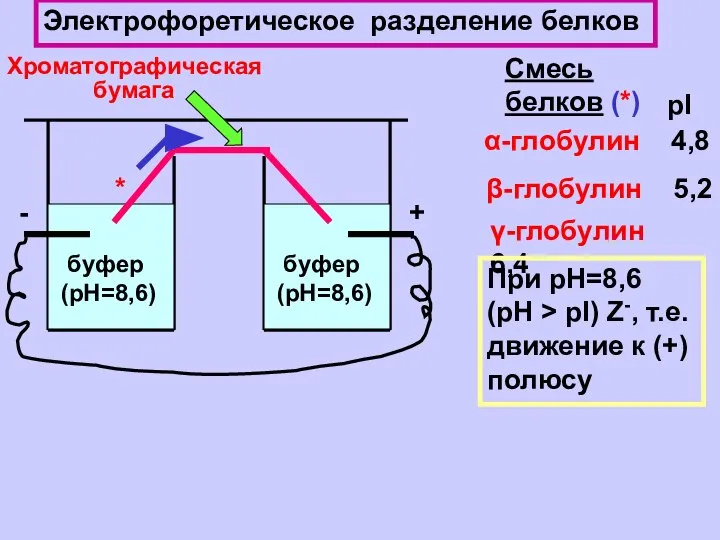
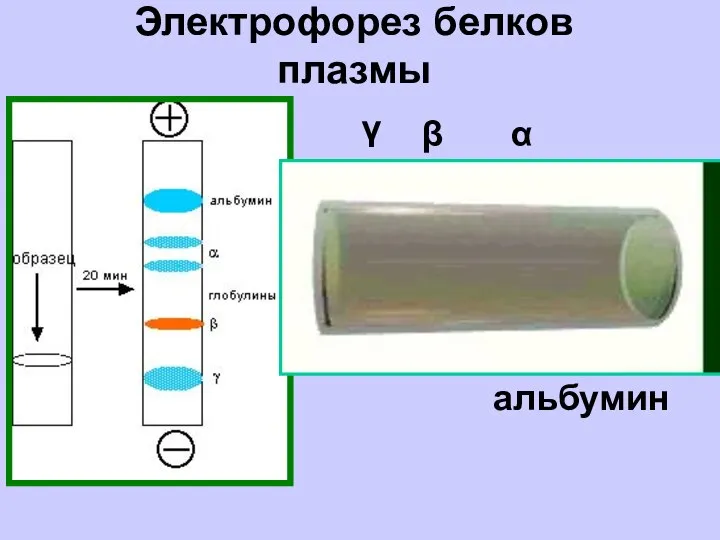
- 22. Электрофоретическое разделение белков буфер (рН=8,6) буфер (рН=8,6) + - Хроматографическая бумага Смесь белков (*) рI α-глобулин
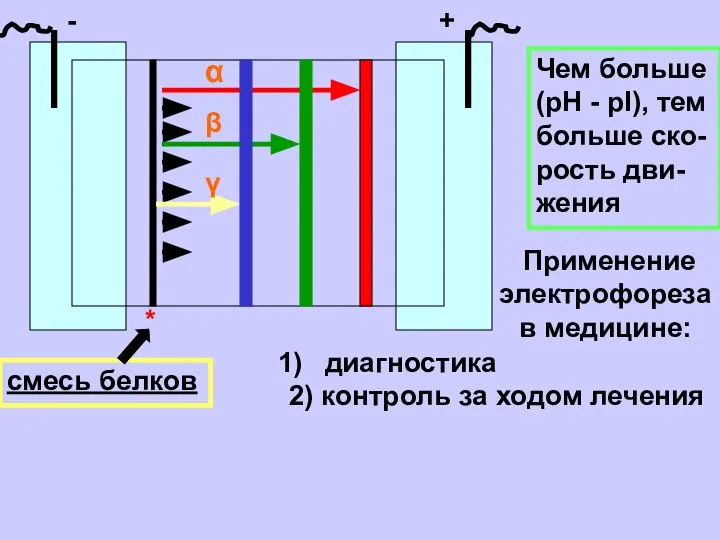
- 23. + - * смесь белков α Чем больше (pH - pI), тем больше ско- рость дви-
- 24. Электрофорез белков плазмы α β γ альбумин
- 25. II. Косвенные методы Ряд свойств белков экстремален (max или min) в изоэлектрической точке 1. Гидратация -
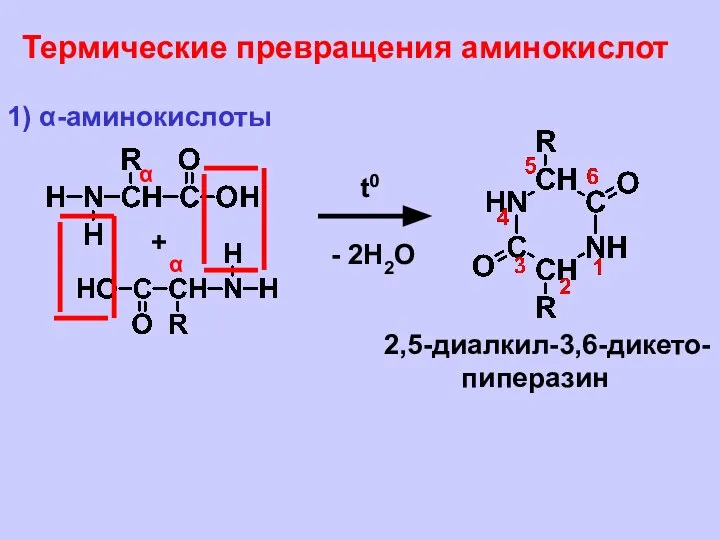
- 26. Термические превращения аминокислот 1) α-аминокислоты α α + t0 - 2H2O 2,5-диалкил-3,6-дикето- пиперазин
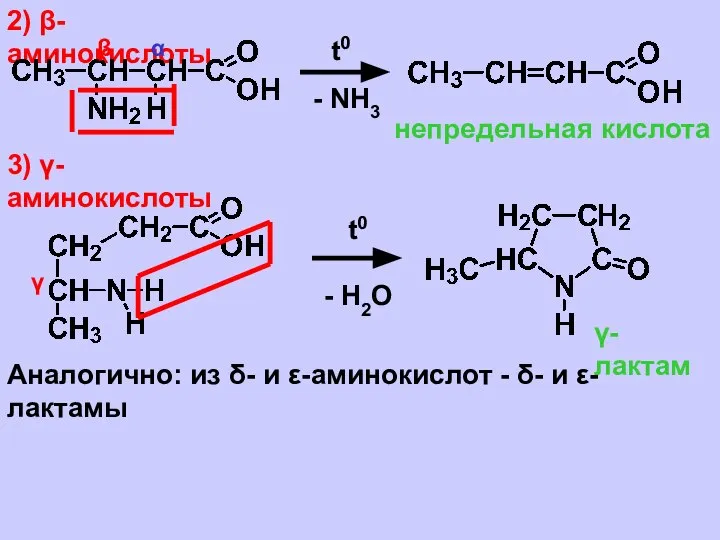
- 27. 2) β-аминокислоты α β t0 - NH3 непредельная кислота 3) γ-аминокислоты γ t0 - H2O γ-лактам
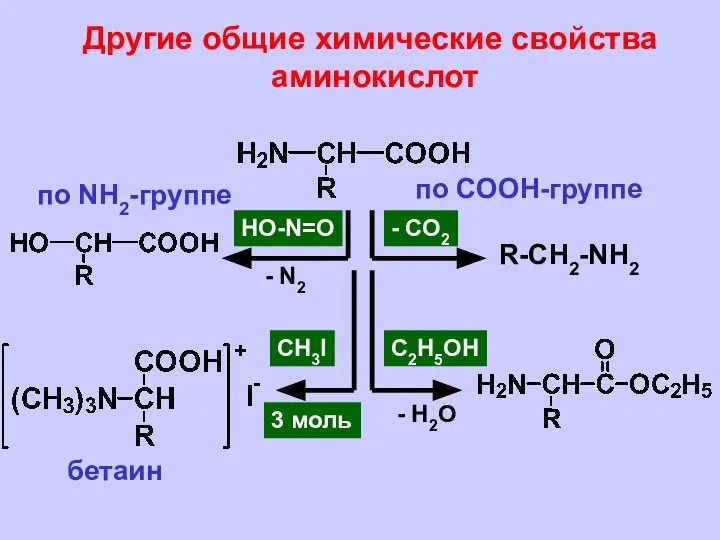
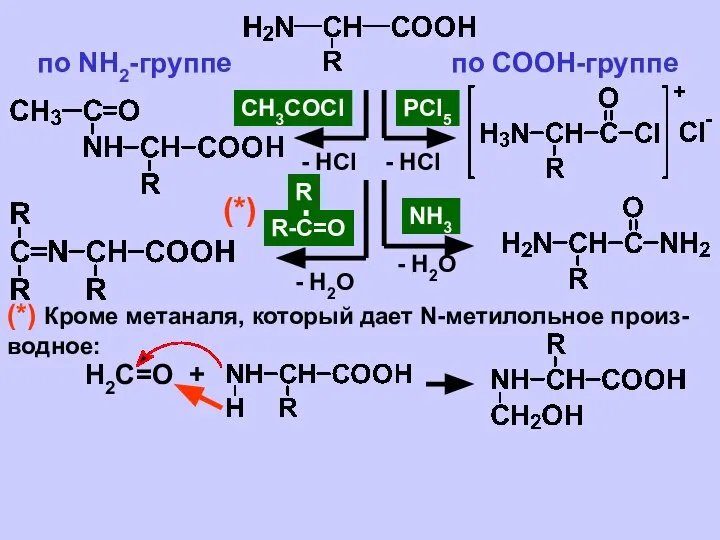
- 28. Другие общие химические свойства аминокислот по NH2-группе по СООН-группе - СО2 R-CH2-NH2 HO-N=O - N2 C2H5OH
- 29. по NH2-группе по СООН-группе PCl5 CH3COCl - HCl - HCl NH3 - H2O R-C=O R -
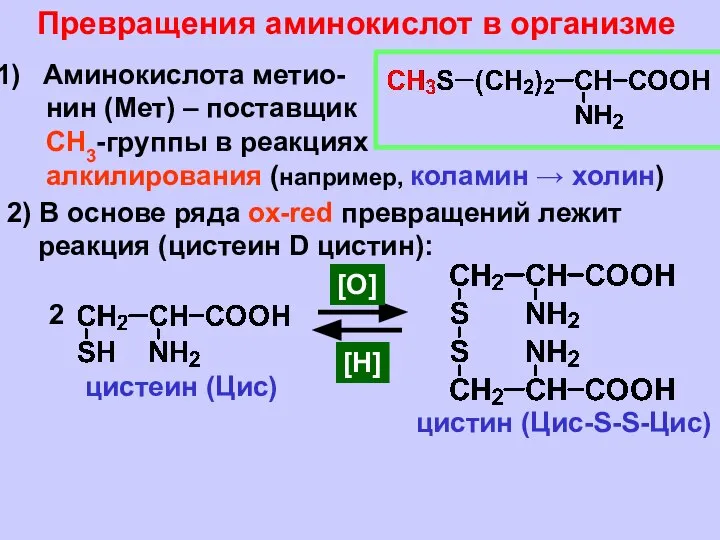
- 30. Превращения аминокислот в организме Аминокислота метио- нин (Мет) – поставщик СН3-группы в реакциях алкилирования (например, коламин
- 31. 3) Дезаминирование (генетическая связь α-аланина, молочной кислоты и ПВК) Н2O [O] [H] NН3 4) Декарбоксилирование H2N-(CH2)5-NH2
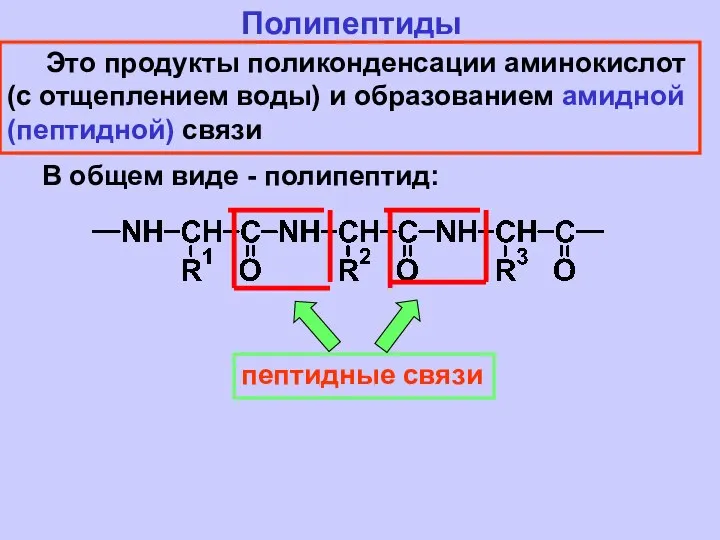
- 32. Полипептиды Это продукты поликонденсации аминокислот (с отщеплением воды) и образованием амидной (пептидной) связи В общем виде
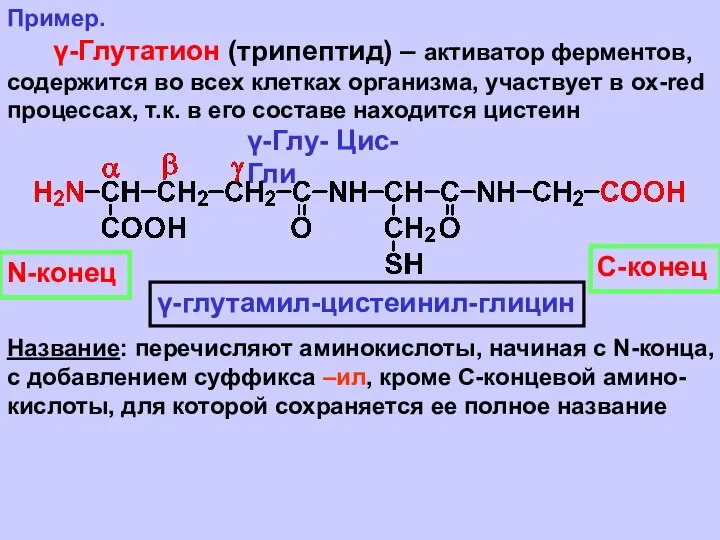
- 33. Пример. γ-Глутатион (трипептид) – активатор ферментов, содержится во всех клетках организма, участвует в ox-red процессах, т.к.
- 34. Специфичность белков определяется: аминокислотным составом – природой и количеством аминокислот 2) аминокислотной последовательностью – первичной структурой
- 35. Пространственное строение полипептидов Вторичная структура белка 1. Пептидная связь а) частичная двоесвязанность (из-за р-π сопряжения электронной
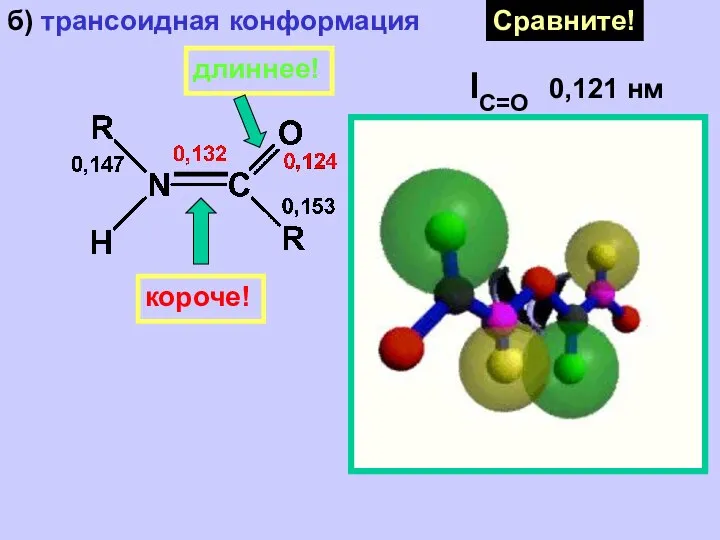
- 36. б) трансоидная конформация Сравните! lС=O 0,121 нм lN-С 0,147 нм длиннее! короче!
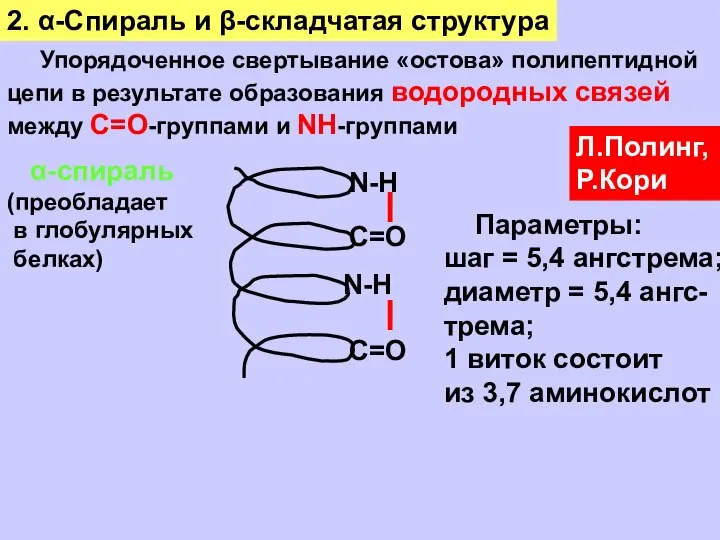
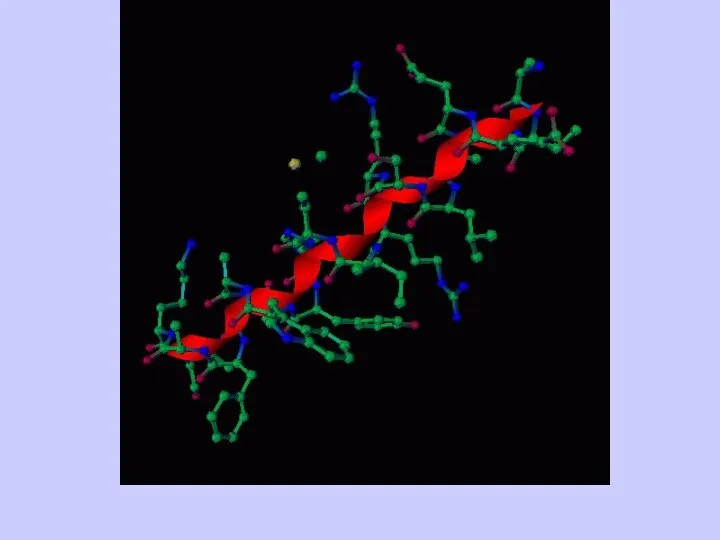
- 37. 2. α-Спираль и β-складчатая структура Упорядоченное свертывание «остова» полипептидной цепи в результате образования водородных связей между
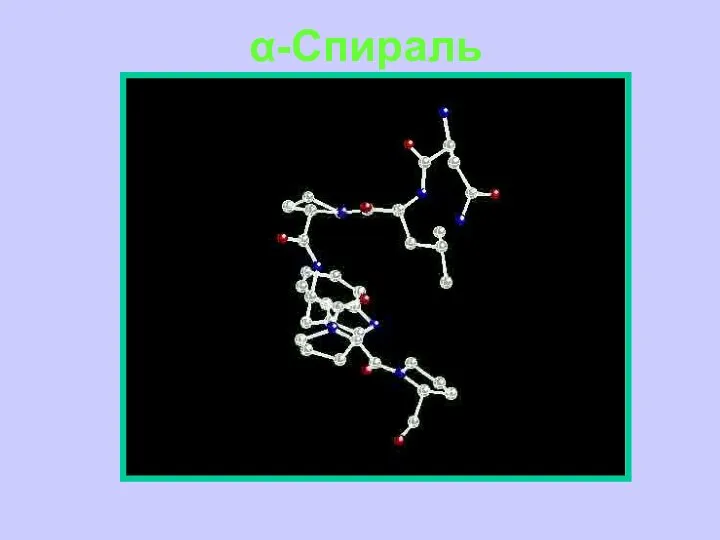
- 39. α-Спираль
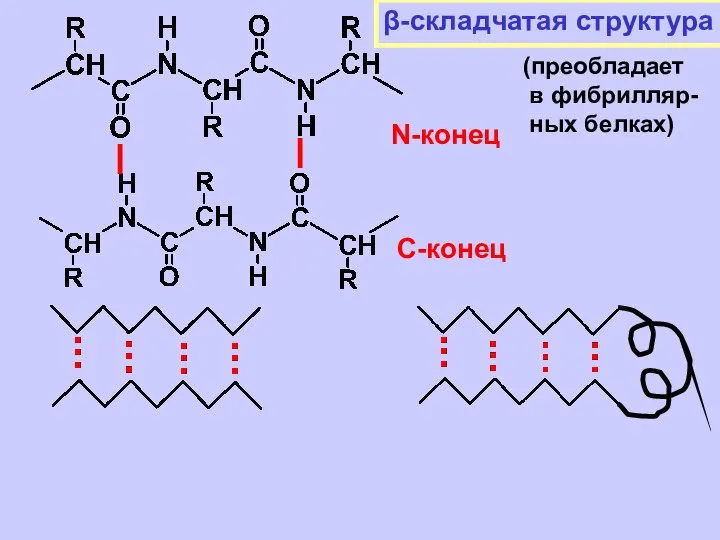
- 40. β-складчатая структура N-конец С-конец (преобладает в фибрилляр- ных белках)
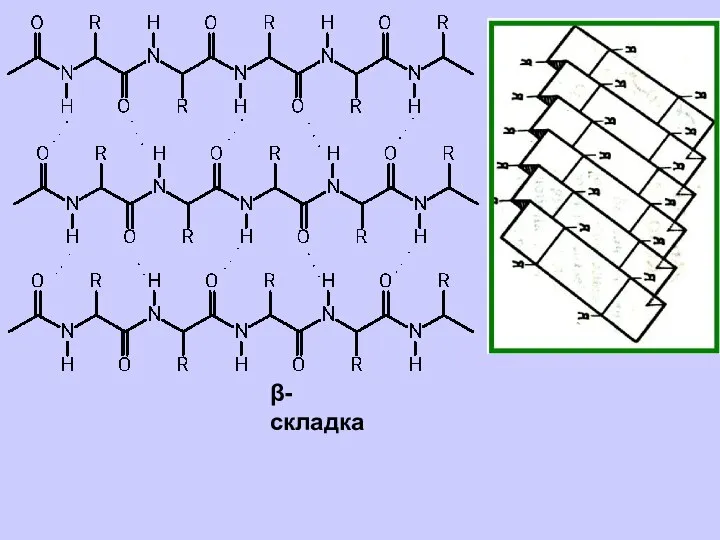
- 41. β-складка
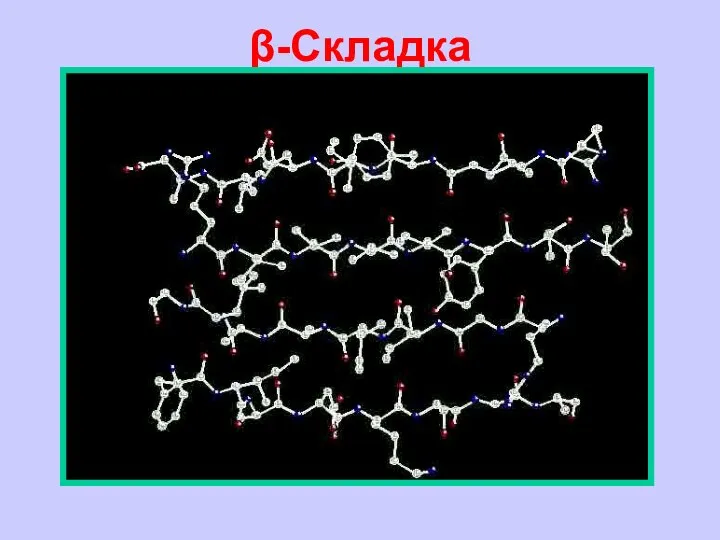
- 42. β-Складка
- 43. Полипептид
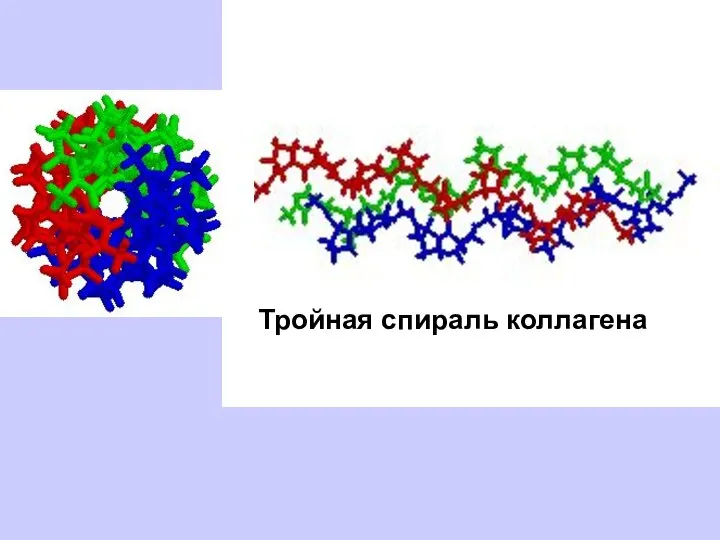
- 44. Тройная спираль коллагена
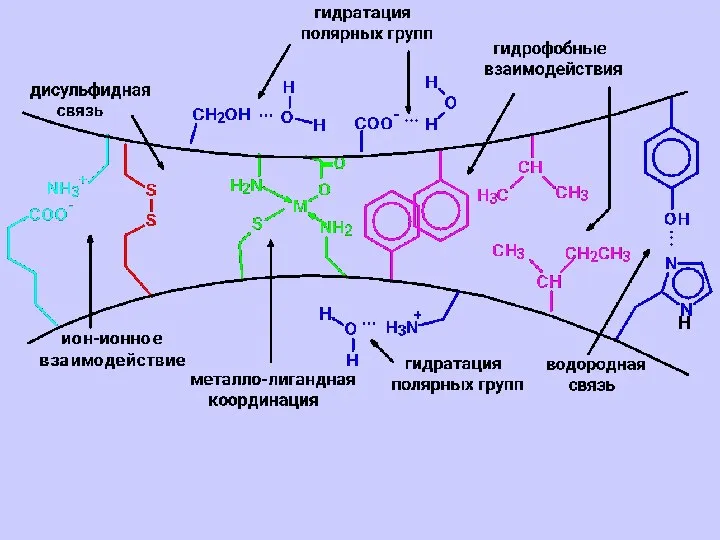
- 45. Третичная структура белка Трехмерное свертывание полипептидной цепи, приводя- щее к наложению одних участ- ков α-спирали или
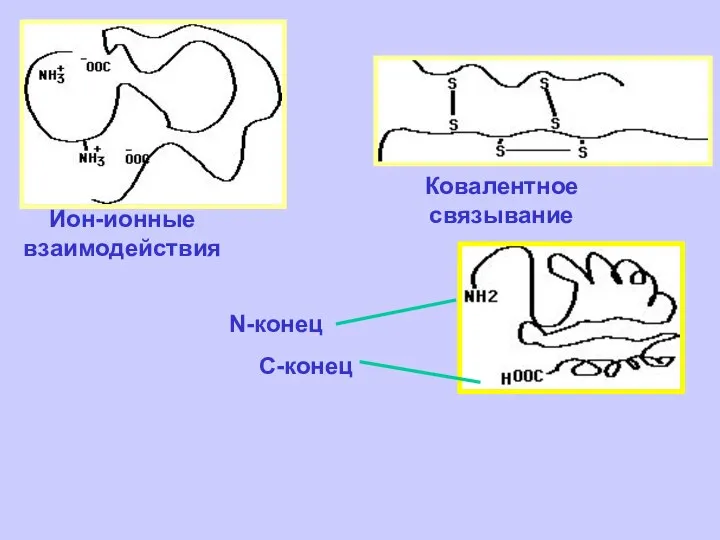
- 47. Ион-ионные взаимодействия Ковалентное связывание N-конец С-конец
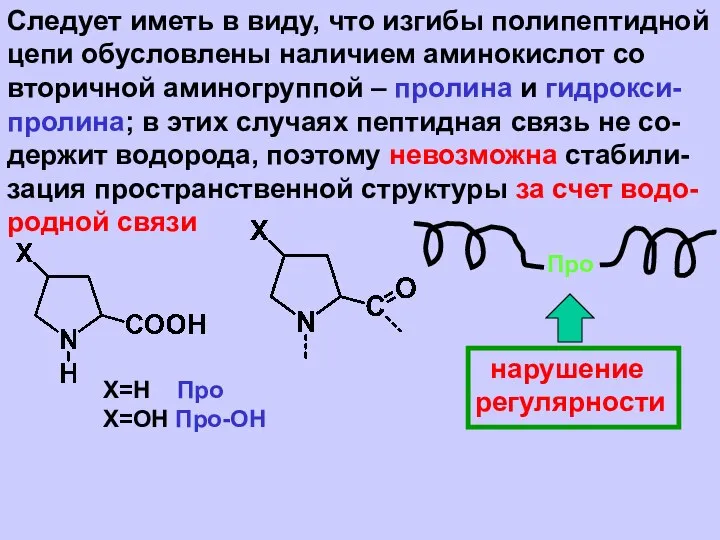
- 48. Следует иметь в виду, что изгибы полипептидной цепи обусловлены наличием аминокислот со вторичной аминогруппой – пролина
- 49. Некоторые белки, например гемоглобин, обладают чет- вертичной структурой; при этом одинаковые или сход- ные субъединицы соединя-
- 50. Полипептид
- 52. Скачать презентацию
![3. Аминокислоты - комплексоны Хелатный эффект [Ni(NH3)6]2+ Кнест. ≈ 10-8 Кнест.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300353/slide-12.jpg)
![[Н+] = Ка1 . Ка2 ; рН = рI = pКа1](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300353/slide-17.jpg)

![3) Дезаминирование (генетическая связь α-аланина, молочной кислоты и ПВК) Н2O [O]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300353/slide-30.jpg)





 Операторы Делегаты и события. Атрибуты. Свойства и индексаторы. Пространство имен. (Лекция 5)
Операторы Делегаты и события. Атрибуты. Свойства и индексаторы. Пространство имен. (Лекция 5) А.C. Пушкин в живописи Презентацию подготовила учитель русского языка, литературы и МХК МБОУСОШ № 119 г.Новосибирска Рябизо
А.C. Пушкин в живописи Презентацию подготовила учитель русского языка, литературы и МХК МБОУСОШ № 119 г.Новосибирска Рябизо Ауызекі сөйлеу стилі
Ауызекі сөйлеу стилі Христианство и палеохристиане
Христианство и палеохристиане Введение в объектно-ориентированное программирование
Введение в объектно-ориентированное программирование Технология изготовления и организация производства двутавровой балки
Технология изготовления и организация производства двутавровой балки Қазақ халқының қолөнері
Қазақ халқының қолөнері Презентация "Мастера земли Калевальской" - скачать презентации по МХК
Презентация "Мастера земли Калевальской" - скачать презентации по МХК грибы - презентация для начальной школы
грибы - презентация для начальной школы Бизнес-курс. Начало. Этапы прохождения курса
Бизнес-курс. Начало. Этапы прохождения курса Законы и принципы психологии
Законы и принципы психологии урок 4
урок 4 Księdzem Bosco
Księdzem Bosco Презентация на тему "Учебно-методические комплекты" - скачать презентации по Педагогике
Презентация на тему "Учебно-методические комплекты" - скачать презентации по Педагогике Выпускная квалификационная работа: Сравнительный анализ систем связи 4G и 5G
Выпускная квалификационная работа: Сравнительный анализ систем связи 4G и 5G Презентация на тему "Эпилепсия. Органические, включая симптоматические расстройства" - скачать презентации по Медицине
Презентация на тему "Эпилепсия. Органические, включая симптоматические расстройства" - скачать презентации по Медицине Презентация: Практические аспекты применения критериев достаточной переработки товара при определении его страны происхождения
Презентация: Практические аспекты применения критериев достаточной переработки товара при определении его страны происхождения  Презентация на тему "Родительское собрание будущих первоклассников" - скачать презентации по Педагогике
Презентация на тему "Родительское собрание будущих первоклассников" - скачать презентации по Педагогике Подготовка мясных грузов к доставке
Подготовка мясных грузов к доставке Игра по темам: «Основные направления и перспективы развития ТД», «Научно-технический прогресс в ТД» Выполнила: студентка 3-го
Игра по темам: «Основные направления и перспективы развития ТД», «Научно-технический прогресс в ТД» Выполнила: студентка 3-го  Сетевые протоколы
Сетевые протоколы Аэродинамика. Самолёты и планеры
Аэродинамика. Самолёты и планеры Подход компании «Сименс» к реализации цифровых сетей
Подход компании «Сименс» к реализации цифровых сетей Розробка програмної системи «Автобазар»
Розробка програмної системи «Автобазар» Правописание гласных в корне орфография
Правописание гласных в корне орфография Презентация "«Модель денег»" - скачать презентации по Экономике
Презентация "«Модель денег»" - скачать презентации по Экономике Международный кредит
Международный кредит Проект на тему: «Технологии, повышающие качество жизни школьников».
Проект на тему: «Технологии, повышающие качество жизни школьников».