Содержание
- 2. При 25 °С Кд =1.8·10 -16 Концентрацию молекул воды как в чистой воде, так и в
- 3. В соответствии с принципом Ле Шателье при добавлении кислот или оснований равновесие H2O ↔ H+ +
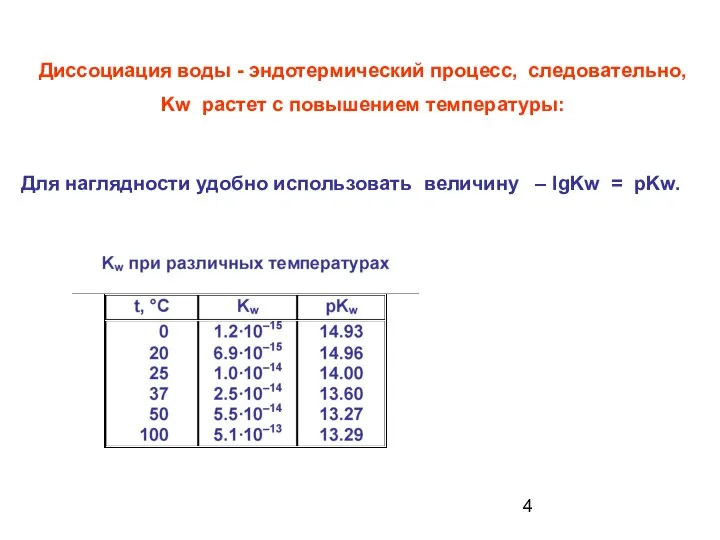
- 4. Диссоциация воды - эндотермический процесс, следовательно, Kw растет с повышением температуры: Для наглядности удобно использовать величину
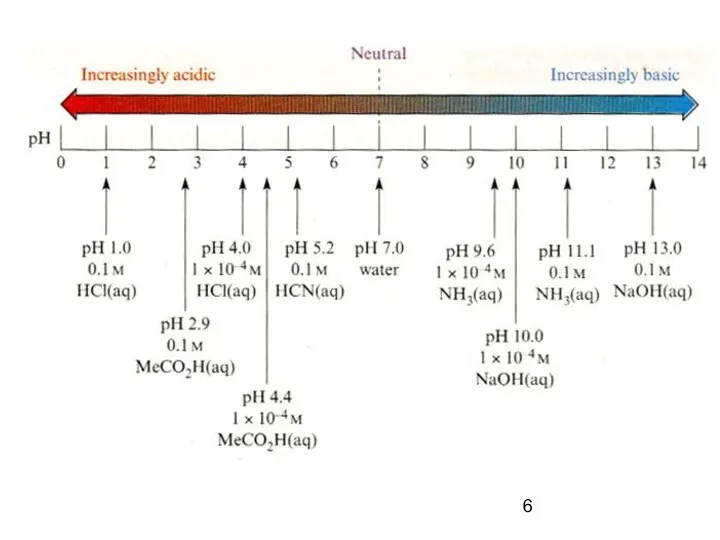
- 5. Для удобства в расчетах пользуются величинами водородного и гидроксильного показателей - рH и рОН, pH -
- 8. Для чистой воды рН=7 Дождевая вода за счет растворенного СО2 имеет рН ~ 5.5 – 6.0
- 9. Мрамор СаСО3 под действием слабокислой дождевой среды переходит в растворимый гидрокарбонат Са(НСО3)2
- 10. Александр Федорович Тур (1894–1974) 1930-1934 -заведующий кафедрой физиологии, гигиены и диететики ребенка 1934-1939 - заведующий кафедрой
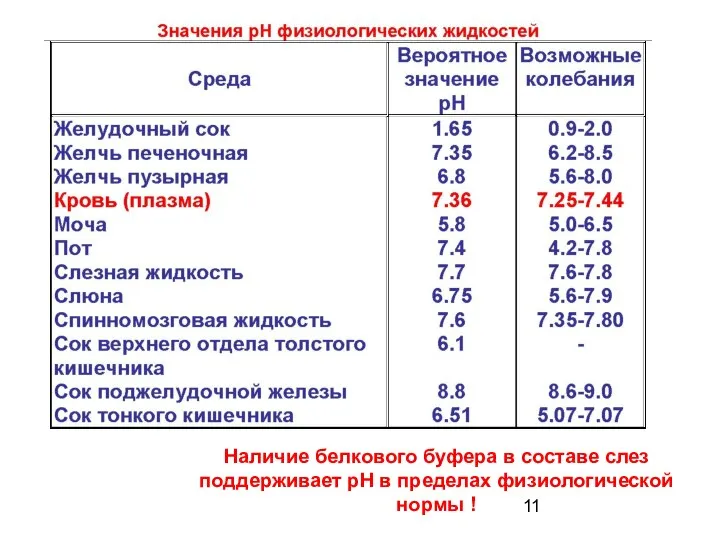
- 11. Наличие белкового буфера в составе слез поддерживает рН в пределах физиологической нормы !
- 12. Расчет рН в сильных электролитах Сильные: Рассчитать рН, рОН, [OH-] для 0,001 м НNO3 рН =
- 14. Расчет [ Н+] и рН для растворов слабых электролитов Кислоты Смесь кислот
- 15. Для смеси оснований Основания
- 16. Общая, активная и потенциальная кислотность Активная кислотность – концентрация свободных катионов Н+, имеющихся в растворе при
- 17. Основные функции воды в организме Обеспечение процессов всасывания и механического передвижения питательных веществ Поддержание оптимального осмотического
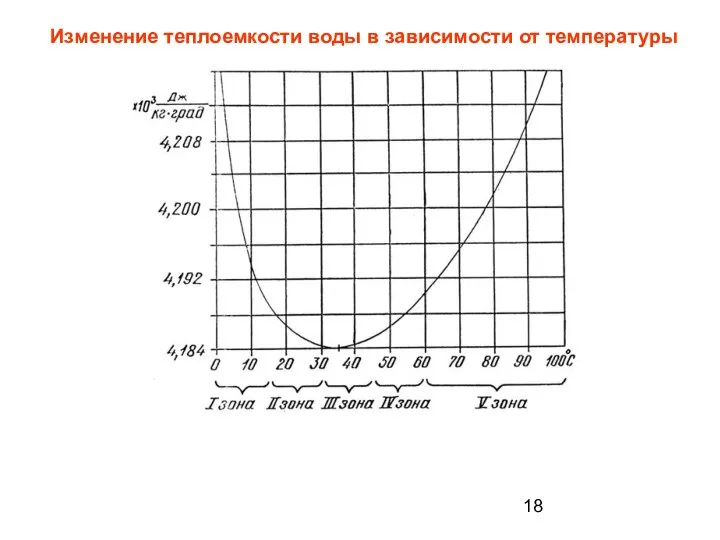
- 18. Изменение теплоемкости воды в зависимости от температуры
- 19. Значение растворов в жизнедеятельности организмов. Важнейшие биологические жидкости - кровь, лимфа моча, слюна, пот являются растворами
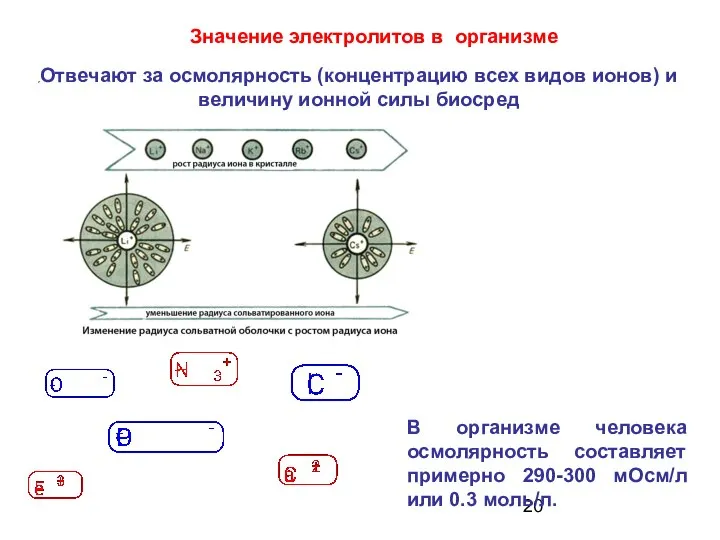
- 20. Отвечают за осмолярность (концентрацию всех видов ионов) и величину ионной силы биосред Значение электролитов в организме
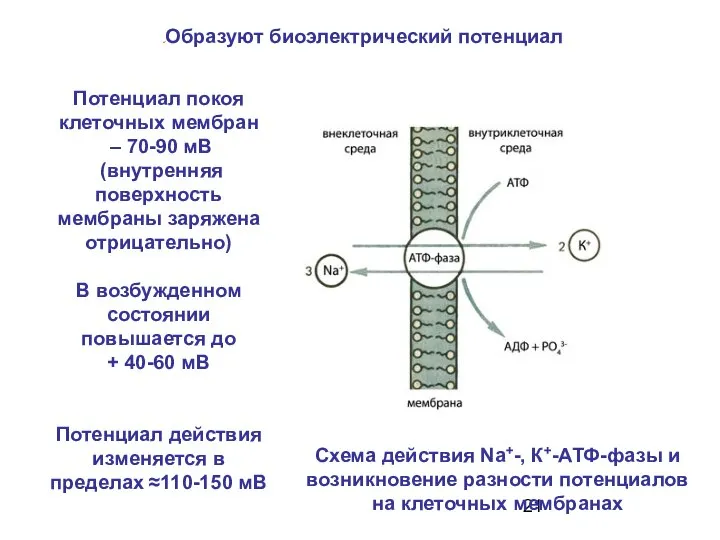
- 21. Схема действия Na+-, К+-АТФ-фазы и возникновение разности потенциалов на клеточных мембранах Потенциал покоя клеточных мембран –
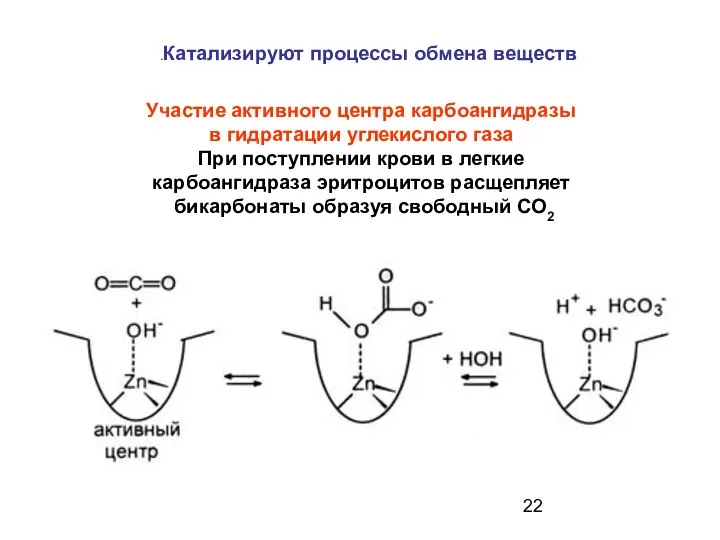
- 22. Участие активного центра карбоангидразы в гидратации углекислого газа При поступлении крови в легкие карбоангидраза эритроцитов расщепляет
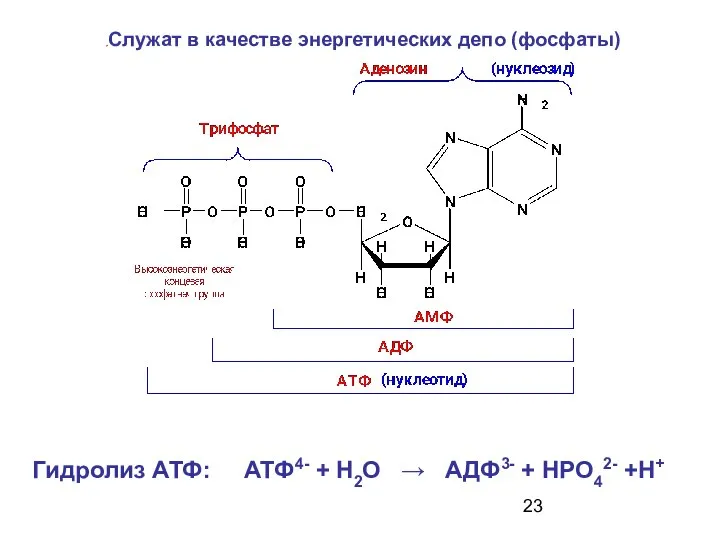
- 23. Гидролиз АТФ: АТФ4- + Н2О → АДФ3- + НРО42- +Н+ Служат в качестве энергетических депо (фосфаты)
- 24. Участвуют в свертывающей системы крови
- 25. Образование защитного эмалевого слоя Лечение кариеса фторидами Стабилизируют костные ткани
- 26. Выпускники 2018 года
- 28. Скачать презентацию







![Расчет рН в сильных электролитах Сильные: Рассчитать рН, рОН, [OH-] для](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1301157/slide-11.jpg)

![Расчет [ Н+] и рН для растворов слабых электролитов Кислоты Смесь кислот](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1301157/slide-13.jpg)







 Механическое оборудование и система вентиляции
Механическое оборудование и система вентиляции Тема: Сравнение слов-названий, слов-действий и слов-признаков со словами, которые выражают различные чувства. урок русского языка
Тема: Сравнение слов-названий, слов-действий и слов-признаков со словами, которые выражают различные чувства. урок русского языка Столовая посуда, приборы и столовое белье
Столовая посуда, приборы и столовое белье 2 класс 2 четверть Авторы: Хомутовская Л.Н., МОУ Саваслейская ср. шк. Каргина В.В., МОУ Новосельская ср. шк. 2005
2 класс 2 четверть Авторы: Хомутовская Л.Н., МОУ Саваслейская ср. шк. Каргина В.В., МОУ Новосельская ср. шк. 2005 Гимнастика после дневного сна
Гимнастика после дневного сна Использование компьютерных систем в оптимизации производства бензинов
Использование компьютерных систем в оптимизации производства бензинов Сказочное путешествие в страну Дроби - презентация для начальной школы
Сказочное путешествие в страну Дроби - презентация для начальной школы Презентация____
Презентация____ Теория пар сил
Теория пар сил Тема 15. Управление человеческими ресурсами
Тема 15. Управление человеческими ресурсами  Ручное изготовление диадемы с использованием традиционных материалов
Ручное изготовление диадемы с использованием традиционных материалов Обобщение опыта работы. Презентация опыта работы по теме самообразования « Самостоятельная работа как средство развития поз
Обобщение опыта работы. Презентация опыта работы по теме самообразования « Самостоятельная работа как средство развития поз Проектно - исследовательская работа на тему: «И С Т О Р И Я И Г Р У Ш К И. С В И С ТУ Л Ь К А .» Автор работы: Тюрина Юлия Ученица 1 «А» кл
Проектно - исследовательская работа на тему: «И С Т О Р И Я И Г Р У Ш К И. С В И С ТУ Л Ь К А .» Автор работы: Тюрина Юлия Ученица 1 «А» кл Религия. Искусство. Мораль
Религия. Искусство. Мораль Кратные интегралы
Кратные интегралы Лекція 18. Основи структурного програмування
Лекція 18. Основи структурного програмування Массовая культура (pop culture)
Массовая культура (pop culture) Практическая работа: изображение подводного мира. 6 класс
Практическая работа: изображение подводного мира. 6 класс 5 ლექცია
5 ლექცია Пьер Ферма - француз математик, физик. Мамандығы бойынша заңгер
Пьер Ферма - француз математик, физик. Мамандығы бойынша заңгер ПРОДУКТИВНОЕ И СПЕЦИФИЧЕСКОЕ ВОСПАЛЕНИЕ
ПРОДУКТИВНОЕ И СПЕЦИФИЧЕСКОЕ ВОСПАЛЕНИЕ Здоровый образ жизни
Здоровый образ жизни Красноярский медицинский университет им.проф.В.Ф.Войно-Ясенецкого.
Красноярский медицинский университет им.проф.В.Ф.Войно-Ясенецкого.  Негативні явища економічних криз
Негативні явища економічних криз Абзац.ppt
Абзац.ppt ЭЛЕКТРОННАЯ ВИКТОРИНА для детей 6-7 лет «Мы – наследники Великой Победы»
ЭЛЕКТРОННАЯ ВИКТОРИНА для детей 6-7 лет «Мы – наследники Великой Победы»  Металлические материалы
Металлические материалы Распределительный метод
Распределительный метод