Содержание
- 2. Н++-:ОН→НОН Н3О+ +-:ОН →2НОН НОН↔ Н++-:ОН Кд
- 3. КW=10-14-const(ионное произведение воды) Метод нейтрализации Рабочие растворы HCl, NaOH 0,1Э. Индикаторы слабые органические кислоты или основания:
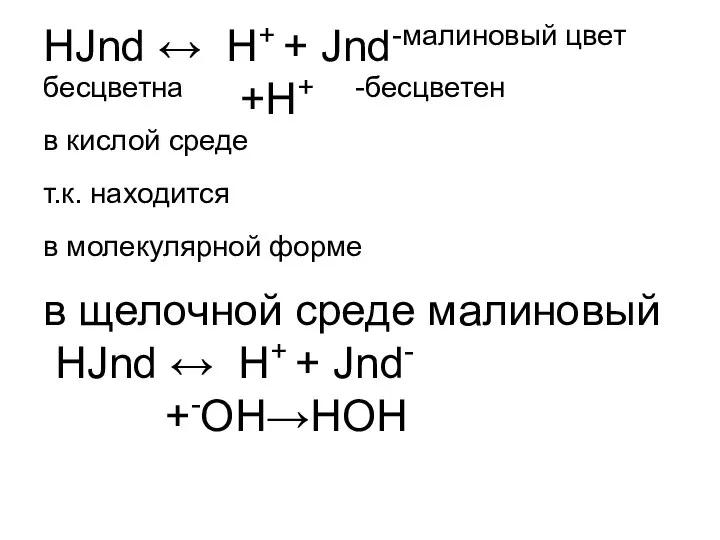
- 4. НJnd ↔ H+ + Jnd-малиновый цвет бесцветна +H+ -бесцветен в кислой среде т.к. находится в молекулярной
- 5. Т.к. находится в анионной форме. рТинд-ра =-lgKdинд-ра рТф-на = -lg10-9=9 рТметилоранжа= -lg5*10-4=4-0,7=3,3 Например:титруем уксусную кислоту NaOH.
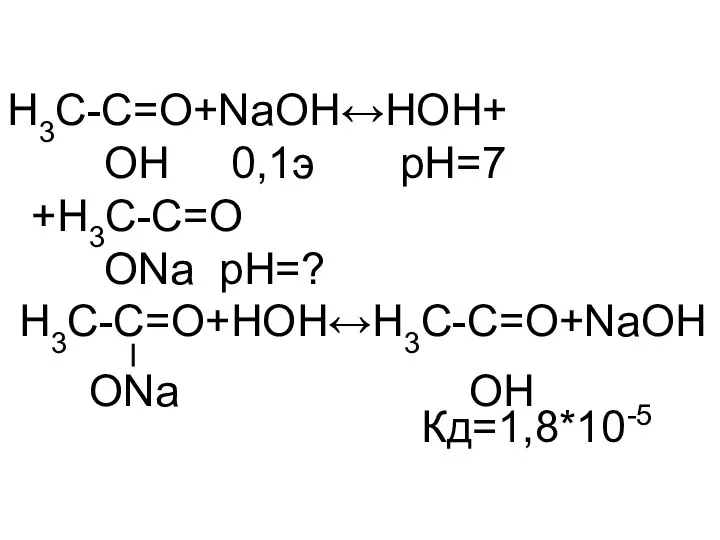
- 6. H3C-C=O+NaOH↔НОН+ OH 0,1э pH=7 +H3C-C=O ОNa pH=? H3C-C=O+HOH↔H3C-C=O+NaOH Кд=1,8*10-5 ОNa OH
- 7. Согласно рН в точке эквивалентности 8,72 выбираем индикатор фенолфталеин. Титруем NH4OH соляной кислотой:
- 9. Скачать презентацию
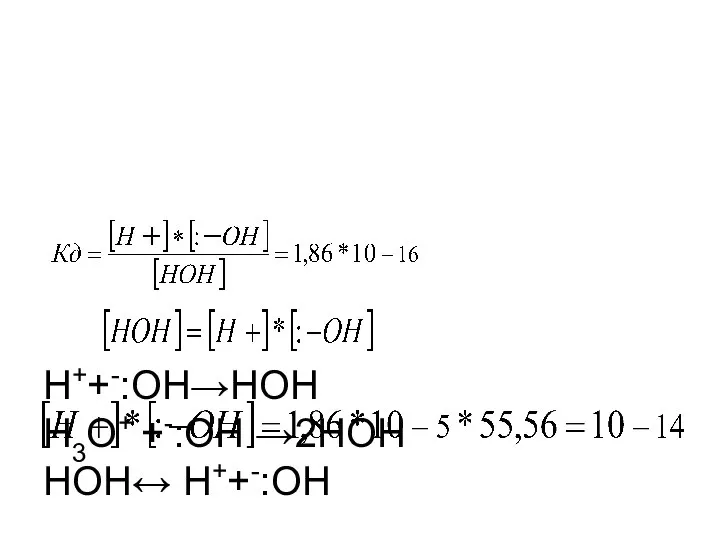



 Меры обеспечения собственной безопасности сотрудников таможенных органов Выполнила: студентка 4-го курса группы Ю-101 Меженько Ю
Меры обеспечения собственной безопасности сотрудников таможенных органов Выполнила: студентка 4-го курса группы Ю-101 Меженько Ю Муниципальное общеобразовательное учреждение Кюсюрская средняя общеобразовательная школа Булунского района Республики Саха(Як
Муниципальное общеобразовательное учреждение Кюсюрская средняя общеобразовательная школа Булунского района Республики Саха(Як Красная площадь в Москве
Красная площадь в Москве Java-технологии
Java-технологии Презентация Общие положения о купле продаже
Презентация Общие положения о купле продаже Презентация История возникновения маржинализма
Презентация История возникновения маржинализма Конституционное (государственное) право как отрасль права в зарубежных странах
Конституционное (государственное) право как отрасль права в зарубежных странах Соблюдай ПДД и будь осторожен - презентация для начальной школы
Соблюдай ПДД и будь осторожен - презентация для начальной школы Методика расследования хулиганства
Методика расследования хулиганства Алгоритмы и структуры данных. Лекция 7. Сбалансированные деревья. АВЛ-деревья
Алгоритмы и структуры данных. Лекция 7. Сбалансированные деревья. АВЛ-деревья Сообщение по методу Цезаря
Сообщение по методу Цезаря Условная выборка строк
Условная выборка строк  Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Презентация Классификация и кодирование товаров
Презентация Классификация и кодирование товаров Бизнес, который вдохновляет. Vegfaste - здоровое питание
Бизнес, который вдохновляет. Vegfaste - здоровое питание Авраам Лінкольн
Авраам Лінкольн Дипломный проект. Расширение телекоммуникационной сети ПАО «Ростелеком» на основе технологии GPON
Дипломный проект. Расширение телекоммуникационной сети ПАО «Ростелеком» на основе технологии GPON осложнения СД
осложнения СД  Христианство. Православие
Христианство. Православие Издержки производства и прибыль предприятия
Издержки производства и прибыль предприятия Сказка о бывалом солдате, царе и двенадцати разбойниках - презентация для начальной школы
Сказка о бывалом солдате, царе и двенадцати разбойниках - презентация для начальной школы Управление взаимоотношениями с клиентами DATA Mining
Управление взаимоотношениями с клиентами DATA Mining Нейронные компьютеры
Нейронные компьютеры Международное движение капитала Понятие, сущность и формы движения капитала Цели, причины и факторы движения капитала Современн
Международное движение капитала Понятие, сущность и формы движения капитала Цели, причины и факторы движения капитала Современн Компьютерный сленг
Компьютерный сленг Государство 2
Государство 2 Летний тренировочный лагерь 2018
Летний тренировочный лагерь 2018 МЕЖДУНАРОДНОЕ ДВИЖЕНИЕ КАПИТАЛА к.э.н., доцент Капусткин Вадим Игоревич
МЕЖДУНАРОДНОЕ ДВИЖЕНИЕ КАПИТАЛА к.э.н., доцент Капусткин Вадим Игоревич