Содержание
- 2. План Общая характеристика фенолов и ароматических кислот. Фенолы. Методы получение, свойства, анализ, применение. Условия сохранения. Ароматические
- 3. Фенолы – это производные ароматических углеводородов, содержащие в молекуле одну или несколько гидроксогрупп –ОН, которые непосредственно
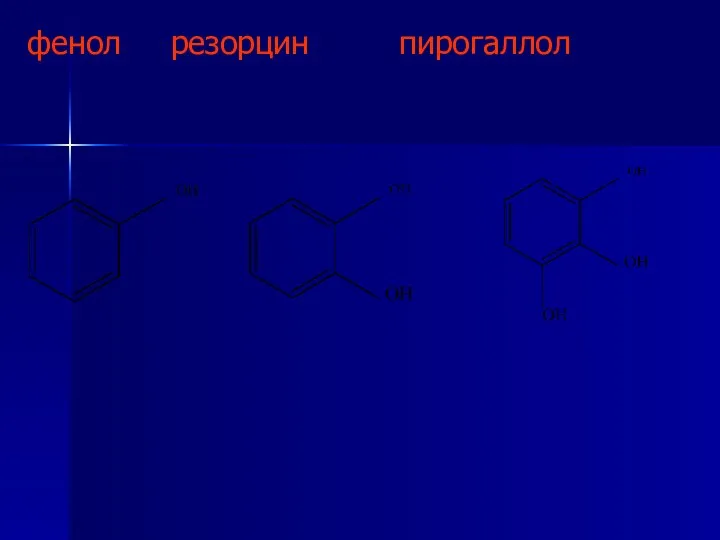
- 4. фенол резорцин пирогаллол
- 5. В зависимости от взаимного расположения фенольных гидроксилов в молекулах двух- и трехатомных фенолов, могут существовать различные
- 6. Свойства. Большинство фенолов представляет собой кристаллические вещества с сильным характерным запахом. Одноатомные фенолы плохо растворимы в
- 7. 1. Кислотные свойства фенолов выражены более сильно, чем у спиртов вследствие взаимодействия электронной пары атома Оксигена
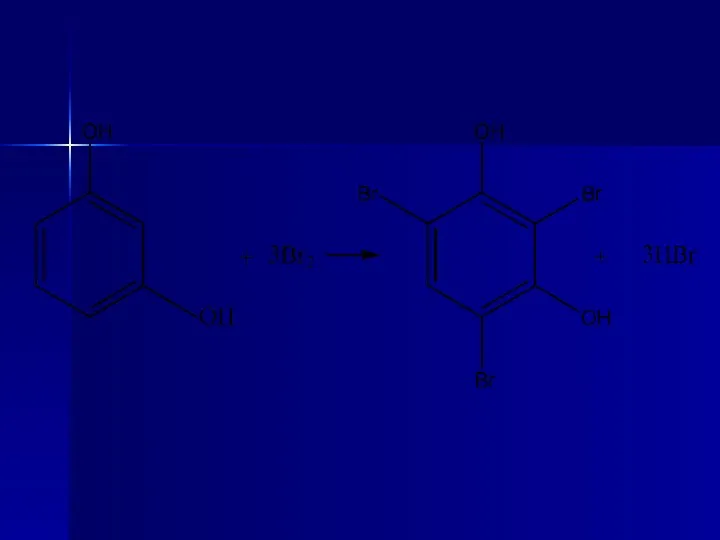
- 8. 2. Реакции замещения, обусловленные наличием ароматического ядра, в орто- и пара-положении к фенольному гидроксилу: галогенирование (бромпроизводные
- 9. 4. Сочетание с солями диазония в щелочной среде с образованием азокрасителей. В качестве реактива обычно берут
- 10. Количественное определение фенолов Чаще всего количественное определение фенолов проводят методом броматометрии. С этой целью можно использовать
- 11. 2. Броматометрия, обратное титрование, с йодометрическим окончанием. К исследуемому раствору прибавляют калий бромид KBr, раствор хлоридной
- 12. Фармакологическое действие. Фенолы проявляют антисептическое действие, которое основано на их способности свертывать белки. Фенолы обладают бактерицидным
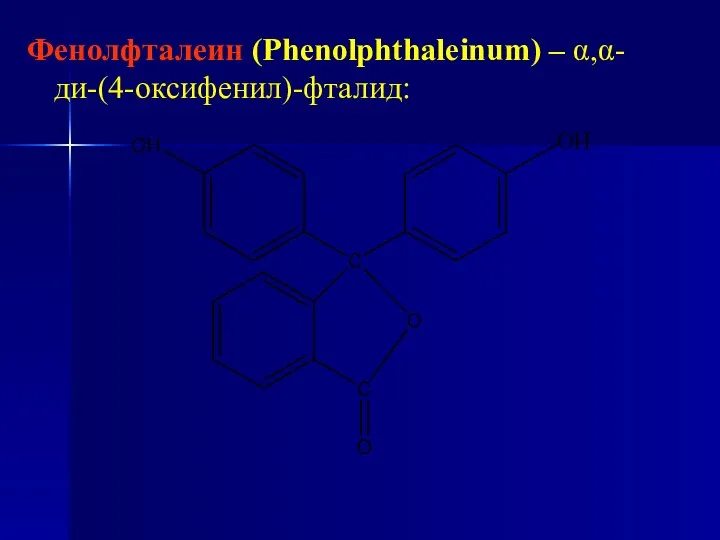
- 13. Фенолфталеин (Phenolphthaleinum) – α,α-ди-(4-оксифенил)-фталид:
- 14. Это белый или слабо желтоватый мелкокристаллический порошок без запаха и вкуса, очень мало растворим в воде,
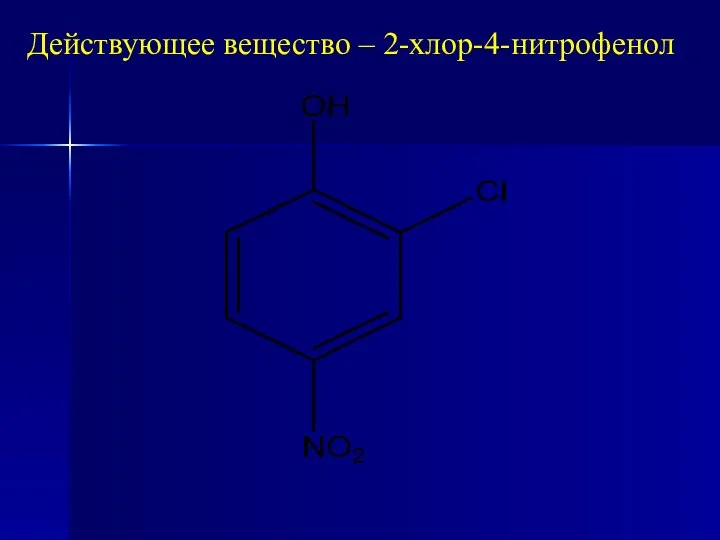
- 15. Нитрофунгин (Nitrofungin) – это раствор, содержащий 2-хлор-4-нитрофенола 1 г, триэтиленгликоля 10 г, спирта 50 % до
- 16. Действующее вещество – 2-хлор-4-нитрофенол
- 17. оказывающий противогрибковое действие. Применяют для лечения грибковых заболеваний кожи: эпидермофитии, трихофитии, кандидозов кожи и др. путем
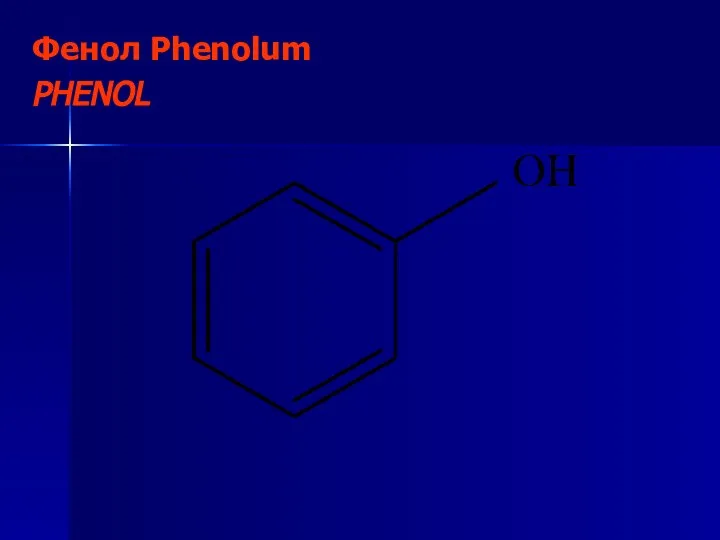
- 18. Фенол Phenolum PHENOL
- 19. Acidum carbolicum Кислота карболовая С6Н6О М.м. = 94,1 г/моль Химическое название: гидроксибензен, гидроксибензол
- 20. Получение 1. С каменноугольной смолы. При сухой перегонке (коксировании) каменного угля без доступа воздуха при температуре
- 21. Полученный раствор фенолята обрабытывают углекислым газом СО2 или разбавленной минеральной кислотой, например, хлоридной кислотой HCl. При
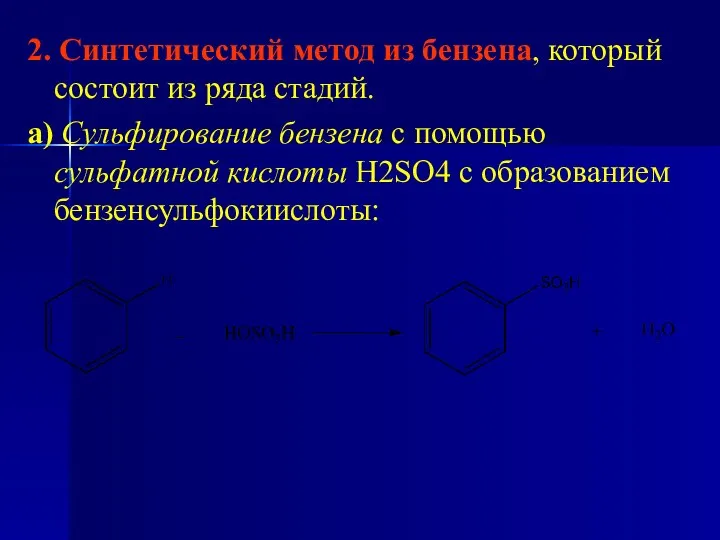
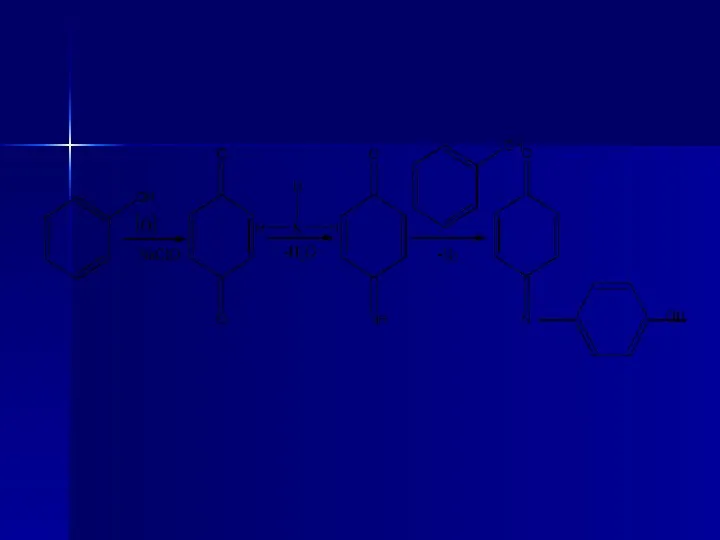
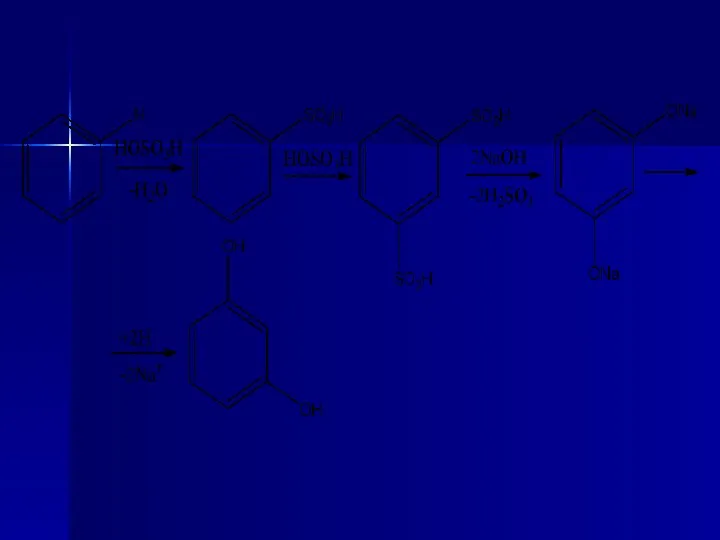
- 22. 2. Синтетический метод из бензена, который состоит из ряда стадий. а) Сульфирование бензена с помощью сульфатной
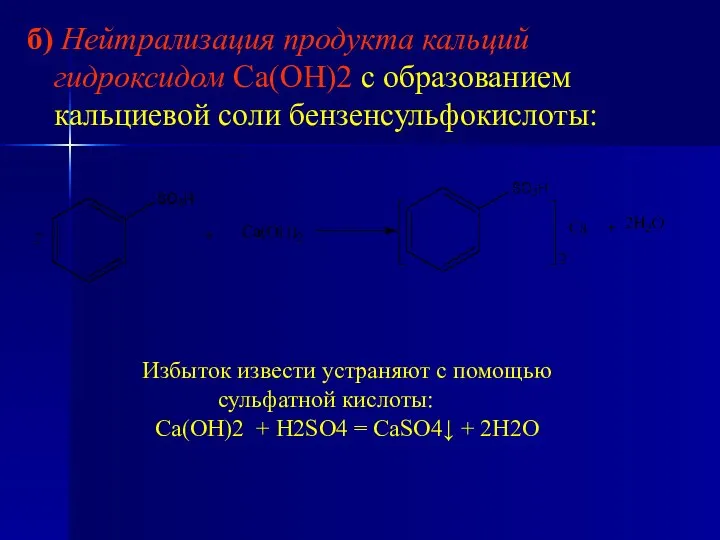
- 23. б) Нейтрализация продукта кальций гидроксидом Са(ОН)2 с образованием кальциевой соли бензенсульфокислоты: Избыток извести устраняют с помощью
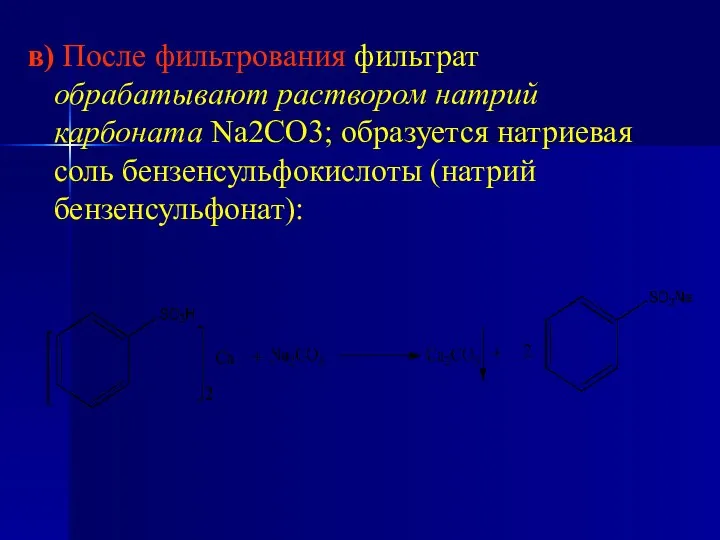
- 24. в) После фильтрования фильтрат обрабатывают раствором натрий карбоната Na2CO3; образуется натриевая соль бензенсульфокислоты (натрий бензенсульфонат):
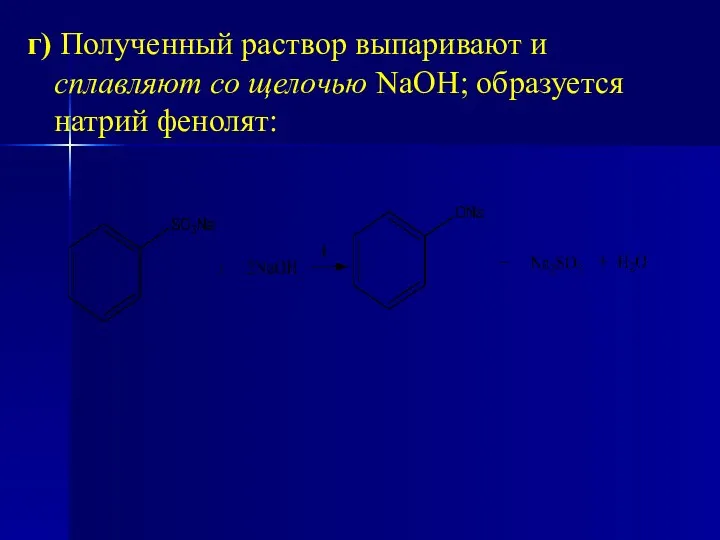
- 25. г) Полученный раствор выпаривают и сплавляют со щелочью NaOH; образуется натрий фенолят:
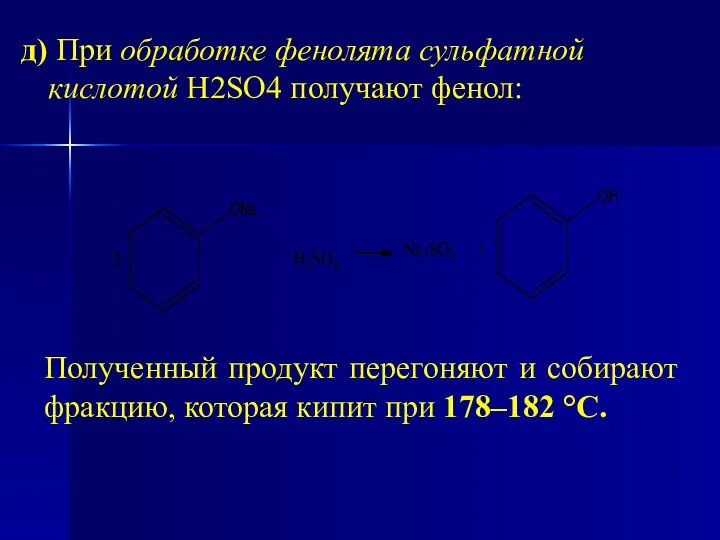
- 26. д) При обработке фенолята сульфатной кислотой Н2SO4 получают фенол: Полученный продукт перегоняют и собирают фракцию, которая
- 27. Свойства Описание. ГФУ. Бесцветные или бледно-розовые или бледно-желтоватые кристаллы или кристалическая масса, которая расплывается на воздухе.
- 28. Идентифиция А. ГФУ. Окисление препарата натрий гипохлоритом в присутствии аммиака (индофеноловая реакция). Субстанцию растворяют в растворе
- 30. В. ГФУ. Реакция с нейтральным раствором феррум (ІІІ) хлорида (реакция на фенольный гидроксил). При прибавлении к
- 31. Сине-фиолетовое окрашевание Этой реакцией можно отличить раствор фенола от раствора салициловой кислоты (фенолокислоты); в этом случае
- 32. С. ГФУ. Реакция с бромной водой (реакция на бензеновое кольцо). При добавлении к водному раствору фенола
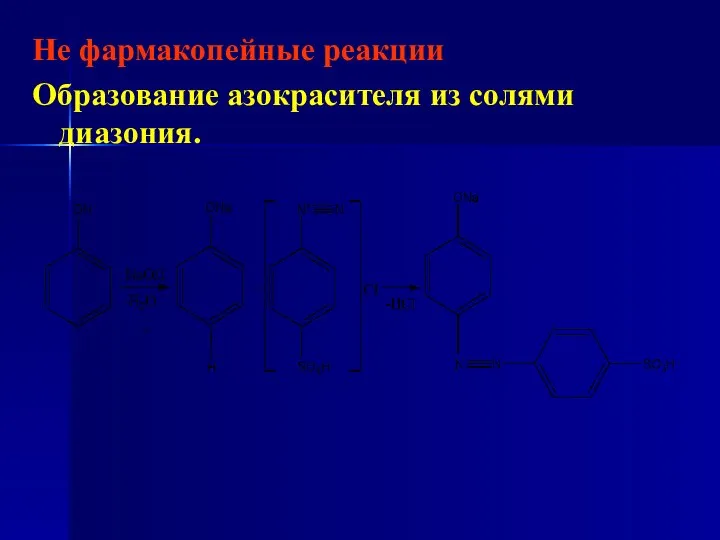
- 33. Не фармакопейные реакции Образование азокрасителя из солями диазония.
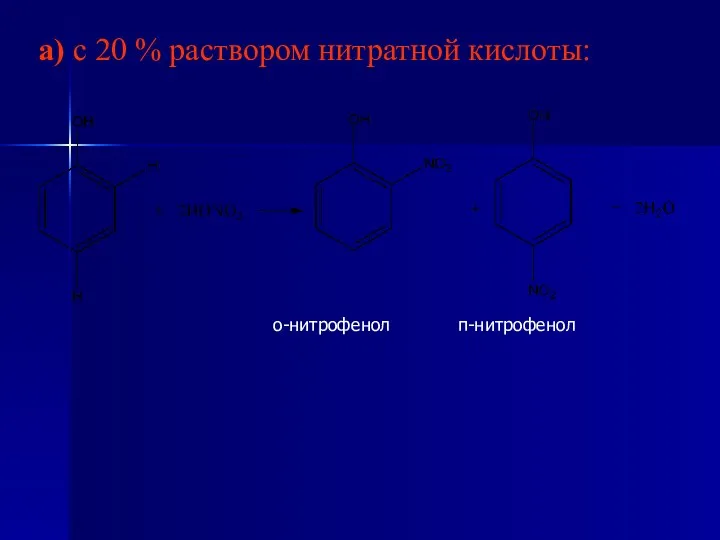
- 34. 2. Взаимодействие с нитратной кислотой. При взаимодействии с нитратной кислотой HNO3 в зависимости от ее концентрации
- 35. а) с 20 % раствором нитратной кислоты: о-нитрофенол п-нитрофенол
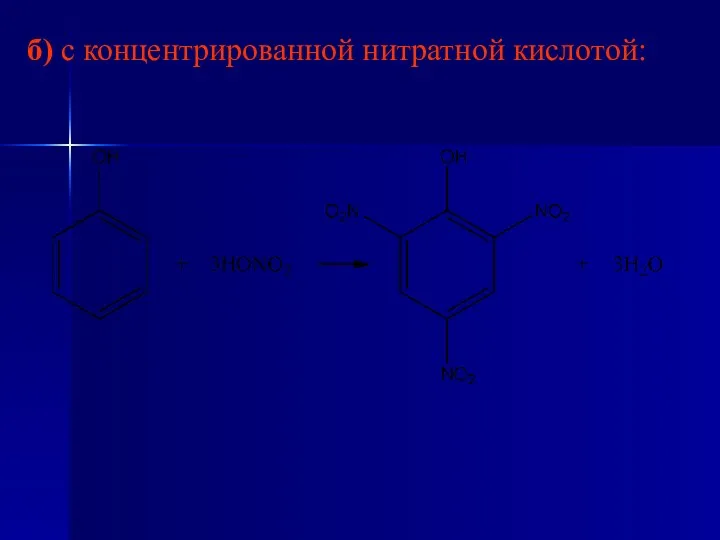
- 36. б) с концентрированной нитратной кислотой:
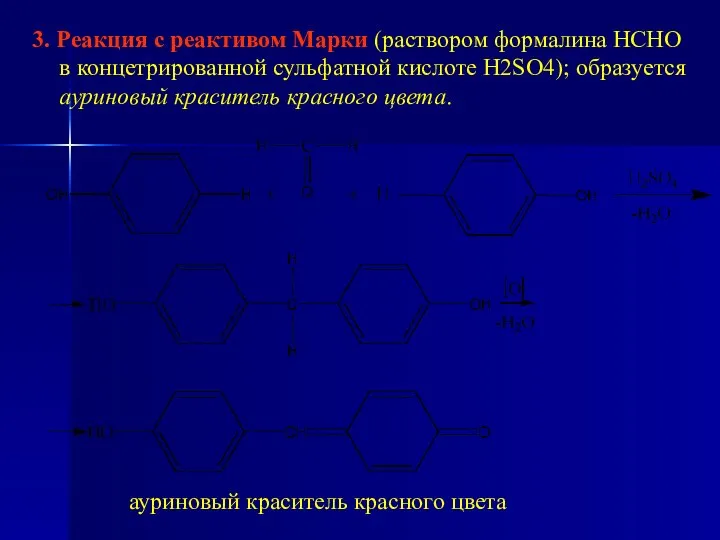
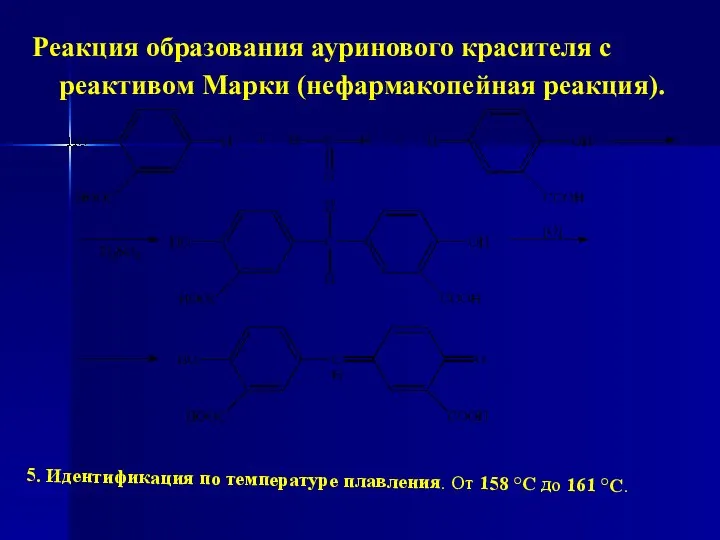
- 37. 3. Реакция с реактивом Марки (раствором формалина НСНО в концетрированной сульфатной кислоте H2SO4); образуется ауриновый краситель
- 38. Испытания на чистоту. 1. Прозрачность раствора S (водный раствор субстанции). Раствор S должен быть прозрачным. 2.
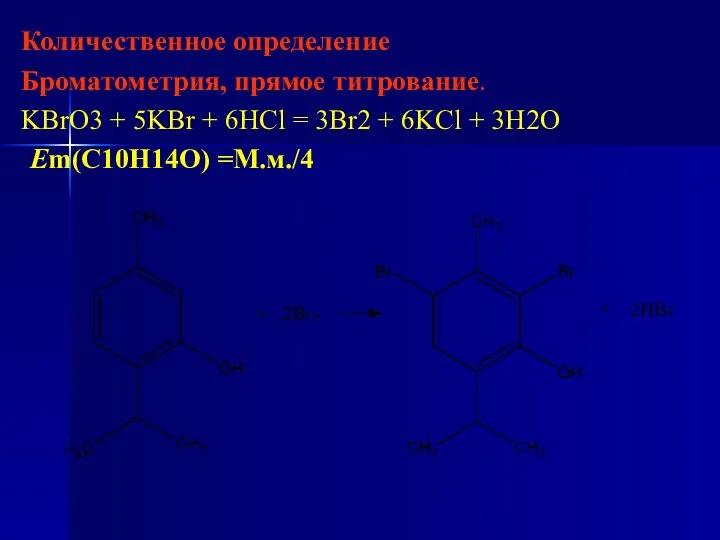
- 39. Количественное определение ГФУ. Броматометрия, обратное титрование, с иодометрическим окончанием. KBrO3 + 5KBr + 6HCl = 3Br2
- 40. Не прореагировавший бром Br2 реагирует с калий иодидом KI с образованием иода I2: Br2 + 2KI
- 41. Параллельно проводят контрольный опыт. Еm(С6Н6О) =М.м./6 Хранение Список сильнодействующих веществ. В воздухонепроникном контейнере, в защищенном от
- 42. Иногда назначают при некоторых кожных заболеваниях и при воспалении среднего уха. Действует раздражающе и прижигающе на
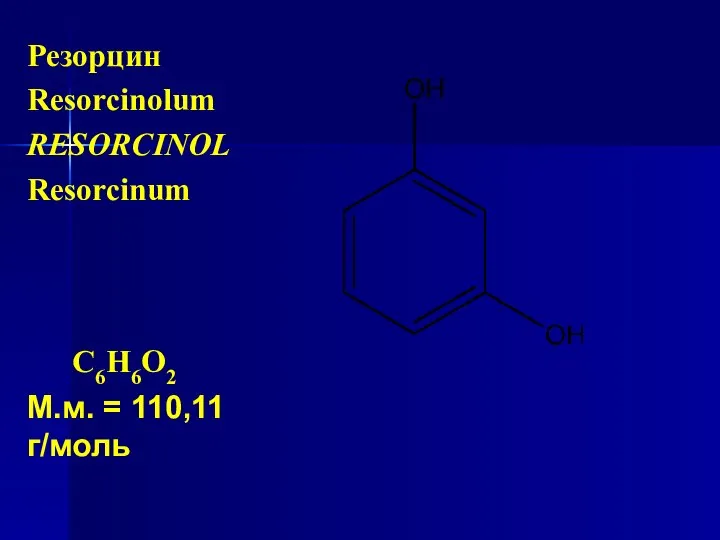
- 43. Резорцин Resorcinolum RESORCINOL Resorcinum С6Н6О2 М.м. = 110,11 г/моль
- 44. Химическое название: бензол-1,3-диол, бензен-1,3-диол, 1,3-диоксибензол, мета-диоксибензол Резорцин содержит не менее 98,5 % и не более 101,0
- 46. Свойства Описание. ГФУ. Кристаллический порошок или кристаллы бесцветные, или бледного розово-серого цвета. Краснеют под действием света
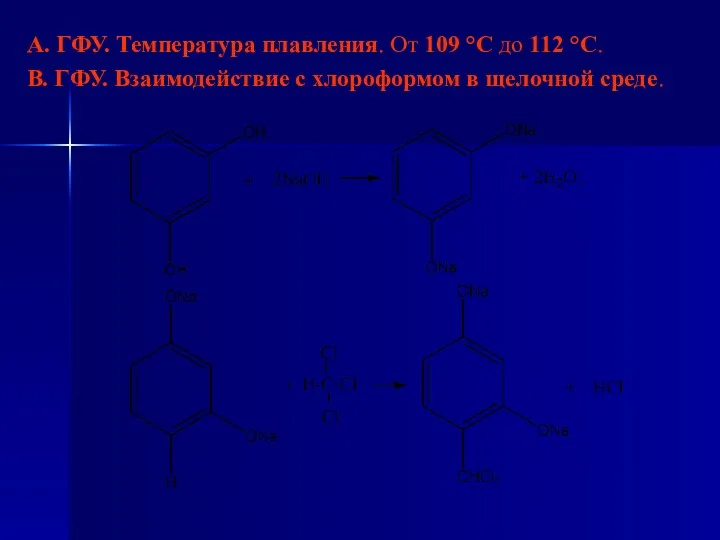
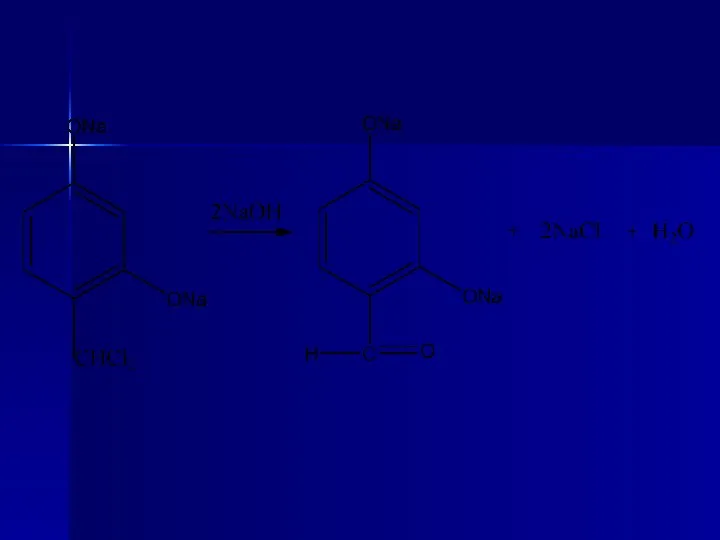
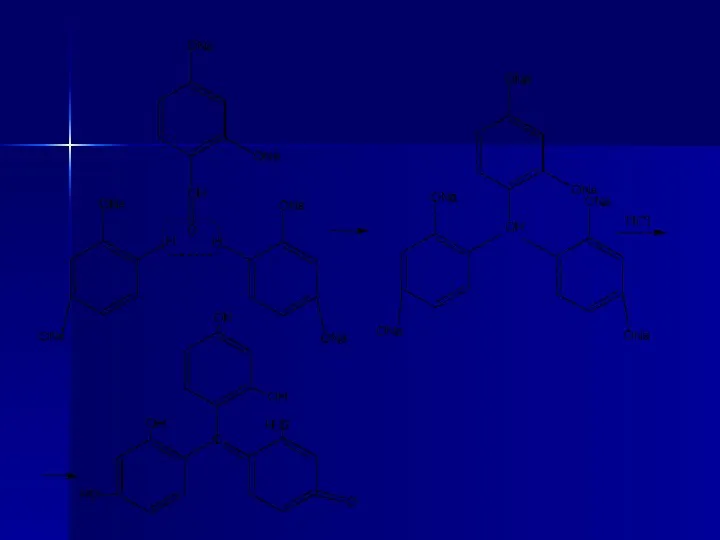
- 47. А. ГФУ. Температура плавления. От 109 °С до 112 °С. В. ГФУ. Взаимодействие с хлороформом в
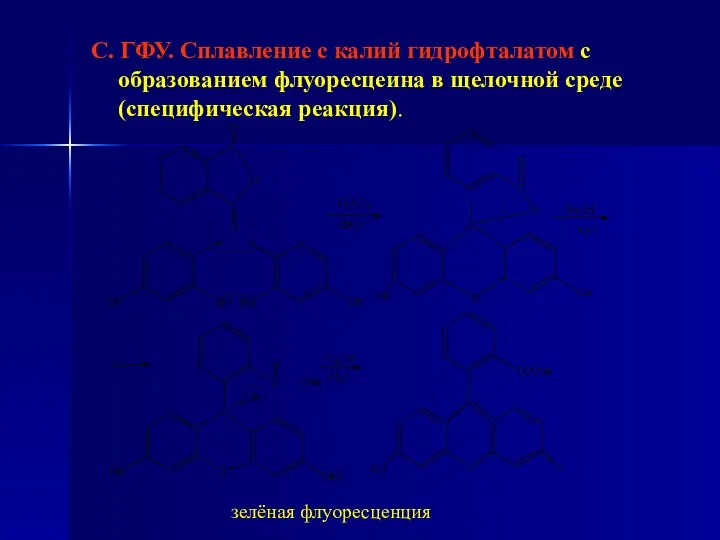
- 50. С. ГФУ. Сплавление с калий гидрофталатом с образованием флуоресцеина в щелочной среде (cпецифическая реакция). зелёная флуоресценция
- 51. Другие реакции идентификации 1. ГФ Х. Реакция с феррум(ІІІ) хлоридом. При прибавлении к водному раствору субстанции
- 52. Испытания на чистоту 1. Прозрачность раствора. Раствор S (раствор субстанции в воде, свободной от СО2) должен
- 53. 5. Пирокатехин. К раствору S прибавляют раствор аммоний молибдата (NH4)2MoO4 и перемешивают; желтое окрашивание должно быть
- 54. Количественное определение ГФУ, ГФ Х. Броматометрия, обратное титрование, с иодометрическим окончанием. Химизм происходящих в процессе опыта
- 56. Не прореагировавший бром Br2 реагирует с калий иодидом KI с образованием иода I2: Br2 + 2KI
- 57. Хранение Список сильнодействующих веществ. В хорошо укопоренном контейнере, в банках с оранжевого стекала, в защищенном от
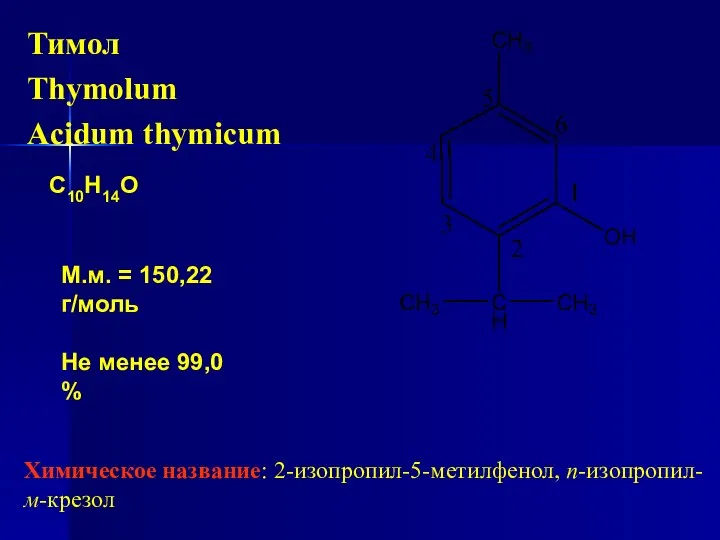
- 58. Тимол Thymolum Acidum thymicum С10Н14О М.м. = 150,22 г/моль Не менее 99,0 % Химическое название: 2-изопропил-5-метилфенол,
- 59. Получение 1. Из чебрецового эфирного масла, содержащего 25–50 % фенолов, борнеол, цимол и другие природные соединения.
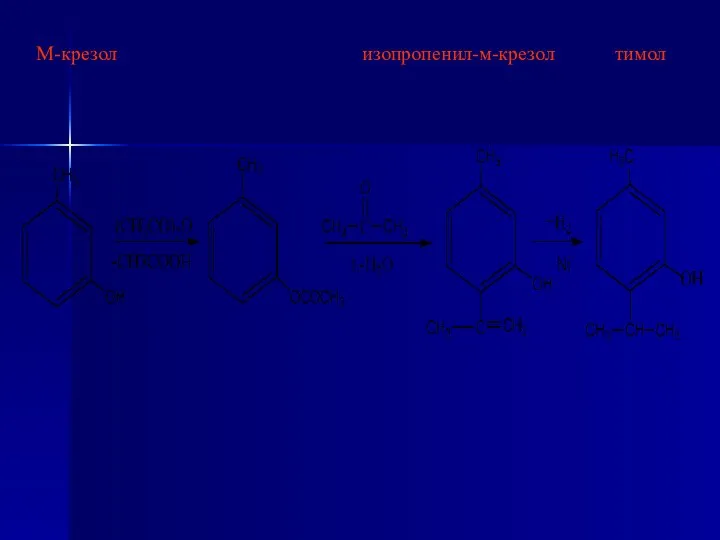
- 60. 2. Синтетический метод из 3-метилфенола (м-крезола). м-Крезол сульфуют с помощью H2SO4, образующуюся сульфокислоту конденсируют с изопропанолом
- 61. М-крезол изопропенил-м-крезол тимол
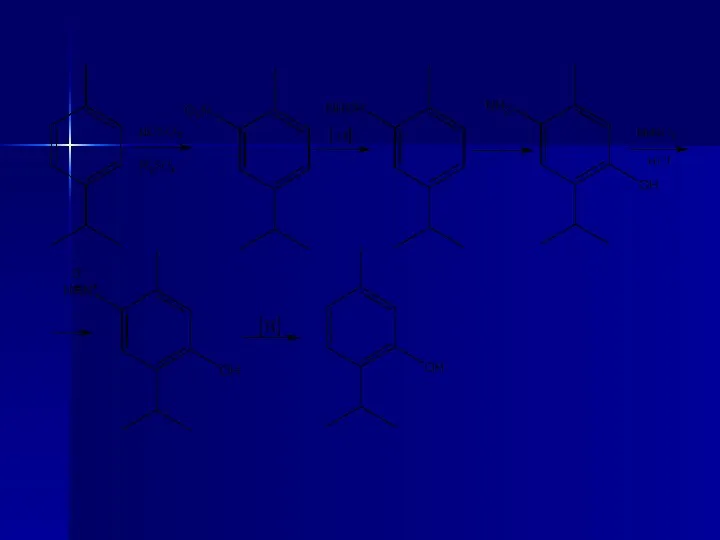
- 62. 3. Синтетический метод из п-изопропилтолуэна (п-цимола). п-Цимол нитруют с помощью HNO3, полученный 2-нитроцимол восстанавливают электролитически до
- 64. Свойства Описание. Крупные бесцветные кристаллы или кристаллический порошок с характерным запахом и пряно-жгучим вкусом. Летуч с
- 65. Идентификация 1. Поведение в воде. В холодной воде тимол погружается вниз; при повышения температуры до 45
- 66. 3. Длительное нагревание тимола с раствором натрий гидроксида. Препарат нагревают на водяном нагревателе с раствором натрий
- 67. Испытания на чистоту 1. Кислотность или щелочность. Водно-спиртовый раствор субстанции должен иметь нейтральную реакцию. 2. Фенол.
- 68. Количественное определение Броматометрия, прямое титрование. KBrO3 + 5KBr + 6HCl = 3Br2 + 6KCl + 3H2O
- 69. Хранение Список сильнодействующих веществ. В плотно укопоренном контейнере, предохраняющем от действия света. Применение. Антисептическое и противоглистное
- 70. Ксероформ Xeroformium Bismuthi tribromphenolas basicus С12Н5 Bi3Br6О6 М.м. = 1351,6 г/моль Не менее 50,0 % и
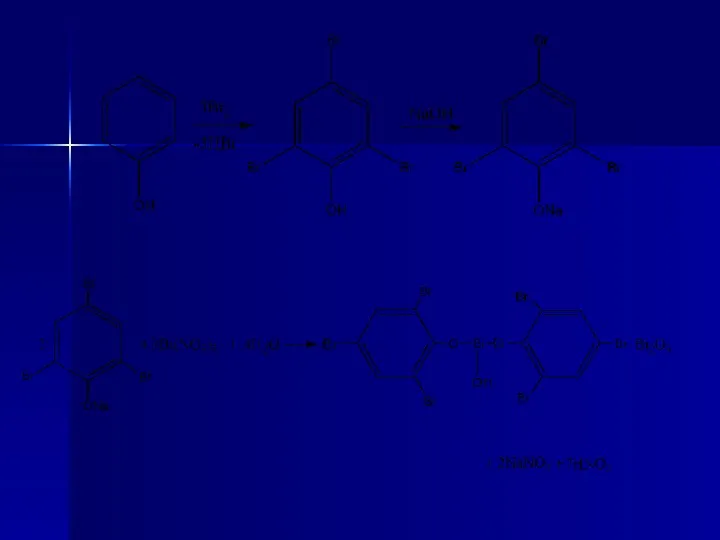
- 71. Химическое название: бисмута трибромфенолят основный с висмута оксидом. Получение Синтетический метод из фенола путем бромирования, взаимодействия
- 73. Свойства Описание. Мелкий аморфный порошок желтого цвета с слабым своеобразным запахом. Растворимость. Практически нерастворим в воде,
- 74. Идентификация 1. Реакции на ионы Бисмута Bi3+ а) ГФУ, ГФ Х. Реакция с раствором натрий сульфида
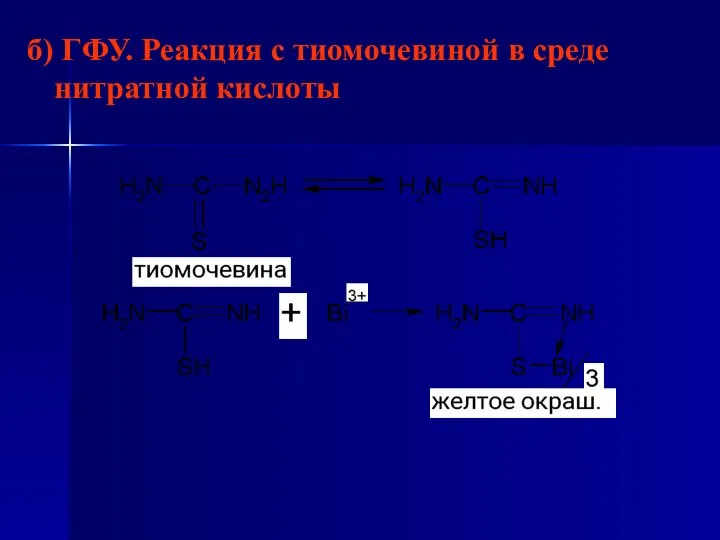
- 75. б) ГФУ. Реакция с тиомочевиной в среде нитратной кислоты
- 76. в) Нефармакопейная реакция. Взаимодействие с раствором калий иодида. Bi3+ + 3I– → BiI3↓ BiI3 + KI
- 77. Испытания на чистоту 1. Свободный трибромфенол (недопустимая примесь). Препарат взбалтывают с 95 % спиртом (в спирте
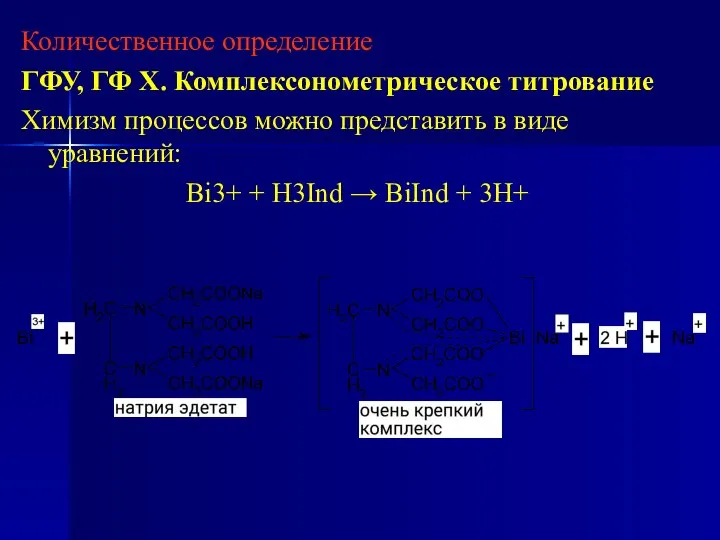
- 78. Количественное определение ГФУ, ГФ Х. Комплексонометрическое титрование Химизм процессов можно представить в виде уравнений: Bi3+ +
- 79. Расчет ведут на Bi2O3, которого должно быть 50,0–55,0 %. Еm = М.м./2 Bi2O3
- 80. Хранение В плотно укопоренном контейнере, предохраняющем от действия влаги и света. Применение. Вяжущее, подсушивающее и антисептическое
- 81. Ароматические кислоты – производные ароматических углеводородов, в молекулах которых в ароматическом ядре один или несколько атомов
- 82. Фармакологическое действие и медицинское применение. Введение карбоксильной группы в молекулу ароматического углеводорода понижает токсичность соединения и
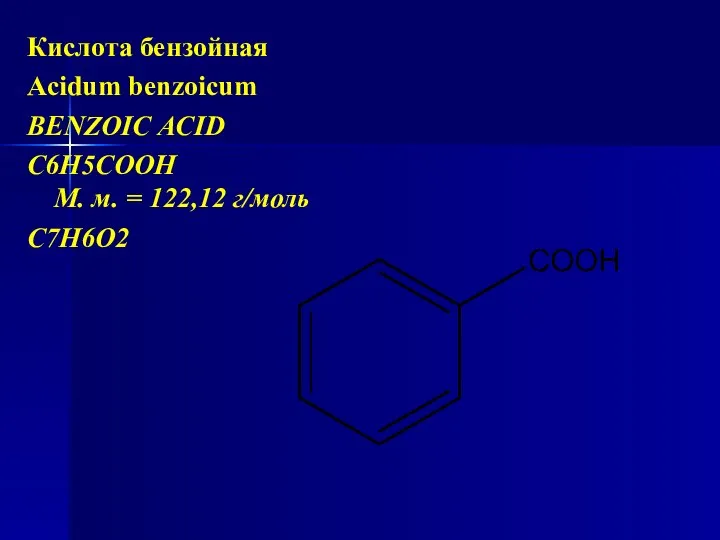
- 83. Кислота бензойная Acidum benzoicum BENZOIC ACID C6H5COOH М. м. = 122,12 г/моль С7Н6О2
- 84. Химическое название: бензолкарбоновая кислота, бензойная кислота, бензоатная кислота. Кислота бензойная содержит не менее 99,0 % и
- 85. Получение В настоящее время кислоту бензойную получают несколькими синтетическими методами. 1. Окисление толуола (толуена, метилбензена) в
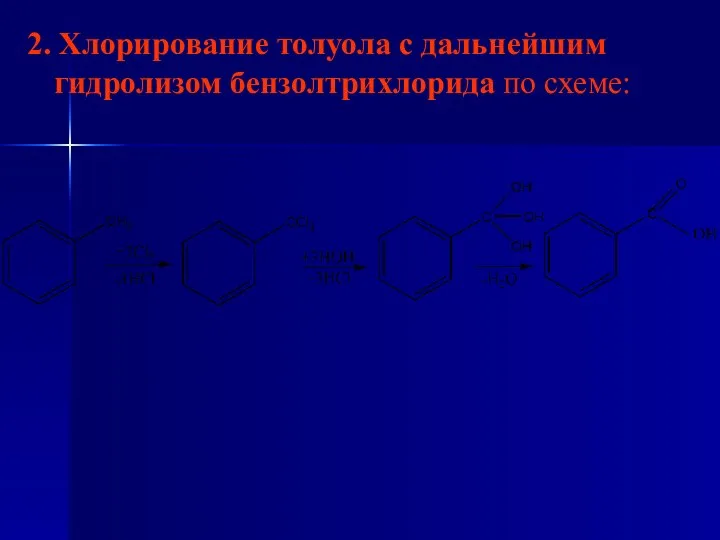
- 86. 2. Хлорирование толуола с дальнейшим гидролизом бензолтрихлорида по схеме:
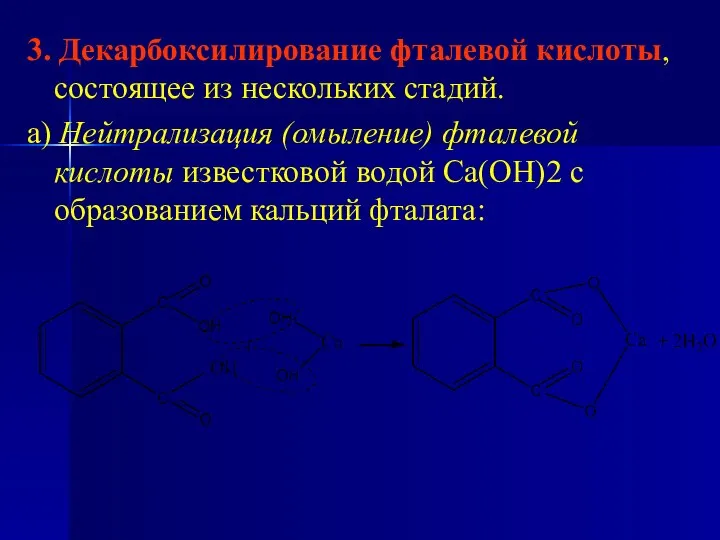
- 87. 3. Декарбоксилирование фталевой кислоты, состоящее из нескольких стадий. а) Нейтрализация (омыление) фталевой кислоты известковой водой Са(ОН)2
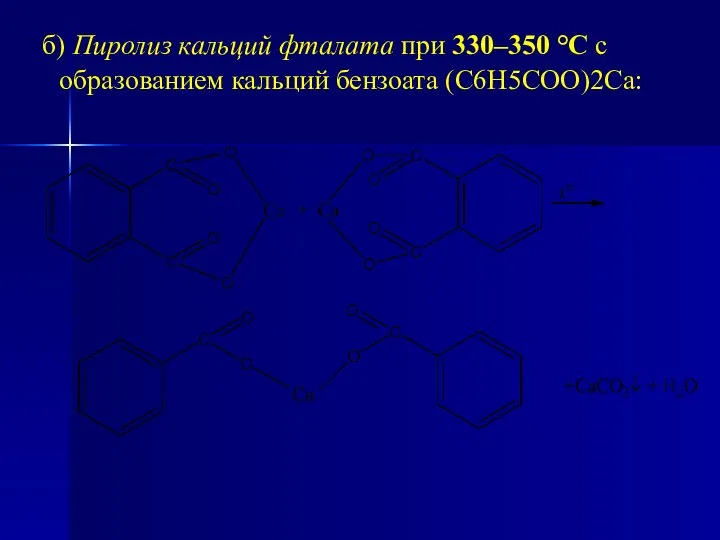
- 88. б) Пиролиз кальций фталата при 330–350 °С с образованием кальций бензоата (С6Н5СОО)2Са:
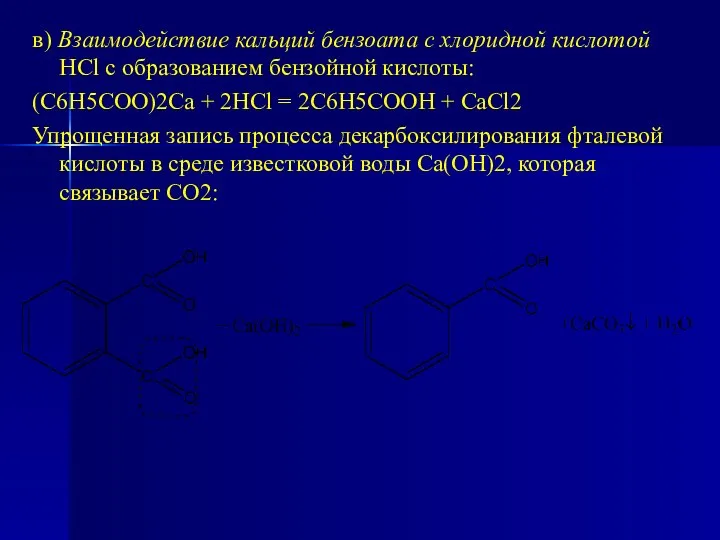
- 89. в) Взаимодействие кальций бензоата с хлоридной кислотой HCl с образованием бензойной кислоты: (С6Н5СОО)2Са + 2HCl =
- 90. Свойства Описание. ГФУ, дополн. 1. Кристаллический порошок белого цвета или бесцветные кристаллы, без запаха или с
- 91. Идентификация А. ГФУ, ГФУ, дополн. 1. Определение температуры плавления. Препарат после перекристаллизации из теплой воды Р
- 92. ГФ Х. Препарат растворяют в растворе натрий гидроксида NaOH (реакция должна быть нейтральной, так как в
- 93. в) ГФУ. Сублимация препарата. Несколько кристаллов размельченного препарата смачивают кислотой сульфатной Р H2SO4, осторожно нагревают дно
- 94. Испытания на чистоту 1. ГФУ, дополн. 1. Прозрачность и цветность раствора. Раствор S (раствор субстанции в
- 95. 3. ГФУ, дополн.1. Восстанавливающие вещества. Субстанцию растворяют в кипящей воде Р, охлаждают, встряхивают и фильтруют. К
- 96. 5. ГФУ, дополн. 1. Галогенопроизводные и галогениды. Определяют методом спектрофотометрии, измеряя оптическую плотность испытуемого раствора и
- 97. Количественное определение ГФУ, дополн. Алкалиметрия в спиртовом растворе, прямое титрование C6H5COOH + NaOH = C6H5COONa +
- 98. Хранение В плотно укопоренном контейнере. Применение. Наружное антисептическое средство. Применяют наружно в качестве противомикробного и фунгицидного
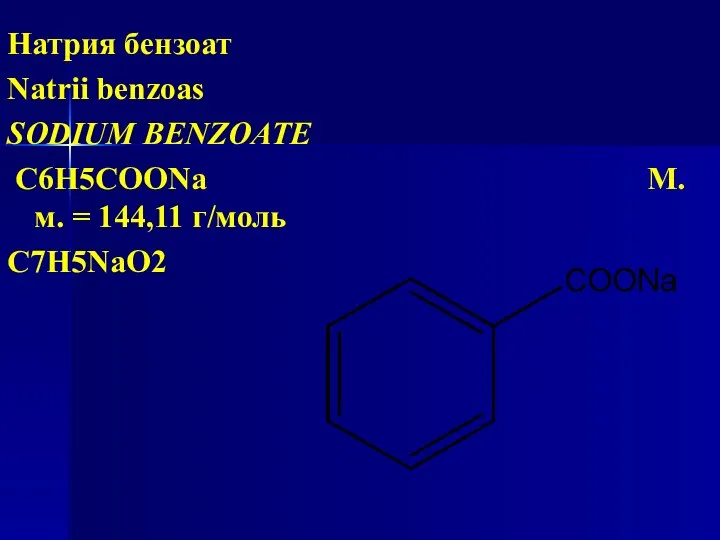
- 99. Натрия бензоат Natrii benzoas SODIUM BENZOATE C6H5COONa М. м. = 144,11 г/моль С7Н5NaО2
- 100. Химическое название: натрий бензолкарбоксилат, натрий бензоат, натриевая соль бензойной кислоты Натрия бензоат содержит не менее 99,0
- 101. Получение Растворение кислоты бензойной в горячем растворе натрий карбоната Na2CO3 (соды). 2С6H5COOH + Na2CO3 = 2С6H5COONa
- 102. Свойства Описание. ГФУ, дополн. 1. Кристаллический или гранулированный порошок или хлопья белого цвета. Слабо гигроскопичен. ГФ
- 103. Идентификация 1. Реакции на ионы Натрия (ГФУ, дополн. 1 – субстанция дает реакцию (а) на Натрий)
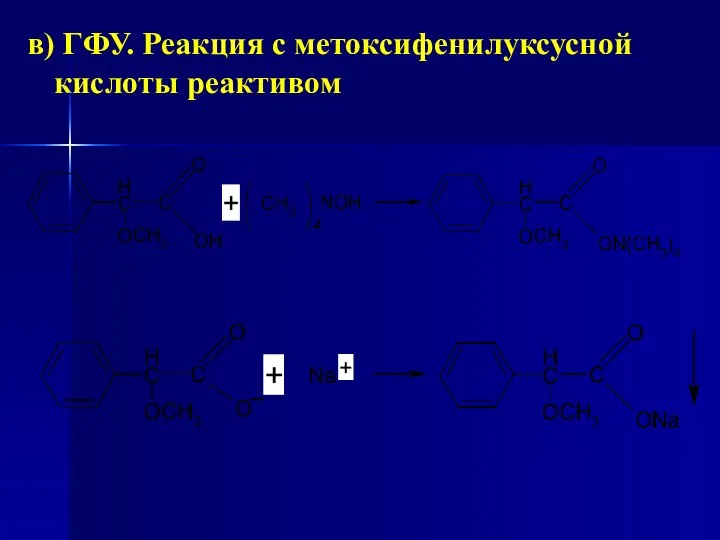
- 104. в) ГФУ. Реакция с метоксифенилуксусной кислоты реактивом
- 105. с) ГФУ, N. Окрашивание пламени. Соль Натрия, смоченная кислотой хлоридной Р и внесенная в бесцветное пламя,
- 106. 2. Реакции на бензоат-ионы (ГФУ, дополн. 1 – субстанция дает реакции (в) и (с) на бензоаты,
- 107. с) ГФУ. Определение температуры плавления продукта взаимодействия с хлоридной кислотой (кислоты бензойной). К раствору препарата прибавляют
- 108. Испытания на чистоту 1. Прозрачность раствора. Раствор S (раствор препарата в воде, свободной от карбон диоксида,
- 109. 4. Галогенопроизводные (хлорид-ионы, общий Хлор). Рекомендуется для данного испытания использовать отдельную стеклянную посуду, свободную от хлоридов.
- 110. Количественное определение Ацидиметрия, неводное титрование Химизм процесса можно представить в две стадии: C6H5COONa + СН3СООН →
- 111. 2. ГФ Х. Ацидиметрия, прямое титрование в присутствии эфира С6H5COONa + HCl = С6H5COOH + NaCl
- 112. Хранение В плотно укопоренном контейнере. Применение. Отхаркивающее средство Применяют перорально как отхаркивающее средство при бронхитах и
- 113. Натрия бензоат применяют также для исследования антитоксической функции печени. Принцип применения состот в том, что глицин
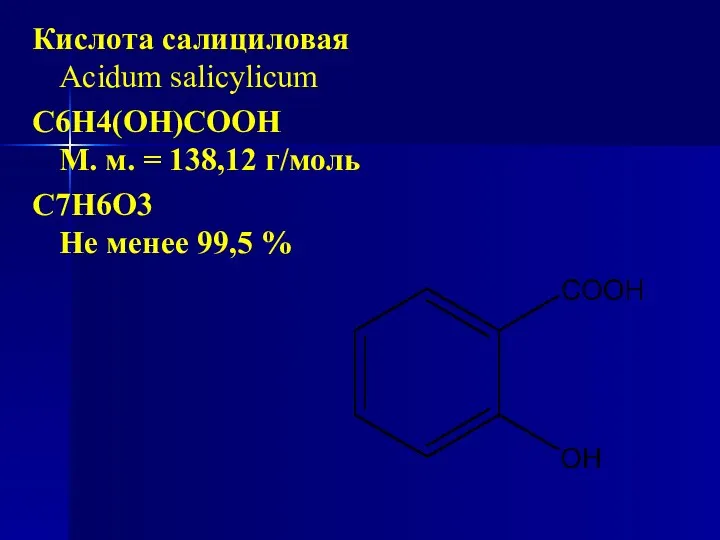
- 114. Кислота салициловая Acidum salicylicum C6H4(OH)COOH М. м. = 138,12 г/моль С7Н6О3 Не менее 99,5 %
- 115. Химическое название: о-оксибензойная кислота Нахождение в природе Салициловая кислота широко распространена в растительных организмах как в
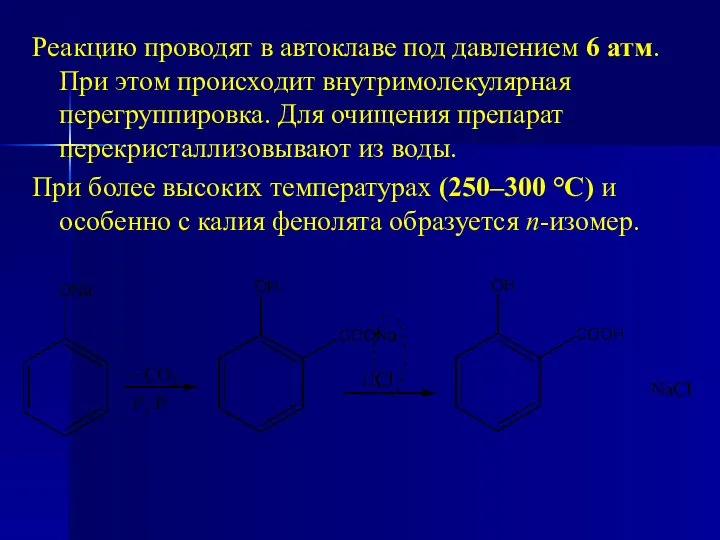
- 116. Получение Взаимодействие твердого натрий фенолята с углекислым газом при температуре 125 °С по схеме (метод Кольбе-Шмидта):
- 117. Реакцию проводят в автоклаве под давлением 6 атм. При этом происходит внутримолекулярная перегруппировка. Для очищения препарат
- 118. Свойства Описание. Белые мелкие игольчатые кристаллы или легкий кристаллический порошок без запаха, сладковато-кислого вкуса. Летуч с
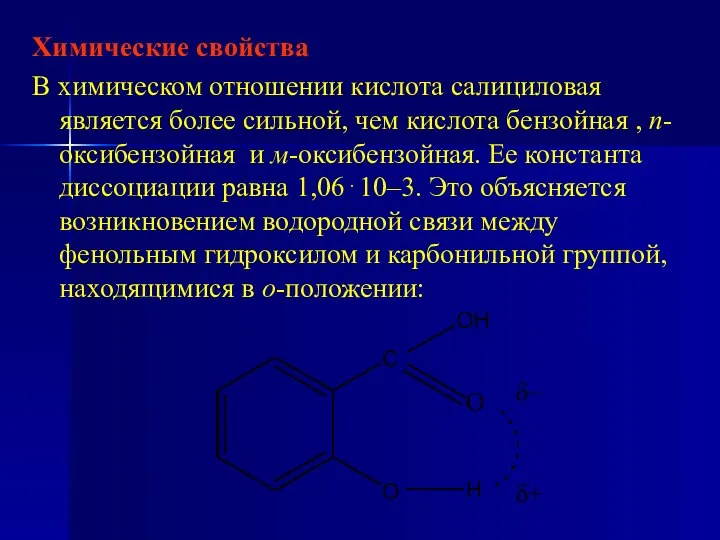
- 119. Химические свойства В химическом отношении кислота салициловая является более сильной, чем кислота бензойная , п-оксибензойная и
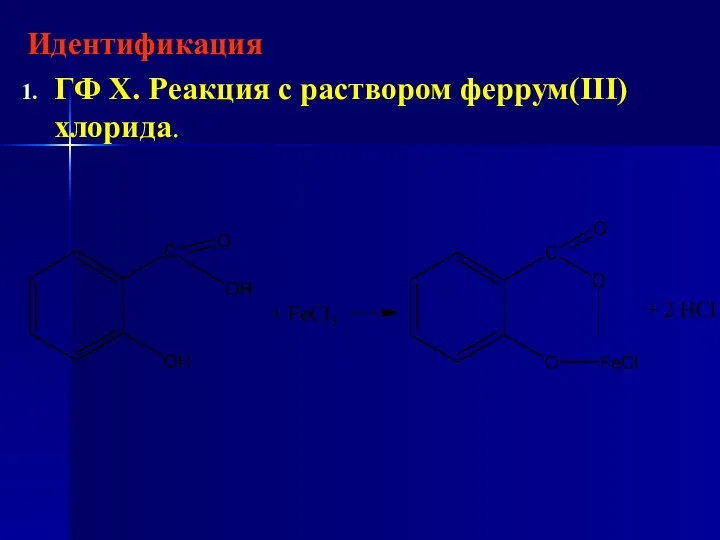
- 120. Идентификация ГФ Х. Реакция с раствором феррум(ІІІ) хлорида.
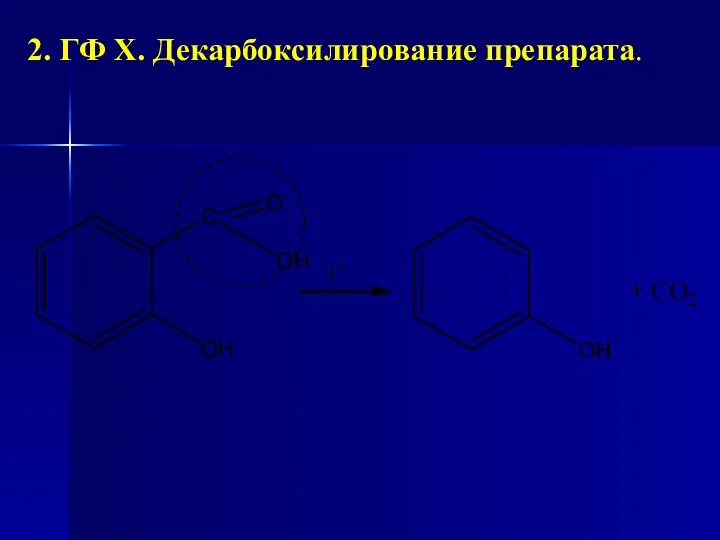
- 121. 2. ГФ Х. Декарбоксилирование препарата.
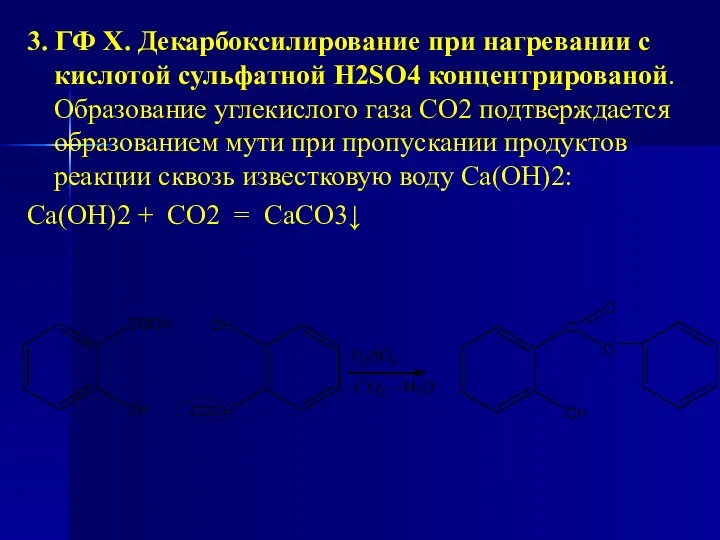
- 122. 3. ГФ Х. Декарбоксилирование при нагревании с кислотой сульфатной H2SO4 концентрированой. Образование углекислого газа СО2 подтверждается
- 123. Реакция образования ауринового красителя с реактивом Марки (нефармакопейная реакция). 5. Идентификация по температуре плавления. От 158
- 124. Испытания на чистоту 1. Прозрачность и цветность раствора. Раствор препарата в спирте должен быть прозрачным и
- 125. 5. Оксидифенил (специфическая примесь). Во время синтеза кислоты салициловой может образоваться оксидифенил С6Н5–С6Н4–ОН. Его определяют по
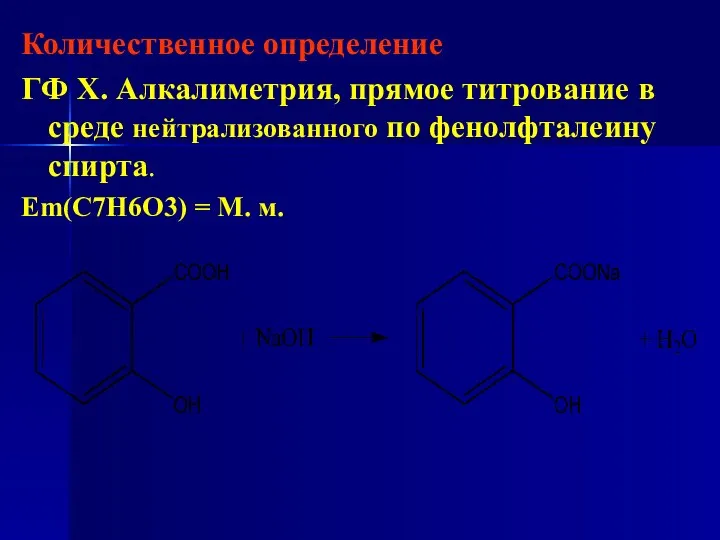
- 126. Количественное определение ГФ Х. Алкалиметрия, прямое титрование в среде нейтрализованного по фенолфталеину спирта. Еm(С7Н6О3) = М.
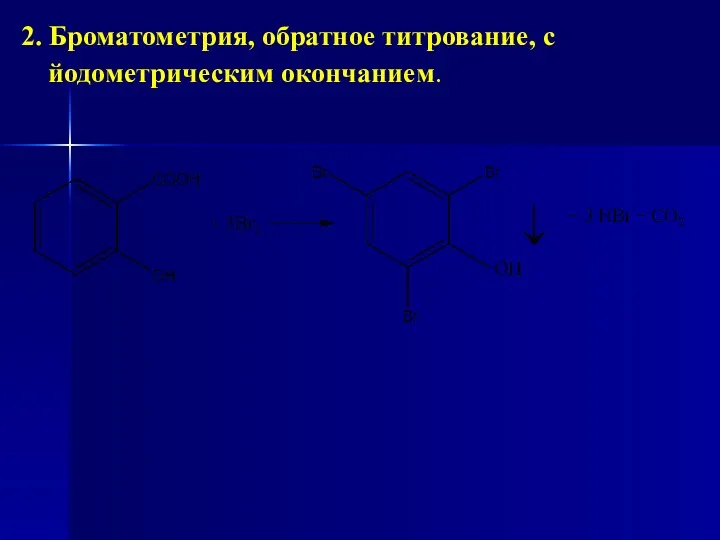
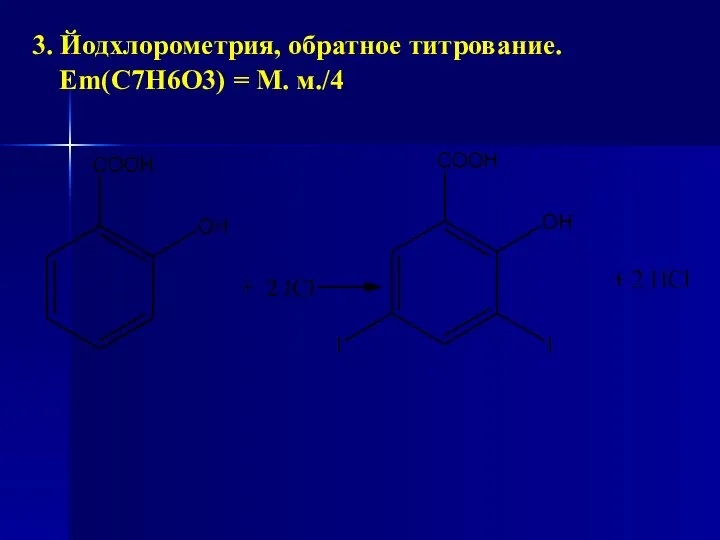
- 127. 2. Броматометрия, обратное титрование, с йодометрическим окончанием.
- 128. 3. Йодхлорометрия, обратное титрование. Еm(С7Н6О3) = М. м./4
- 129. Хранение. В плотно укопоренном контейнере, предохраняющем от действия света, в защищенном от света месте. Применение. Наружное
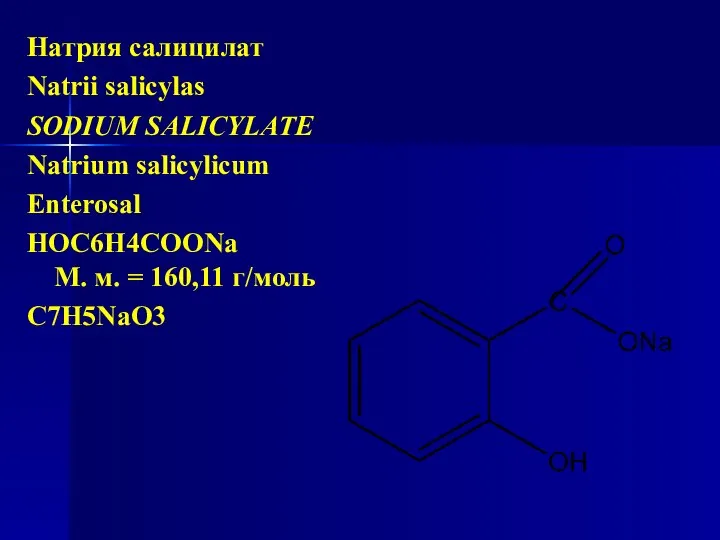
- 130. Натрия салицилат Natrii salicylas SODIUM SALICYLATE Natrium salicylicum Enterosal НОC6H4COONa М. м. = 160,11 г/моль С7Н5NaО3
- 131. Химическое название: натрия 2-гидроксибензолкарбоксилат, натриевая соль о-оксибензойной кислоты. Натрия салицилат содержит не менее 99,0 % и
- 132. Свойства Описание. ГФУ, дополн. 1. Кристаллический порошок белого цвета, или мелкие бесцветные кристаллы, или блестящие чешуйки.
- 133. Идентификация Первая идентификация: А, С. Вторая идентификация: В, С. А. ИК-спектроскопия. ИК-спектр субстанции должен соответствовать ИК-спектру
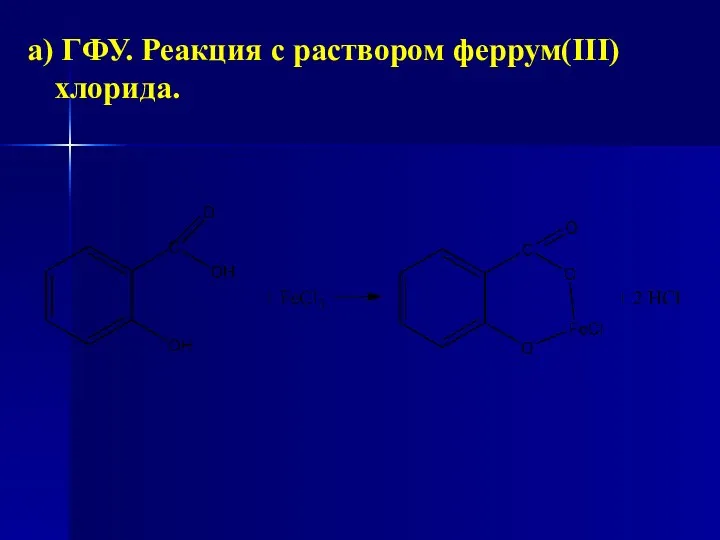
- 134. а) ГФУ. Реакция с раствором феррум(ІІІ) хлорида.
- 135. в) ГФУ. Определение температуры плавления продукта взаимодействия с хлоридной кислотой (кислоты салициловой). НОC6H4COONa + HCl =
- 136. Нефармакопейная реакция Реакция образования ауринового красителя с реактивом Марки; образуется красное окрашивание (см. кислота салициловая). С.
- 137. Испытания на чистоту 1. Прозрачность раствора. Раствор S (раствор препарата в воде, свободной от карбон диоксида,
- 138. 3. Кислотность. К раствору S прибавляют несколько капель раствора фенолового красного Р; появляется желтое окрашивание, которое
- 139. Количественное определение ГФУ, дополн. 1. Ацидиметрия, неводное титрование потенциометрически HOC6H4COONa + СН3СООН → HOC6H4COONaН+⋅СН3СОО– СН3СООН +
- 140. 2. ГФ Х. Ацидиметрия, прямое титрование в присутствии эфира. Методика титрования аналогична определению натрия бензоата. НОС6H4COONa
- 141. Хранение В воздухонепроникном контейнере, в сухом защищенном от света месте. Применение. Противоревматическое, противовоспалительное, болеутоляющее, жаропонижающее средство.
- 142. Курс лечение ревматизма салицилатами длительный – доза на курс для взрослых достигает 300–350 г. Формы выпуска:
- 143. Эстеры карбоновых кислот имеют общую формулу RCOOR1. Получение. Их получают в результате реакции эстерификации – реакции
- 144. Реакция эстерификации является обратимой. Она протекает быстрее и будет необратимой, если вместо карбоновой кислоты использовать ее
- 145. Свойства. Во многих случаях эстеры – это жидкости с приятным, иногда фруктовым запахом. Низшие гомологи растворимы
- 146. Физиологическое действие. Физиологическая активность этих соединений зависит от атомов и групп атомов, входящих в состав их
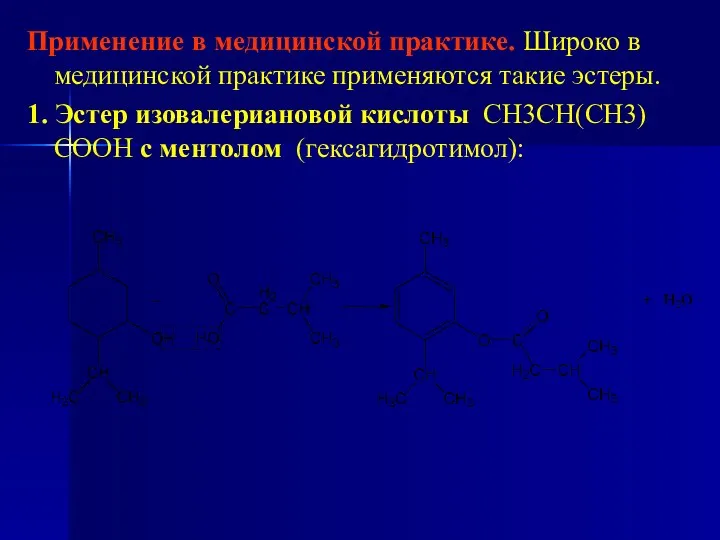
- 147. Применение в медицинской практике. Широко в медицинской практике применяются такие эстеры. 1. Эстер изовалериановой кислоты СН3СН(СН3)СООН
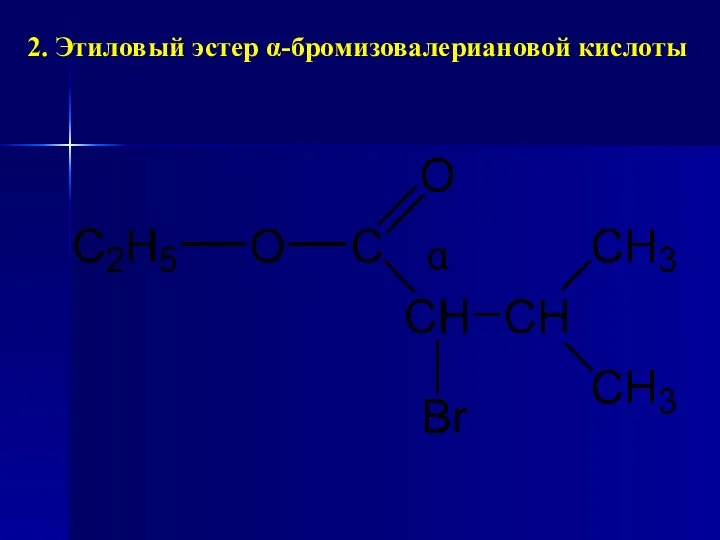
- 148. 2. Этиловый эстер α-бромизовалериановой кислоты
- 149. 3. Бензиловый эстер бензойной кислоты (бензилбензоат) 4. Эстеры салициловой кислоты: а) по карбоксильной группе: метилсалицилат и
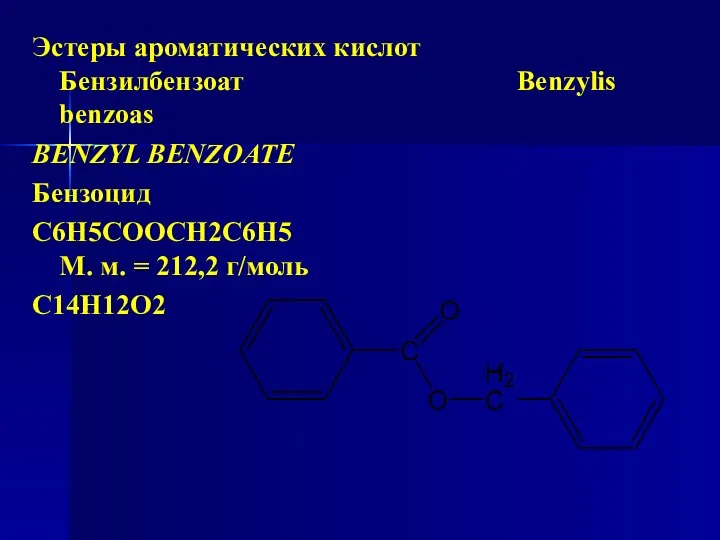
- 150. Эстеры ароматических кислот Бензилбензоат Benzylis benzoas BENZYL BENZOATE Бензоцид C6H5COOCH2C6H5 М. м. = 212,2 г/моль C14H12O2
- 151. Химическое название: фенилметилбензоат, бензиловый эстер бензойной кислоты Бензилбензоат содержит не менее 99,0 % и не более
- 152. Свойства Описание. ГФУ, дополн. 1. Кристаллы бесцветные или почти бесцветные, или бесцветная или почти бесцветная маслянистая
- 153. Идентификация Первая идентификация: А. Вторая идентификация: В, С. А. ИК-спектроскопия. ИК-спектр субстанции должен соответствовать эталонному ИК-спектру
- 154. С. Определение температуры плавления продукта окисления бензилового спирта С6Н5СН2ОН + КMnO4 + KOH = C6H5COOH +
- 155. Испытания на чистоту 1. Кислотность. К раствору субстанции в 96 % спирте Р прибавляют раствор фенолфталеина
- 156. Количественное определение Обратное кислотно-основное титрование продукта щелочного гидролиза С6Н5СООСН2С6Н5 + КОН (изб.) = С6Н5СООК + С6Н5СН2ОН
- 157. Хранение В воздухонепроницаемом, максимально заполненном контейнере, в защищенном от света месте. Суспензию можно хранить при комнатной
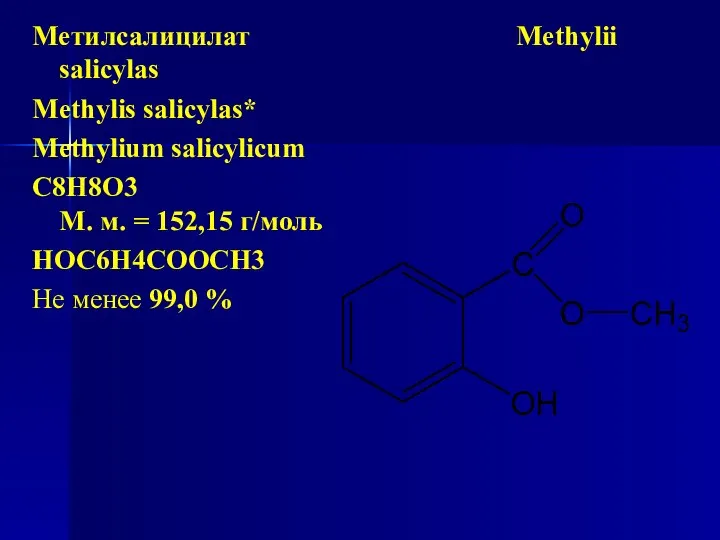
- 158. Метилсалицилат Methylii salicylas Methylis salicylas* Methylium salicylicum C8H8O3 М. м. = 152,15 г/моль HOC6H4COOCH3 Не менее
- 159. Химическое название: метилсалицилат, метиловый эстер 2-оксибензойной кислоты, метиловый эстер салициловой кислоты. Нахождение в природе Метилсалицилат содержится
- 160. Свойства Описание. Бесцветная или желтоватая жидкость с характерным ароматическим запахом. Плотность 1,176–1,184 г/мл. Температура кипения 219–225
- 161. Идентификация 1. ГФ Х. Реакция с раствором феррум(ІІІ) хлорида (наличие фенольного гидроксила). СН3ОСОС6Н4ОН + FeCl3 =
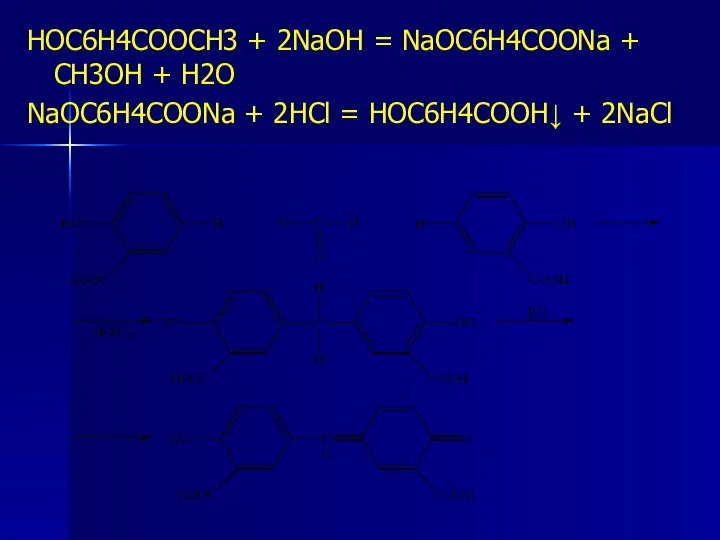
- 162. HOC6H4COOCH3 + 2NaOH = NaOC6H4COONa + CH3OH + H2O NaOC6H4COONa + 2HCl = HOC6H4COOH↓ + 2NaCl
- 163. 3. Плотность. От 1,176 г/см3 до 1,184 г/см3. 4. Показатель преломления. От 1,535 до 1,538. Испытания
- 164. Количественное определение 1. Ацидиметрия после предварительного щелочного гидролиза HOC6H4COOCH3 + 2NaOH = NaOC6H4COONa + CH3OH +
- 165. Хранение В плотно укопоренном контейнере, предохраняющем от действия света. Применение. Наружное противоревматическое, противовоспалительное, болеутоляющее средство. Относится
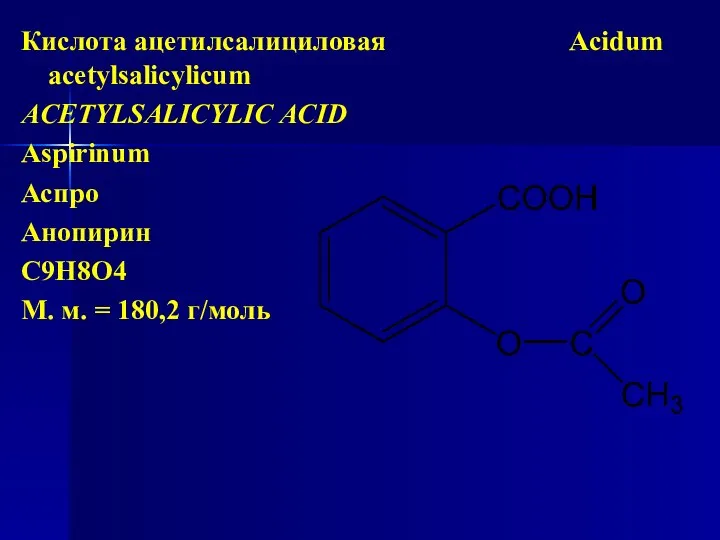
- 166. Кислота ацетилсалициловая Acidum acetylsalicylicum ACETYLSALICYLIC ACID Aspirinum Аспро Анопирин С9Н8О4 М. м. = 180,2 г/моль
- 167. Химические название: 2-(ацетокси)бензойная кислота, салициловый эстер уксусной (ацетатной) кислоты (эстерификация по фенольному гидроксилу салициловой кислоты). Кислота
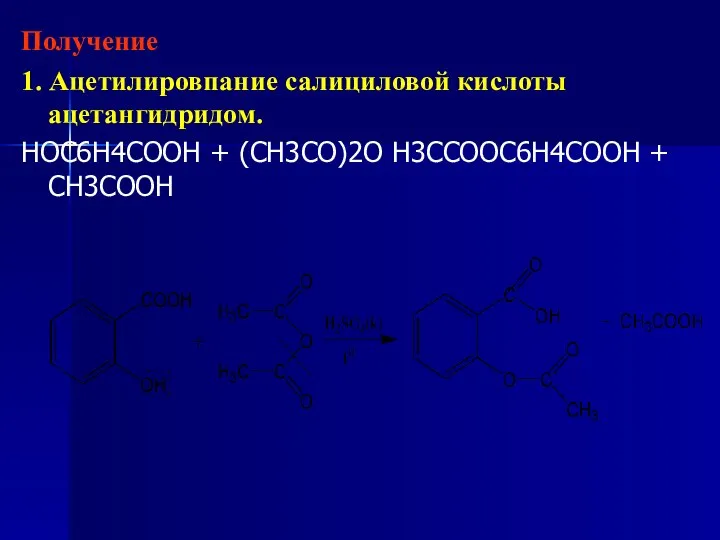
- 168. Получение 1. Ацетилировпание салициловой кислоты ацетангидридом. HOC6H4COOH + (CH3CO)2O H3CCOOC6H4COOH + CH3COOH
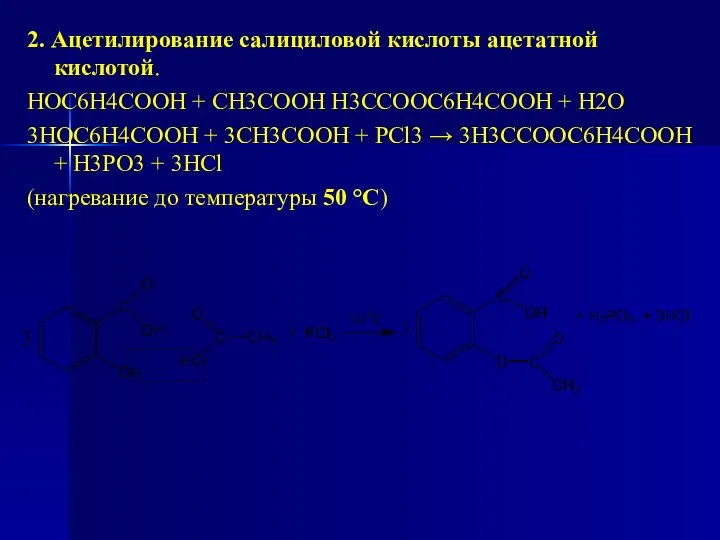
- 169. 2. Ацетилирование салициловой кислоты ацетатной кислотой. HOC6H4COOH + CH3COOH H3CCOOC6H4COOH + H2O 3HOC6H4COOH + 3CH3COOH +
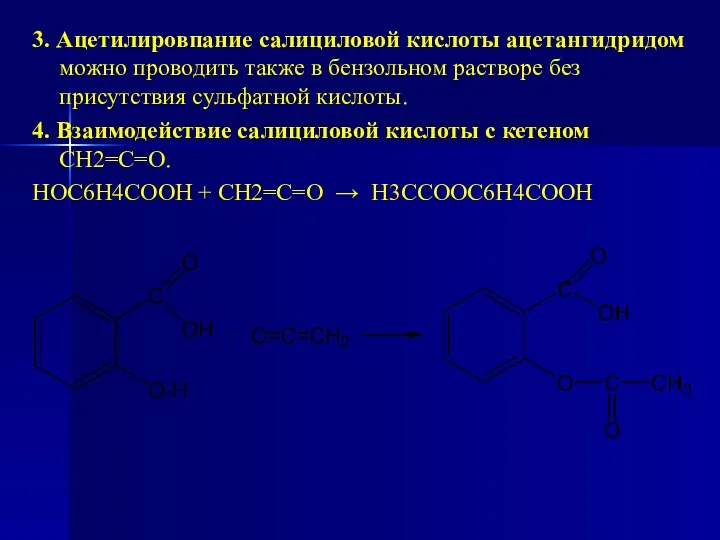
- 170. 3. Ацетилировпание салициловой кислоты ацетангидридом можно проводить также в бензольном растворе без присутствия сульфатной кислоты. 4.
- 171. Свойства Описание. ГФУ. Кристаллический порошок белого цвета или бесцветные кристаллы. ГФ Х и др. л-ра. Бесцветные
- 172. Идентификация Первая идентификация: А, В. Вторая идентификация: В, С, D. А. ИК-спектроскопия. ИК-спектр поглощения субстанции должен
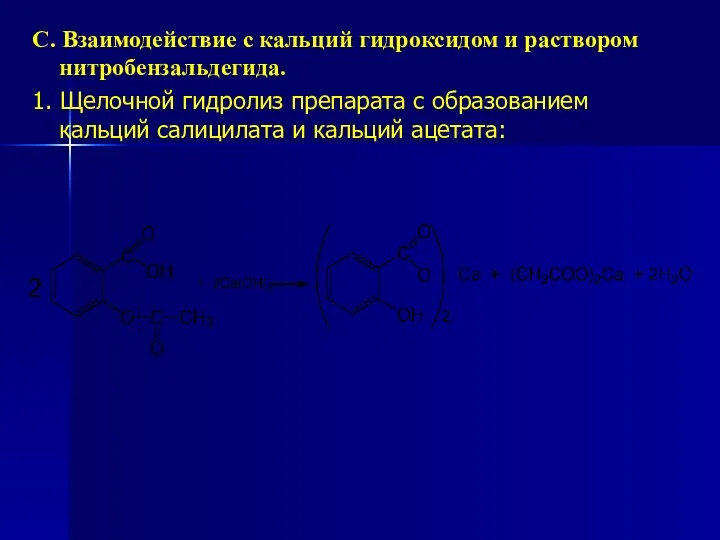
- 173. С. Взаимодействие с кальций гидроксидом и раствором нитробензальдегида. 1. Щелочной гидролиз препарата с образованием кальций салицилата
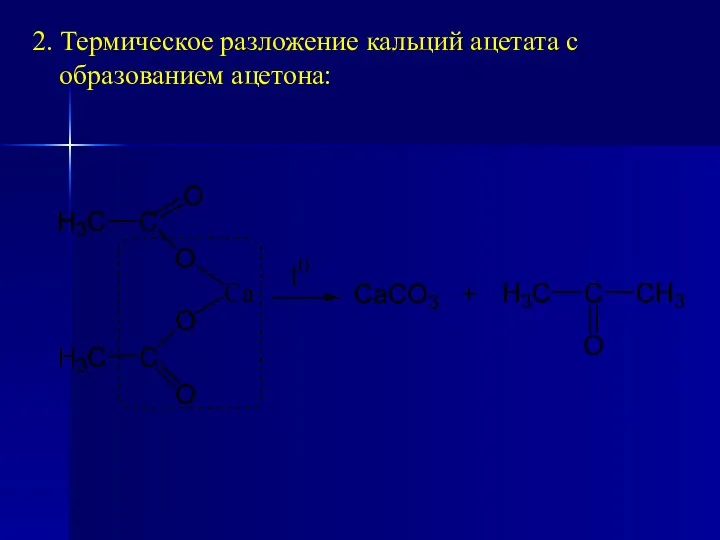
- 174. 2. Термическое разложение кальций ацетата с образованием ацетона:
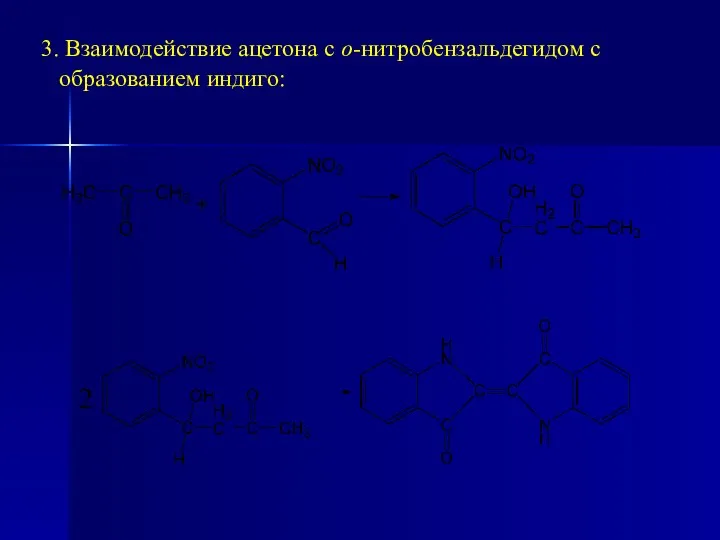
- 175. 3. Взаимодействие ацетона с о-нитробензальдегидом с образованием индиго:
- 176. Количественное определение ГФУ. Ацидиметрия, после омыления спиртового раствора препарата ГФ Х. Алкалиметрия, прямое титрование в среде
- 177. Хранение В плотно укопоренном воздухонепроникном контейнере. При хранении во влажном воздухе препарат имеет острый запах уксуса
- 178. Применение. Противовоспалительное, жаропонижающее, болеутоляющее, противоревматическое средство. В желудке кислота ацетилсалициловая не изменяется, а в кишечнике под
- 179. Противопоказания. Язвенная болезнь желудка и двенадцатиперсной кишки (ульцерогенное действие, возможны желудочные кровотечения), при нарушениях свертываемости крови,
- 180. Применяют кислоту ацетилсалициловую самостоятельно и в сочетании с другими лекарственными средствами. Существует целый ряд готовых лекарственных
- 181. Зарубежные комбинированные лекарственные препараты, в состав которых входит ацетилсалициловая кислота: ”Алька-Зельтцер” (”шипучие таблетки”, содержат еще натрия
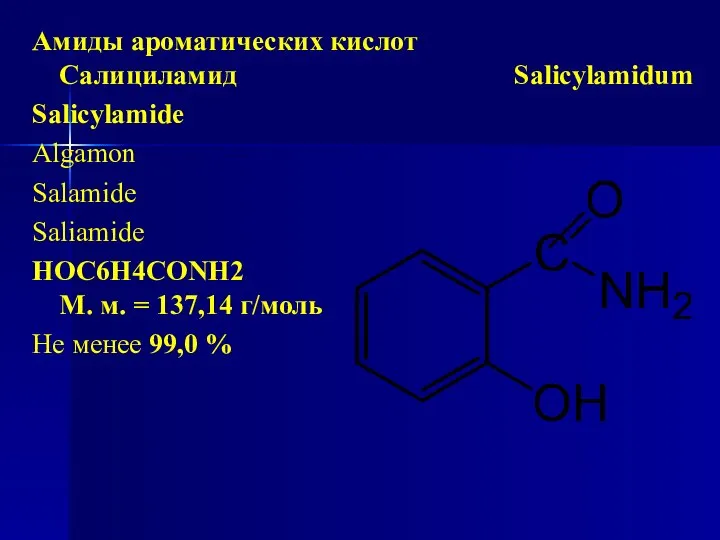
- 182. Амиды ароматических кислот Салициламид Salicylamidum Salicylamidе Algamon Salamide Salіamide НОС6Н4СОNH2 М. м. = 137,14 г/моль Не
- 183. Химическое название: амид салициловой кислоты, салициламид Получение Впервые салициламид получен в 1843 г. действием аммиака на
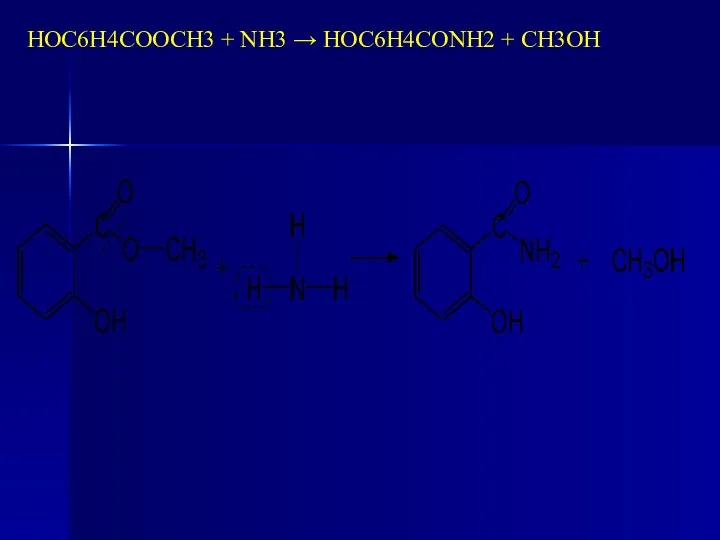
- 184. НОС6Н4СООСН3 + NH3 → НОС6Н4СОNH2 + CH3OH
- 185. Cвойства Описание. Белый кристаллический порошок без запаха. При нагревании сублимирует (возгоняется). Температура плавления 140–142 °С. Растворимость.
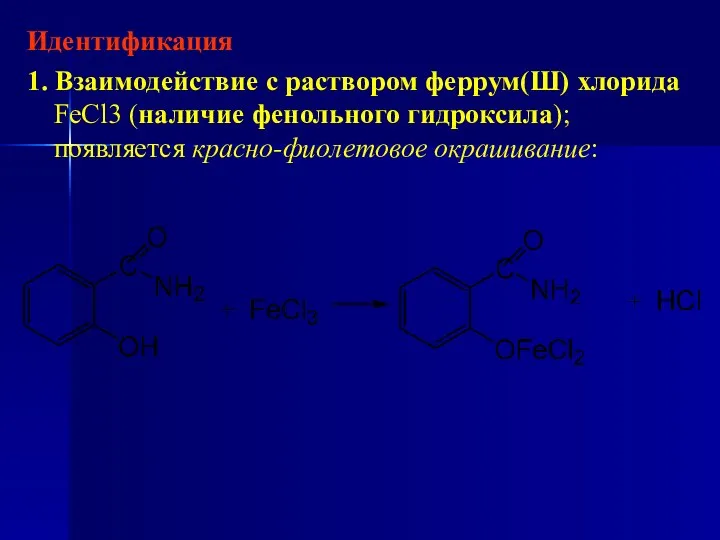
- 186. Идентификация 1. Взаимодействие с раствором феррум(Ш) хлорида FeCl3 (наличие фенольного гидроксила); появляется красно-фиолетовое окрашивание:
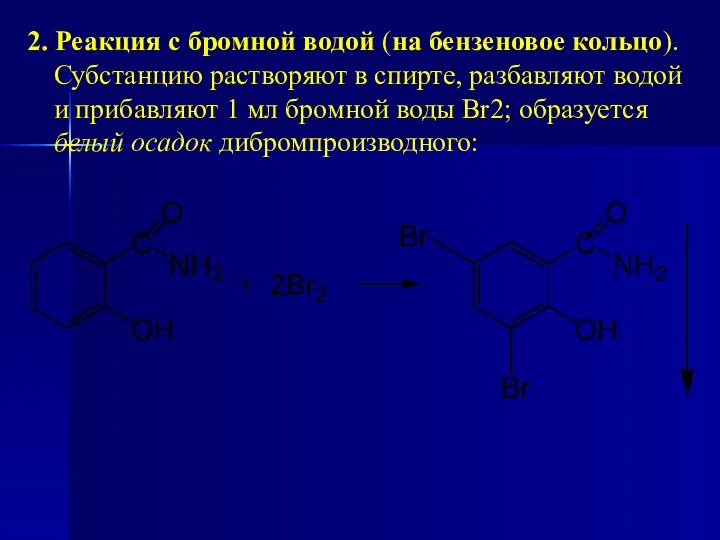
- 187. 2. Реакция с бромной водой (на бензеновое кольцо). Субстанцию растворяют в спирте, разбавляют водой и прибавляют
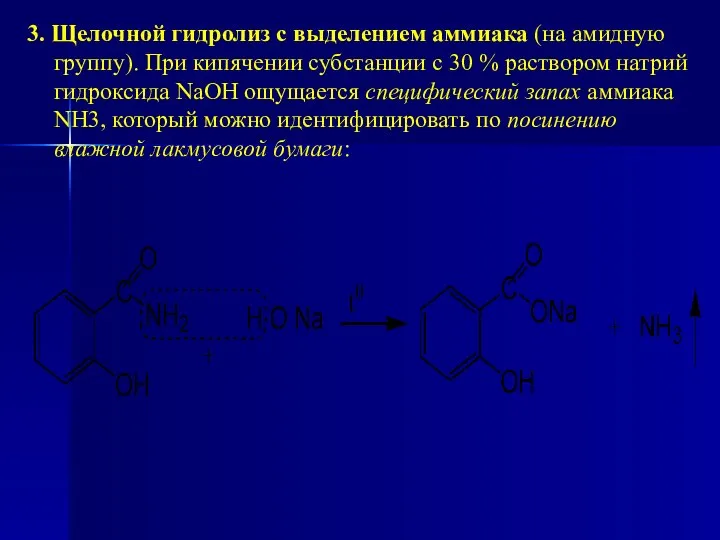
- 188. 3. Щелочной гидролиз с выделением аммиака (на амидную группу). При кипячении субстанции с 30 % раствором
- 189. Количественное определение 1. Модифицированный метод Кьельдаля, устанавливая содержание образующего при щелочном гидролизе аммиака. а) Субстанцию гидролизуют
- 190. Хранение. В хорошо укопоренном контейнере, в защищенном от света месте. Применение. Болеутоляющее, жаропонижающее и противоревматическое средство.
- 191. Назначают внутрь как жаропонижающее и болеутоляющее средство по 0,25–0,5 г 2–3 раза в день. При ревматизме
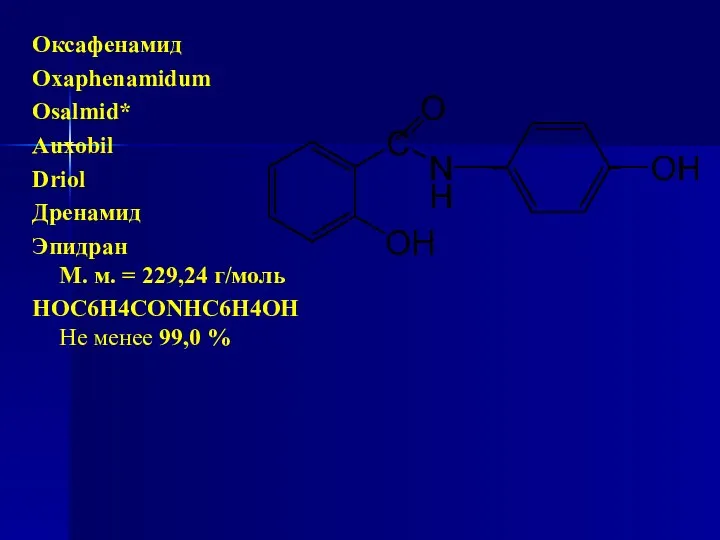
- 192. Оксафенамид Oxaphenamidum Osalmid* Auxobil Driol Дренамид Эпидран М. м. = 229,24 г/моль НОС6Н4СОNHС6Н4ОН Не менее 99,0
- 193. Химическое название: n-Оксифенилсалициламид Получение 1. Сплавление n-аминофенола с фенилсалицилатом: HOC6H4COOC6H5 + H2NC6H4OH = HOC6H4CONHC6H4OH + C6H5OH
- 194. Cвойства Описание. Белый или белый с лиловато-серым оттенком порошок без запаха. Температура плавления 175–178 °С. Растворимость.
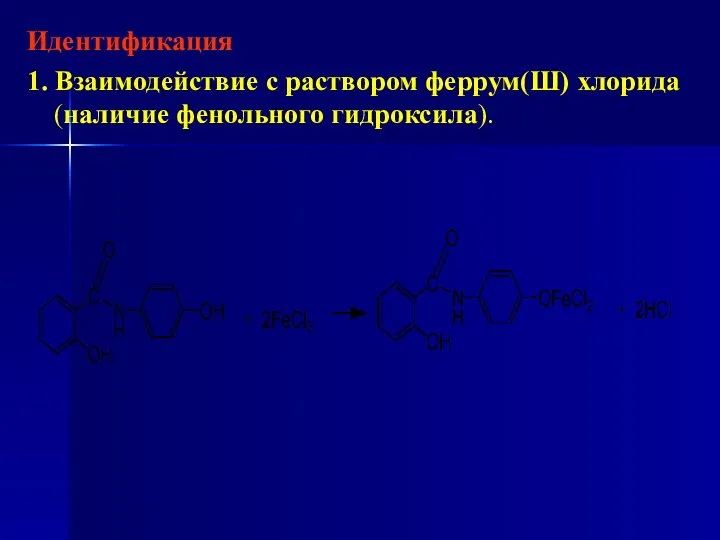
- 195. Идентификация 1. Взаимодействие с раствором феррум(Ш) хлорида (наличие фенольного гидроксила).
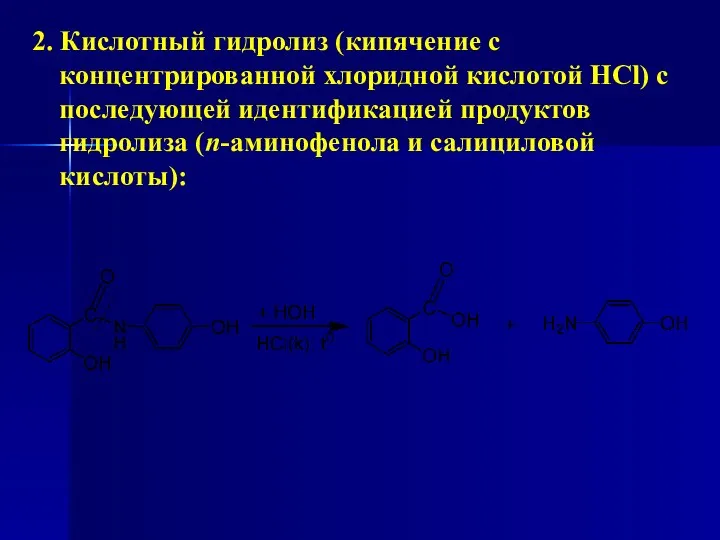
- 196. 2. Кислотный гидролиз (кипячение с концентрированной хлоридной кислотой HCl) с последующей идентификацией продуктов гидролиза (n-аминофенола и
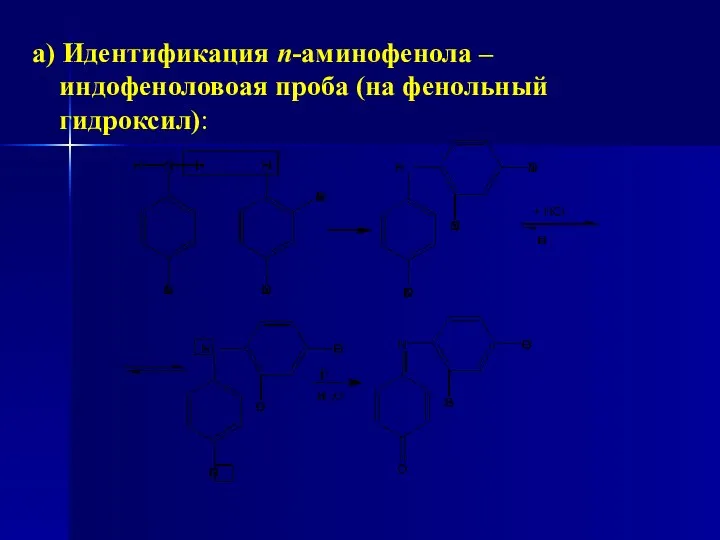
- 197. а) Идентификация n-аминофенола – индофеноловоая проба (на фенольный гидроксил):
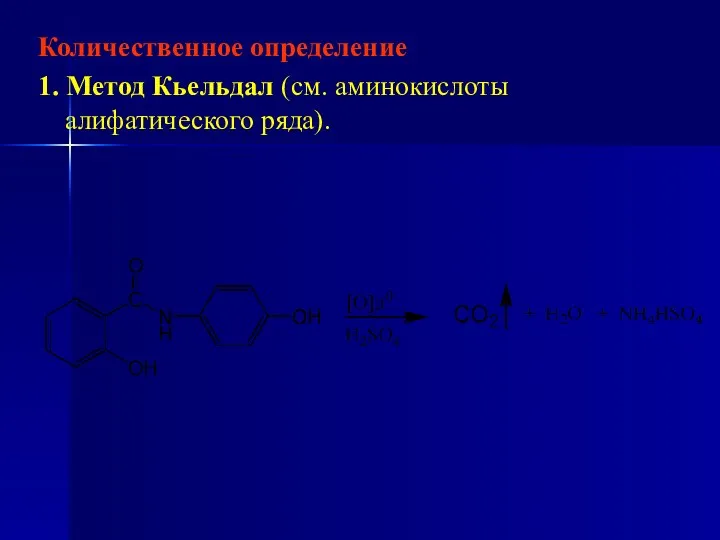
- 198. Количественное определение 1. Метод Кьельдал (см. аминокислоты алифатического ряда).
- 199. б) Прибавляют 30 % раствор щелочи NaOH: NH4HSO4 + NaOH = Na2SO4 + NH3↑ + 2H2O
- 200. Хранение. В хорошо укопоренном контейнере, в защищенном от света месте. Применение. Желчегонное средство. Усиливает образование и
- 201. При острых воспалительных ппроцессах в желчевыводящих путях и желчном пузыре рекомендуется сочетать оксафенамид с антибактериальными препаратами.
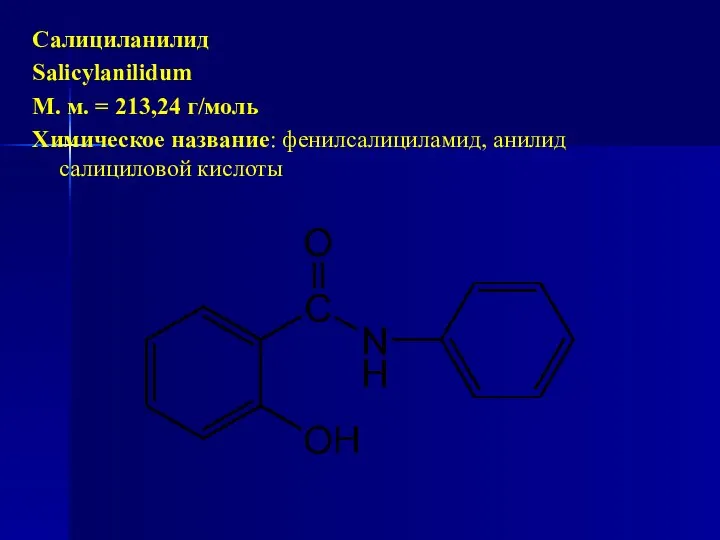
- 202. Салициланилид Salicylanilidum М. м. = 213,24 г/моль Химическое название: фенилсалициламид, анилид салициловой кислоты
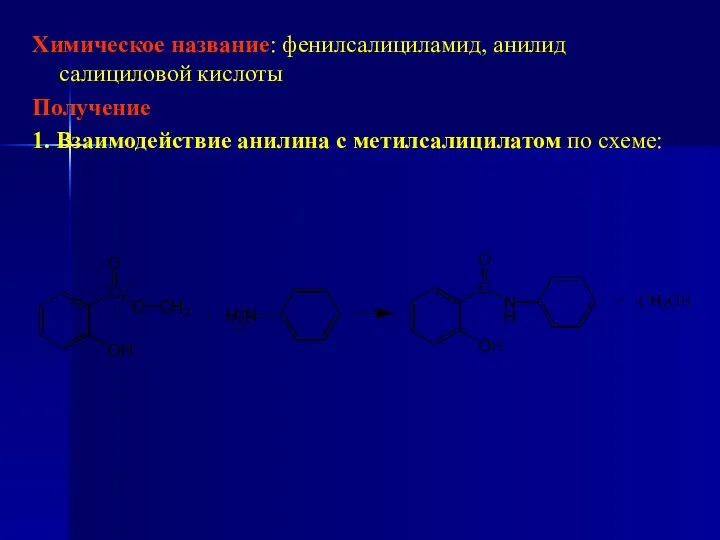
- 203. Химическое название: фенилсалициламид, анилид салициловой кислоты Получение 1. Взаимодействие анилина с метилсалицилатом по схеме:
- 204. Свойства Описание. Белый или желтоватый кристаллический порошок, пекучего вкуса. Температура плавления 134 °С. Растворимость. Нерастворим в
- 205. Производное п-аминофенола Парацетамол Paracetamolum PARACETAMOL* C8H9NO2 М. м. = 151,2 г/моль СН3СОNHC6H4OH Парацетамол содержит не менее
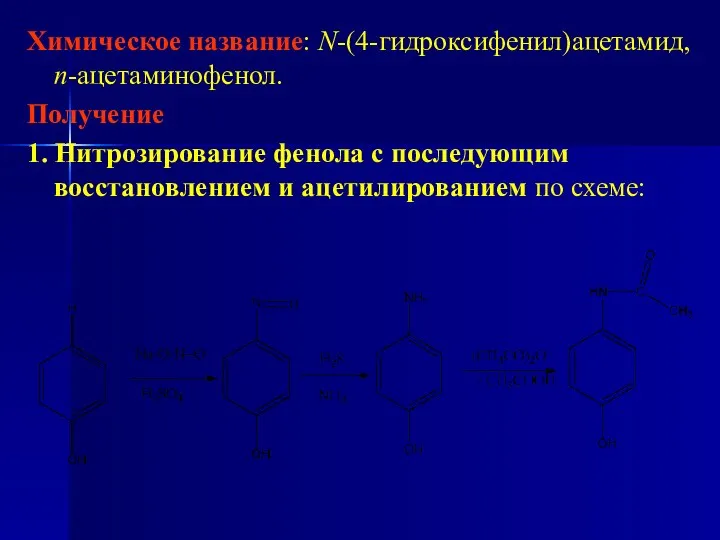
- 206. Химическое название: N-(4-гидроксифенил)ацетамид, п-ацетаминофенол. Получение 1. Нитрозирование фенола с последующим восстановлением и ацетилированием по схеме:
- 207. Свойства Описание. ГФУ. Кристаллический порошок белого цвета. ГФ Х и др. л-ра. Белый или белый с
- 208. Идентификация Первая идентификация: А, С. Вторая идентификация: А, В, D, Е. А. Температура плавления. От 168
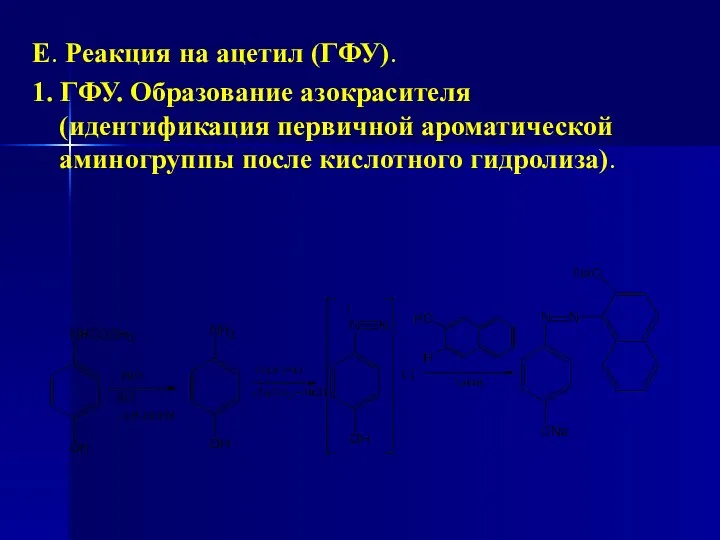
- 210. Е. Реакция на ацетил (ГФУ). 1. ГФУ. Образование азокрасителя (идентификация первичной ароматической аминогруппы после кислотного гидролиза).
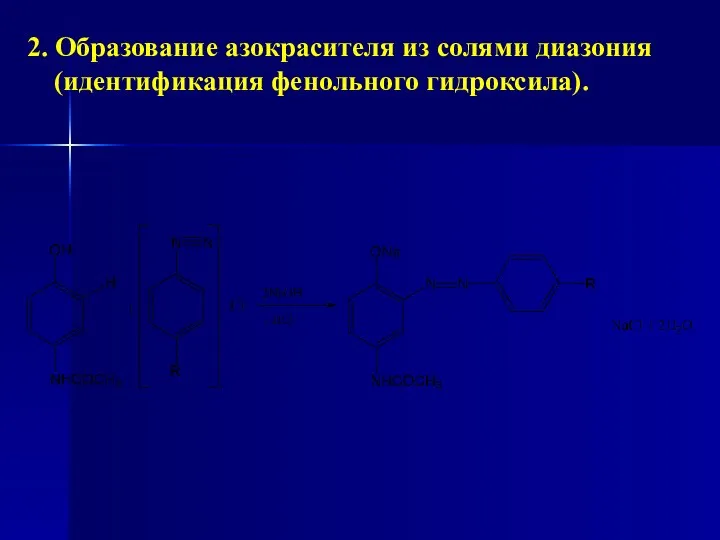
- 211. 2. Образование азокрасителя из солями диазония (идентификация фенольного гидроксила).
- 212. 3. ГФ Х. Взаимодействие с раствором феррум(Ш) хлорида (наличие фенольного гидроксила). появляется сине-фиолетовое окрашивание: СН3СОNHC6H4OH +
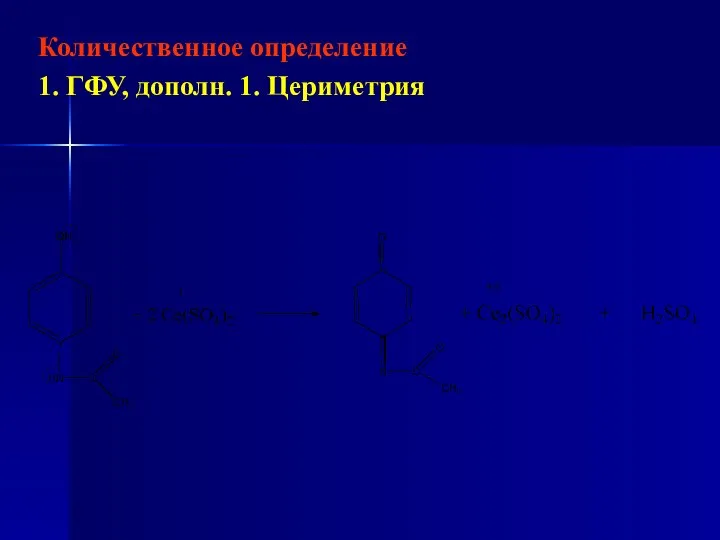
- 213. Количественное определение 1. ГФУ, дополн. 1. Цериметрия
- 214. Хранение. Список сильнодействующих веществ. В плотно укупоренном контейнере, в защищенном от света месте. В. р. д.
- 216. Скачать презентацию










































































































































 Качество и точность импульсных САУ
Качество и точность импульсных САУ Программное обеспечение (ПО)
Программное обеспечение (ПО)  Лекц10 Выд АФК
Лекц10 Выд АФК Проект «Урок фізичної культури через 60 років»
Проект «Урок фізичної культури через 60 років» Культура и поведение
Культура и поведение Стилі мовлення: розмовний, науковий, художній, офіційно-діловий та публіцистичний. Ситуація спілкування
Стилі мовлення: розмовний, науковий, художній, офіційно-діловий та публіцистичний. Ситуація спілкування Вывод данных из оперативной памяти на экран монитора
Вывод данных из оперативной памяти на экран монитора Презентация Системный подход в организационной теории.
Презентация Системный подход в организационной теории.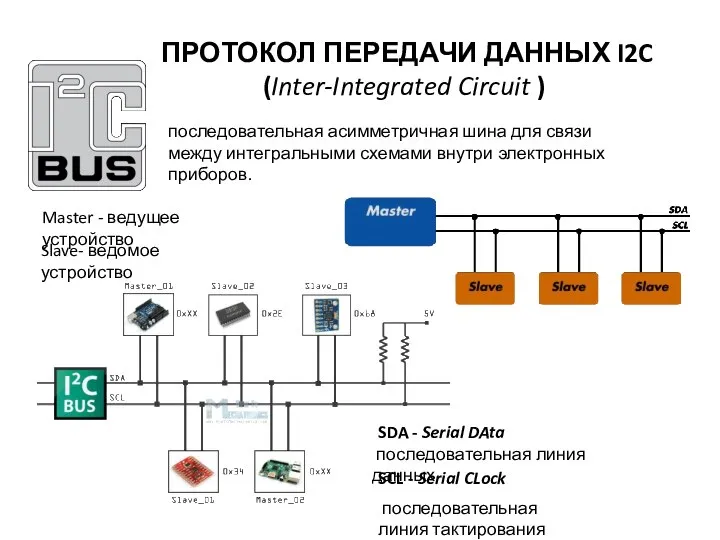 Протокол передачи данных I2C
Протокол передачи данных I2C Рождество. Празднование Рождества
Рождество. Празднование Рождества Oszustwo
Oszustwo 13 занятие_стом.ppt
13 занятие_стом.ppt СПИРТ: ДРУГ ИЛИ ВРАГ ? Применение спиртов. Воздействие алкоголя на организм человека.
СПИРТ: ДРУГ ИЛИ ВРАГ ? Применение спиртов. Воздействие алкоголя на организм человека. Путешествие в страну знаний - презентация для начальной школы
Путешествие в страну знаний - презентация для начальной школы Культура «бунташного века»
Культура «бунташного века» ТАКИЕ РАЗНЫЕ ПТИЦЫ Орлова Галина Александровна учитель МОУ СОШ №1 г. Данилов Ярославская область
ТАКИЕ РАЗНЫЕ ПТИЦЫ Орлова Галина Александровна учитель МОУ СОШ №1 г. Данилов Ярославская область Спектрально-корреляционный анализ детерминированных сигналов в инфотелекоммуникации
Спектрально-корреляционный анализ детерминированных сигналов в инфотелекоммуникации Презентация "Покупательское поведение на рынках" - скачать презентации по Экономике
Презентация "Покупательское поведение на рынках" - скачать презентации по Экономике TIPY_ORGANIZATsIONNYKh_KUL_TUR
TIPY_ORGANIZATsIONNYKh_KUL_TUR Служба метрологического контроля
Служба метрологического контроля Выявление причин не включения компрессора на одной из секции электропоезда ЭТ2М
Выявление причин не включения компрессора на одной из секции электропоезда ЭТ2М Троица - Зелёные Святки
Троица - Зелёные Святки Культура і цивілізація
Культура і цивілізація Немецкая классическая философия
Немецкая классическая философия Словесные забавы
Словесные забавы Political system of society. Ethnopolitics and international relationships. (Lecture 4)
Political system of society. Ethnopolitics and international relationships. (Lecture 4) Конституционные основы формы правления в зарубежных странах
Конституционные основы формы правления в зарубежных странах Кто же такой Дед Мороз? Выполнила ученица 3 «б» класса МОУ гимназии №3 города Ставрополя Николенко Анастасия. Руководитель: Спев
Кто же такой Дед Мороз? Выполнила ученица 3 «б» класса МОУ гимназии №3 города Ставрополя Николенко Анастасия. Руководитель: Спев