Содержание
- 2. S-образная кривая зависимости скорости реакции от концентрации субстрата Арчибальд Хилл 1886-1977 Английский физиолог Нобелевская премия по
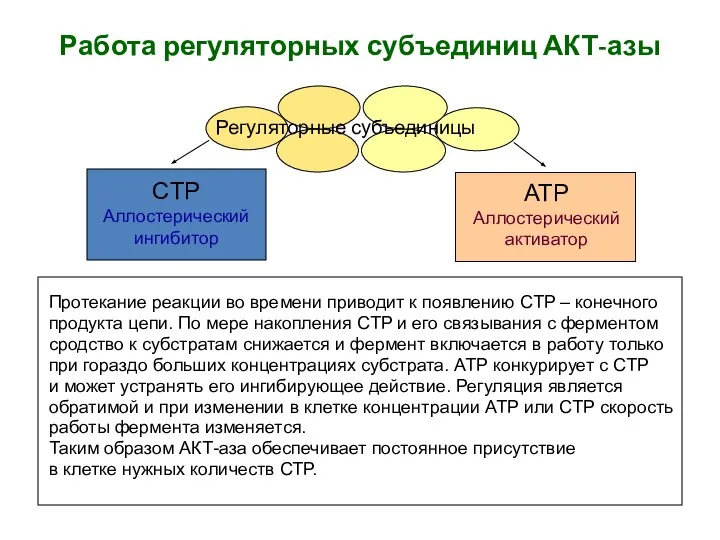
- 3. Работа регуляторных субъединиц АКТ-азы Протекание реакции во времени приводит к появлению СTP – конечного продукта цепи.
- 4. Кооперативное связывание Аллостерические ферменты обладают свойством кооперативности: взаимодействие эффектора с аллостерическим центром вызывает последовательное кооперативное изменение
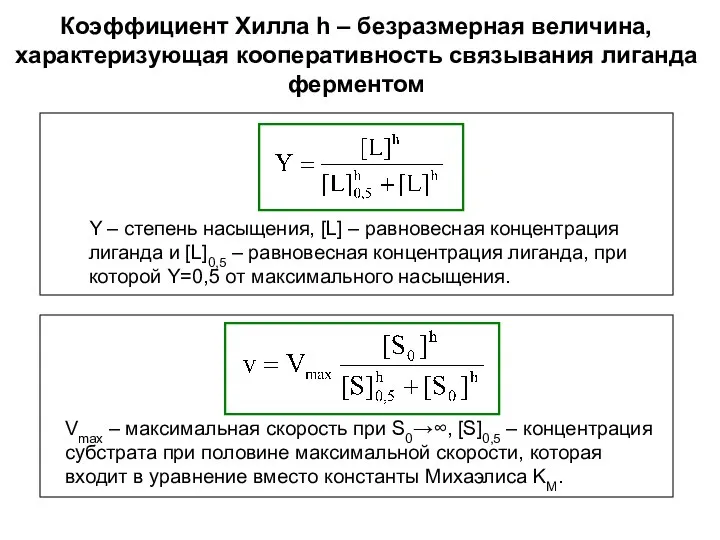
- 5. Коэффициент Хилла h – безразмерная величина, характеризующая кооперативность связывания лиганда ферментом Y – степень насыщения, [L]
- 6. Графическое определение коэффициента Хилла lg(v/( Vmax-v)) = h lg[S0] – h lg[S]0,5
- 7. Для изостерических ферментов, у которых кооперативного взаимодействия между активными центрами нет, то есть сродство фермента к
- 8. Особенности строения и функционирования аллостерических ферментов: - обычно это олигомерные белки, состоящие из нескольких протомеров (субъединиц);
- 9. - аллостерические ферменты обладают свойством кооперативности; - регуляция аллостерических ферментов обратима: отсоединение эффектора от регуляторной субъединицы
- 10. Эффект кооперативности: Присоединение первой молекулы соответствующего лиганда (субстрата к активному центру или эффектора к аллостерическому центру)
- 11. Кооперативные эффекты подразделяют на гомотропные и гетеротропные. Гомотропные эффекты, при которых взаимодействия с лигандами могут быть
- 13. Скачать презентацию


![Графическое определение коэффициента Хилла lg(v/( Vmax-v)) = h lg[S0] – h lg[S]0,5](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1305299/slide-5.jpg)





 Культура Ислама
Культура Ислама Завод - презентация для начальной школы_
Завод - презентация для начальной школы_ Ременные передачи
Ременные передачи Aztec
Aztec Презентация сайта НБ АГТУ+ЭБС
Презентация сайта НБ АГТУ+ЭБС Международное движение капитала Движение за границу и его функционирование там.
Международное движение капитала Движение за границу и его функционирование там. США. Административно-территориальное устройство
США. Административно-территориальное устройство ГОРНЫЕ ПОРОДЫ
ГОРНЫЕ ПОРОДЫ  Линейная функция Урок обобщающего повторения
Линейная функция Урок обобщающего повторения  Степенная функция - презентация по Алгебре_
Степенная функция - презентация по Алгебре_ Симметрия – основа гармонии в архитектуре. Работа учениц 8 класса ГОУ СОШ № 1190 Макушкиной М., Селиверстовой Ю.
Симметрия – основа гармонии в архитектуре. Работа учениц 8 класса ГОУ СОШ № 1190 Макушкиной М., Селиверстовой Ю. Усадьба Остафьево
Усадьба Остафьево Религия как одна из форм культуры
Религия как одна из форм культуры Машины для земляных работ
Машины для земляных работ Циркуляция
Циркуляция Функции и массивы в PHP. (Лекция 11)
Функции и массивы в PHP. (Лекция 11) Производство домокомплектов
Производство домокомплектов Радиолокационные системы
Радиолокационные системы ПРОФЕССИОНАЛЬНАЯ КОМПЕТЕНТНОСТЬ МЕНЕДЖЕРА ОБРАЗОВАНИЯ
ПРОФЕССИОНАЛЬНАЯ КОМПЕТЕНТНОСТЬ МЕНЕДЖЕРА ОБРАЗОВАНИЯ Light athletics
Light athletics Мода Франции XVI века
Мода Франции XVI века Застосування права
Застосування права Main trends of international cooperation in combating сrimes
Main trends of international cooperation in combating сrimes Жан Огюст Доминик Энгр - французский живописец
Жан Огюст Доминик Энгр - французский живописец Внешние запоминающиеся устройства
Внешние запоминающиеся устройства Природа России Автор: Зудина Н.Ф. ГОУ СОШ №337 г. Санкт-Петербург учитель начальных классов Урок по предмету «Окружа
Природа России Автор: Зудина Н.Ф. ГОУ СОШ №337 г. Санкт-Петербург учитель начальных классов Урок по предмету «Окружа Аттестационная работа. Величием своей судьбы Москва гордиться вправе
Аттестационная работа. Величием своей судьбы Москва гордиться вправе Религии
Религии