Содержание
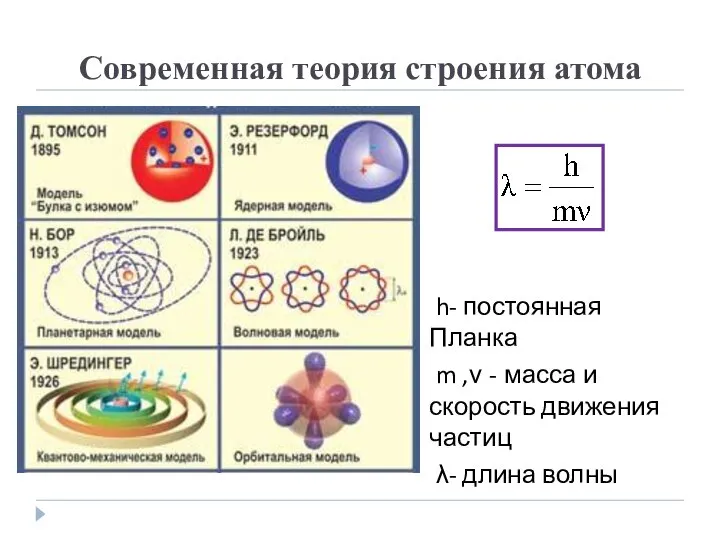
- 2. Современная теория строения атома h- постоянная Планка m ,ν - масса и скорость движения частиц λ-
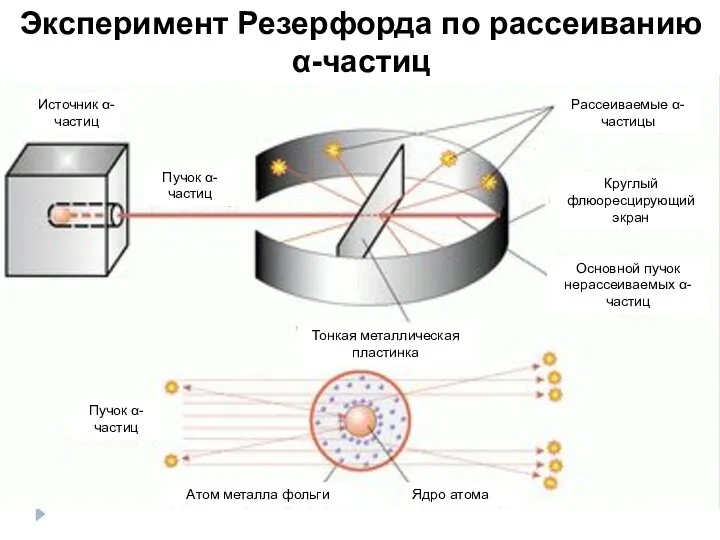
- 3. Эксперимент Резерфорда по рассеиванию α-частиц
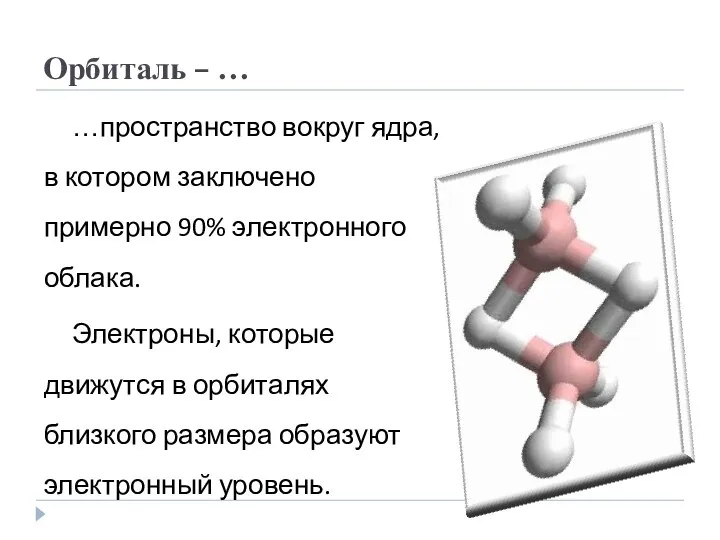
- 4. Орбиталь – … …пространство вокруг ядра, в котором заключено примерно 90% электронного облака. Электроны, которые движутся
- 5. Квантовые числа Главное квантовое число n характеризует энергию электронов определенного уровня и принимает значение положительных чисел
- 6. Квантовые числа Побочное (орбиальное) квантовое число - величина, отражающая различия в энергетическом состоянии электронов различных подуровней.
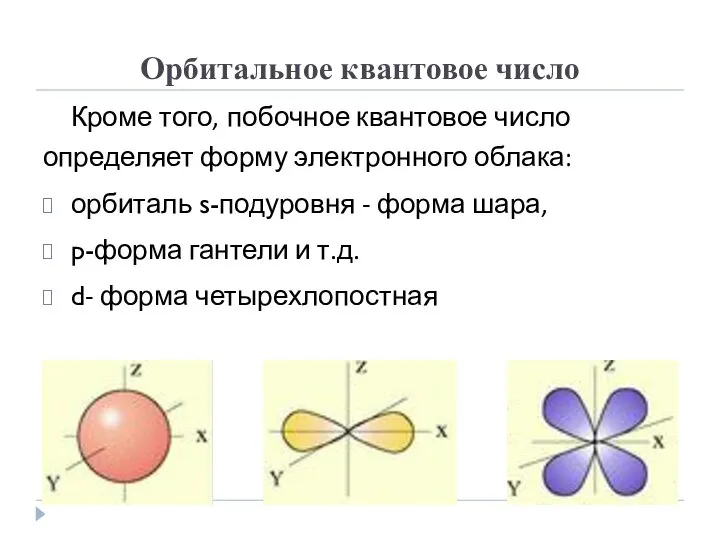
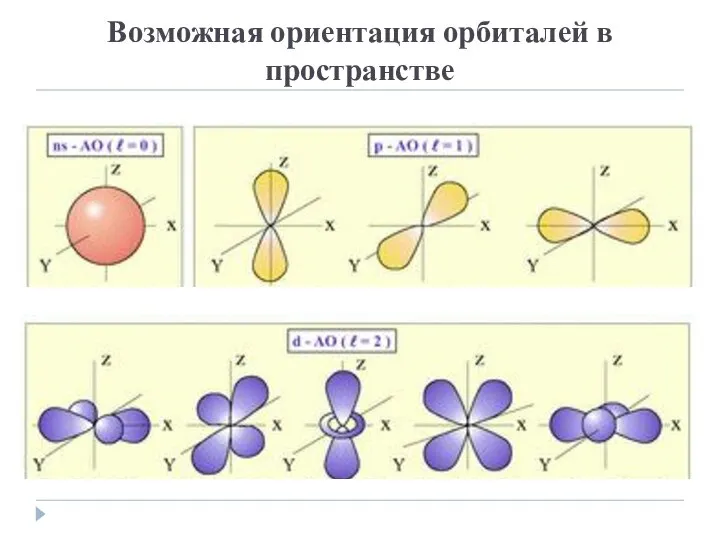
- 7. Орбитальное квантовое число Кроме того, побочное квантовое число определяет форму электронного облака: орбиталь s-подуровня - форма
- 8. Примеры энергетических уровней n = 1, ℓ = 0 – s орбиталь; n = 2, ℓ
- 9. Обозначение свободных орбиталей s орбиталь p орбиталь d орбиталь f орбиталь
- 10. Возможная ориентация орбиталей в пространстве
- 11. Магнитное квантовое число Ориентация орбиталей в пространстве характеризуется магнитным квантовым числом ml, поэтому количество орбиталей одного
- 12. Значения квантовых чисел n = 1, ℓ = 0 – s орбиталь n = 2, ℓ
- 13. Спиновое квантовое число ms Число ms характеризует собственный момент количества движения электрона, получивший название спин, и
- 14. Принцип минимума энергии ē в невозбужденном атоме распределяются по энергетическим уровням и подуровням так, чтобы их
- 15. Порядок заполнения атомных орбиталей электронами Таким образом, при записи электронной конфигурации необходимо учитывать последовательность заполнения электронами
- 16. Принцип Паули В атоме не может быть двух электронов с одинаковым набором значений всех четырех квантовых
- 17. Принцип Паули Общее число электронов на заполненных уровнях (1,2,3,4)соответствует формуле: Xn=2n2 n- номер рассматриваемого уровня 16S
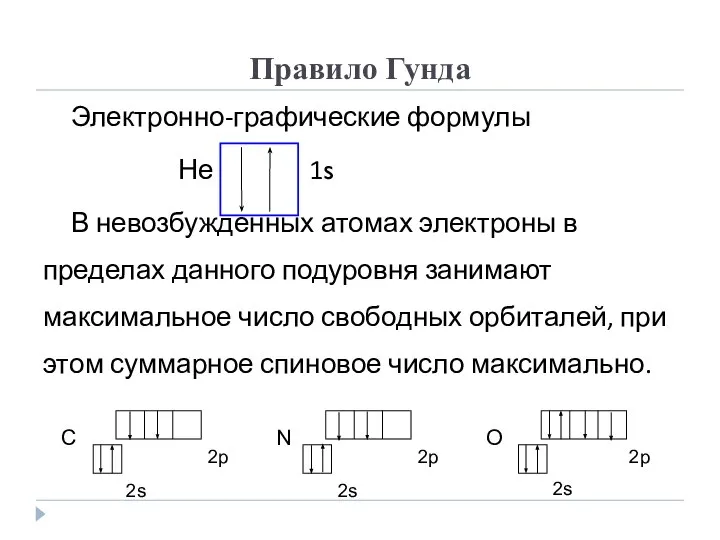
- 18. Правило Гунда Электронно-графические формулы Не 1s В невозбужденных атомах электроны в пределах данного подуровня занимают максимальное
- 19. Электронно-графические формулы 33As ) ) ) ) 2 8 18 5
- 21. Скачать презентацию












 Презентация Ереси - религиозные учения
Презентация Ереси - религиозные учения System Partyjny Wielkiej Brytanii
System Partyjny Wielkiej Brytanii Презентация Легисакционный процесс
Презентация Легисакционный процесс Геохимия ландшафтной оболочки
Геохимия ландшафтной оболочки Условия для создания образовательной среды для взрослых на приходе
Условия для создания образовательной среды для взрослых на приходе Презентация "Монастырь" - скачать презентации по МХК
Презентация "Монастырь" - скачать презентации по МХК Теория принятия решений принятие оптимальных решений методами динамического программирования
Теория принятия решений принятие оптимальных решений методами динамического программирования Arrays Loops. Java Core
Arrays Loops. Java Core Праздники. Все популярные праздники
Праздники. Все популярные праздники Смазочно-охлаждающие жидкости (СОЖ)
Смазочно-охлаждающие жидкости (СОЖ) Принцип относительности Галилея и электромагнитные явления
Принцип относительности Галилея и электромагнитные явления Измерители параметров движения корпуса судна
Измерители параметров движения корпуса судна ПРОМЫВКА СКВАЖИНЫ
ПРОМЫВКА СКВАЖИНЫ  Определение метода
Определение метода  Особенности проектирования разработки газоконденсатного месторождения
Особенности проектирования разработки газоконденсатного месторождения Архивное дело за рубежом
Архивное дело за рубежом Политическое лидерство и политическая идеология. Политическая культура
Политическое лидерство и политическая идеология. Политическая культура Услуги по защите окружающей среды Выполнила студентка ФТД-4 группа Т-103 Лепичева Наталия
Услуги по защите окружающей среды Выполнила студентка ФТД-4 группа Т-103 Лепичева Наталия Презентация Специальная таможенная процедура
Презентация Специальная таможенная процедура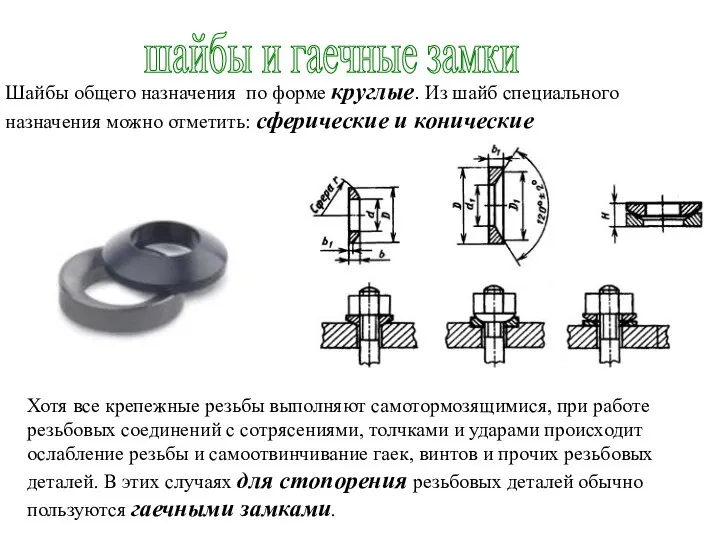 Шайбы и гаечные замки
Шайбы и гаечные замки Биоэнергетика мышечной деятельности в фехтовании
Биоэнергетика мышечной деятельности в фехтовании Презентация_____
Презентация_____ трихинеллез токсакароз
трихинеллез токсакароз Урок №31 (112) Тест «Единицы длины»
Урок №31 (112) Тест «Единицы длины»  Военная прокуратура и система ее органов. Понятие правосудия и его отличительные признаки
Военная прокуратура и система ее органов. Понятие правосудия и его отличительные признаки Ведение проектной документации IT- специалистами Слова улетают, написанное остается Денис Тучин i-Sys Денис Тучин i-Sys Международная о
Ведение проектной документации IT- специалистами Слова улетают, написанное остается Денис Тучин i-Sys Денис Тучин i-Sys Международная о Первая медицинская помощь при утоплении
Первая медицинская помощь при утоплении Подходы и соотношение понятий «контроль» и «надзор» Выполнила студентка группы Э091
Подходы и соотношение понятий «контроль» и «надзор» Выполнила студентка группы Э091