Содержание
- 2. Теория электролитической диссоциации Аррениуса – 1880 г. Основные положения теории Аррениуса Электролиты при растворении в воде
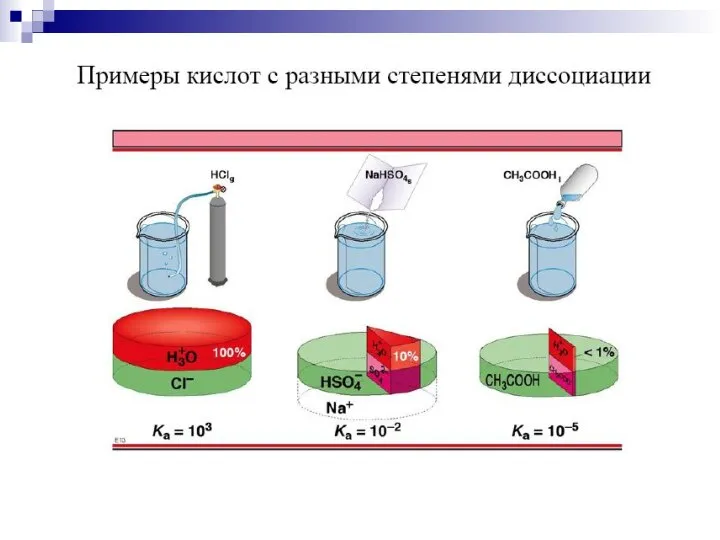
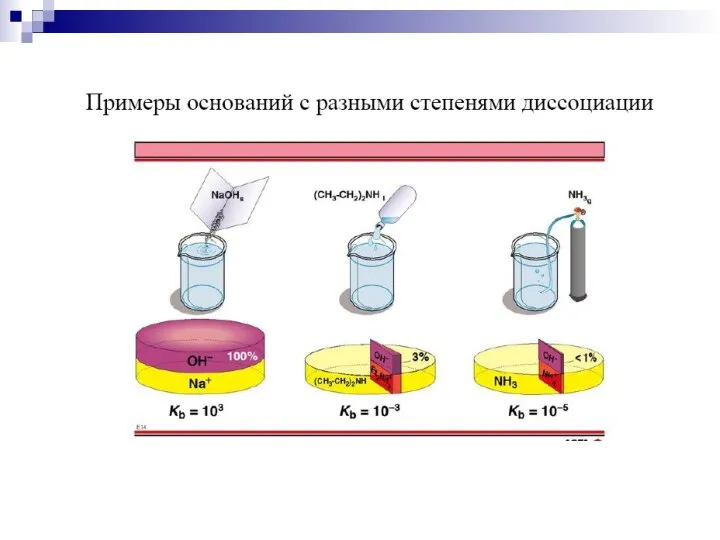
- 3. 1. Кислота – вещество, дающее в растворе ионы водорода. HCl H+ + Cl- Основание – вещество,
- 6. 3. СН3СООН СН3СОО- + Н+ В общем виде для кислоты НА: НА Н+ + А- Для
- 7. Недостатки теории Аррениуса: а) не объясняла причину диссоциации электролитов на ионы; б) роль растворителя при диссоциации
- 8. Электронная теория Льюиса Электронная теория Льюиса Кислота − акцептор электронной пары. Основание − донор электронной пары.
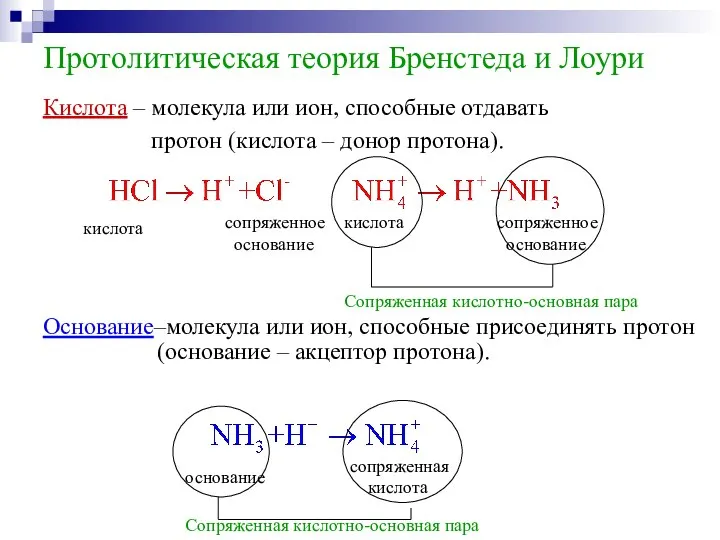
- 9. Протолитическая теория Бренстеда и Лоури Кислота – молекула или ион, способные отдавать протон (кислота – донор
- 10. Типы протолитических реакций 1.Реакции ионизации Н2CО3 + H2O ↔ НCО3- + H3O+ Константа кислотности (Ка) и
- 11. Автопротолиз воды. H2O + H2O H3O+ + OH- [H3O+] = [OH-] = 10-7; [H3O+] > [OH-];
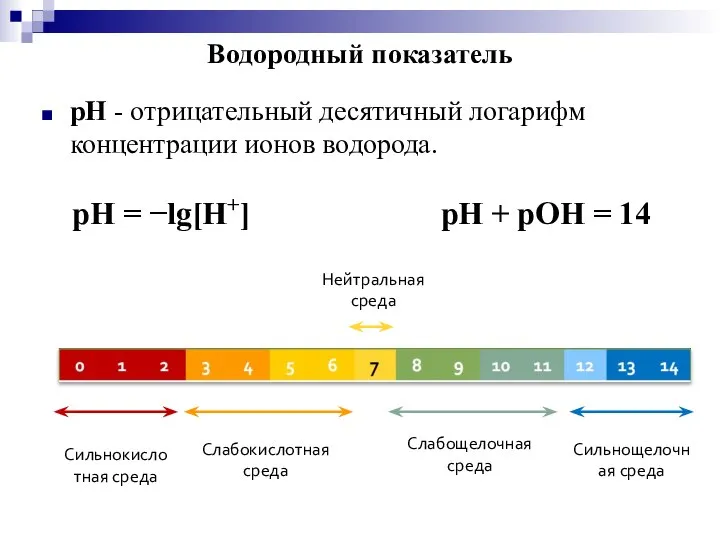
- 12. Сильнокислотная среда Слабокислотная среда Нейтральная среда Слабощелочная среда Сильнощелочная среда Водородный показатель pH - отрицательный десятичный
- 13. 3. Реакции нейтрализации HCl + OH- Cl- + H2O 4. Реакции гидролиза гидролиз по катиону –
- 15. Скачать презентацию






![Автопротолиз воды. H2O + H2O H3O+ + OH- [H3O+] = [OH-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1291555/slide-10.jpg)

 L2_MAP_2019
L2_MAP_2019 Методы точечного оценивания
Методы точечного оценивания  Урок по алгебре в 9 классе Числовые последовательности
Урок по алгебре в 9 классе Числовые последовательности  Русская духовная музыка в храмовом синтезе искусств
Русская духовная музыка в храмовом синтезе искусств a Метрология, статметоды случайная погрешность
a Метрология, статметоды случайная погрешность Моделирование на UML. Моделирование структуры. Лекция 4
Моделирование на UML. Моделирование структуры. Лекция 4 Глава 5. Экономика мира 34. Россия в международной экономике
Глава 5. Экономика мира 34. Россия в международной экономике Спортивные танцы на колясках
Спортивные танцы на колясках Игра «Угадай-ка!»
Игра «Угадай-ка!» Хімічні властивості деревини і кори. Елементний склад. Вміст основних органічних речовин
Хімічні властивості деревини і кори. Елементний склад. Вміст основних органічних речовин Актуальні питання дослідження гендерної лінгвістики
Актуальні питання дослідження гендерної лінгвістики Методы защиты человека
Методы защиты человека тест5tp1
тест5tp1 Малькова Инна Николаевна учитель истории и обществознания МКОУ Барсовская ООШ
Малькова Инна Николаевна учитель истории и обществознания МКОУ Барсовская ООШ Понятие безработицы. Типы и причины ее возникновения Составитель Гультяева Л.И.
Понятие безработицы. Типы и причины ее возникновения Составитель Гультяева Л.И. Монтаж гидроагрегата. Монтаж гидротурбины
Монтаж гидроагрегата. Монтаж гидротурбины DVB
DVB Презентация "Мировая торговля" - скачать презентации по Экономике
Презентация "Мировая торговля" - скачать презентации по Экономике Огибающая, фаза и частота
Огибающая, фаза и частота Основные этапы проведения статистического наблюдения
Основные этапы проведения статистического наблюдения История зимних Олимпийских игр
История зимних Олимпийских игр Одномерные массивы
Одномерные массивы Концепции современного естествознания
Концепции современного естествознания Политическая система США
Политическая система США Декоративно-прикладное искусство
Декоративно-прикладное искусство ВИПКРО Кафедра педагогического менеджмента Курс «Введение в должность» Курсовой проект СОЦИАЛЬНАЯ КОМПЕТЕНТНОСТЬ ПОДРОСТКА: П
ВИПКРО Кафедра педагогического менеджмента Курс «Введение в должность» Курсовой проект СОЦИАЛЬНАЯ КОМПЕТЕНТНОСТЬ ПОДРОСТКА: П Программа КриптоПро
Программа КриптоПро Теколит лучше Велокс - миф или реальность
Теколит лучше Велокс - миф или реальность