Содержание
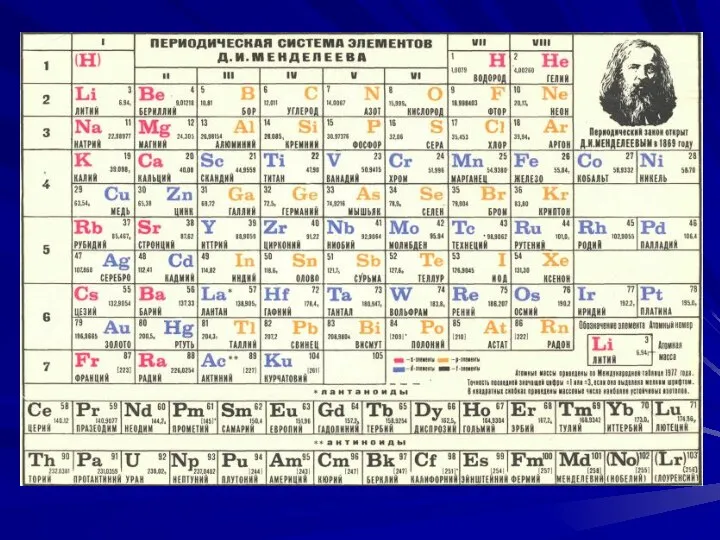
- 3. В 1869г. Д. И. Менделеевым был открыт периодический закон и построена периодическая система элементов, объяснение которой
- 4. 2) Принцип Паули: В атоме может существо-вать только один электрон в состоянии, характеризуемом данными значениями четырех
- 5. Совокупность электронов, обладающих одина-ковым главным квантовым числом образует слой. Слои имеют названия : Совокупность электронов, имеющих
- 6. Принцип Паули ограничивает число электронов на той или иной электронной оболочке. Дейст-вительно, электроны в невозбужденном атоме
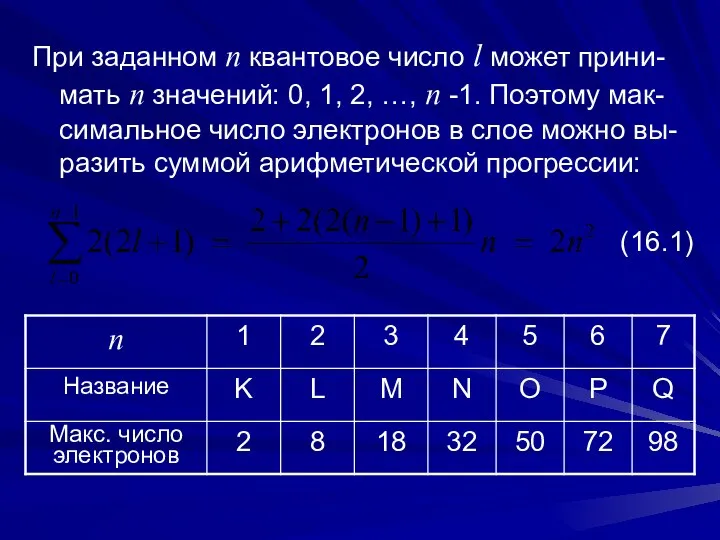
- 7. Установим теперь, сколько электронов может находится на оболочке и в атоме. Т.к. число ms может иметь
- 8. При заданном n квантовое число l может прини-мать n значений: 0, 1, 2, …, n -1.
- 9. Конфигурация электронных оболочек атомов за-писывается с помощью следующих обозначе-ний. Каждая оболочка обозначается соответст-вующим n и буквой,
- 10. Итак, принцип Паули дает следующую картину построения электронной оболочки атомов. Каж-дый вновь присоединяемый электрон связыва-ется в
- 11. Например, 19-ый электрон калия должен (соглас-но идеальной схеме) находиться в 3d-оболоч-ке. Однако химические и спектроскопические данные
- 12. По этой же причине 20-ый электрон кальция тоже присоединяется в 4s-состояние, а нормальное за- полнение 3d-оболочки
- 14. Скачать презентацию









 Политическое лидерство - сущность, типы, основные функции
Политическое лидерство - сущность, типы, основные функции Презентация на тему "Развитие мелкой моторики" - скачать презентации по Педагогике
Презентация на тему "Развитие мелкой моторики" - скачать презентации по Педагогике Lektsia_6_Krivye_vtorogo_poryadka
Lektsia_6_Krivye_vtorogo_poryadka Страхование ІСО и криптовалют
Страхование ІСО и криптовалют Галактики
Галактики 1 сентября – День Знаний. Первый раз в первый класс.
1 сентября – День Знаний. Первый раз в первый класс. Традиционный японский дом
Традиционный японский дом Презентация "ТIS-Рабочее время. Пользовательский функционал." - скачать презентации по Экономике
Презентация "ТIS-Рабочее время. Пользовательский функционал." - скачать презентации по Экономике КРАСОТА что это? Погонцева Д.В. ©
КРАСОТА что это? Погонцева Д.В. © Тестирование аэробной мощности у спортсменов
Тестирование аэробной мощности у спортсменов Презентация на тему "Предметно-развивающая среда" - скачать презентации по Педагогике
Презентация на тему "Предметно-развивающая среда" - скачать презентации по Педагогике БИЗНЕС ПЛАН – ОСНОВА СОЗДАНИЯ ФИРМЫ Выполнила: ученица 11 класса «А» ГОУ ЦО № 1484 им. А.М. Горького САРЫЧЕВА АННА
БИЗНЕС ПЛАН – ОСНОВА СОЗДАНИЯ ФИРМЫ Выполнила: ученица 11 класса «А» ГОУ ЦО № 1484 им. А.М. Горького САРЫЧЕВА АННА  По следам исчезнувшей деревни
По следам исчезнувшей деревни Культура и религия древнего Египта
Культура и религия древнего Египта Турецкий язык Türkçe. Урок № 2. Притяжательные местоимения в турецком языке
Турецкий язык Türkçe. Урок № 2. Притяжательные местоимения в турецком языке Политические системы современности. Политические режимы
Политические системы современности. Политические режимы Народы и религии
Народы и религии L’image des français dans le monde
L’image des français dans le monde Сценарное планирование в современном стратегическом менеджменте
Сценарное планирование в современном стратегическом менеджменте Артикуляционный отдел
Артикуляционный отдел  Автор Дудова Любовь Анатольевна Учитель начальных классов ГОУ № 246 Приморского района Санкт-Петербурга
Автор Дудова Любовь Анатольевна Учитель начальных классов ГОУ № 246 Приморского района Санкт-Петербурга Номенклатура конфиденциальных дел
Номенклатура конфиденциальных дел Клод Моне «Клод Моне читает газету» Ренуар. 1872
Клод Моне «Клод Моне читает газету» Ренуар. 1872  Сотворение мира
Сотворение мира  Практика выполнения постановления 242П. Обеспечение непрерывности деятельности Банка на примере проекта. Мария Акатьева – дире
Практика выполнения постановления 242П. Обеспечение непрерывности деятельности Банка на примере проекта. Мария Акатьева – дире Национальный костюм
Национальный костюм Презентация "Финансовый Форум ММВБ" - скачать презентации по Экономике
Презентация "Финансовый Форум ММВБ" - скачать презентации по Экономике Здоровы ли мы?
Здоровы ли мы?