Содержание
- 2. Энзимология – наука о ферментах Фермент – биологический катализатор белковой природы. Энзимология появилась на стыке химической,
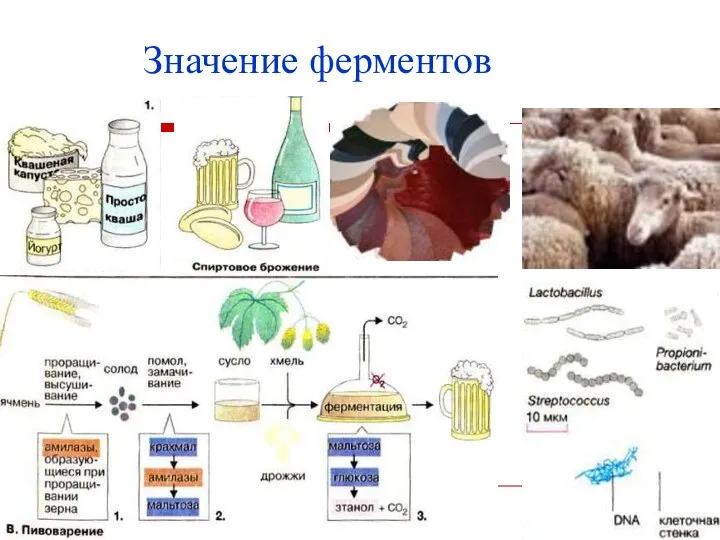
- 3. Значение ферментов любые химические превращения веществ в организме происходят при участии ферментов, практическое применение ферментов во
- 4. Значение ферментов
- 5. Инженерная энзимология Иммобилизованная β-галактозидаза, присоединённая к магнитному стержню-мешалке, используется для снижения содержания молочного сахара в молоке,
- 6. История развития энзимологии Появилась энзимология в 1814 году, когда Кирхгоф показал, что в вытяжке из проросшего
- 7. Доказательства белковой природы ферментов все выделенные ферменты – белки, методы получение ферментов и белков одинаковы, факторы,
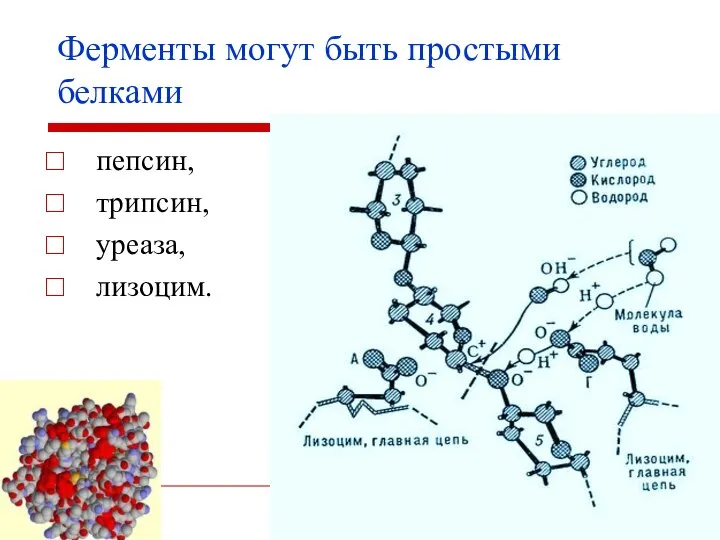
- 8. Ферменты могут быть простыми белками пепсин, трипсин, уреаза, лизоцим.
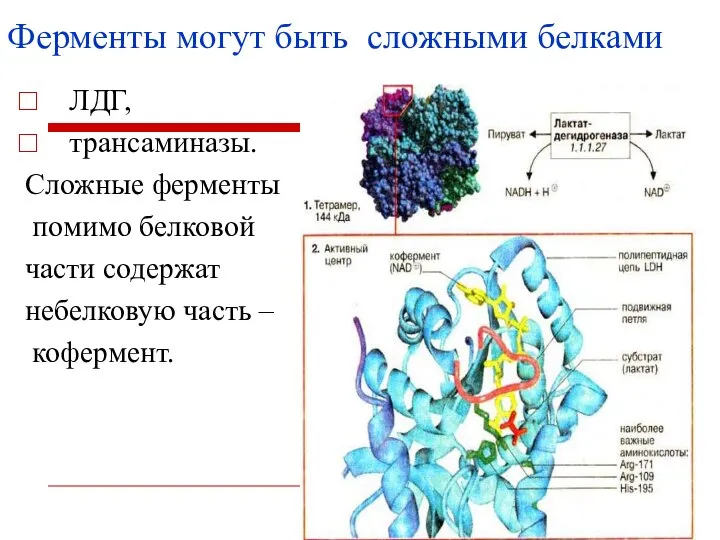
- 9. ЛДГ, трансаминазы. Сложные ферменты помимо белковой части содержат небелковую часть – кофермент. Ферменты могут быть сложными
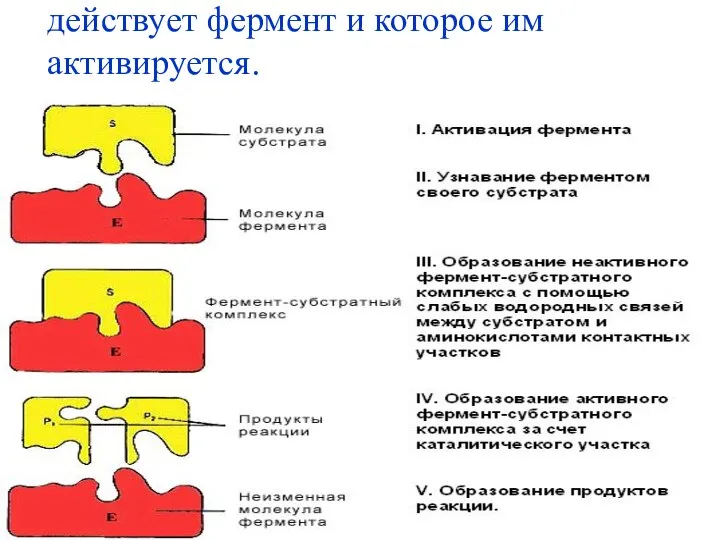
- 10. Субстрат – вещество, на которое действует фермент и которое им активируется.
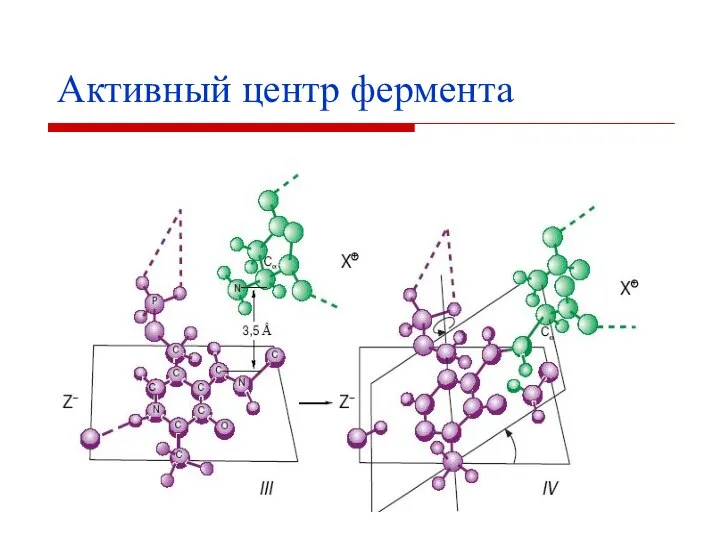
- 11. Активный центр фермента – несколько аминокислотных остатков, которые в ходе ферментативного катализа взаимодействуют с субстратом. У
- 12. Активный центр фермента
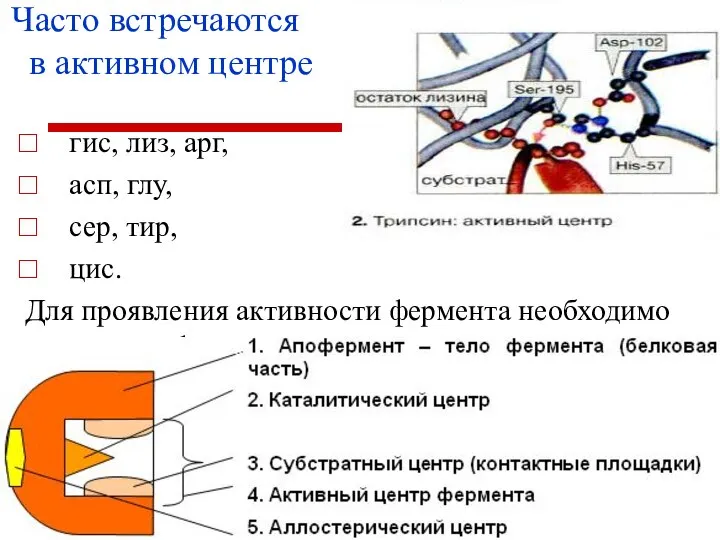
- 13. Часто встречаются в активном центре гис, лиз, арг, асп, глу, сер, тир, цис. Для проявления активности
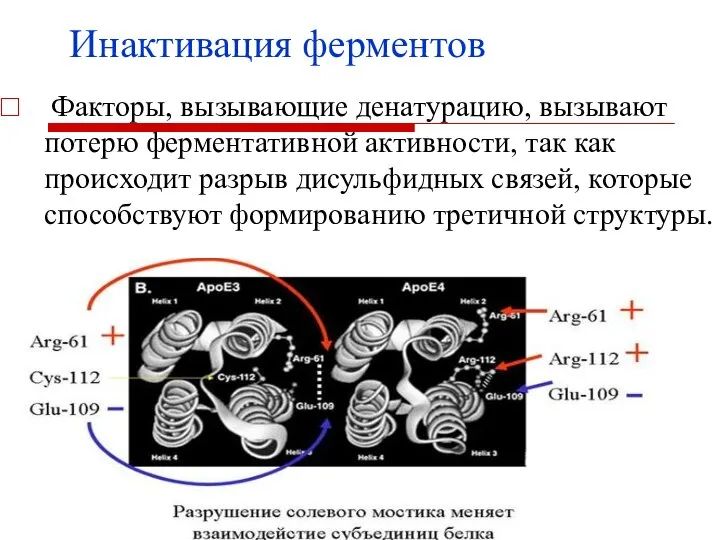
- 14. Инактивация ферментов Факторы, вызывающие денатурацию, вызывают потерю ферментативной активности, так как происходит разрыв дисульфидных связей, которые
- 15. Отличия ферментов от неорганических катализаторов высокая молекулярная активность, лабильность - ферменты действуют при относительно мягких условиях
- 16. Влияние температуры Термолабильность – чувствительность ферментов к температуре. При температуре 60º наступает денатурация. Миокиназа мышц выдерживает
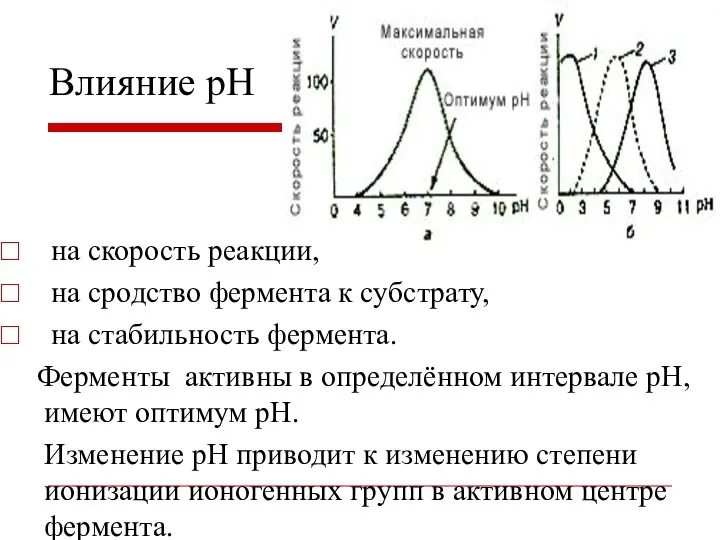
- 17. на скорость реакции, на сродство фермента к субстрату, на стабильность фермента. Ферменты активны в определённом интервале
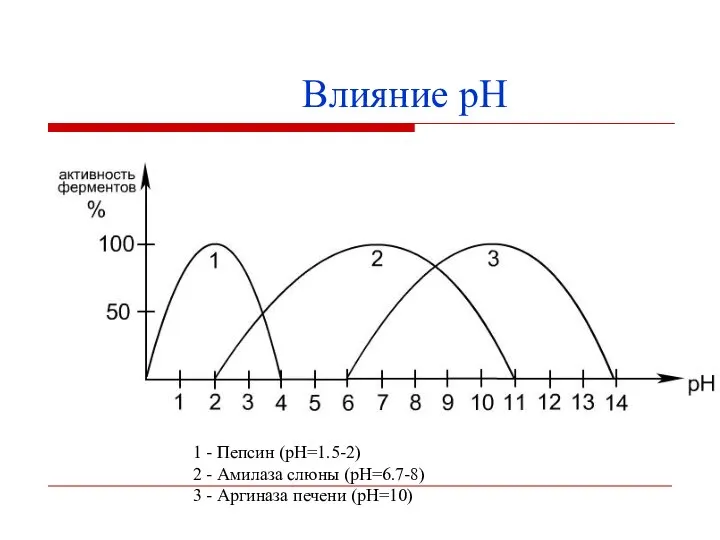
- 18. 1 - Пепсин (pH=1.5-2) 2 - Амилаза слюны (pH=6.7-8) 3 - Аргиназа печени (pH=10) Влияние рН
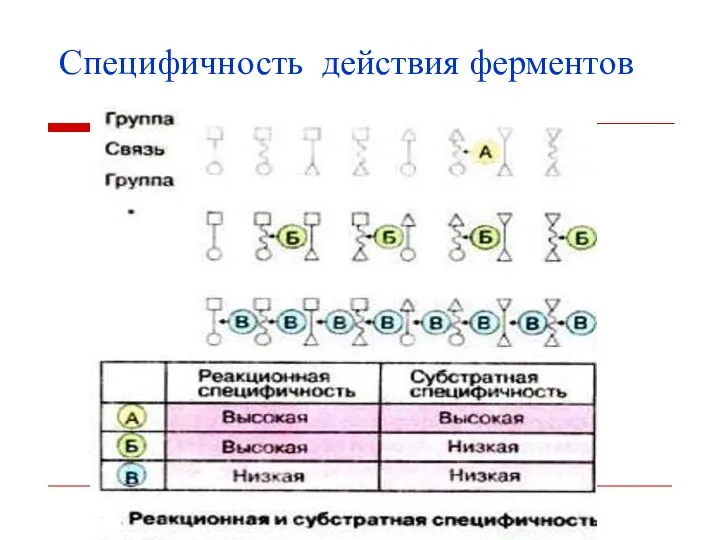
- 19. Специфичность действия ферментов Каждый фермент действует строго на одно вещество или очень небольшое число близкородственных веществ.
- 20. Специфичность действия ферментов
- 21. Абсолютная специфичность Фермент катализирует превращение только одного субстрата. уреаза, аргиназа.
- 22. Стереоспецифичность фермент катализирует превращение одного из стереоизомеров, оксидазы L и D аминокислот.
- 23. Относительная специфичность Фермент действует на субстраты разных групп химических соединений. Специфичность по типу реакции. Цитохром Р450.
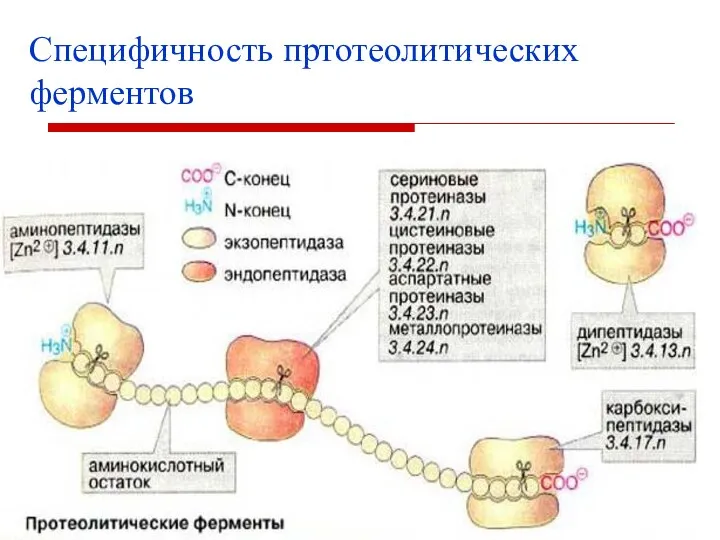
- 24. Групповая специфичность Фермент действует на отдельные связи определённой группы субстратов. Пепсин расщепляет связи, образованные аминогруппой тирозина
- 25. Специфичность пртотеолитических ферментов
- 26. Энзимопатология раздел медицины, изучающий заболевания, связанные с нарушением функционирования ферментов.
- 27. Энзимопатии наследственные (фенилкетонурия, гликогенозы), токсические (передозировка лекарств, воздействие токсинов инфекционных агентов), алиментарные (при недостаточном поступлении в
- 28. Изоферменты- множественные молекулярные формы фермента данной особи, катализирующие одну и ту же реакцию, но разделяющиеся при
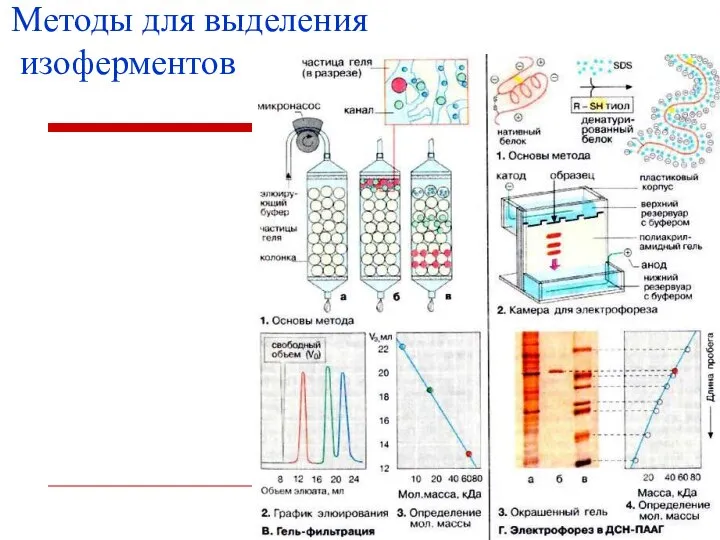
- 29. Методы для выделения изоферментов электрофорез, ионообменная хроматография, гельфильтрация, избирательная адсорбция, иммунохимический метод.
- 30. Методы для выделения изоферментов
- 31. Изоферменты Генетически детерминированные изоферменты возникают в результате множественности аллелей в одном локусе. Посттрансляционные (вторичные) изоферменты возникают
- 32. Применение изоферментов С помощью изоферментного анализа удаётся выявить небольшие мутации. Изоферменты изменяются в процессе развития и
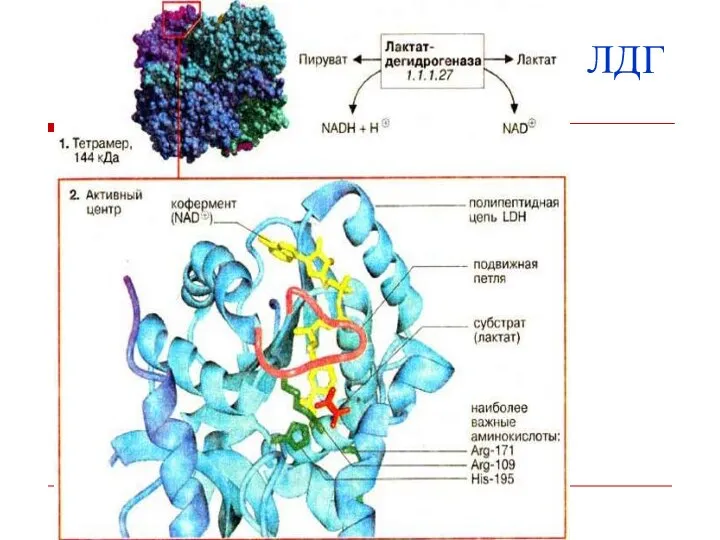
- 33. ЛДГ Ткани человека продуцируют 2 электрофоретически различающихся субъединицы ЛДГ: Н и М. Так как ЛДГ –
- 34. ЛДГ
- 35. ЛДГ5 катализирует образование лактата, а ЛДГ1 – её утилизацию. В тканях с высоким уровнем аэробного обмена
- 36. Определение изоферментов сыворотке крови для диагностики При инфаркте миокарда в крови повышается активность ЛДГ1, а при
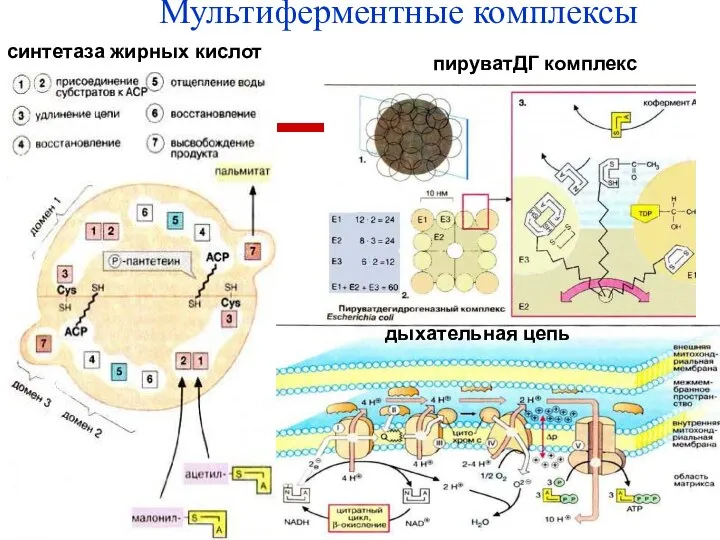
- 37. Мультиферментные комплексы ряд ферментов многоэтапного биохимического процесса: действие одного фермента – необходимый этап для действия другого.
- 38. Мультиферментные комплексы синтетаза жирных кислот, пируватДГ комплекс, дыхательная цепь, ферменты гликолиза.
- 39. Мультиферментные комплексы синтетаза жирных кислот дыхательная цепь пируватДГ комплекс
- 40. Строение Чаще ферменты построены из двух или более полипептидов, каждый из которых уложен в отдельную глобулу.
- 42. Скачать презентацию

























 Культура России XVII века
Культура России XVII века Русская дворянка второй половины XIX века
Русская дворянка второй половины XIX века Презентация "О новых системах оплаты труда в учреждениях бюджетной сферы Республики Башкортостан" - скачать презентации по Э
Презентация "О новых системах оплаты труда в учреждениях бюджетной сферы Республики Башкортостан" - скачать презентации по Э Пятидесятница
Пятидесятница Эффективное управление капиталом компании
Эффективное управление капиталом компании  Хрюк на елке - презентация для начальной школы
Хрюк на елке - презентация для начальной школы Права потребителя при обнаружении недостатков выполненной работы (оказанной услуги)
Права потребителя при обнаружении недостатков выполненной работы (оказанной услуги) Праздник здоровья. База отдыха «Ирбис»
Праздник здоровья. База отдыха «Ирбис» Текущий ремонт гаражного бокса
Текущий ремонт гаражного бокса Программирование на языке Паскаль. Процедуры
Программирование на языке Паскаль. Процедуры Причины государственного вмешательства в экономику.
Причины государственного вмешательства в экономику. Рекламное Агенство ProДвижение
Рекламное Агенство ProДвижение Прославление Христа
Прославление Христа Образ современного педагога
Образ современного педагога Лекция 12. Моделирование рынка: оценивание функций Торнквиста Содержание лекции: Подходы к моделированию рынка Зависимость сп
Лекция 12. Моделирование рынка: оценивание функций Торнквиста Содержание лекции: Подходы к моделированию рынка Зависимость сп Комплекс 1. Ноги+пресс
Комплекс 1. Ноги+пресс Классификация белков
Классификация белков  Мониторинг судебных процессов
Мониторинг судебных процессов Методы информационно-психологического воздействия
Методы информационно-психологического воздействия Биографический метод в социальной психологии
Биографический метод в социальной психологии Литературный процесс XIX века в странах Западной Европы и США
Литературный процесс XIX века в странах Западной Европы и США  Чертежи предметов с использованием геометрических построений
Чертежи предметов с использованием геометрических построений Эвольвенттік іліністі құру
Эвольвенттік іліністі құру Стратегии поведения в конфликте
Стратегии поведения в конфликте Semiconductor technology
Semiconductor technology Железобетонные и каменные конструкции. Сущность железобетона
Железобетонные и каменные конструкции. Сущность железобетона Накопители на магнитных дисках
Накопители на магнитных дисках Презентация "Можем ли мы услышать живопись?" - скачать презентации по МХК
Презентация "Можем ли мы услышать живопись?" - скачать презентации по МХК