Содержание
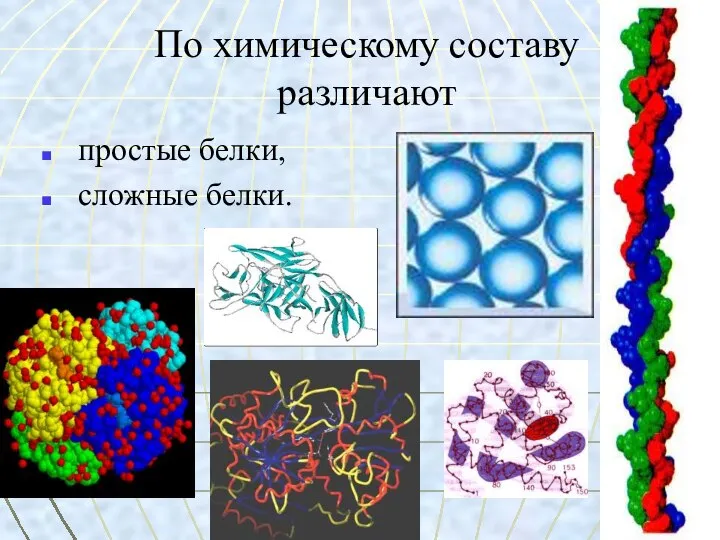
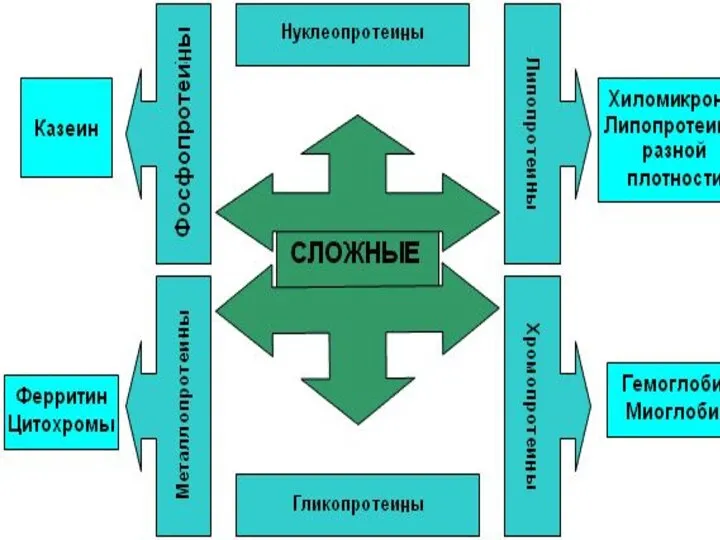
- 2. По химическому составу различают простые белки, сложные белки.
- 3. Классификация простых белков альбумины, глобулины, гистоны, протамины, протеиноиды.
- 4. Альбумины глобулярные белки, молекулярная масса 70 000, растворимы в воде, ИЭТ 5, высаливаются 100% сульфатом аммония,
- 5. Функции альбуминов депо белка в организме, осморегуляция, неспецифическая защита, транспорт лекарств, металлов, холестерина, билирубина, желчных пигментов,
- 6. Глобулины глобулярные белки, молекулярная масса 150 000 дальтон, растворимы в солевых растворах, ИЭТ 7, имеют ряд
- 7. Функции глобулинов ферменты, транспорт витаминов, гормонов, металлов, защита (иммунитет), γ-глобулины являются антителами.
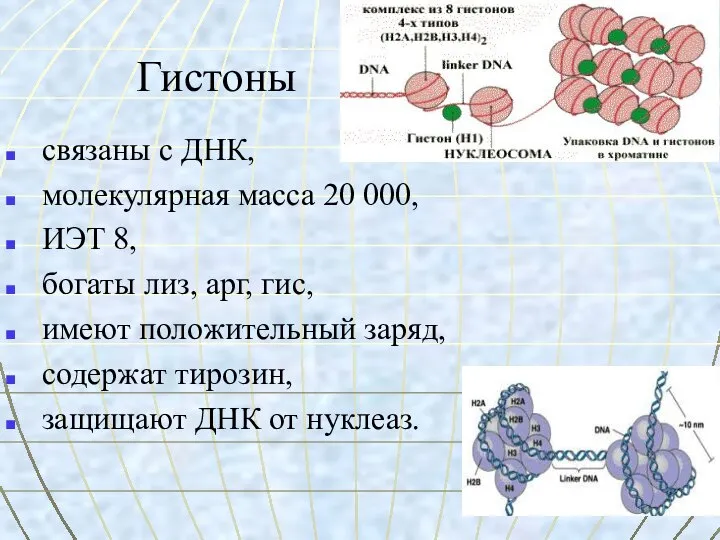
- 8. Гистоны связаны с ДНК, молекулярная масса 20 000, ИЭТ 8, богаты лиз, арг, гис, имеют положительный
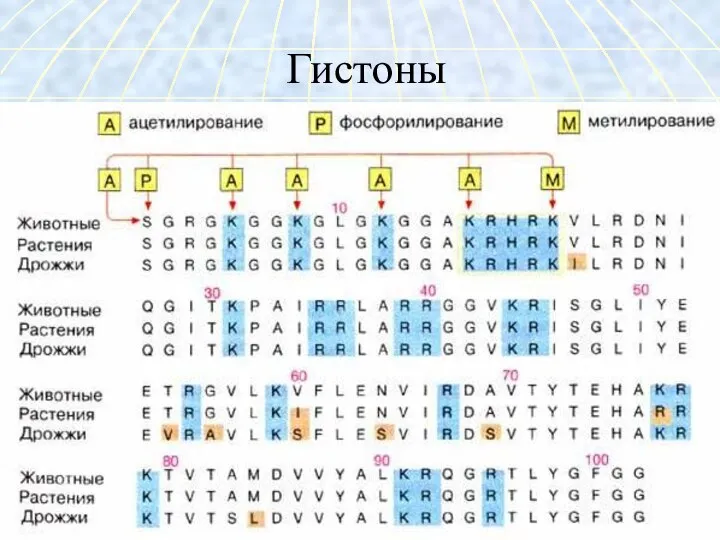
- 9. Гистоны
- 10. Протамины молекулярная масса 5000, ИЭТ 11, содержат много арг, лиз, имеют положительный заряд, не содержат тирозин,
- 11. Проламины и глютелины белки растительного происхождения, содержатся в семенах злаков, растворимы в 60-80% водном растворе, а
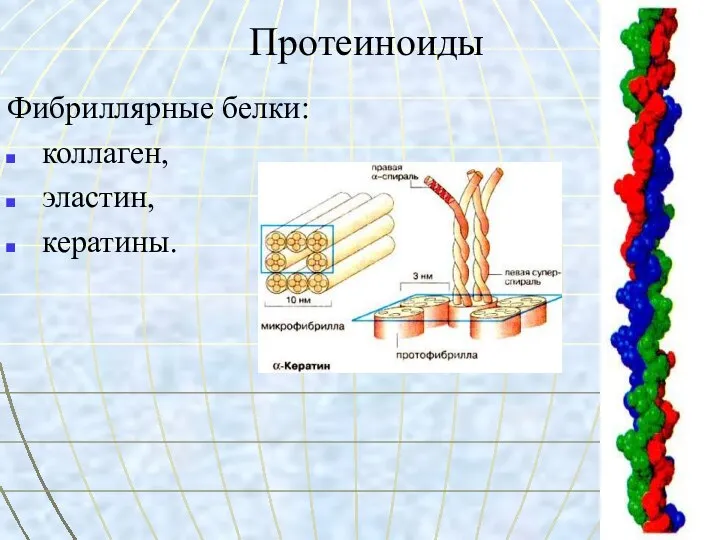
- 12. Протеиноиды Фибриллярные белки: коллаген, эластин, кератины.
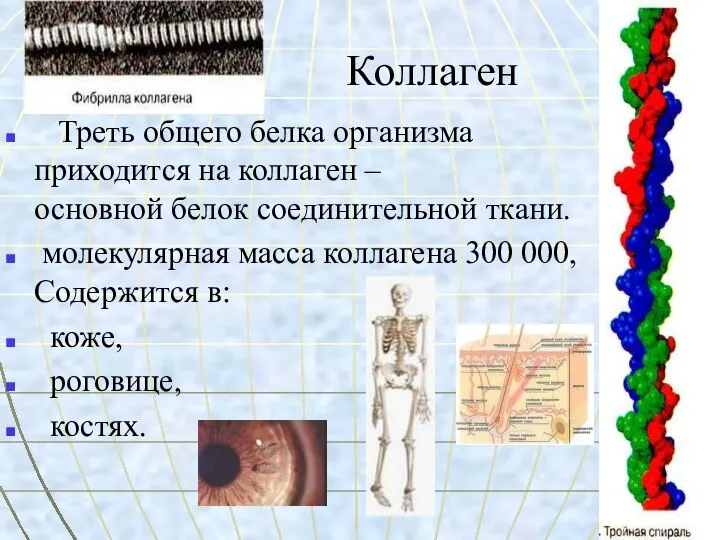
- 13. Коллаген Треть общего белка организма приходится на коллаген – основной белок соединительной ткани. молекулярная масса коллагена
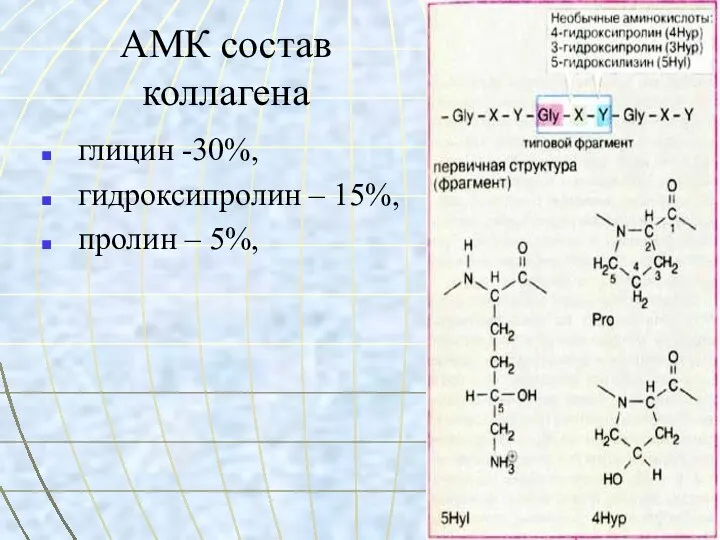
- 14. АМК состав коллагена глицин -30%, гидроксипролин – 15%, пролин – 5%,
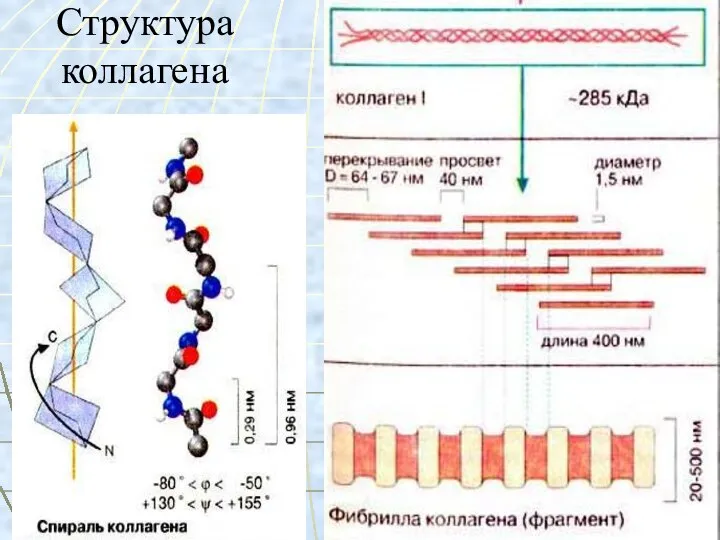
- 15. Строение коллагена молекула коллагена состоит из 3 пептидных цепей, в каждой примерно 1000 АМК, вторичная структура
- 16. Структура коллагена
- 17. Уникальная особенность метаболизма гидроксипролина эта АМК, входящая в состав белков пищи, не включается в коллаген, пищевой
- 18. Известно 19 типов коллагена. Определённую роль в синтезе коллагена играют белки-шапероны, обеспечивающие «контроль качества» коллагена. Ряд
- 19. Заболевания, связанные с нарушением синтеза коллагена несовершенный остеогенез, хондродисплазии, семейная аневризма аорты.
- 20. По мере старения фибриллы коллагена становятся более жёсткими и хрупкими, меняются свойства хрящей, сухожилий, роговицы.
- 21. Эластин гликопротеин с множеством гидрофобных АМК, сеть полипептидных цепей, поперечно-связанных остатками десмозина, фибриллы эластина хорошо растягиваются,
- 22. α-кератины образуют волосы, шерсть, перья, рога, когти, чешую, наружный слой кожи.
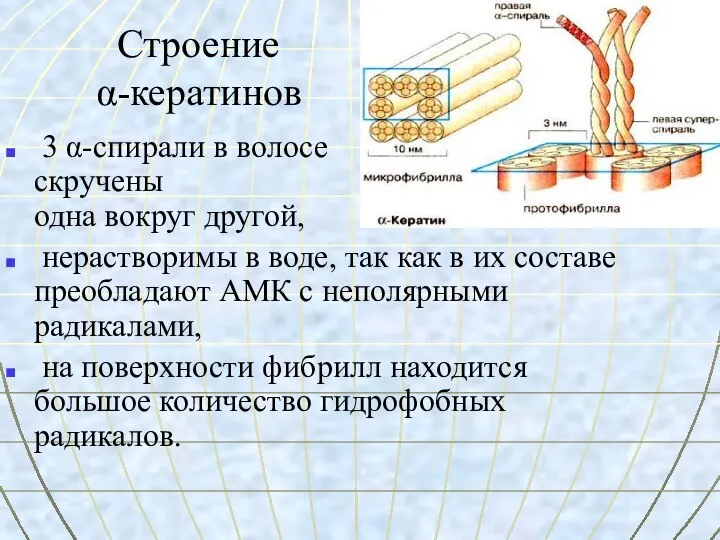
- 23. Строение α-кератинов 3 α-спирали в волосе скручены одна вокруг другой, нерастворимы в воде, так как в
- 24. .
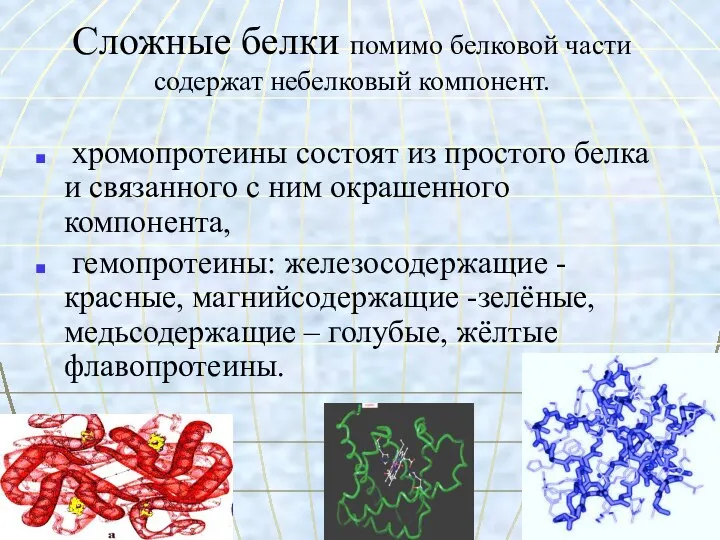
- 25. Сложные белки помимо белковой части содержат небелковый компонент. хромопротеины состоят из простого белка и связанного с
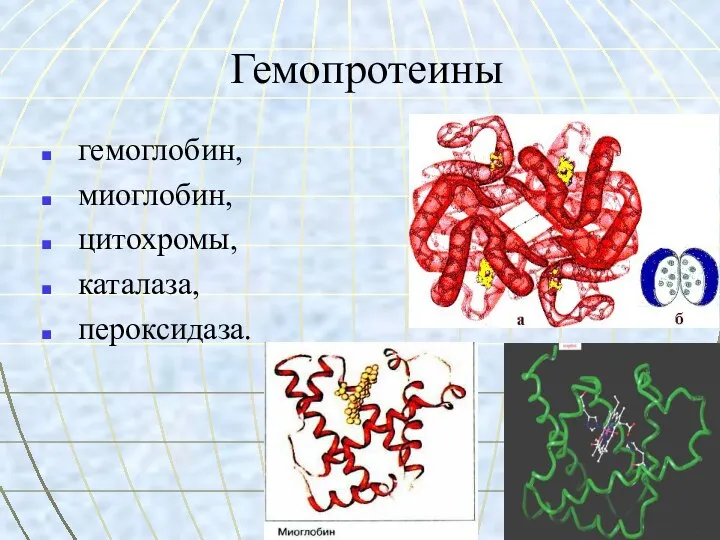
- 26. Гемопротеины гемоглобин, миоглобин, цитохромы, каталаза, пероксидаза.
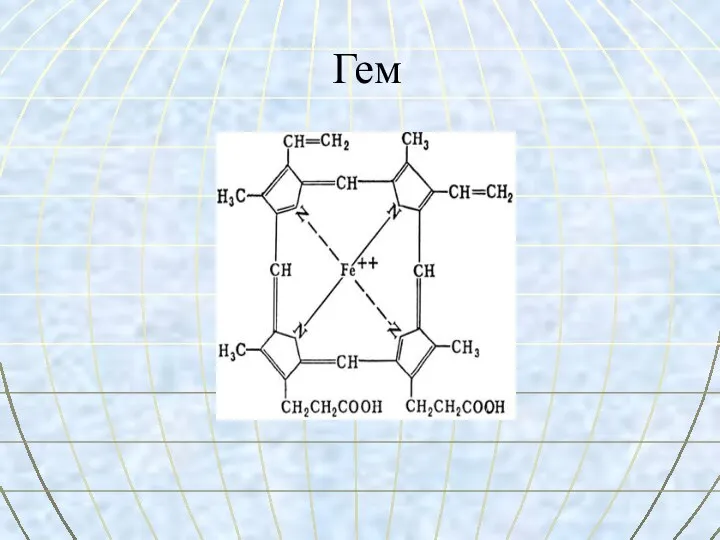
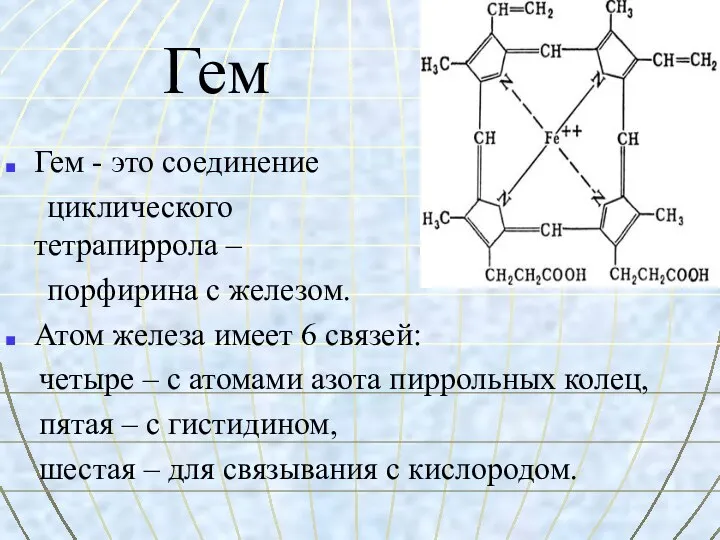
- 27. Гем
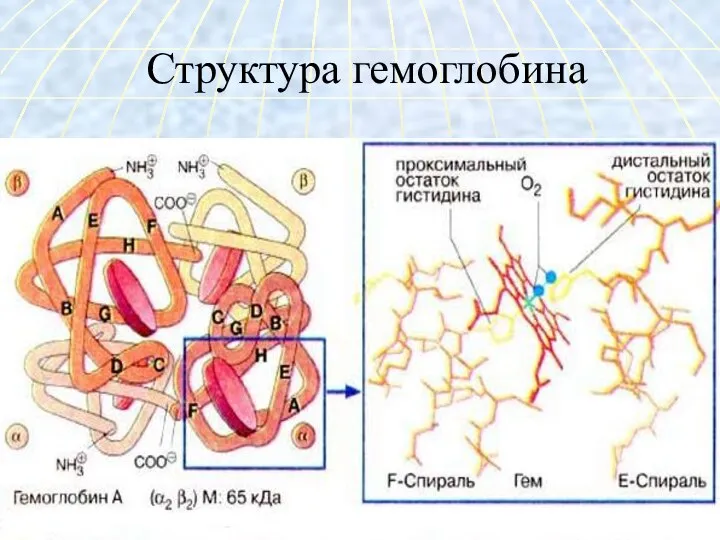
- 28. Характеристика структуры гемоглобина Гемоглобин – глобулярный белок, железосодержащий хромопротеин. В состав гемоглобина входят 574 аминокислоты. Молекулярная
- 29. Структура гемоглобина
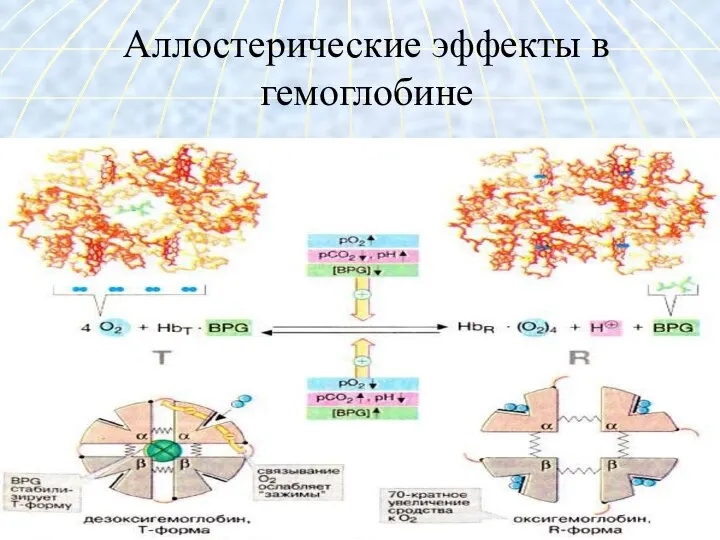
- 30. Аллостерические эффекты в гемоглобине
- 31. Гем Гем - это соединение циклического тетрапиррола – порфирина с железом. Атом железа имеет 6 связей:
- 32. Глобин - белок типа альбуминов синтезируется в нормобластах состоит из четырёх полипептидных цепей: 2α -цепи по
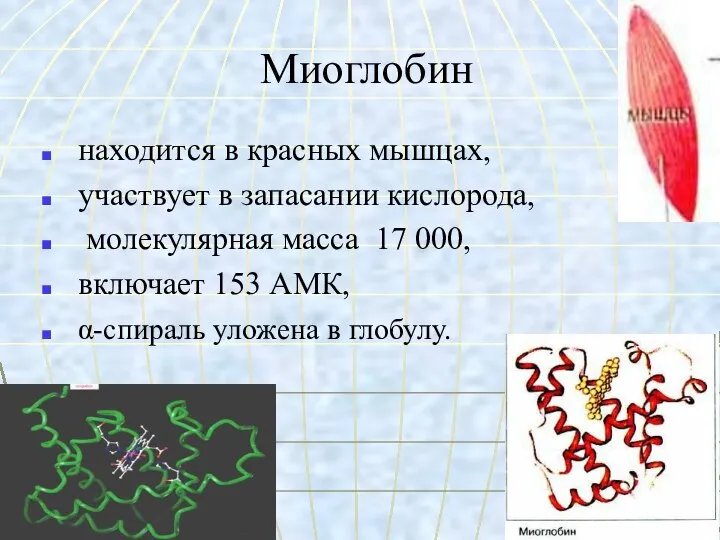
- 33. Миоглобин находится в красных мышцах, участвует в запасании кислорода, молекулярная масса 17 000, включает 153 АМК,
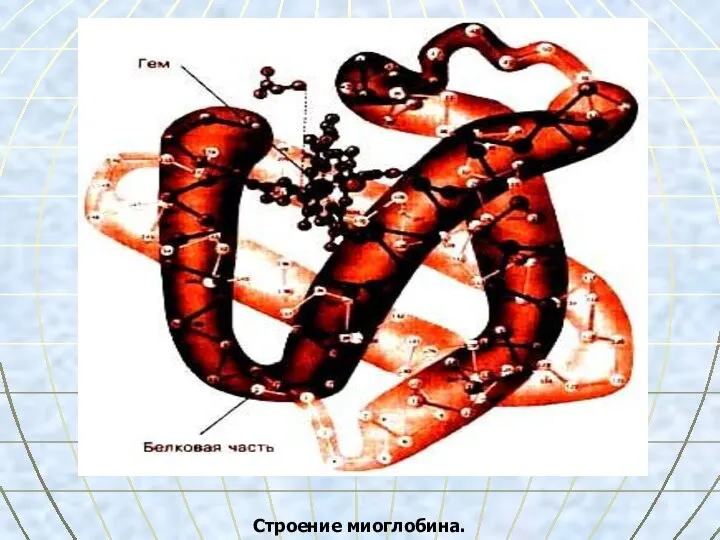
- 34. Строение миоглобина.
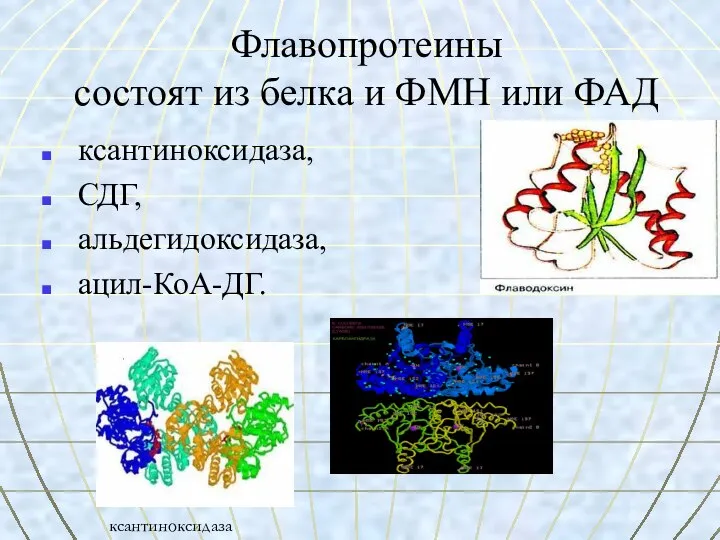
- 35. Флавопротеины состоят из белка и ФМН или ФАД ксантиноксидаза, СДГ, альдегидоксидаза, ацил-КоА-ДГ. ксантиноксидаза
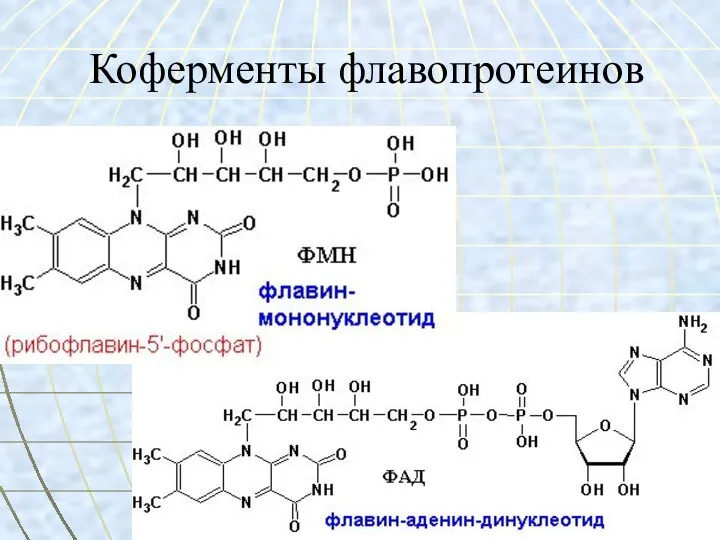
- 36. Коферменты флавопротеинов
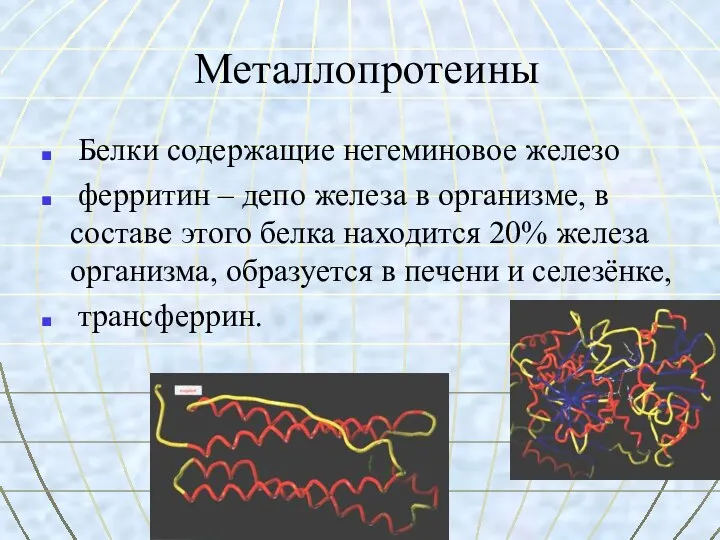
- 37. Металлопротеины Белки содержащие негеминовое железо ферритин – депо железа в организме, в составе этого белка находится
- 38. Белки-ферменты - металлопротеины Сu-содержащие: цитохромоксидаза, церулоплазмин, тирозиназа, Mn-содержащие: аргиназа, Zn-содержащие: карбоангидраза, алкогольДГ.
- 39. Фосфопротеины состоят из белка и фосфорной кислоты, фосфорная кислота присоединяется через ОН-группу серина.
- 40. Фосфопротеины казеиноген в молоке, овальбумин и фосвитин в яйцах, ихтулин в икре рыбы, в большом количестве
- 41. Биологическая роль фосфопротеинов входят в состав мозга, в растущем организме фосфор – пластический материал, способны отдавать
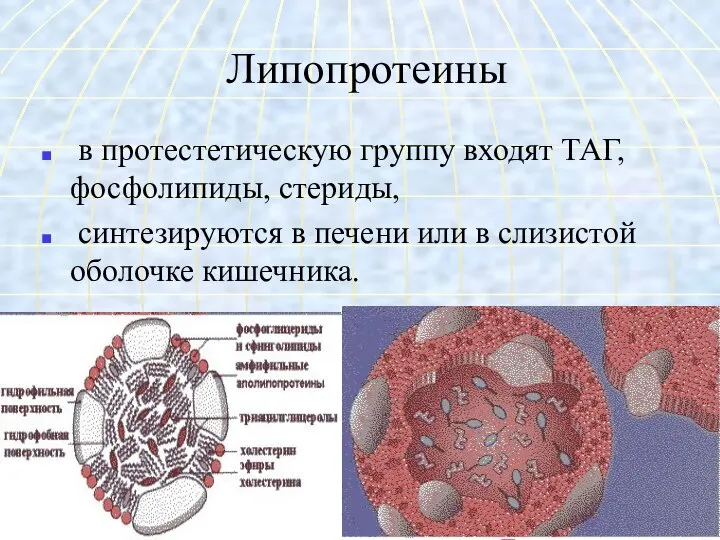
- 42. Липопротеины в протестетическую группу входят ТАГ, фосфолипиды, стериды, синтезируются в печени или в слизистой оболочке кишечника.
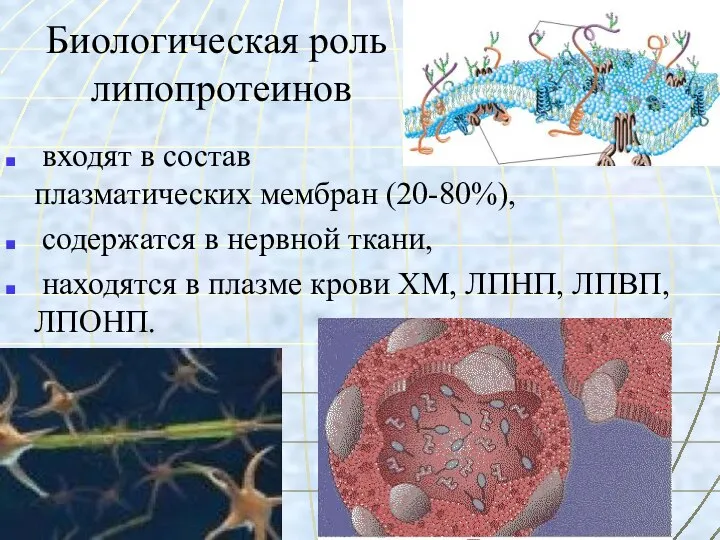
- 43. Биологическая роль липопротеинов входят в состав плазматических мембран (20-80%), содержатся в нервной ткани, находятся в плазме
- 44. Гликопротеины (гликоконъюгаты) белки, содержащие олигосахаридные цепи, ковалентно присоединённые к полипептидной основе, углеводные компоненты ковалентно соединены с
- 45. Углеводный компонент галактоза, глюкоза, манноза, N-ацетилгалактозамин, N-ацетилглюкозамин, N-ацетилненйраминовая кислота, фукоза.
- 46. Функции гликопротеинов структурная (находятся в плазматических мембранах), смазочная и защитная (муцины, слизь), транспорт витаминов, липидов, микроэлементов
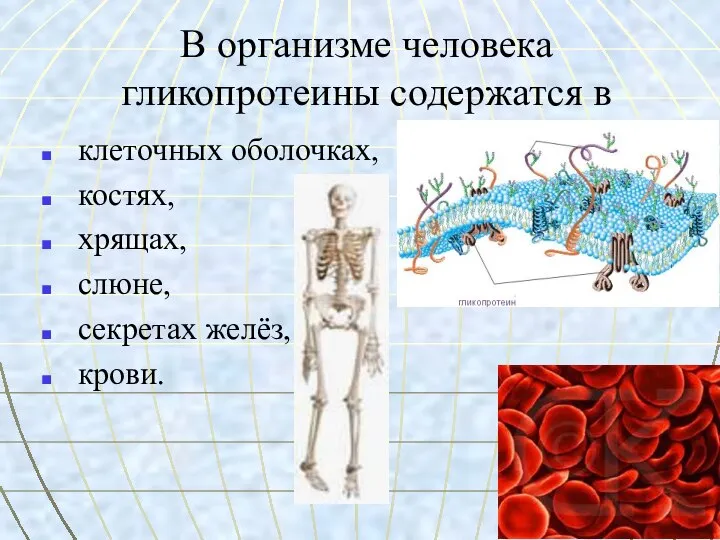
- 47. В организме человека гликопротеины содержатся в клеточных оболочках, костях, хрящах, слюне, секретах желёз, крови.
- 48. Интерфероны образуются в клетке в ответ на внедрение вирусной НК, ограничивая вирусную агрессию, сложные белки, молекулярная
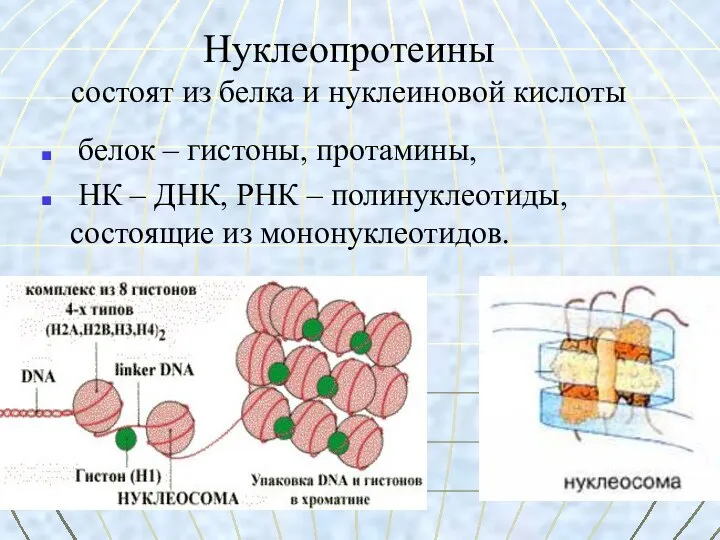
- 49. Нуклеопротеины состоят из белка и нуклеиновой кислоты белок – гистоны, протамины, НК – ДНК, РНК –
- 50. Значение нуклеотидов синтез НК, энергетическая роль, коферменты, транспортная функция.
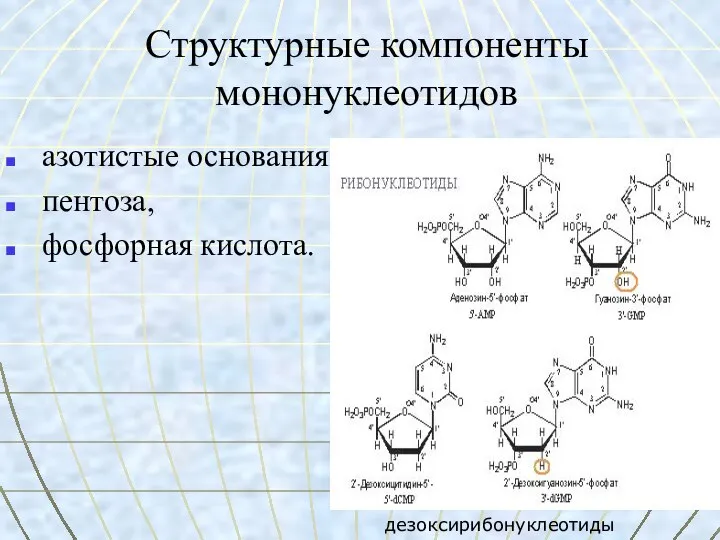
- 51. Структурные компоненты мононуклеотидов азотистые основания, пентоза, фосфорная кислота. дезоксирибонуклеотиды
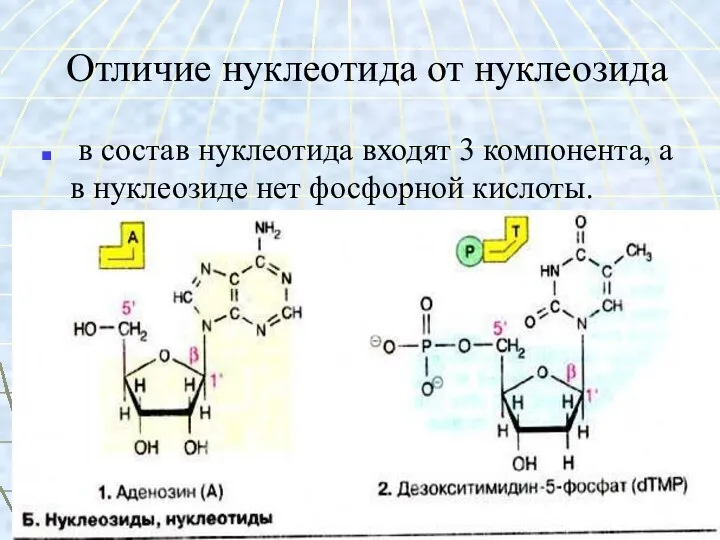
- 52. Отличие нуклеотида от нуклеозида в состав нуклеотида входят 3 компонента, а в нуклеозиде нет фосфорной кислоты.
- 53. Правила Чаргаффа молярная доля пуринов равна молярной доле пиримидинов А+Г=Ц+Т, количество аденина и цитозина равно количеству
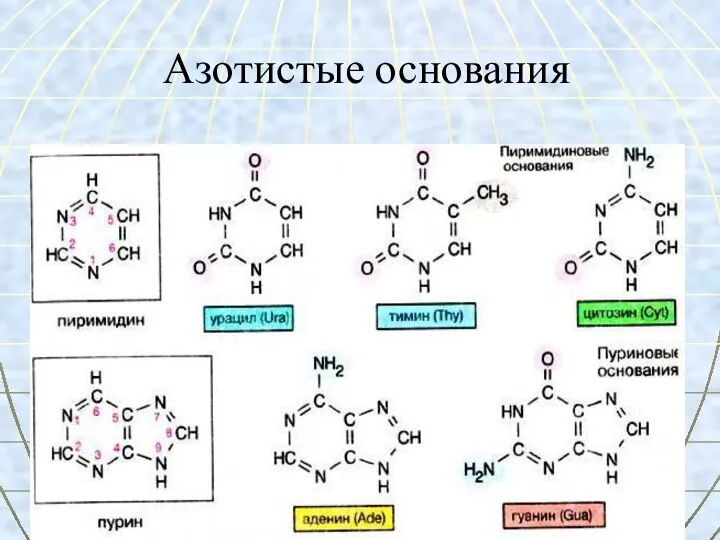
- 54. Азотистые основания
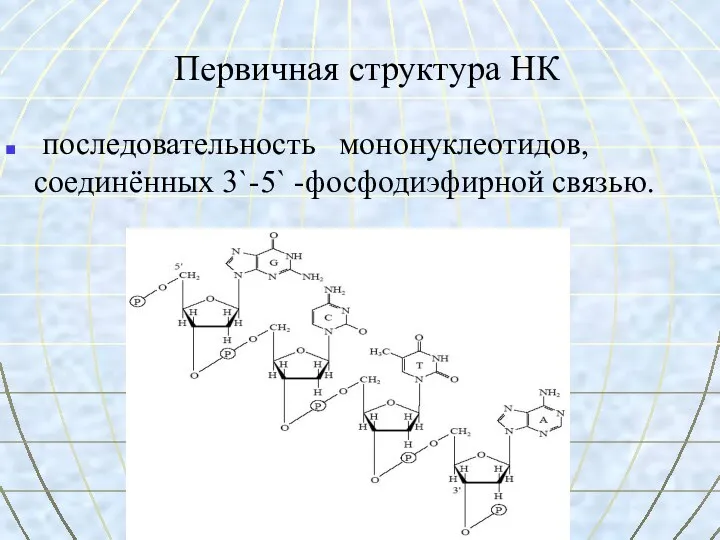
- 55. Первичная структура НК последовательность мононуклеотидов, соединённых 3`-5` -фосфодиэфирной связью.
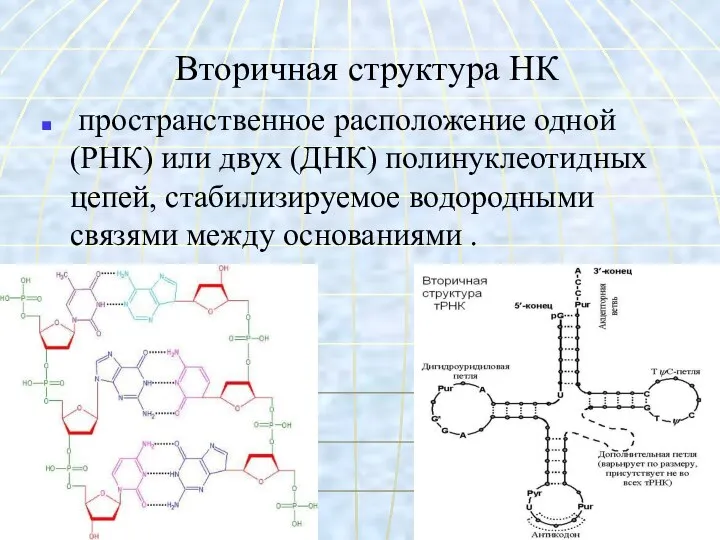
- 56. Вторичная структура НК пространственное расположение одной (РНК) или двух (ДНК) полинуклеотидных цепей, стабилизируемое водородными связями между
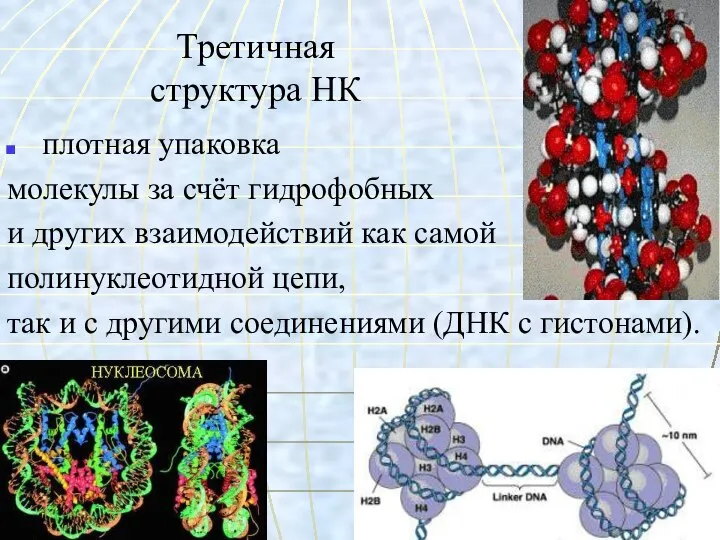
- 57. Третичная структура НК плотная упаковка молекулы за счёт гидрофобных и других взаимодействий как самой полинуклеотидной цепи,
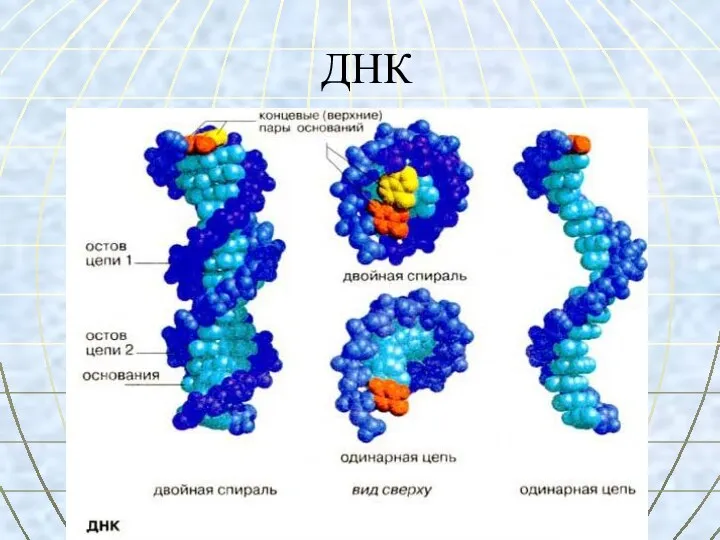
- 58. ДНК
- 60. Скачать презентацию


























 Designing & Deploying Connected Device Solutions for Small and Medium Business
Designing & Deploying Connected Device Solutions for Small and Medium Business Вища рада юстиції
Вища рада юстиції WebAPI
WebAPI Проецирование плоскости
Проецирование плоскости Презентация Затратное ценообразование. Затраты, существенные для обоснования цен
Презентация Затратное ценообразование. Затраты, существенные для обоснования цен Социальная утопия Возрождения
Социальная утопия Возрождения Оценка персонала. Тема 5
Оценка персонала. Тема 5 Проектирование пространства, функционала и деятельности инновационного научно-исследовательского центра
Проектирование пространства, функционала и деятельности инновационного научно-исследовательского центра Политическая история Венгрии
Политическая история Венгрии Разработка компьютерной программы, обучающей умениям оценивания диагностируемости систем управления
Разработка компьютерной программы, обучающей умениям оценивания диагностируемости систем управления Проверка знаний : Основные положения хромосомной теории Гемизиготные признаки Каков процент возникновения здоровых детей (м
Проверка знаний : Основные положения хромосомной теории Гемизиготные признаки Каков процент возникновения здоровых детей (м Гемостаз и гемореалогия
Гемостаз и гемореалогия Текстовые файлы в C#
Текстовые файлы в C#  Промышленные образцы
Промышленные образцы Думстеры
Думстеры Программирование разветвляющихся алгоритмов
Программирование разветвляющихся алгоритмов Линии передачи
Линии передачи МЫШЕЧНЫЕ ТКАНИ ЛЕКЦИЯ ПО ГИСТОЛОГИИ
МЫШЕЧНЫЕ ТКАНИ ЛЕКЦИЯ ПО ГИСТОЛОГИИ История крейсера Аврора - презентация для начальной школы
История крейсера Аврора - презентация для начальной школы Презентация на тему "ТУЛЯРЕМИЯ" - скачать презентации по Медицине
Презентация на тему "ТУЛЯРЕМИЯ" - скачать презентации по Медицине Педагогический стандарт «Педагог». Зачетные вопросы. Методика обучения плаванию
Педагогический стандарт «Педагог». Зачетные вопросы. Методика обучения плаванию Стр.память
Стр.память  Презентация "Своеобразие художественной культуры древнего востока. Символический характер искусства. Природа и человек-главна
Презентация "Своеобразие художественной культуры древнего востока. Символический характер искусства. Природа и человек-главна LUCAS CRANACH the Elder (1472-1559)
LUCAS CRANACH the Elder (1472-1559)  Скульптура древней Греции Скульптура Древней Греции внесла огромный вклад в мировую культуру и стала основой для развития этого
Скульптура древней Греции Скульптура Древней Греции внесла огромный вклад в мировую культуру и стала основой для развития этого  Презентация "Иван Николаевич Крамской" - скачать презентации по МХК
Презентация "Иван Николаевич Крамской" - скачать презентации по МХК Аппаратное обеспечение для подключения к сети интернет
Аппаратное обеспечение для подключения к сети интернет Основные виды лыжных ходов. Техника
Основные виды лыжных ходов. Техника