Содержание
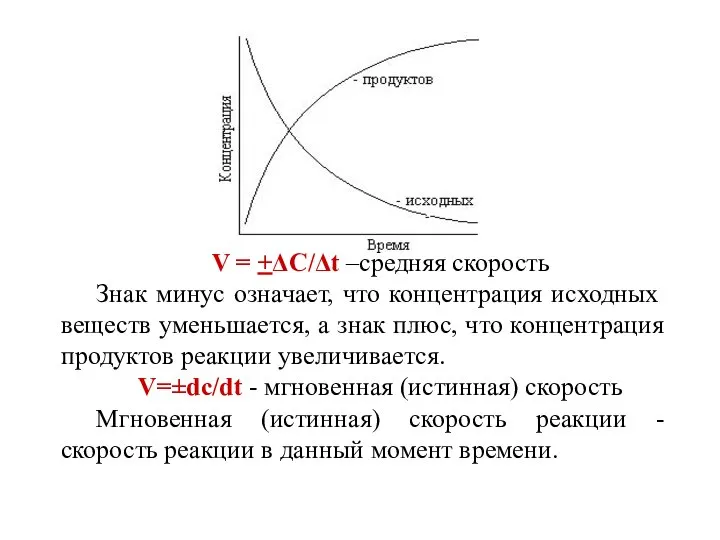
- 2. V = +ΔC/Δt –средняя скорость Знак минус означает, что концентрация исходных веществ уменьшается, а знак плюс,
- 3. Молекулярность реакции - число молекул (атомов или ионов) реагента одновременно участвующих в одном элементарном акте реакции.
- 4. Для необратимой реакции bB + dD = lL + mM V = k·CBnb·CDnd Это уравнение -
- 5. Если реакция bB + dD = lL + mM протекает в одну стадию, то nb =b
- 6. Реакции первого порядка Кинетическое уравнение имеет вид: V = k·С. Приравняв V=-dс/dt и V = k*С,
- 7. Реакции второго порядка Кинетическое уравнение V=k·СВ·СD. Если СВ=СD или реагируют одинаковые частицы, то V=kc2. dc/с2=-k·dt Единицы
- 8. Зависимость скорости реакции от времени
- 9. Гетерогенные реакции Скорость реакции зависит от площади реакционной поверхности (S): V = k*C*S. Концентрация твердого вещества
- 10. Скорость гетерогенной химической реакции зависит от скорости подвода реагентов в зону химической реакции. Скорость диффузии VД
- 11. VД>>V - реагенты без проблем подаются в реакционное пространство - кинетический контроль реакции. VД=V - смешанный
- 12. Зависимость константы скорости реакции от температуры Правило Вант-Гоффа: скорость реакции ускоряется в 2-4 раза при повышении
- 13. А⎯В А…….В А В + → : : → ⏐ + ⏐ Д⎯С Д……С Д С
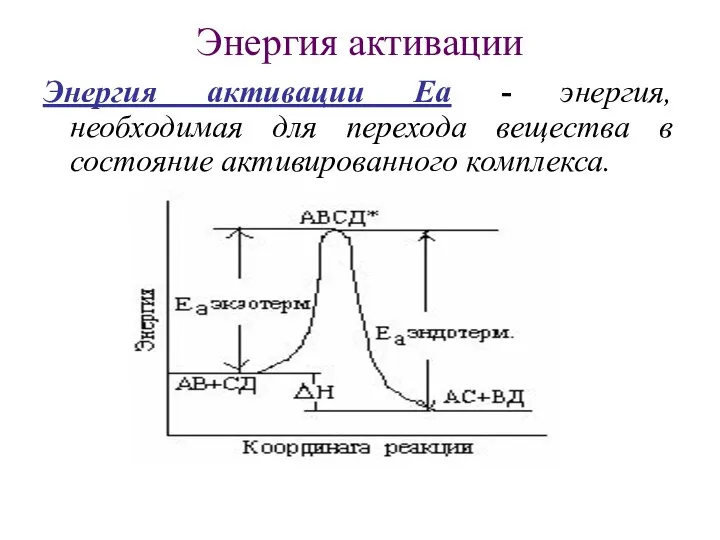
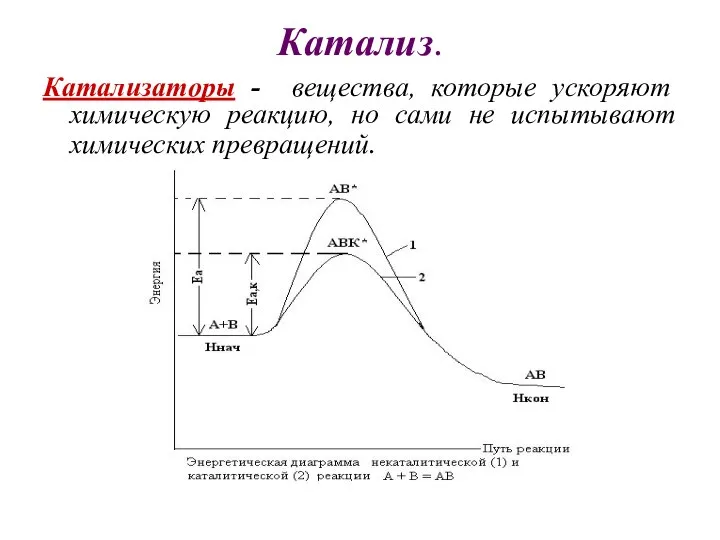
- 14. Энергия активации Энергия активации Еа - энергия, необходимая для перехода вещества в состояние активированного комплекса.
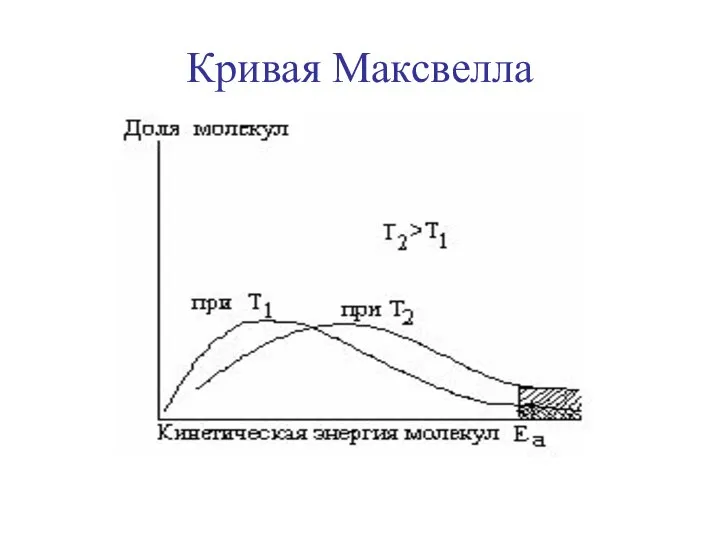
- 15. Кривая Максвелла
- 16. Уравнение Аррениуса : экспоненциальная и логарифмическая k = A·e‑Ea/RT lnk = - Ea/RT + lnA При
- 17. Физический смысл предэкспоненциального множителя: Величина А соответствует такой (максимальной) скорости реакции, когда Еа равна нулю, то
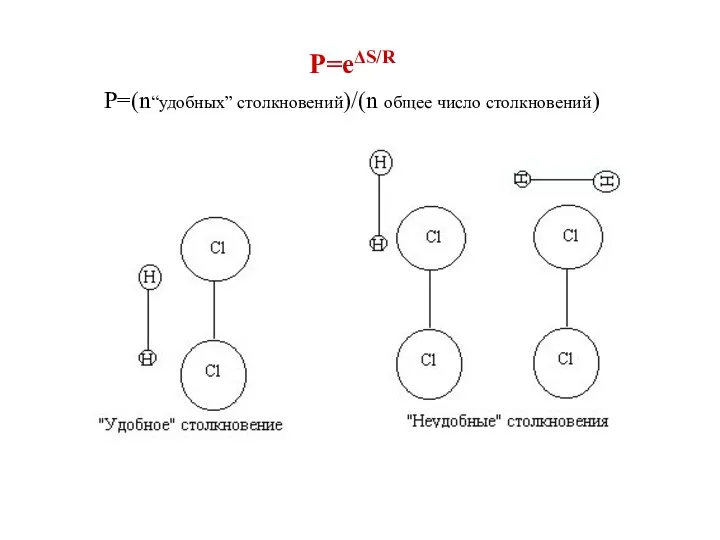
- 18. P=eΔS/R Р=(n“удобных” столкновений)/(n общее число столкновений)
- 19. Катализ. Катализаторы - вещества, которые ускоряют химическую реакцию, но сами не испытывают химических превращений.
- 20. Виды катализа Гомогенный – катализатор находится в системе в том же фазовом состоянии, что и реагенты.
- 21. Гетерогенный – катализатор и реагенты находятся в разных фазах и имеют границу раздела. Механизм: Kat Kat
- 22. Ферментативный катализ. Наиболее эффективный вид катализа. Ферменты подходят к перерабатываемым молекулам, как ключ к замку –
- 23. Катализатор резко ускоряет реакцию. Реакция разложения 2HI→H2+I2 имеет следующие скорости: Некатализируемая: Еа = 168 кДж/моль Vотносит
- 24. Промоторы катализа - вещества, которые сами не являются катализаторами, но добавление к их в реакционную катализируемую
- 25. Классификация химических реакций Простые - протекают в одну стадию и называются одностадийными. Порядок реакции совпадает с
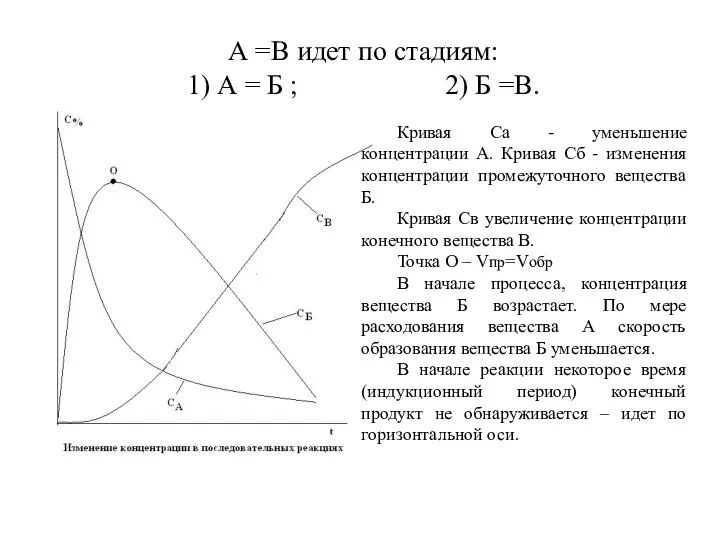
- 26. А =В идет по стадиям: 1) А = Б ; 2) Б =В. Кривая Са -
- 27. Скорость химической реакции определяется наиболее медленной стадией, эта стадия лимитирующая. 2 N2О5 = 4 NО2 +
- 28. Реакции, которые могут идти двумя параллельными путями с образованием различных продуктов реакции называются параллельными. Разложение гидразина
- 29. А→Б Для 1-ой реакции КБ и ЕаАБ; ΔНАБ, ↓ В для 2-ой реакции КВ, ЕаАВ, ΔНАВ.
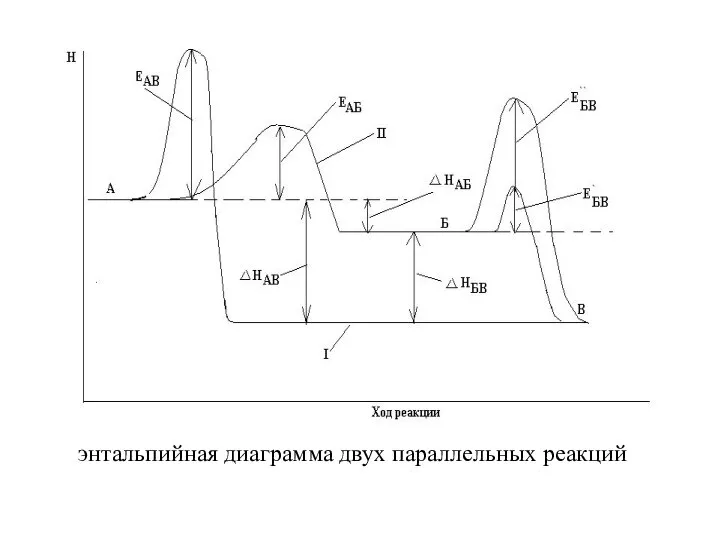
- 30. энтальпийная диаграмма двух параллельных реакций
- 31. Если ЕаАВ>ЕаАБ, а ΔНАВ>ΔНАБ, термодинамически более вероятно образование вещества В, но из-за меньшего значения энергии активации
- 32. Если с одним и тем же реагентом одновременно взаимодействуют два или более вещества, то такие реакции
- 33. Цепные реакции Их скорость зависит от формы, материала и объёма сосуда, при определенных условиях реакция ускоряется
- 34. Развитие цепи H2 + Cl* → HCl + H*; H* + Cl2 → HCl + Cl*
- 35. Фотохимические реакции Протекают под действием квантов света. Первый закон фотохимии: фотохимически активным является лишь поглощенный свет.
- 36. Использование фотохимических реакций 1) фотосинтез: 6СО2+6Н2О+hν→C6H12O6+6O2 ΔH0298= 2815 кДж 2) фотографирование: 2AgBr +2hν→ 2Ag + Br2
- 37. 3) фотохимических реакций в верхних слоях атмосферы: Образование озонового слоя: λ=241нм мягкое УФ - излучение: O2+hν→2O
- 38. Расходование озонового слоя: 1) λ=80-240нм жесткое УФ - излучение O3+hν →O2+О
- 40. Скачать презентацию






























 Христианское образование
Христианское образование Освоение культурного наследия Многоканальная модель освоения культурного наследия
Освоение культурного наследия Многоканальная модель освоения культурного наследия Введение в XML
Введение в XML Режим дня младшего школьника
Режим дня младшего школьника  Whatsapp-лендинг. Очередь клиентов в любой бизнес без сайта и с конверсией до 80%
Whatsapp-лендинг. Очередь клиентов в любой бизнес без сайта и с конверсией до 80% Вкусовой и обонятельный анализатор
Вкусовой и обонятельный анализатор профессиональный стандарт педагога (ПСП)
профессиональный стандарт педагога (ПСП) Каменная кладка. Четыре стадии работы кладки под нагрузкой при сжатии
Каменная кладка. Четыре стадии работы кладки под нагрузкой при сжатии Техническая информация Thermo Top C, Thermo Top V
Техническая информация Thermo Top C, Thermo Top V Народные гуляния как традиция, исторически сложившаяся в советскую эпоху
Народные гуляния как традиция, исторически сложившаяся в советскую эпоху Презентация_modif
Презентация_modif  Құқықтық сана және құқықтық тәртіп
Құқықтық сана және құқықтық тәртіп Татарские народные праздники и обычаи
Татарские народные праздники и обычаи МЕТОДИЧЕСКАЯ ТЕМА: «АКТИВИЗАЦИЯ ПОЗНАВАТЕЛЬНОЙ ДЕЯТЕЛЬНОСТИ УЧАЩИХСЯ НА УРОКАХ ПУТЕМ ИСПОЛЬЗОВАНИЯ НОВЫХ ПЕДАГОГИЧЕСКИХ ТЕХН
МЕТОДИЧЕСКАЯ ТЕМА: «АКТИВИЗАЦИЯ ПОЗНАВАТЕЛЬНОЙ ДЕЯТЕЛЬНОСТИ УЧАЩИХСЯ НА УРОКАХ ПУТЕМ ИСПОЛЬЗОВАНИЯ НОВЫХ ПЕДАГОГИЧЕСКИХ ТЕХН План строительства пятиэтажного здания
План строительства пятиэтажного здания Студенческие арт-клубы УГНТУ
Студенческие арт-клубы УГНТУ Адаптация учащихся в предметной учебной деятельности формированием понятийного аппарата, или Как овладеть языком предмета - през
Адаптация учащихся в предметной учебной деятельности формированием понятийного аппарата, или Как овладеть языком предмета - през Общая характеристика Зарубежной Европы
Общая характеристика Зарубежной Европы Карловы Вары
Карловы Вары Формула Тейлора
Формула Тейлора  Метод комплексных амплитуд
Метод комплексных амплитуд Социальные проблемы и безработица Выполнили ученицы 11Б класса СОШ№2: Коптева Анастасия Грачева Наталья
Социальные проблемы и безработица Выполнили ученицы 11Б класса СОШ№2: Коптева Анастасия Грачева Наталья  Boże Narodzenie
Boże Narodzenie Выполнила учитель начальных классов МОУ – Сукроменская СОШ Банникова Наталья Олеговна
Выполнила учитель начальных классов МОУ – Сукроменская СОШ Банникова Наталья Олеговна Презентация "Путешествие от барокко к классицизму 4" - скачать презентации по МХК
Презентация "Путешествие от барокко к классицизму 4" - скачать презентации по МХК Современная Front-End разработка. Объектно-ориентированное программирование в JavaScript. (Лекция 4)
Современная Front-End разработка. Объектно-ориентированное программирование в JavaScript. (Лекция 4) Електроємність. Конденсатори. (Лекция 6)
Електроємність. Конденсатори. (Лекция 6) Инклюзивный ПрофГид. Содействие профориентации и трудоустройству лиц с ОВЗ и инвалидностью
Инклюзивный ПрофГид. Содействие профориентации и трудоустройству лиц с ОВЗ и инвалидностью