Содержание
- 2. План Химическая связь Понятие и виды химической связи Локализованная химическая связь Ковалентные связи (σ- и π-
- 3. Химическая связь Понятие и виды химической связи Химическая связь – совокупность взаимодействий между электронами и ядрами,
- 4. Локализованная связь – это химическая связь, электроны которой поделены между двумя атомами. Ковалентная связь – это
- 5. Атомная орбиталь – это область пространства в окрестности ядра, где имеется максимальная вероятность найти данный электрон
- 6. Гибридизация – это смешивание двух и более АО разной формы и энергии с образованием новых АО
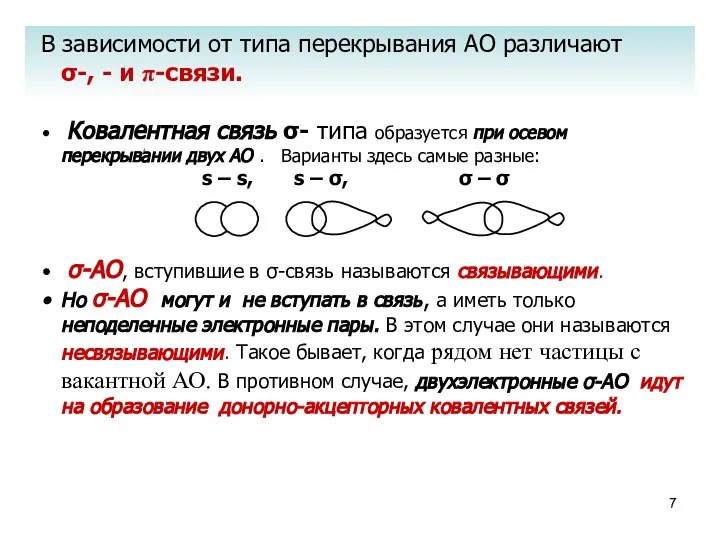
- 7. В зависимости от типа перекрывания АО различают σ-, - и π-связи. Ковалентная связь σ- типа образуется
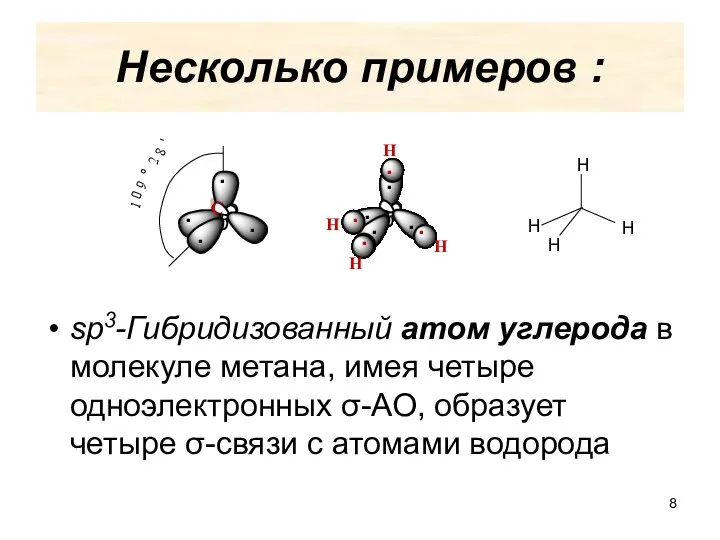
- 8. Несколько примеров : sp3-Гибридизованный атом углерода в молекуле метана, имея четыре одноэлектронных σ-АО, образует четыре σ-связи
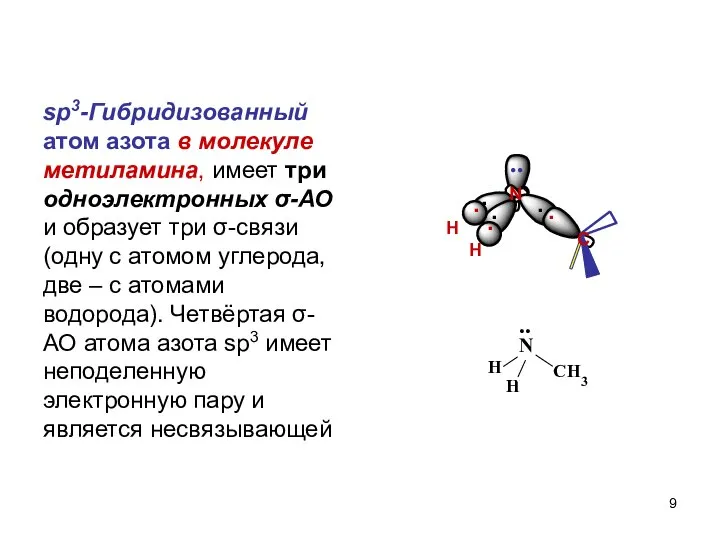
- 9. sp3-Гибридизованный атом азота в молекуле метиламина, имеет три одноэлектронных σ-АО и образует три σ-связи (одну с
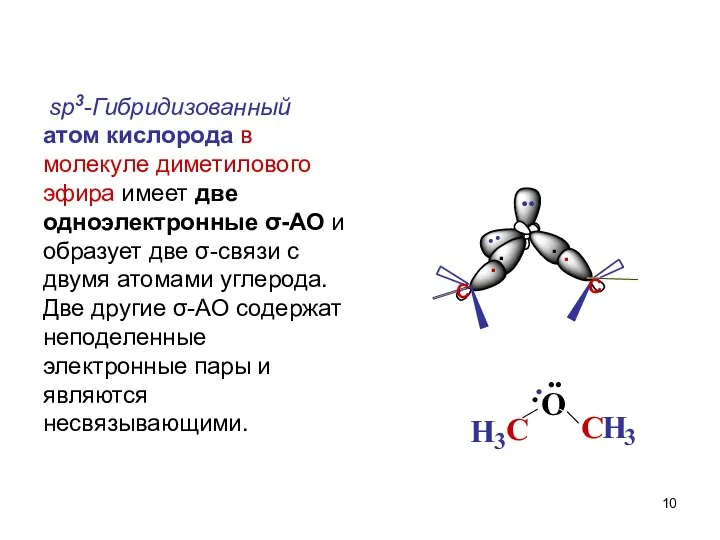
- 10. sp3-Гибридизованный атом кислорода в молекуле диметилового эфира имеет две одноэлектронные σ-АО и образует две σ-связи с
- 11. Аналогично идет построение σ-связей у sp2- и sp- гибридизованных атомов-органогенов sp2= 1s + 2p = 3
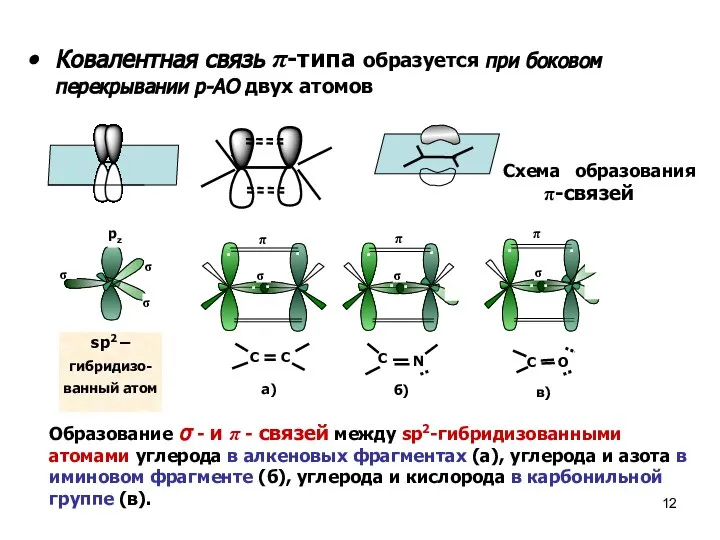
- 12. Ковалентная связь π-типа образуется при боковом перекрывании р-АО двух атомов Схема образования π-связей Образование σ -
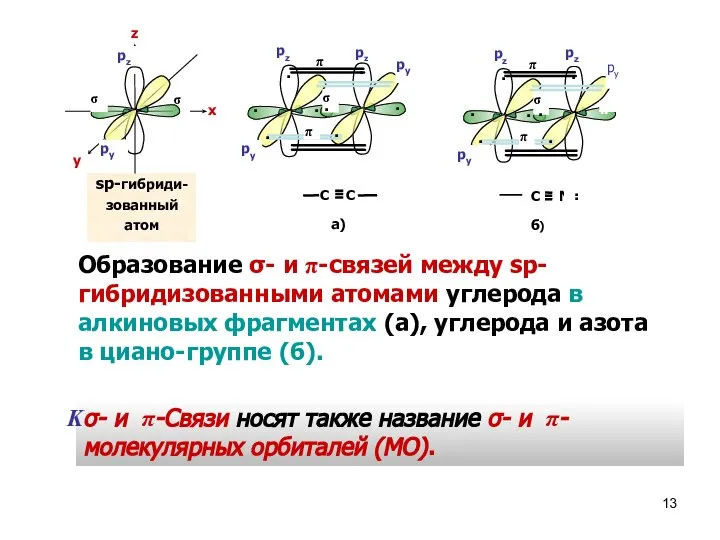
- 13. Образование σ- и π-связей между sp-гибридизованными атомами углерода в алкиновых фрагментах (а), углерода и азота в
- 14. По способу обобществления электронов (или по механизму образования) Ковалентные связи бывают Обычные (обменные) Донорно-акцепторные Обычная ковалентная
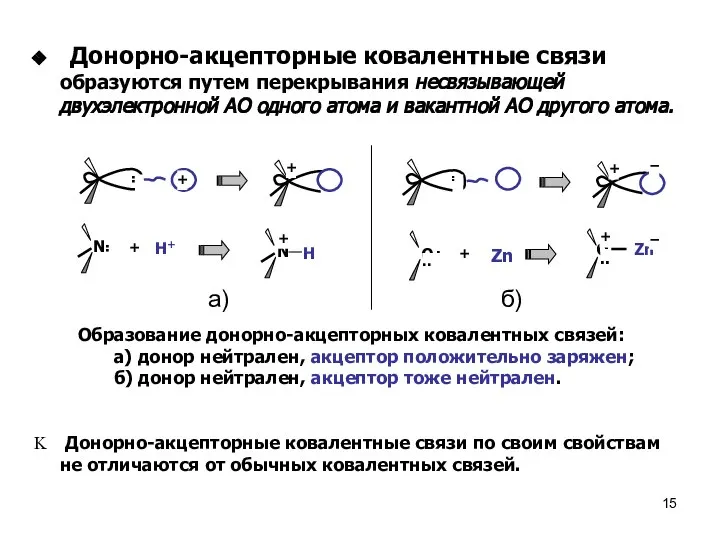
- 15. Донорно-акцепторные ковалентные связи образуются путем перекрывания несвязывающей двухэлектронной АО одного атома и вакантной АО другого атома.
- 16. Делокализованная химическая связь Делокализованная химическая связь – это ковалентная связь, молекулярная орбиталь которой охватывает более двух
- 17. Сопряженные системы с открытой цепью. Если две двойные связи разделены одинарной или рядом с двойной связью
- 18. Тот выигрыш энергии, который получается в результате эффекта сопряжения, называется энергией сопряжения, или энергией делокализации. В
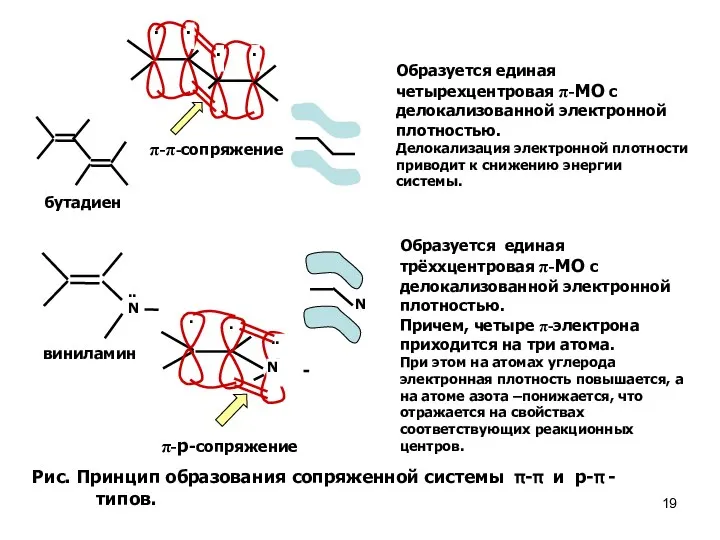
- 19. π-π-сопряжение Образуется единая четырехцентровая π-МО с делокализованной электронной плотностью. Делокализация электронной плотности приводит к снижению энергии
- 20. Сопряженные системы термодинамически стабильны. Они тяжело вступают в реакции присоединения по двойным связям и плохо окисляются.
- 22. Сопряженные системы с замкнутой цепью. Среди таких систем наиболее важное значение имеют ароматические системы. Ароматичность –
- 23. Классическим примером ароматической системы является бензол. Бензол имеет замкнутый плоский σ-скелет (все атомы углерода в sp
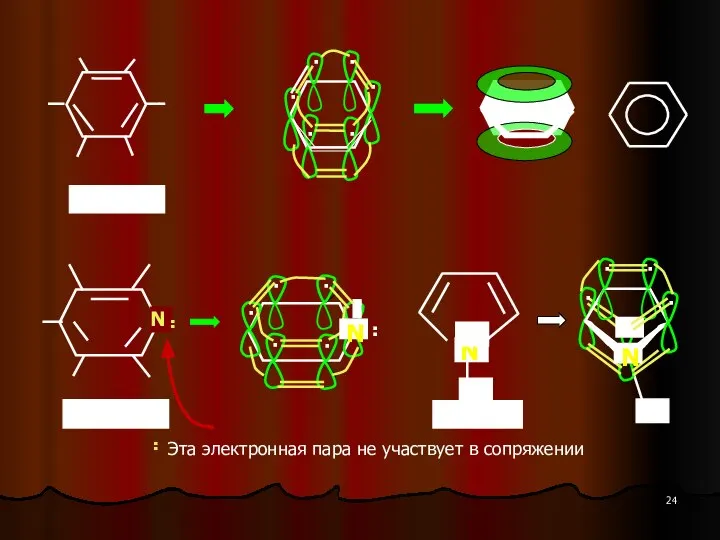
- 24. Эта электронная пара не участвует в сопряжении N ∙∙ Н пиррол ∙∙ ∙ ∙ N Н
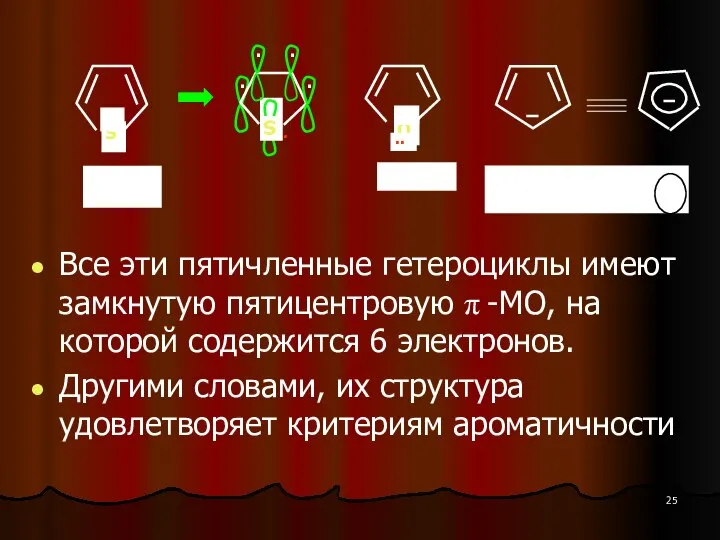
- 25. Все эти пятичленные гетероциклы имеют замкнутую пятицентровую π -МО, на которой содержится 6 электронов. Другими словами,
- 26. Ароматические системы (даже ионы) еще более устойчивы, чем системы с открытой цепью сопряжения. В обычных условиях
- 27. Взаимное влияние атомов в молекулах Взаимное влияние атомов в молекуле или ионе передаётся с помощью электронных
- 28. Электронные эффекты Электронные эффекты возникают, если в цепи ковалентно связанных атомов присутствуют неравноценные по электроотрицательности или
- 29. Такие заместители оказывают полярное влияние на электронную плотность атома партнера, что передается на следующие атомы. При
- 30. Электронные эффекты (продолжение) В зависимости от того, как передается полярное влияние заместителя по цепи ковалентно связанных
- 31. Индуктивный эффект – это передача полярного влияния заместителя по σ-связям в любой цепи. Например, в молекуле
- 32. Поскольку σ-связь плохо поляризуется, то частичные положительные заряды на каждом последующем атоме меньше, чем на предыдущем.
- 33. Индуктивный эффект бывает положительным и отрицательным. Если заместитель понижает электронную плотность соседних участков, то эффект этого
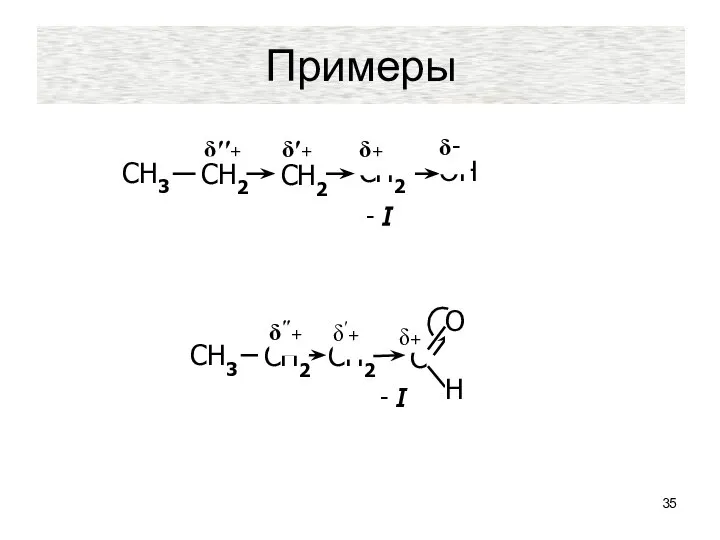
- 34. Отрицательный индуктивный эффект вызывают любые заместители, содержащие более электроотрицательные атомы по сравнению с углеродом: галогены (F,
- 35. Примеры СН3 δ′′+ СН2 СН2 δ+ ОН δ- - I
- 36. Положительным индуктивным эффектом обладают алкильные R-группы, связанные с sp2 и sp-гибридизованными атомами углерода, алкоксид-анион, оксид-анионные центры,
- 37. Мезомерный эффект – это передача полярного влияния атома или группы атомов по π -связям в сопряженной
- 38. Примеры В π-π- сопряженной системе мезомерный эффект направлен в сторону более электро отрицательного атома В р-π-
- 39. Знак мезомерного эффекта оценивается, исходя из графического обозначения, по тому же принципу, что и знак индуктивного
- 40. Электронодоноры и электроноакцепторы Заместители, обладающие -I и -М-эффектами, называются электроноакцепторами. Заместители, обладающие +I и +М-эффектами, называются
- 42. Скачать презентацию




























 Презентация Инвестиционная политика в РФ
Презентация Инвестиционная политика в РФ Механизм и функции и государства
Механизм и функции и государства Организация деятельности складского хозяйства предприятия (на примере торговой организации ИП Маньшина Л.Е.)
Организация деятельности складского хозяйства предприятия (на примере торговой организации ИП Маньшина Л.Е.) Лекція №1. Директиви препроцесора. Багатомодульне програмування
Лекція №1. Директиви препроцесора. Багатомодульне програмування Титаны Возрождения Леонардо да Винчи (1452-1519)
Титаны Возрождения Леонардо да Винчи (1452-1519) Презентация Индия
Презентация Индия Реконструкция ПС 110/10 «Сулеево» Альметьевского района
Реконструкция ПС 110/10 «Сулеево» Альметьевского района Стили изобразительного искусства Урок изобразительного искусства в 8 классе
Стили изобразительного искусства Урок изобразительного искусства в 8 классе Навыки обслуживания клиентов
Навыки обслуживания клиентов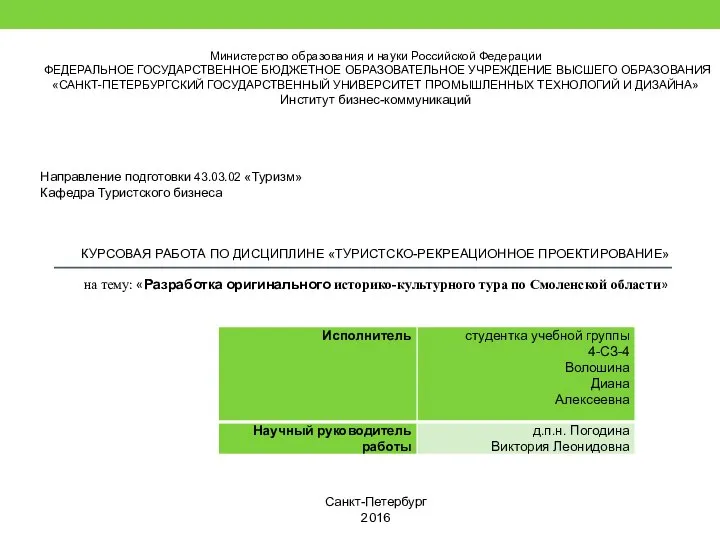 Разработка оригинального историко-культурного тура по Смоленской области
Разработка оригинального историко-культурного тура по Смоленской области Презентация на тему "Формирование универсальных учебных действий средствами УМК « Гармония»" - скачать презентации по Педаго
Презентация на тему "Формирование универсальных учебных действий средствами УМК « Гармония»" - скачать презентации по Педаго Авиаперевозка. Классификация специальных грузов
Авиаперевозка. Классификация специальных грузов Индия - страна чудес. (10 класс)
Индия - страна чудес. (10 класс) ОБЪЕМНЫЕ ИЗОБРАЖЕНИЯ В СКУЛЬПТУРЕ
ОБЪЕМНЫЕ ИЗОБРАЖЕНИЯ В СКУЛЬПТУРЕ Северо-Западное таможенное управление Выполнили: Кузнецова Крестина, Салчак Айлан, Ю-113б
Северо-Западное таможенное управление Выполнили: Кузнецова Крестина, Салчак Айлан, Ю-113б Физиология системы крови
Физиология системы крови Методы и средства Цифровой Обработки Сигналов Фильтры
Методы и средства Цифровой Обработки Сигналов Фильтры  Брахитерапия онкозаболеваний Брахитерапия онкозаболеваний
Брахитерапия онкозаболеваний Брахитерапия онкозаболеваний  Еволюційні алгоритми
Еволюційні алгоритми Фундаменты глубокого заложения. Геотехника II. Лекция 23
Фундаменты глубокого заложения. Геотехника II. Лекция 23 Буквы Н и НН в именах прилагательных, образованных от имен существительных (сказочное путешествие)
Буквы Н и НН в именах прилагательных, образованных от имен существительных (сказочное путешествие) Прямая и обратная пропорциональная зависимости 6 класс
Прямая и обратная пропорциональная зависимости 6 класс  Ich habe eine frage
Ich habe eine frage Архитектура и искусство Древней Руси
Архитектура и искусство Древней Руси Оптово-распределительный центр сельскохозяйственной продукции International Food Market в Санкт-Петербурге. Проект
Оптово-распределительный центр сельскохозяйственной продукции International Food Market в Санкт-Петербурге. Проект Обеспечение сохранности и защиты документов организации
Обеспечение сохранности и защиты документов организации Концертный зал им. И.Шакирова
Концертный зал им. И.Шакирова Презентация "Почему мы изучаем историю?" - скачать презентации по МХК
Презентация "Почему мы изучаем историю?" - скачать презентации по МХК