Содержание
- 2. План лекции: 1. Значение и задачи физической химии. 2. Методы физико-химических исследований 3. Краткая история физ.химии
- 3. Физическая химия – наука изучающая взаимосвязь химических процессов и физических явлений, которые их сопровождают, устанавливает закономерности
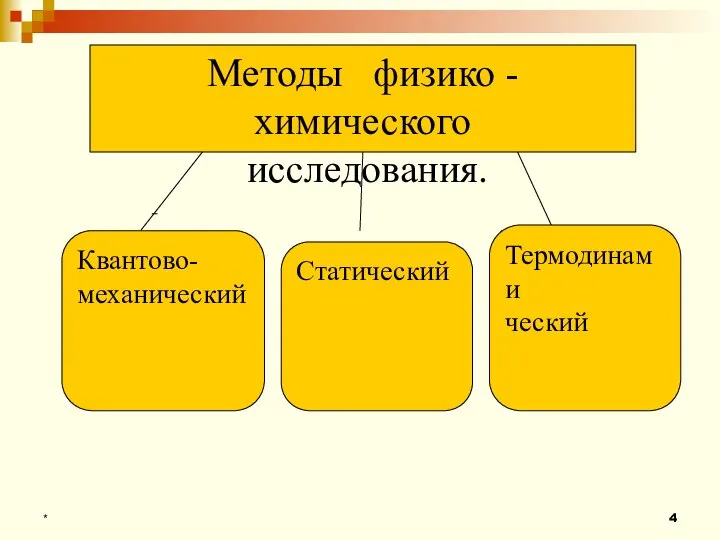
- 4. * Методы физико - химического исследования. Квантово- механический Термодинами ческий Статический
- 5. Разделы физической химии: Строение вещества Химическая термодинамика Фазовые равновесия Растворы Электрохимия Кинетика и катализ Физикохимия поверхностных
- 6. История физической химии. * XVIII в. становление науки «физическая химия». М.В. Ломоносов ввел понятие «физическая химия».
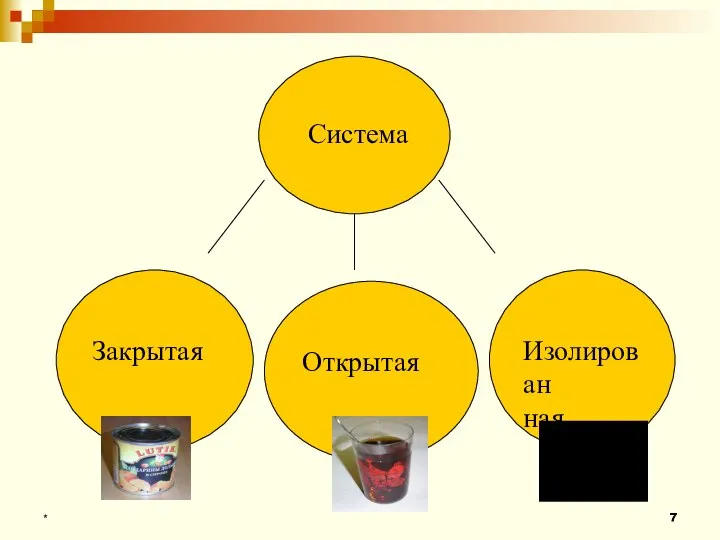
- 7. * Система Закрытая Открытая Изолирован ная
- 8. Газовые системы: 1. Смеси газов -однородные по составу, истинные растворы, представляющие собой одну «фазу». 2. При
- 9. Свойства газовых систем: 1. масса 2. обьем 3.температура 4. давление 5. плотность *
- 10. Температура Мера средней кинетической энергии молекул некоего тела. Передача движения молекул одного тела молекулами другого. *
- 11. Состояние газа: P V T T = f (P,V). !!! Нулевой закон (начало) термодинамики: две системы
- 12. Если два тела, нагретые до разных температур приведены в контакт друг с другом и остаются в
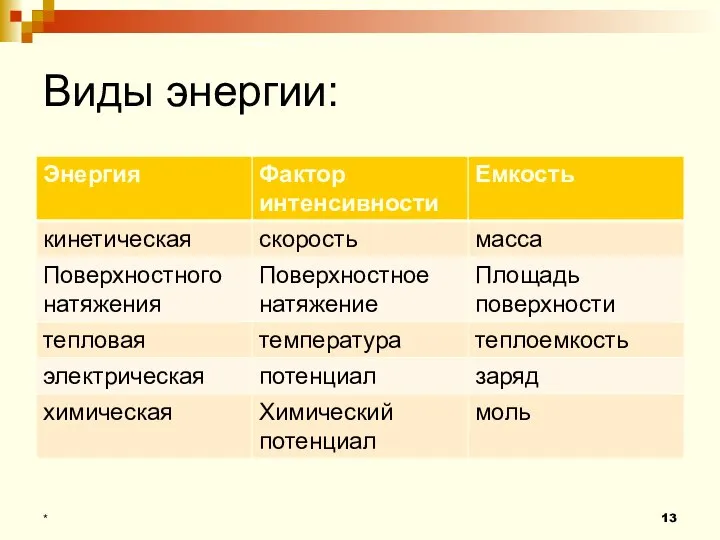
- 13. Виды энергии: *
- 14. Законы поведения идеальных газов: Закон Бойля (P1,V1 = P2,V2) Закон Шарля(Гей-Люссака):при охлаждении газа при постоянном давлении
- 15. Абсолютная температура – нижний предел температуры -273С (абсолютный нуль температуры). Шкала кельвина. T = t+273 При
- 16. Теплоемкость Теплоемкость газов: количество тепла которое необходимо для повышения температуры на 1С. Удельная теплоемкость (С) количество
- 17. Для газов удобно пользоваться молярной теплоемкостью сμ − количество теплоты, необходимое для нагревания 1 моля газа
- 18. * Реальные (неидеальные газы)
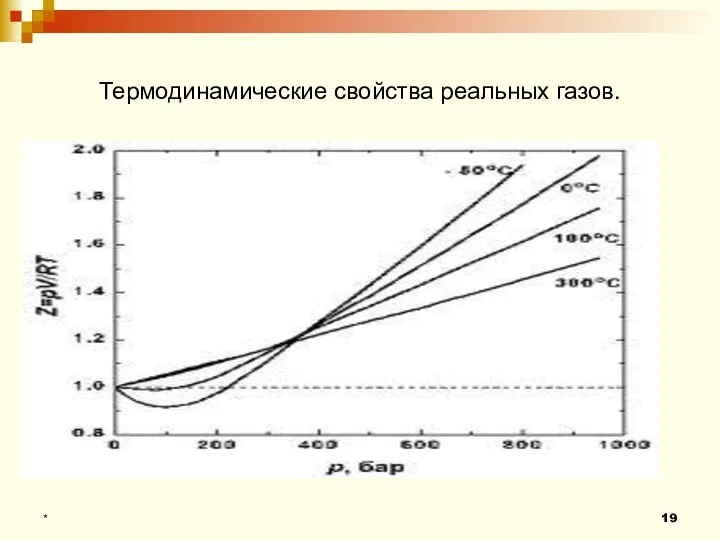
- 19. Термодинамические свойства реальных газов. *
- 20. Законы термодинамики; свободная энергия. Термодинамика – наука о превращении теплоты. *
- 21. 3. Установление критериев равновесного состояния термодинамических систем. Задачи химической термодинамики: 1 Установление энергетических эффектов химических и
- 22. Понятия термодинамики Энергия – способность производить работу. Термодинамические системы – макроскопические объекты, отделенные от окружающего пространства
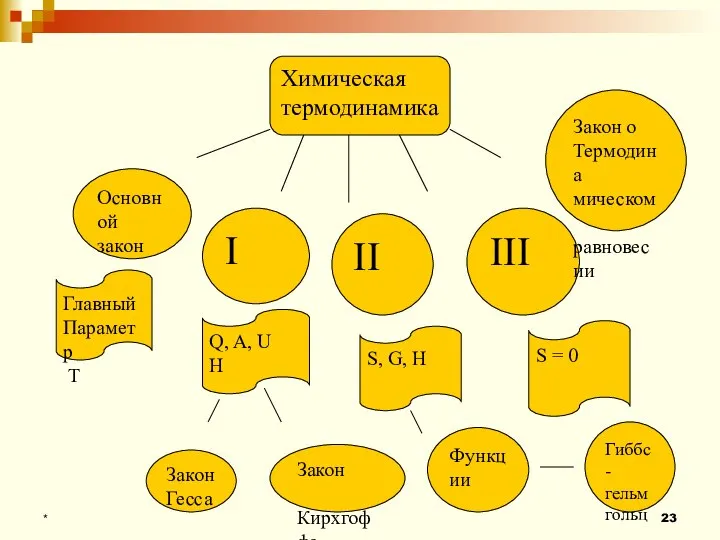
- 23. * Химическая термодинамика Основной закон I II III Закон о Термодина мическом равновесии Главный Параметр Т
- 24. Два постулата термодинамики: 1. Любая изолированная система с течением времени приходит в равновесное состояние и самопроизвольно
- 25. Энергия, связанная с внутренними движениями частиц системы и их взаимодействиями между собой, называется внутренней. Внутренняя энергия
- 26. Внутренняя энергия (U) – однозначная функция состояния термодинамической системы: изменение внутренней энергии ΔU при переходе системы
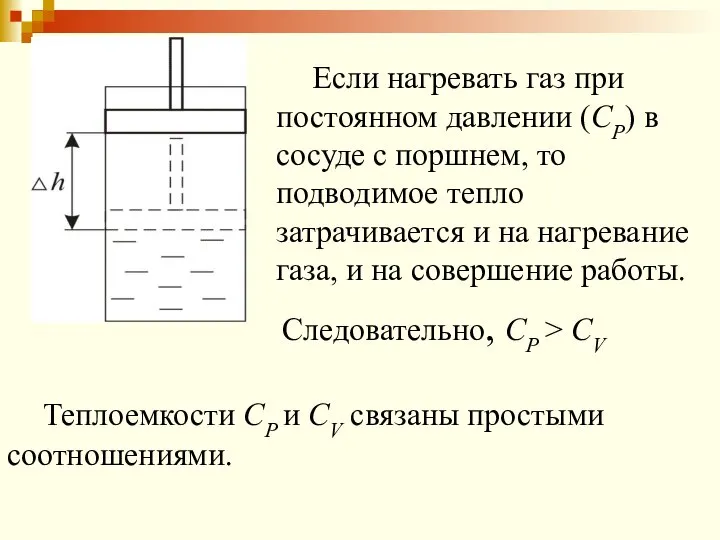
- 27. Если нагревать газ при постоянном давлении (СР) в сосуде с поршнем, то подводимое тепло затрачивается и
- 28. Изменение со временем одного из параметров системы или нескольких, следует что в системе протекает процесс. *
- 29. Термодинамические функции: E – внутренняя энергия H - энтальпия S - энтропия G – свободная энергия
- 30. 1. H = E + PV 2. A = E – TS 3. G = H
- 31. Тепловые процессы: Экзотермический процесс Эндотермический процесс
- 32. Факторы ΔН, ΔU: 1) Природа реакции 2) Количество вещества кДж/моль! С8Н18 + 25/2 О2 = 8СО2
- 33. Факторы ΔН, ΔU: Агрегатное состояние и аллотропные модификации Н2Ож → Н2Ог – 44 кДж/моль Сграфит →
- 34. Факторы ΔН, ΔU: Т и р Стандартные условия: p = 105 Па ≈ 1 атм Т
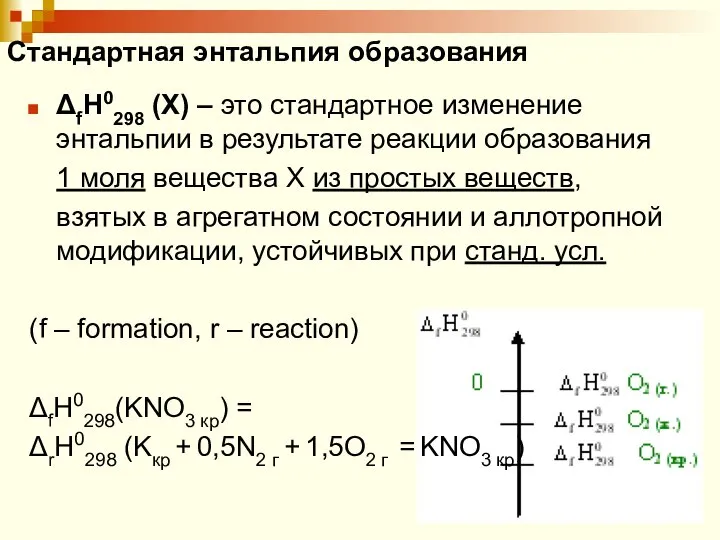
- 35. Стандартная энтальпия образования ΔfH0298 (X) – это стандартное изменение энтальпии в результате реакции образования 1 моля
- 36. Стандартная энтальпия сгорания ΔbH0298 (X) – это энтальпия реакции сгорания 1 моля вещества Х в кислороде
- 37. Стандартные энтальпии фазовых переходов: Стандартная энтальпия сублимации ΔsH0298 (X) Стандартная энтальпия испарения ΔvH0298 (X) Стандартная энтальпия
- 38. Стандартная энтальпия химической связи: – это изменение энтальпии в реакции образования 1 моля газообразных двухатомных частиц
- 39. ТЕРМОДИНАМИЧЕСКИЕ ПАРАМЕТРЫ СОСТОЯНИЯ СИСТЕМЫ (ТПСС) 2. Функции состояния : внутренняя энергия (U), U = Eкин. +
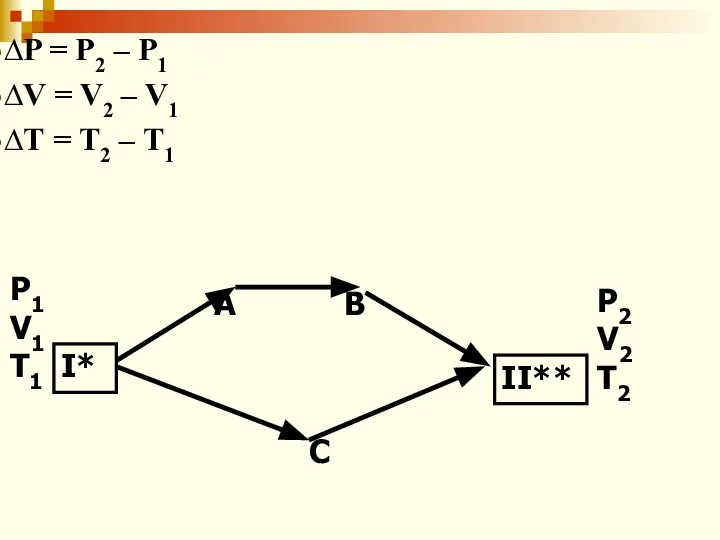
- 40. P1 V1 T1 P2 V2 T2 I* A B II** C ∆P = P2 – P1
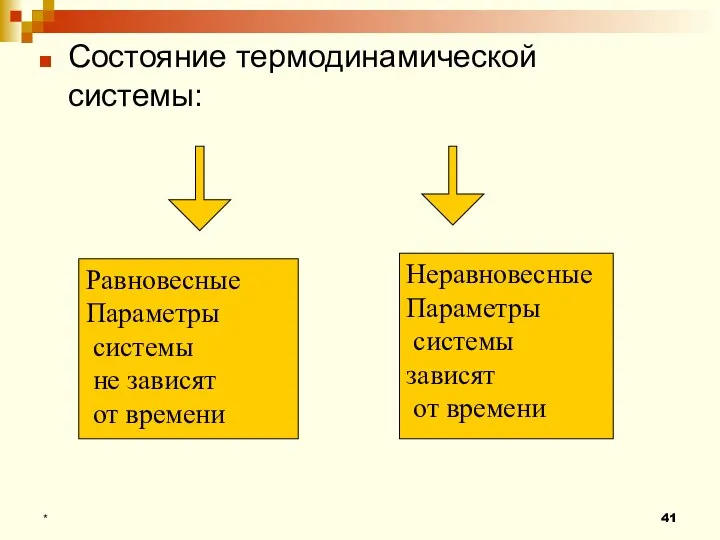
- 41. Состояние термодинамической системы: * Равновесные Параметры системы не зависят от времени Неравновесные Параметры системы зависят от
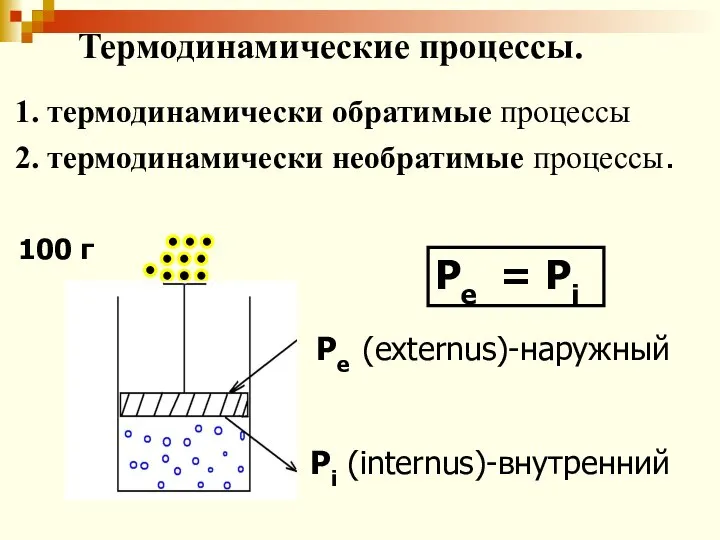
- 42. Pe (externus)-наружный Pi (internus)-внутренний Pe = Pi 100 г Термодинамические процессы. 1. термодинамически обратимые процессы 2.
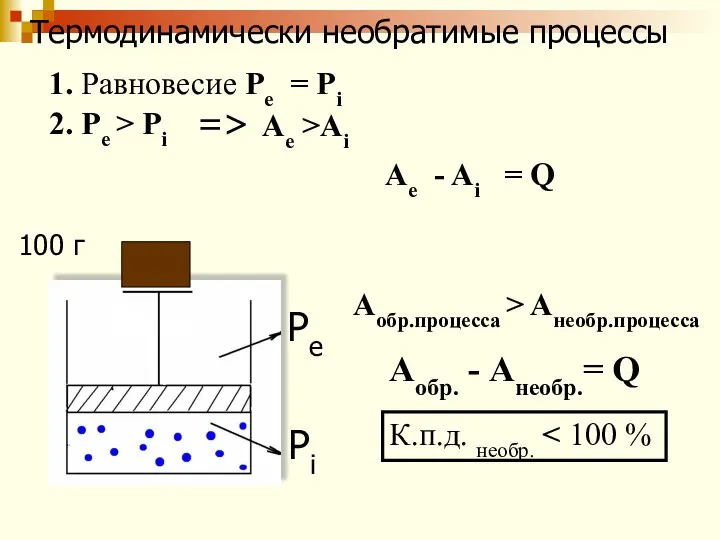
- 43. Термодинамически необратимые процессы Pe Pi 1. Равновесие Pe = Pi 2. Ре > Рi => Ae
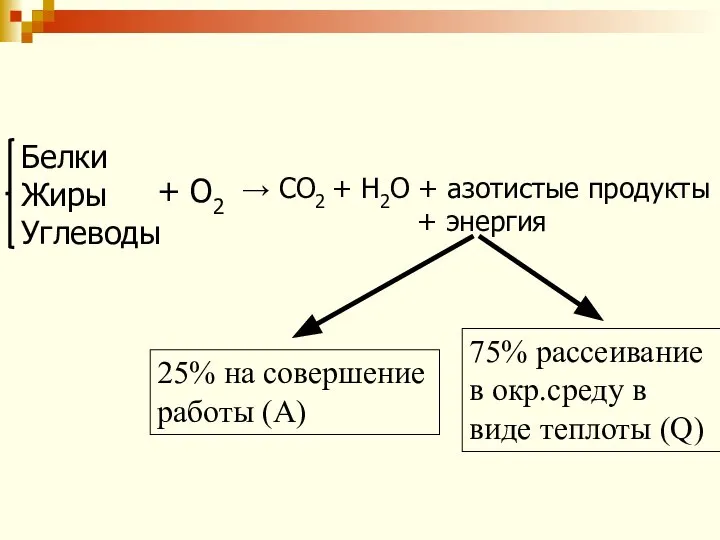
- 44. → СО2 + Н2О + азотистые продукты + энергия Белки Жиры Углеводы + О2 25% на
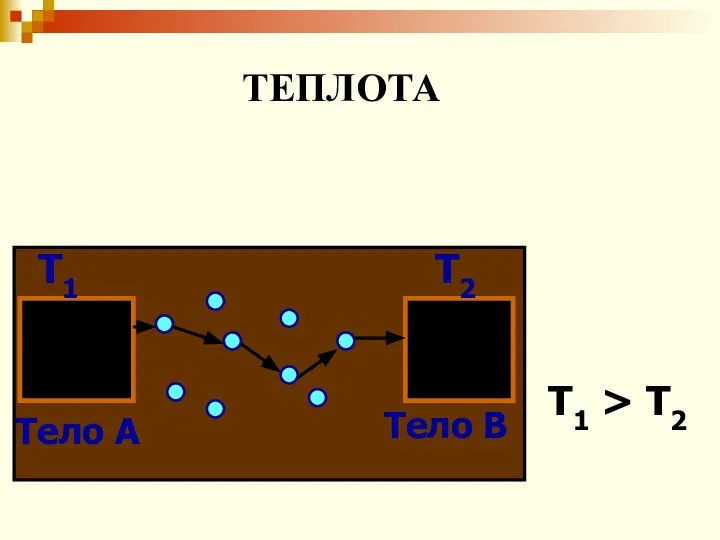
- 45. Тело А Тело В Т1 Т2 Т1 > Т2 ТЕПЛОТА
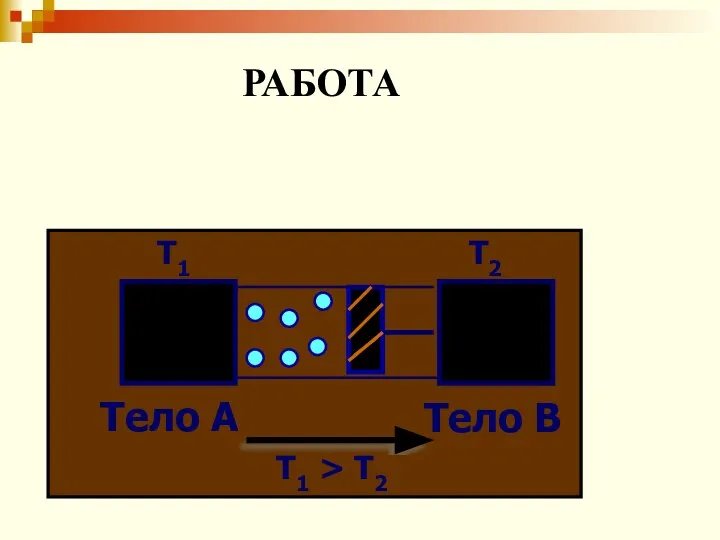
- 46. Тело А Тело B Т1 Т2 Т1 > Т2 РАБОТА
- 47. Первый закон термодинамики Количество энергии, которое выделяется или поглощается в форме теплоты и работы, равно изменению
- 48. Р.Майер (1842 г.), Д. Джоуль (1842 г.), Л. Гельмгольц (1847 г.) Q = ∆U + А
- 49. Применение первого закона (Q = ∆U + А) термодинамики к различным процессам. 1. Изохорные процессы. V
- 50. 2. Изобарные процессы. р =const, ∆р=0, QР = U2 – U1 + р(V2 – V1); QР
- 51. 3. Изотермические процессы. Т = const, ∆Т =0 Q=∆U + A ∆Т = 0, ∆U =
- 52. ТЕРМОХИМИЯ - Тепловой эффект реакции - Q Стандартный тепловой эффект – Q0 Р = 1атм; 101,3
- 53. Термохимические уравнения: Термохимическая форма записи: Н2 (г) + ½ О2(г) → Н2О (ж) + Q; Н2
- 54. Закон Гесса (1840 г.) ΙΙ. а) С + ½ О2 → СО ∆Н1 = - 283
- 55. С6Н12О6(тв) + 6 О2(г) →6 СО2(г) + 6 Н2О(ж); ∆Н =? ∆Нор-ции= (6∆НообрСО2 + 6∆НообрН2О) –
- 56. Стандартная энтальпия сгорания (∆Носг.) – 2 . ∆Нореакции = ∑∆Носг.исх.в-в. - ∑∆Носг.прод.
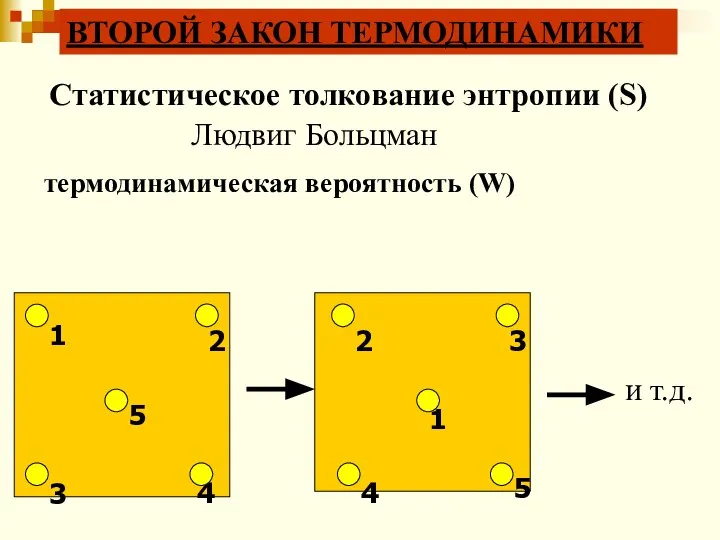
- 57. 1 2 3 4 1 3 4 2 5 5 и т.д. Статистическое толкование энтропии (S)
- 58. S = k· lnW W- термодинамическая вероятность; S – энтропия; k – постоянная Больцмана; R =
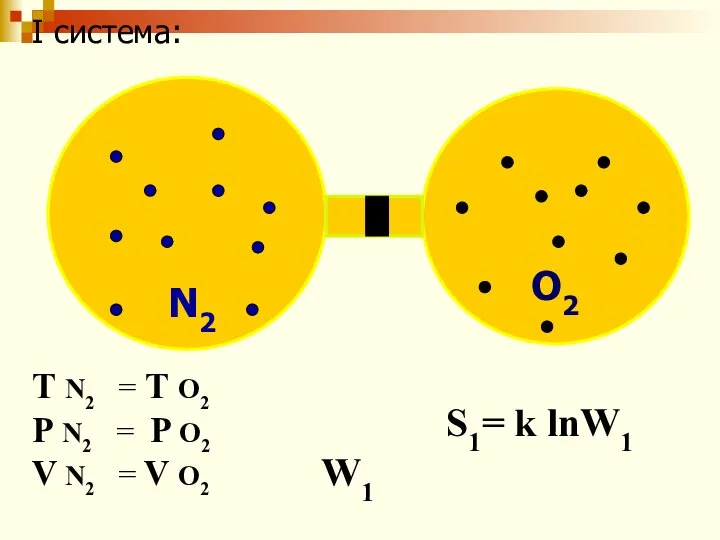
- 59. N2 O2 I система: Т N2 = Т O2 P N2 = P O2 V N2
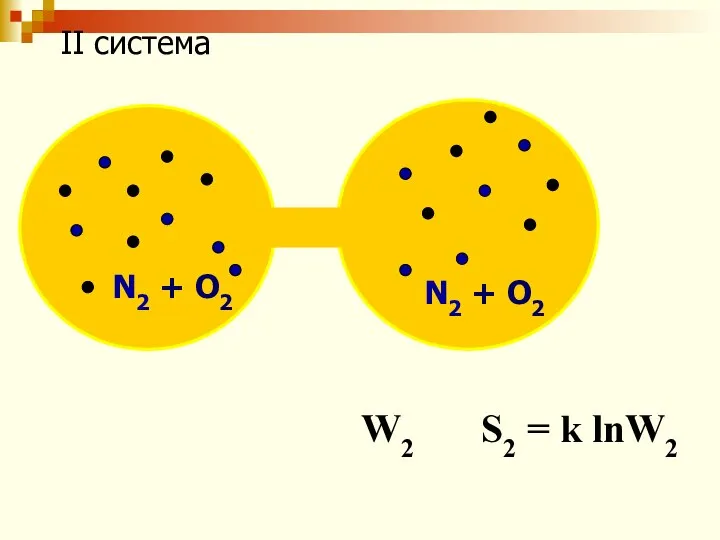
- 60. N2 + O2 N2 + O2 II система W2 S2 = k lnW2
- 61. W2 > W1 => S2 > S1 ∆S = S2 - S1 = k lnW2- k
- 62. ∆S математическое выражение второго закона термодинамики. [S]– [ Дж/ моль·К] Изолированная система: Q = 0 ∆S
- 63. Объединенное уравнение первого и второго законов термодинамики. I. Q = ∆U + А II. ∆S =
- 64. Аобщ. = р·∆V + Аполезн. T·∆S = ∆U + А общая T·∆S = ∆U + р·∆V
- 65. 1. А>0, ∆G 2. А=0, ∆G=0 3. А 0 Влияние энтальпийного (∆Н) и энтропийного (∆S) фактора
- 66. Анализ: ∆G = ∆Н - Т∆S 1) если ∆Н 0, то ∆G 2) если ∆Н>0 (эндо-)
- 67. Расчет свободной энергии Гиббса при стандартных условиях (∆Gо) в химических реакциях. ∆Gо298 обр. - стандартная из
- 68. Расчет ∆Gреакции в реальных условиях. А + В С + D ∆G = ∆Gо + RT
- 69. Термодинамика химического равновесия. хА + уВ mC + nD V1 V2 V1 = V2 химическое равновесие.
- 70. Кх.р. = Чем > Кх.р., тем более глубоко процесс идет вправо Кх.р. зависит: от Т ;
- 71. Уравнение изотермы химической реакции. А + В C + D ∆G = ∆Gо + RT ln
- 72. Анализ: ∆G = RT (ln R, T, Кх.р. - это const в уравнении, поэтому, знак ∆G
- 73. Уравнение изобары химической реак-и р=const; ∆р=0 А + В C + D ∆Gо = - RT
- 74. Анализ: 1. экзотермические реакции: ∆Н а) повышаем Т => Т2>Т1 и тогда ln >0 и К1>К2
- 75. б) понижаем Т => Т2 > 0 тогда ln => равновесие → 2. эндотермические реакции: ∆Н>0
- 77. Скачать презентацию











































![∆S математическое выражение второго закона термодинамики. [S]– [ Дж/ моль·К] Изолированная](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1294503/slide-61.jpg)













 Лекция 5
Лекция 5 Введение в техническую графику. Тест
Введение в техническую графику. Тест Эко-центр активного отдыха и похудения «fitness camp active»
Эко-центр активного отдыха и похудения «fitness camp active» Українські обереги
Українські обереги Национальные костюмы
Национальные костюмы Гражданско-правовая защита имущественных прав
Гражданско-правовая защита имущественных прав  Психодиагностика 30-39 годы
Психодиагностика 30-39 годы Об использовании класса CursorAdapter в Microsoft Visual FoxPro
Об использовании класса CursorAdapter в Microsoft Visual FoxPro СОВРЕМЕННЫЕ ТЕХНОЛОГИИ ОБУЧЕНИЯ ИНОСТРАННОМУ ЯЗЫКУ МБОУ «СОШ№18» г.Балаково Учитель немецкого языка Котунова М.Н.
СОВРЕМЕННЫЕ ТЕХНОЛОГИИ ОБУЧЕНИЯ ИНОСТРАННОМУ ЯЗЫКУ МБОУ «СОШ№18» г.Балаково Учитель немецкого языка Котунова М.Н.  ИММУНОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ
ИММУНОЛОГИЧЕСКАЯ ТОЛЕРАНТНОСТЬ АУТОИММУННЫЕ ЗАБОЛЕВАНИЯ Формирование математических способностей: пути и формы Заседание школы молодого педагога
Формирование математических способностей: пути и формы Заседание школы молодого педагога Модуль числа 8 класс
Модуль числа 8 класс Народные промыслы России
Народные промыслы России КПП переднеприводного автомобиля
КПП переднеприводного автомобиля Программа для преобразования воксельной модели в полигональную
Программа для преобразования воксельной модели в полигональную Обработки Сигналов Аудио системы
Обработки Сигналов Аудио системы  Подъемно-транспортное оборудование
Подъемно-транспортное оборудование Урок №14 (59) Острые и тупые углы. Угольник
Урок №14 (59) Острые и тупые углы. Угольник  Программа испытаний СИ для целей утверждения типа
Программа испытаний СИ для целей утверждения типа ЦЕЛЬ: Воспитание правовой культуры школьников
ЦЕЛЬ: Воспитание правовой культуры школьников Общие понятия о сечениях. Правила выполнения наложенных и вынесенных сечений, их обозначение
Общие понятия о сечениях. Правила выполнения наложенных и вынесенных сечений, их обозначение Структурная схема цифровой обработки сигналов
Структурная схема цифровой обработки сигналов LG Group («Life is Good», элджи груп) – тұрмыстық электроника
LG Group («Life is Good», элджи груп) – тұрмыстық электроника Эффективность применения системы пилатес в процессе занятий с женщинами 45-55 лет
Эффективность применения системы пилатес в процессе занятий с женщинами 45-55 лет Биография Антуана де Сент-Экзюпери
Биография Антуана де Сент-Экзюпери  Особенности препарирования кариозных полостей по Блеку
Особенности препарирования кариозных полостей по Блеку  Борис Николаевич Ельцин
Борис Николаевич Ельцин Методы объектов. (Занятие 8)
Методы объектов. (Занятие 8)