Содержание
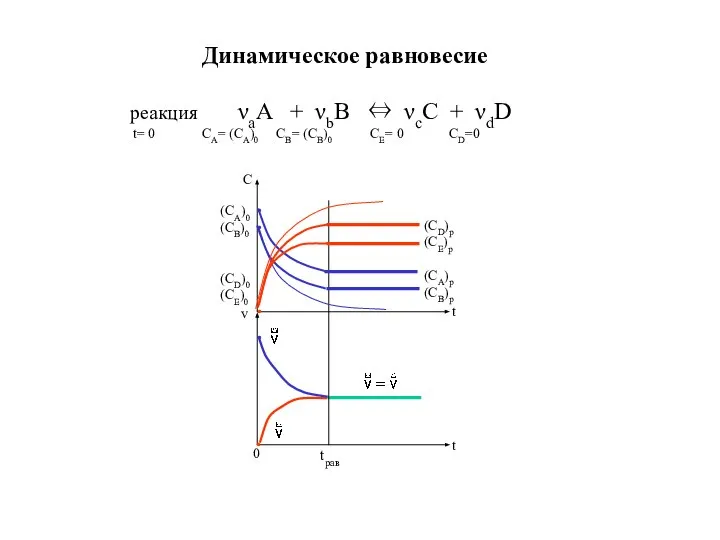
- 2. Динамическое равновесие реакция νаA + νbB ⇔ νсC + νdD t= 0 CA= (CA)0 CB= (CB)0
- 3. Константа равновесия Связь между стандартной К 0 (термодинам.) и К(кинетич.условия) К≡KX - концентрации задаются мольными долями
- 4. Расчет равновесного состава газовой смеси 1. Расчет К0(Т) Т → ΔrG0(T)=ΔrH0(T) –Т·ΔrS0(T) → КX → Xi
- 5. Пример. Диссоциация АВ при Р -const и температуре Т АВ = А + В ni САВ-z
- 6. Равновесие в растворах(дисперсных системах)
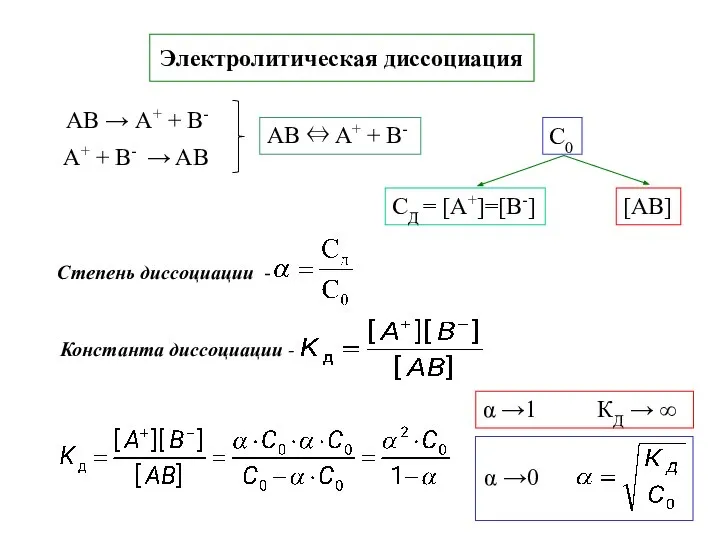
- 7. Электролитическая диссоциация С0 α →1 КД → ∞
- 8. Диссоциация воды H2O ⇔ H+ + OH- Нейтральная среда [H+] = [OH–] = 10-7 [моль/л] Кислая
- 9. Водородный показатель pH = –lg[H+] Нейтральная среда pH = 7 Кислая среда pH Щелочная среда pH
- 10. Растворы кислот и оснований МеOH ⇔ Ме+ + OH- α →0 α →1 рН = –lg[α⋅Скисл]
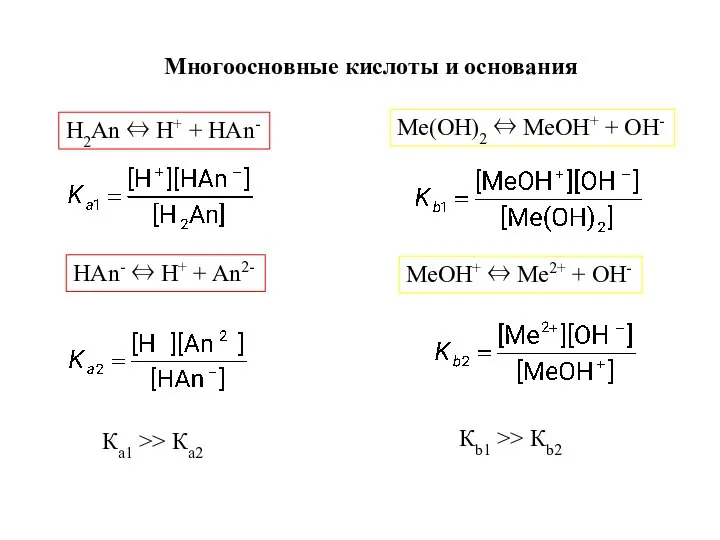
- 11. Многоосновные кислоты и основания H2An ⇔ H+ + НAn- HAn- ⇔ H+ + An2- Ка1 >>
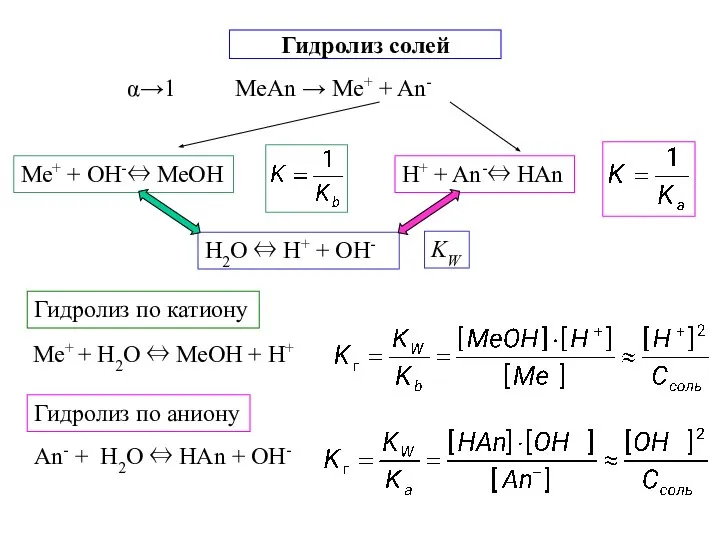
- 12. Гидролиз солей α→1 МеAn → Ме+ + An- Гидролиз по катиону Гидролиз по аниону
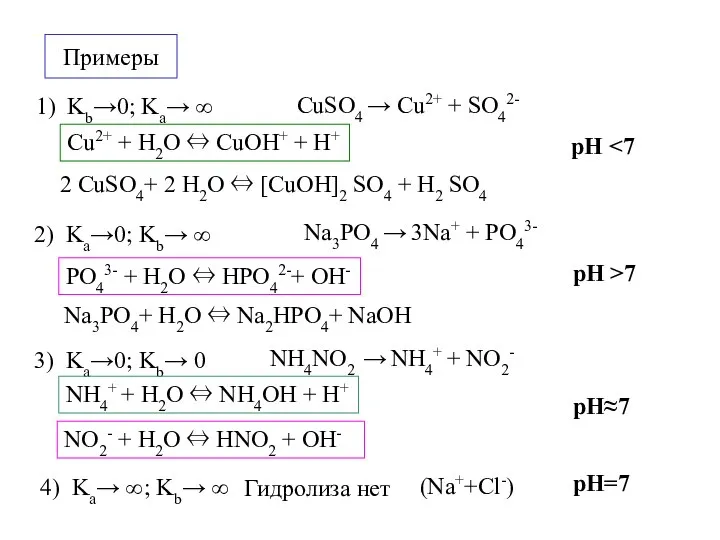
- 13. Примеры 1) Kb→0; Ka→ ∞ CuSO4 → Cu2+ + SO42- 2 CuSO4+ 2 H2O ⇔ [CuOH]2
- 14. Произведение растворимости [Kat+]= x·C [моль/л] [An-]= y·C [моль/л]
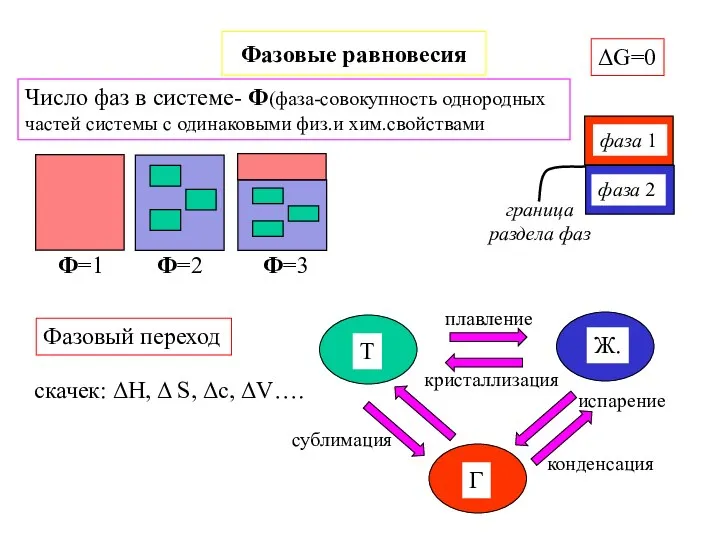
- 15. Фазовые равновесия ΔG=0 Фазовый переход скачек: ΔH, Δ S, Δc, ΔV…. Число фаз в системе- Ф(фаза-совокупность
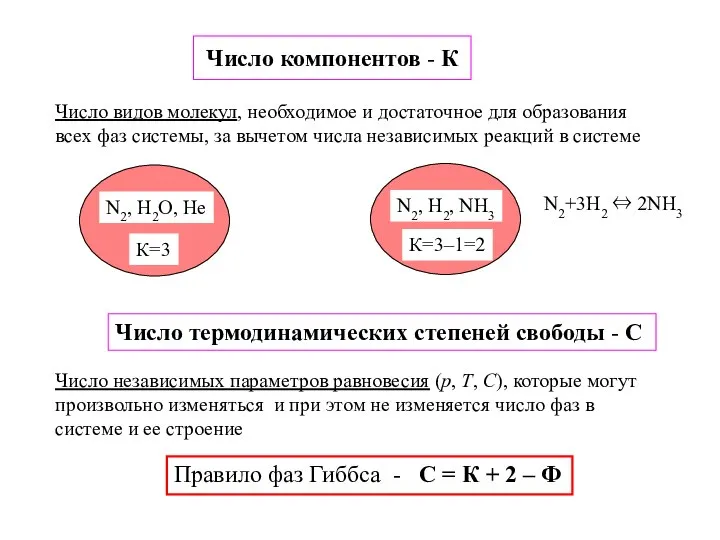
- 16. Число компонентов - К Число видов молекул, необходимое и достаточное для образования всех фаз системы, за
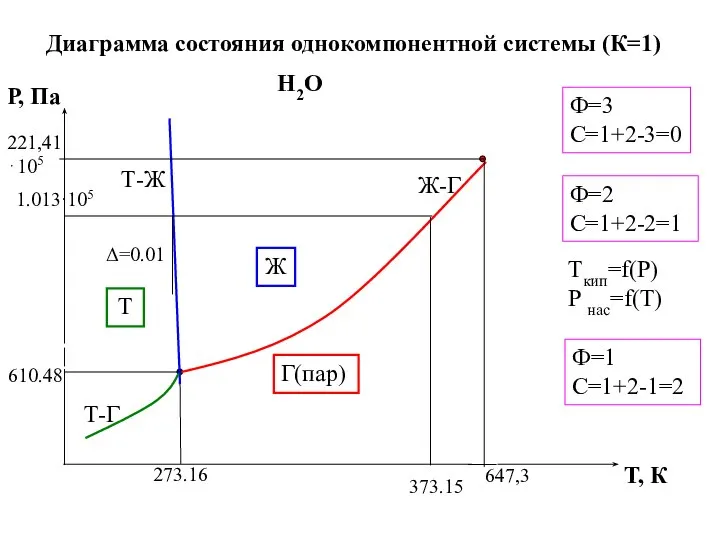
- 17. Диаграмма состояния однокомпонентной системы (К=1) Н2О Ф=2 С=1+2-2=1 Ф=3 С=1+2-3=0 Ф=1 С=1+2-1=2 Ж Г(пар) Т Tкип=f(Р)
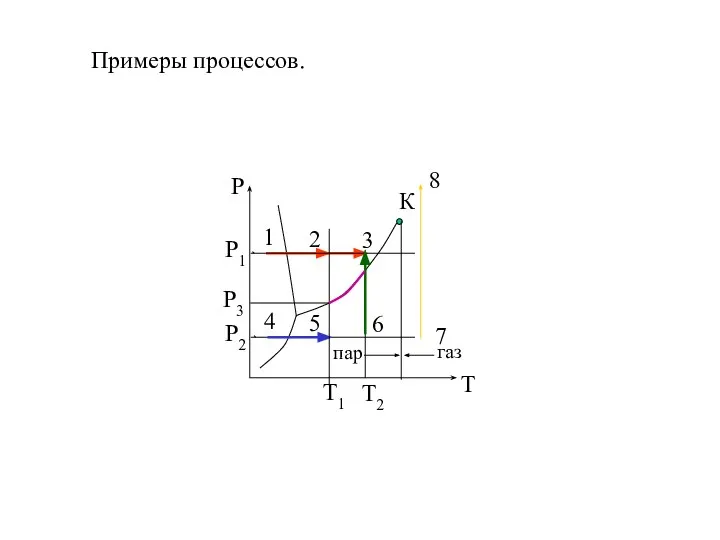
- 18. Примеры процессов.
- 19. Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор). α→0 Двухфазное равновесие С = 2 + 2
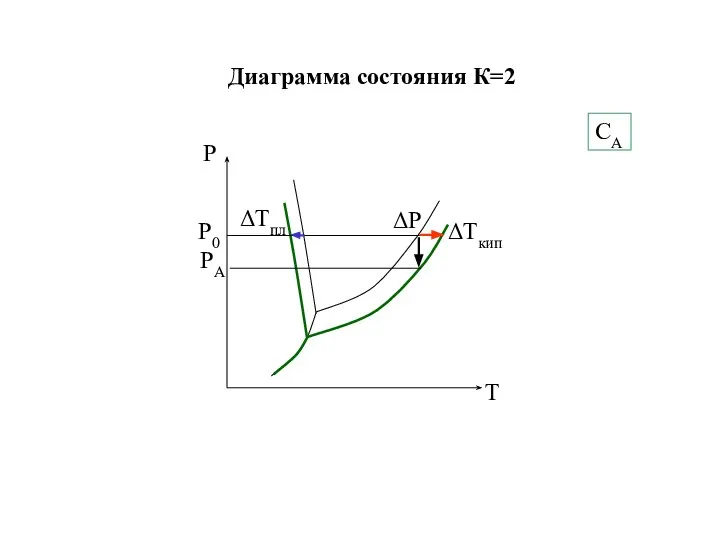
- 20. Диаграмма состояния К=2 СА
- 21. Кипение и кристаллизация растворов Повышение температуры кипения раствора по сравнению с чистым растворителем (ΔТкип) прямо пропорционально
- 22. Эбуллиоскопические и криоскопические постоянные некоторых растворителей
- 24. Скачать презентацию




![Диссоциация воды H2O ⇔ H+ + OH- Нейтральная среда [H+] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300274/slide-7.jpg)
![Водородный показатель pH = –lg[H+] Нейтральная среда pH = 7 Кислая](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300274/slide-8.jpg)

![Произведение растворимости [Kat+]= x·C [моль/л] [An-]= y·C [моль/л]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300274/slide-13.jpg)
![Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор). α→0 Двухфазное равновесие](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1300274/slide-18.jpg)


 Мини-кондитерская по изготовлению пончиков
Мини-кондитерская по изготовлению пончиков Презентация Дифференциация цен в зависимости от расходов на транспортировку товаров
Презентация Дифференциация цен в зависимости от расходов на транспортировку товаров  Электроника. Последовательностная логика
Электроника. Последовательностная логика Методология тестирования web-приложения
Методология тестирования web-приложения Презентация____
Презентация____ Геохронология
Геохронология Краткий курс начинающего инноватора. Freeride по долине смерти Гуревич Дмитрий Алексеевич, коммерческий директор ОАО «МБКИ» - М
Краткий курс начинающего инноватора. Freeride по долине смерти Гуревич Дмитрий Алексеевич, коммерческий директор ОАО «МБКИ» - М Подготовка к ЕГЭ 2014 по математике Решение задания С1
Подготовка к ЕГЭ 2014 по математике Решение задания С1 Многопоточные вычисления на БД
Многопоточные вычисления на БД ГП РФ 2 лекция
ГП РФ 2 лекция Теоретические основы ноксологии
Теоретические основы ноксологии Технология возведения крупнопанельных зданий. (Лекция 4)
Технология возведения крупнопанельных зданий. (Лекция 4) СТАТУЯ СВОБОДЫ Выполнили студенты группы РБ-10 Попова М.В Кириллина А.Ф
СТАТУЯ СВОБОДЫ Выполнили студенты группы РБ-10 Попова М.В Кириллина А.Ф Занятия горожан в старину. Ремёсла - презентация для начальной школы_
Занятия горожан в старину. Ремёсла - презентация для начальной школы_ Центр обработки данных
Центр обработки данных  Презентация Проблема продовольственной безопасности России в современных условиях
Презентация Проблема продовольственной безопасности России в современных условиях Презентация Генномодифицированные продукты
Презентация Генномодифицированные продукты ЭКОНОМИКА КАНАДЫ
ЭКОНОМИКА КАНАДЫ  Агата Крісті
Агата Крісті Художник - анималист
Художник - анималист Цифро-аналоговые преобразователи (ЦАП)
Цифро-аналоговые преобразователи (ЦАП) Системы случайных величин
Системы случайных величин Методы синтеза и анализа цифровых фильтров. КИХ-фильтры (2)
Методы синтеза и анализа цифровых фильтров. КИХ-фильтры (2) Классификация моделей данных
Классификация моделей данных Пересечение поверхностей. Способ вспомогательных концентрических сфер
Пересечение поверхностей. Способ вспомогательных концентрических сфер Частотная дисперсия диэлектрической проницаемости
Частотная дисперсия диэлектрической проницаемости Russiancop casting, совместно с телеканалом ТНТ, проводит кастинг на различные эпизодичные роли в 5 сезоне
Russiancop casting, совместно с телеканалом ТНТ, проводит кастинг на различные эпизодичные роли в 5 сезоне Моделирование, типы моделей
Моделирование, типы моделей