Содержание
- 2. Превращения веществ - химическая реакция Превращения веществ: AB2 C2D → AD BC молекулы обмениваются атомами Уравнение
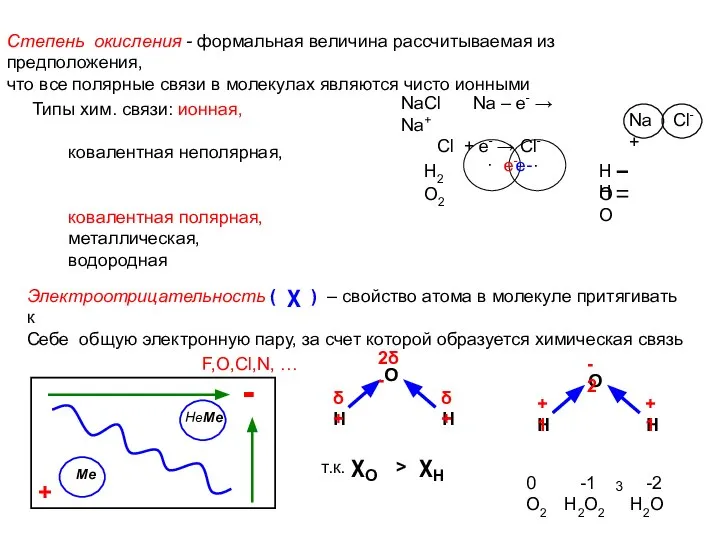
- 3. Степень окисления - формальная величина рассчитываемая из предположения, что все полярные связи в молекулах являются чисто
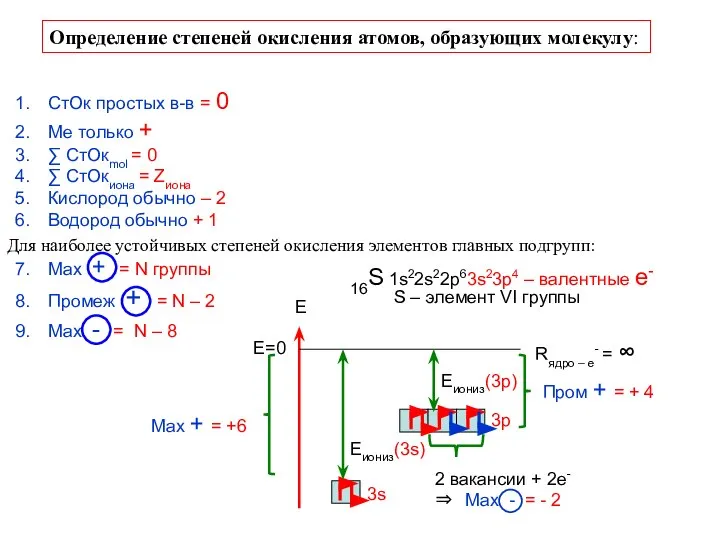
- 4. Определение степеней окисления атомов, образующих молекулу: Для наиболее устойчивых степеней окисления элементов главных подгрупп: СтОк простых
- 5. Исключения и некоторые важные СтОк B, Al +3 N -3 ÷ +5 Hal (Cl2, Br2, I2)
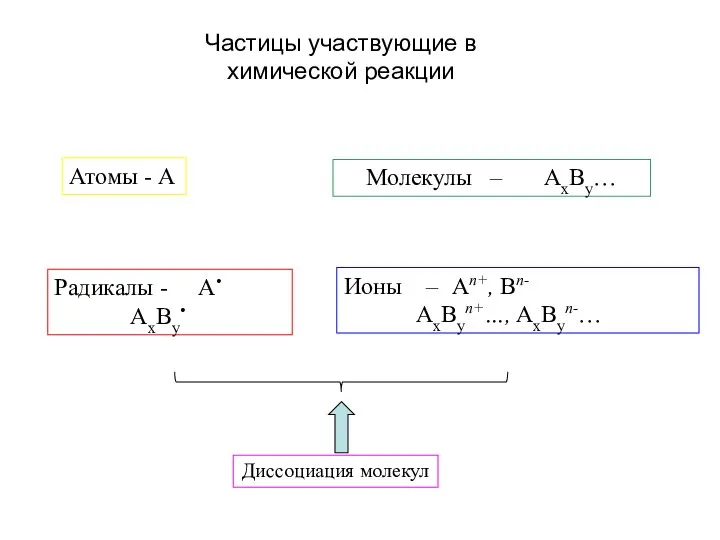
- 6. Частицы участвующие в химической реакции Атомы - А Молекулы – AxBy… Радикалы - А• AxBy• Ионы
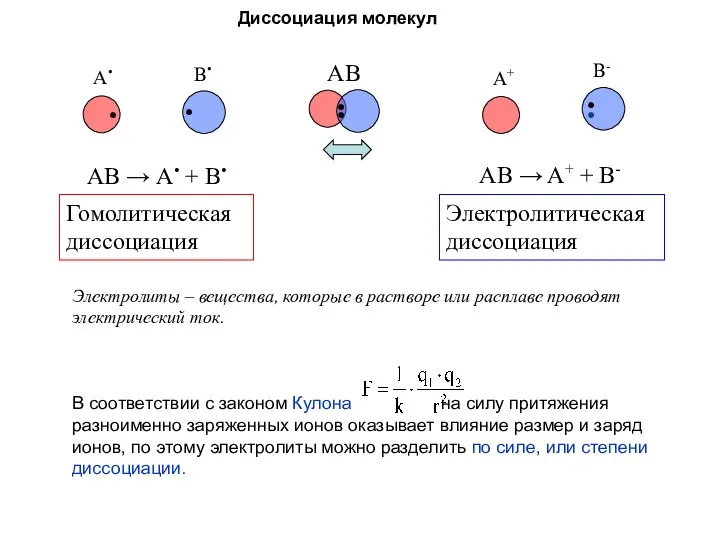
- 7. Диссоциация молекул Электролиты – вещества, которые в растворе или расплаве проводят электрический ток.
- 8. Электролитическая диссоциация Сильные электролиты – α > 30% Слабые электролиты – α Средние электролиты – 3-5%
- 9. К сильным электролитам относятся: a) Сильные основания – растворимы в воде – групповое наименование щелочи: LiOH
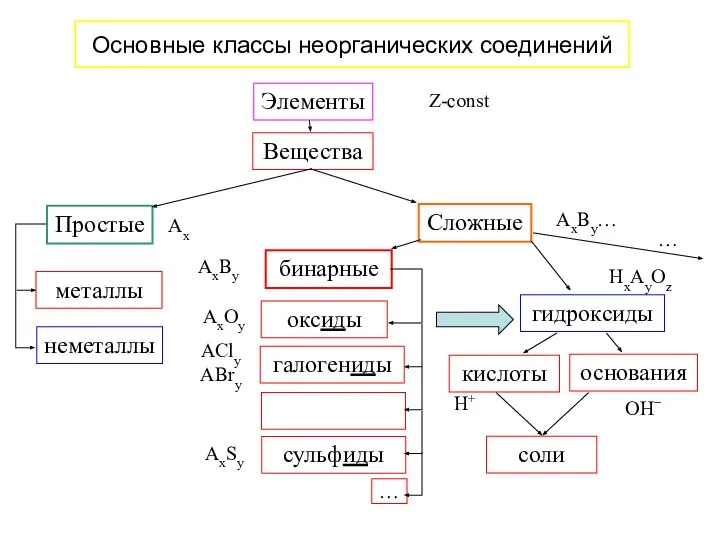
- 10. Z-const Элементы металлы неметаллы Основные классы неорганических соединений
- 11. Оксиды Оксиды – соединения элементов с кислородом, в которых кислород соединен только с элементом ЭхОу СтОк
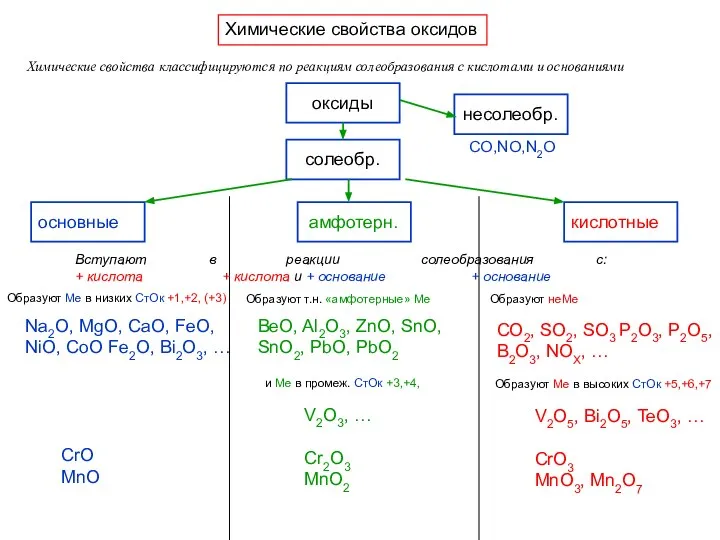
- 12. Химические свойства оксидов Химические свойства классифицируются по реакциям солеобразования с кислотами и основаниями CO,NO,N2O Вступают в
- 13. Кислотно-основные свойства оксидов Доказываются реакциями солеобразования с кислотами (+Н+) и с основаниями (щелочами) (+ОН-) Кисл. св-ва
- 14. Гидроксиды Г. – продукты прямого либо косвенного соединения оксидов с водой Непосредственно с водой реагируют: 1).
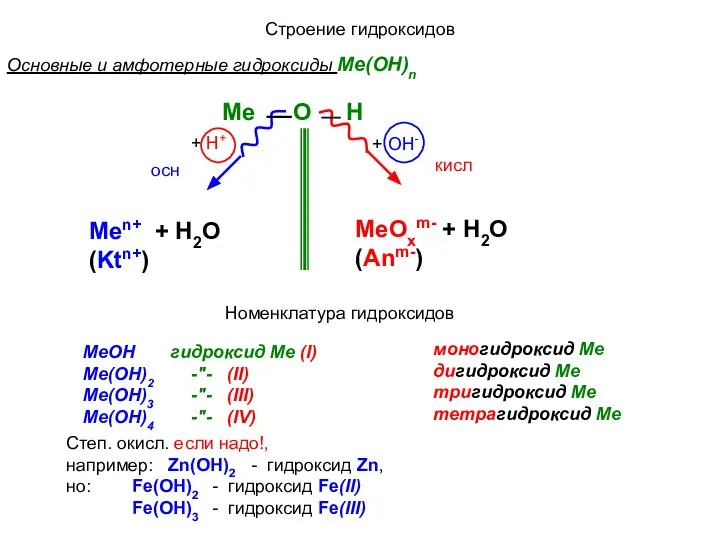
- 15. Строение гидроксидов Men+ + H2O (Ktn+) MeOxm- + H2O (Anm-) Номенклатура гидроксидов МеОН гидроксид Ме (I)
- 17. Скачать презентацию







 Три фактора распространения болезней
Три фактора распространения болезней  МКОУ «Кулунская оош» Акция « Я выбираю спорт как альтернативу пагубным привычкам»
МКОУ «Кулунская оош» Акция « Я выбираю спорт как альтернативу пагубным привычкам»  Разминка по экологическому праву. Подготовила студентку 2 курса юридического факультета группы Ю124Б Тужилова Л.В.
Разминка по экологическому праву. Подготовила студентку 2 курса юридического факультета группы Ю124Б Тужилова Л.В. Технология обучения в сотрудничестве на уроке английского языка (ТОСУА) Основная идея ТОСУА – создание условий для активной учеб
Технология обучения в сотрудничестве на уроке английского языка (ТОСУА) Основная идея ТОСУА – создание условий для активной учеб «Проектная деятельность учащихся» Семинар учителей МОУ СОШ № 27 пгт Смоляниново
«Проектная деятельность учащихся» Семинар учителей МОУ СОШ № 27 пгт Смоляниново Презентация "Стили и направления изобразительного искусства. ХХ век" - скачать презентации по МХК
Презентация "Стили и направления изобразительного искусства. ХХ век" - скачать презентации по МХК Строительство универсальной спортивной площадки на территории микрорайона «Южный-2» в с. Завьялово
Строительство универсальной спортивной площадки на территории микрорайона «Южный-2» в с. Завьялово Презентация на тему "Профессиональная компетентность учителя" - скачать презентации по Педагогике
Презентация на тему "Профессиональная компетентность учителя" - скачать презентации по Педагогике Қайта даму дəуірінің костюмі
Қайта даму дəуірінің костюмі армения старшая группа
армения старшая группа Презентация«Аудит документов по оформлению импортных операций»
Презентация«Аудит документов по оформлению импортных операций»  Табличка на стол (только для CI Дилеров)
Табличка на стол (только для CI Дилеров) Эволюция ЕСТЕСТВЕННОНАУЧНОЙ КАРТИНЫ МИРА. Подготовили: Кондратьев Александр Акинбани Виктория
Эволюция ЕСТЕСТВЕННОНАУЧНОЙ КАРТИНЫ МИРА. Подготовили: Кондратьев Александр Акинбани Виктория Инструкция по использованию инфомата для записи к врачу в порядке электронной очереди с помощью портала пациента
Инструкция по использованию инфомата для записи к врачу в порядке электронной очереди с помощью портала пациента Полевые транзисторы. Основные сведения и классификация
Полевые транзисторы. Основные сведения и классификация Ватутин Николай Фёдорович
Ватутин Николай Фёдорович Архитектурная климатология
Архитектурная климатология Serial Communications
Serial Communications Техническая диагностика подвижного состава
Техническая диагностика подвижного состава Тема : «Классный руководитель – архитектор классного коллектива»
Тема : «Классный руководитель – архитектор классного коллектива» Растревоженная душа В. Шукшина. К 90 – летию писателя
Растревоженная душа В. Шукшина. К 90 – летию писателя 29 ноября - День матери
29 ноября - День матери Презентация ЖК “Лефортово Парк”
Презентация ЖК “Лефортово Парк” Презентация Безопасность продовольственных и непродовольственных товаров
Презентация Безопасность продовольственных и непродовольственных товаров В мире головоломок - презентация для начальной школы_
В мире головоломок - презентация для начальной школы_ Общественный строй в виде тест-тренинга
Общественный строй в виде тест-тренинга Презентация Режим пограничной зоны, территориальных и внутренних вод
Презентация Режим пограничной зоны, территориальных и внутренних вод Степень с целым показателем. 8 класс 1.04.13
Степень с целым показателем. 8 класс 1.04.13