Содержание
- 2. Цель: дать представление о причинах единства всех типов химической связи Задачи. Образовательная: углубить и расширить знания
- 3. Что такое химическая связь? Какова природа химической связи? Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 4. Любая химическая связь образуется только тогда, когда сближение частиц приводит к понижению полной энергии системы. Определяющим
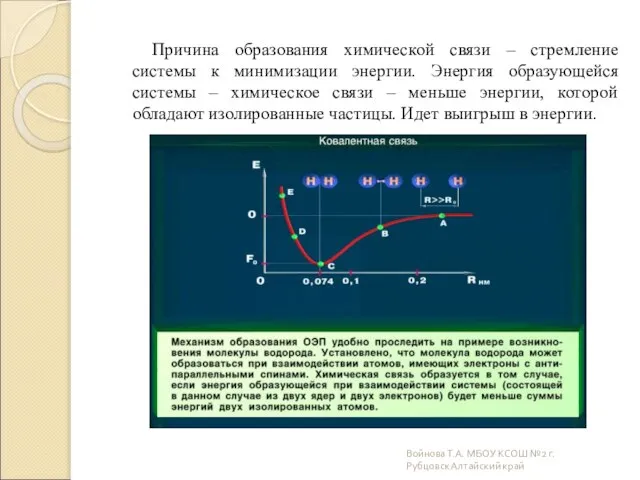
- 5. Причина образования химической связи – стремление системы к минимизации энергии. Энергия образующейся системы – химическое связи
- 6. Войнова Т.А. МОУ "Лицей "Эрудит" г.Рубцовск Алтайский край
- 7. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 8. Важнейшим фактором характеристики атома является его электроотрицательность Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 9. Определение типа связи(по ЭО): Равная ЭО – ковалентная неполярная; Разность ЭО Разность ЭО > 1,7 –
- 10. Кристаллические решётки веществ – это упорядоченное расположение частиц(атомов, молекул, ионов) в строго определённых точках пространства. Точки
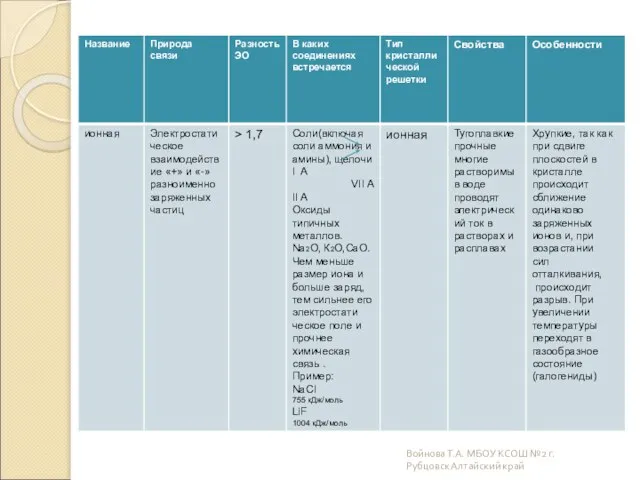
- 11. Ионные Ионными называют кристаллические решетки, в узлах которых находятся ионы. Их образуют вещества с ионной связью.
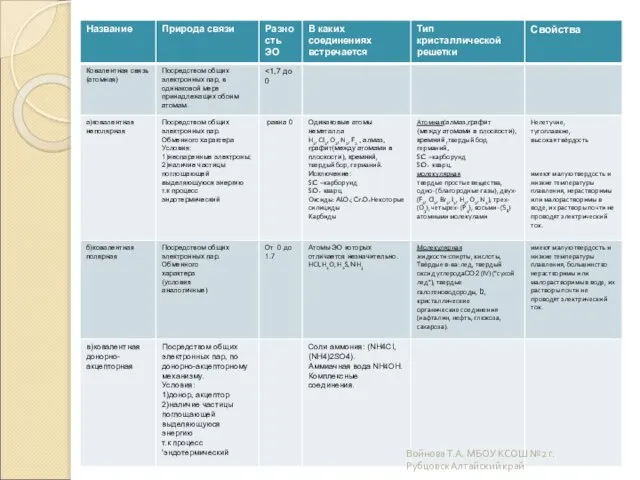
- 12. Атомные Атомными называют кристаллические решётки, в узлах которых находятся отдельные атомы, которые соединены очень прочными ковалентными
- 13. Молекулярные Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы. Химические связи в них ковалентные, как
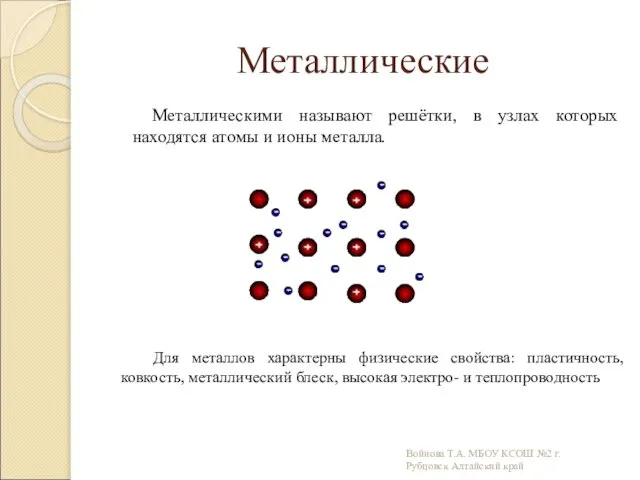
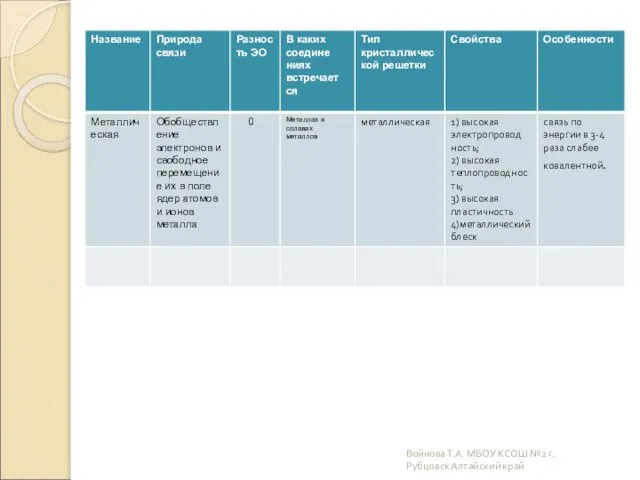
- 14. Металлические Металлическими называют решётки, в узлах которых находятся атомы и ионы металла. Для металлов характерны физические
- 15. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 16. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 17. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 18. Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
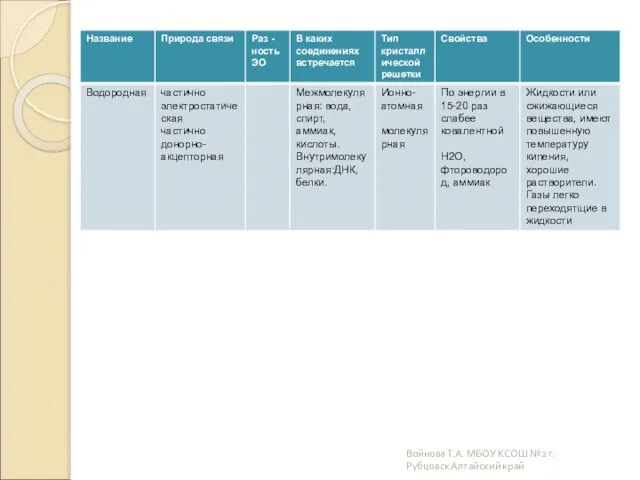
- 19. Какова природа возникновения химической связи? Электронно-ядерное взаимодействие атомов, сопровождающееся выделением энергии Часто встречаются соединения в которых
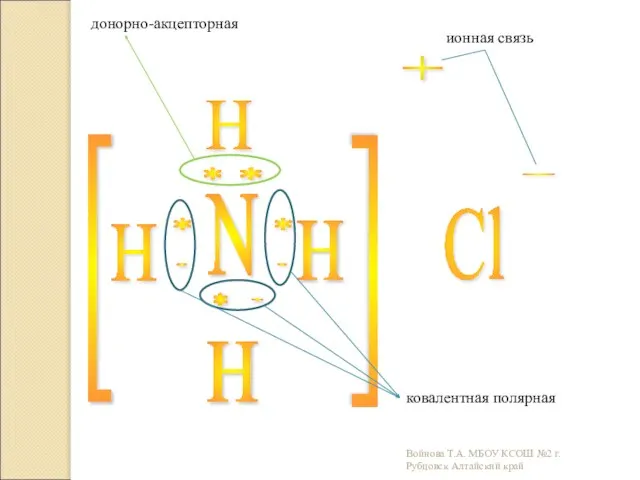
- 20. N H H H Cl - [ [ * * * * * . . .
- 21. В зависимости от условий,возможен переход от одного вида связи в другой: При электролитической диссоциации, соединения с
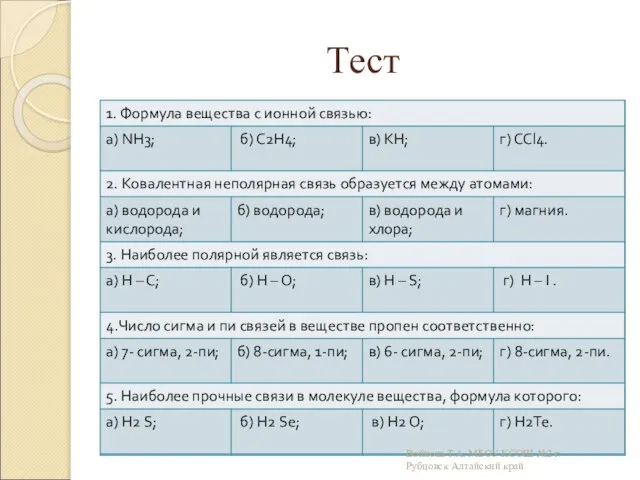
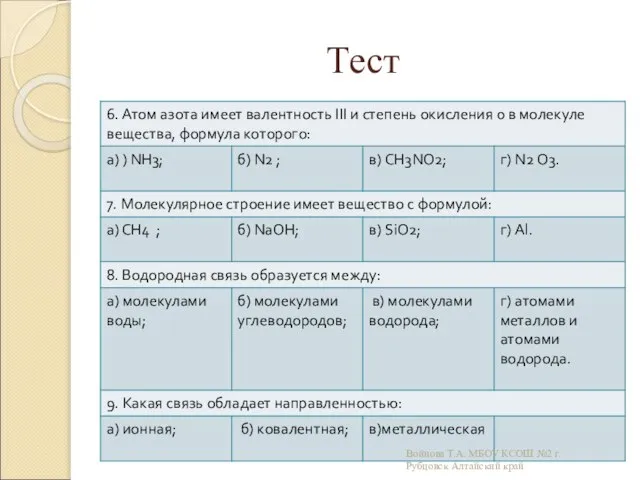
- 22. Тест Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 23. Тест Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск Алтайский край
- 24. Самопроверка в б б б в б а а б Войнова Т.А. МБОУ КСОШ №2 г.Рубцовск
- 25. Рефлексия: что? какой? зачем? Домашнее задание: - повторить § 6; - выполнить упр. 3,4,6 гл.3 Кузьменко.
- 27. Скачать презентацию















 Kartsova Elena
Kartsova Elena Choosing a profession people with disabilities
Choosing a profession people with disabilities Страна Грамматика: личные и притяжательные местоимения Сибирина Елена Рудольфовна, МБОУ СОШ №1 Г.Александров
Страна Грамматика: личные и притяжательные местоимения Сибирина Елена Рудольфовна, МБОУ СОШ №1 Г.Александров Презентация к уроку английского языка "Турнир знатоков английского языка" - скачать
Презентация к уроку английского языка "Турнир знатоков английского языка" - скачать  Презентация к уроку английского языка "Презентация Чтение" - скачать
Презентация к уроку английского языка "Презентация Чтение" - скачать  Презентация Парадокс бережливости
Презентация Парадокс бережливости Personal info, questions - Present, Past, Future
Personal info, questions - Present, Past, Future “Merry School” “Веселая школа” Игнатьева Ю.А., учитель английского языка, МОУ»СОШ№21»Энгельс2010г
“Merry School” “Веселая школа” Игнатьева Ю.А., учитель английского языка, МОУ»СОШ№21»Энгельс2010г Презентация к уроку английского языка "Charlotte Bronte" - скачать
Презентация к уроку английского языка "Charlotte Bronte" - скачать  Презентация к уроку английского языка "Му воnnie Scotland" - скачать
Презентация к уроку английского языка "Му воnnie Scotland" - скачать  The story of my life (present perfect)
The story of my life (present perfect) СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ
СРЕДСТВА ДЛЯ ЛЕЧЕНИЯ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТИ Презентация к уроку английского языка "Национальные символы США, Британии и России" - скачать
Презентация к уроку английского языка "Национальные символы США, Британии и России" - скачать  Noun/Существительное
Noun/Существительное ENGLISH LANGUAGE THEME: “MY GYMNASIUM IS THE BEST.” Completed by: Nastya Grishina , form 6 Supervisor: Tatyana Lesnikova Gymnasium named after S.V. Kovalevskya Pskov Oblast, Velikie Luki. 2009
ENGLISH LANGUAGE THEME: “MY GYMNASIUM IS THE BEST.” Completed by: Nastya Grishina , form 6 Supervisor: Tatyana Lesnikova Gymnasium named after S.V. Kovalevskya Pskov Oblast, Velikie Luki. 2009 Аттестационная работа. Формирование метапредметных результатов при обучении английскому языку
Аттестационная работа. Формирование метапредметных результатов при обучении английскому языку Методическая система оценки достижений метапредметных результатов как критерия качества образования
Методическая система оценки достижений метапредметных результатов как критерия качества образования Звук th (театральный английский, занятие 34)
Звук th (театральный английский, занятие 34) Animal sounds
Animal sounds Modal Verbs. Board Game
Modal Verbs. Board Game Презентация по английскому языку Особенности и системы английских личных имен
Презентация по английскому языку Особенности и системы английских личных имен Mother`s day or mothering Sunday
Mother`s day or mothering Sunday  We are from the Earth planet the Milky Way Galaxy
We are from the Earth planet the Milky Way Galaxy Reasons not to love valentine's day
Reasons not to love valentine's day Musical professions Favourite classmates’ hobbies
Musical professions Favourite classmates’ hobbies  Презентация к уроку английского языка "Хобби на английском языке" - скачать бесплатно
Презентация к уроку английского языка "Хобби на английском языке" - скачать бесплатно The Tower of London
The Tower of London Презентация к уроку английского языка "Chicago" - скачать бесплатно
Презентация к уроку английского языка "Chicago" - скачать бесплатно