Актуальные вопросы регулирования обращения биологических препаратов Ростова Наталья Борисовна Доцент, канд.фарм. наук Апрель,
Содержание
- 2. Основные проблемы Перспективы рынка биологических ЛС Биологическое ЛС, биоаналог – определения и отличия Свойства и особенности
- 3. Биофармацевтический рынок является привлекательным для фармацевтических компаний Объем мировых продаж биофармацевтического рынка за период 2003-2005г. увеличился
- 4. Препараты биологической природы Первые биологические лекарственные средства начали использоваться в клинической медицине в 80-х гг. Более
- 5. Биологические препараты Группа ЛС, близких по строению/ составу к природным веществам, синтезируемым в организме человека/ животных/
- 6. Биологическое лекарственное средство иммунобиологические лекарственные средства; лекарственные средства, производимые путем биотехнологических процессов: технология рекомбинантной ДНК; контролируемая
- 7. Биологические препараты Потенциал медицинского применения клеточных и генных биологических препаратов лечение многих заболеваний, неизлечимых в настоящий
- 8. Определение понятия «биологическое ЛС» 1 Определение EMEA
- 9. Чем отличаются биопрепараты от других ЛС? Высоким молекулярным весом Сложностью пространственной структуры: Четвертичная структура Определенное соотношение
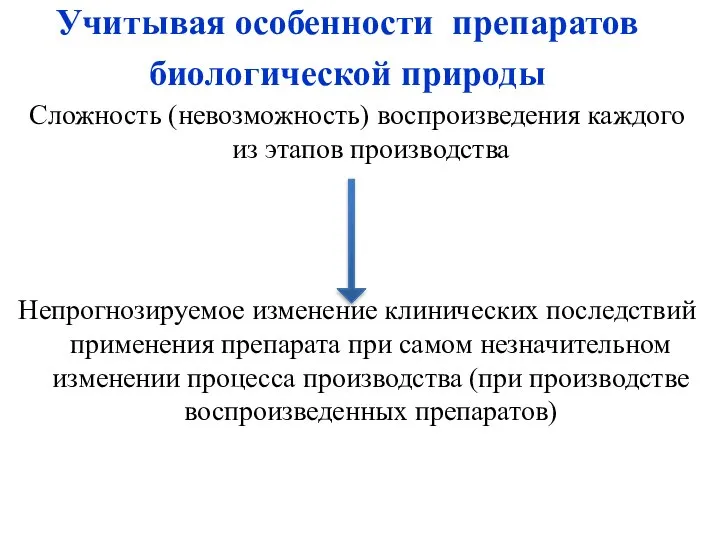
- 10. Учитывая особенности препаратов биологической природы Сложность (невозможность) воспроизведения каждого из этапов производства Непрогнозируемое изменение клинических последствий
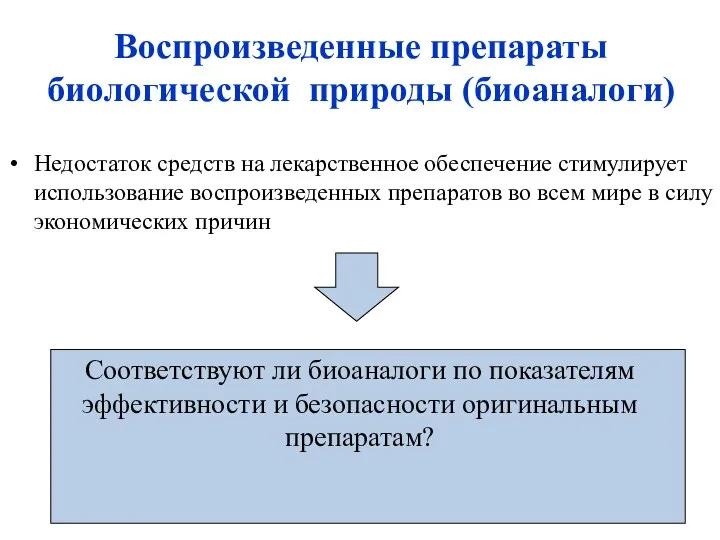
- 11. Недостаток средств на лекарственное обеспечение стимулирует использование воспроизведенных препаратов во всем мире в силу экономических причин
- 12. Биоаналог = дженерик? «Биоаналог - это биологическое лекарственное средство, схожее с оригинальным биологическим лекарственным средством, но
- 13. Какова законодательная основа регуляции обращения воспроизведенных лекарственных средств в РФ?
- 14. Утвержден Приказом Министерства Здравоохранения и социального развития РФ от 30.10.06. №736 АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ ФЕДЕРАЛЬНОЙ СЛУЖБЫ ПО
- 15. АДМИНИСТРАТИВНЫЙ РЕГЛАМЕНТ от 30.10.06. №736 «…В том случае, если отличия регистрируемого ЛС от ранее зарегистрированного относятся
- 16. Для прохождения ускоренной процедуры рассмотрения документов и принятия решения о государственной регистрации, документы и данные указанные
- 17. 1) заявление о государственной регистрации ЛС; 2) квитанцию об осуществлении платы за государственную регистрацию ЛС; 3)
- 18. Терапевтическая эквивалентность Лекарственный препарат терапевтически эквивалентен другому препарату, если он содержит ту же активную субстанцию или
- 19. Подтверждение терапевтической эквивалентности: доказательство биоэквивалентности; сравнительное определение фармакодинамических характеристик; сравнительные клинические испытания; определение растворимости дозированной формы.
- 20. Примеры отзывов биоаналогов с рынка 1996 г, рекомбинантный человеческий интерферон альфа (Lemery, Куба). 1997 г, эпоэтин
- 21. Учитывая вышесказанные аспекты в европейском и американском законодательстве предусмотрены особые требования по регистрации воспроизведенных ЛС биологической
- 22. РЕГИСТРАЦИЯ БИОАНАЛОГОВ Регуляторные органы в ЕС (ЕМЕА) и США (FDA) признают, что биоаналоги отличаются от генериковых
- 23. РЕГИСТРАЦИЯ БИОАНАЛОГОВ В ЕС Появление Директив, описывающих регистрацию биоаналогов в ЕС: Directive 2003/63/EC of 25 June
- 24. ЗАКОНОДАТЕЛЬНАЯ ОСНОВА ДЛЯ БИОАНАЛОГОВ Directive 2004/27/EC – Article 10.4 (Определение): «В случае если биологический препарат аналогичный
- 25. ЗАКОНОДАТЕЛЬНАЯ ОСНОВА ДЛЯ БИОАНАЛОГОВ Annex I Directive 2001/83/EC: Документы для регистрации Биоэквивалентность и биодоступность Другие данные
- 26. ОСНОВНЫЕ АСПЕКТЫ НОВЫХ ТРЕБОВАНИЙ В ЕС Процедура центральной регистрации (Centralized procedure) для всех биопрепаратов и их
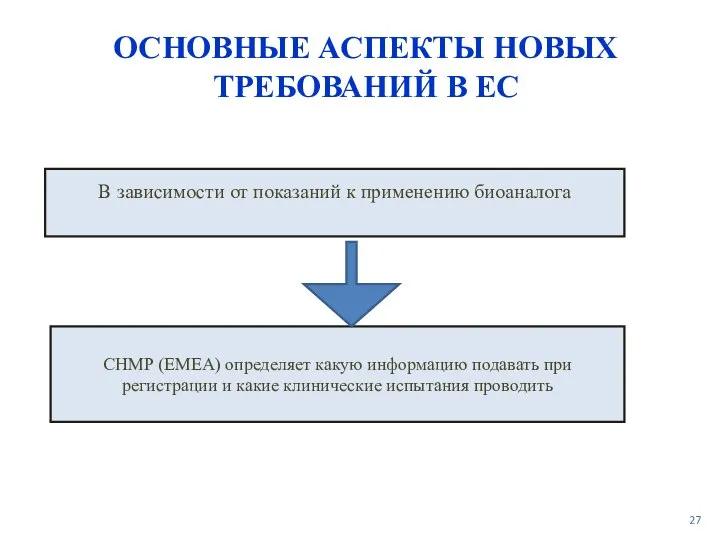
- 27. ОСНОВНЫЕ АСПЕКТЫ НОВЫХ ТРЕБОВАНИЙ В ЕС В зависимости от показаний к применению биоаналога CHMP (EMEA) определяет
- 28. EMEA не гарантирует взаимозаменяемость биологических лекарственных препаратов EMEA не гарантирует взаимозаменяемость биологических лекарственных средств и аналогов,
- 29. Обзор взаимозаменяемости биологических лекарственных средств в различных странах
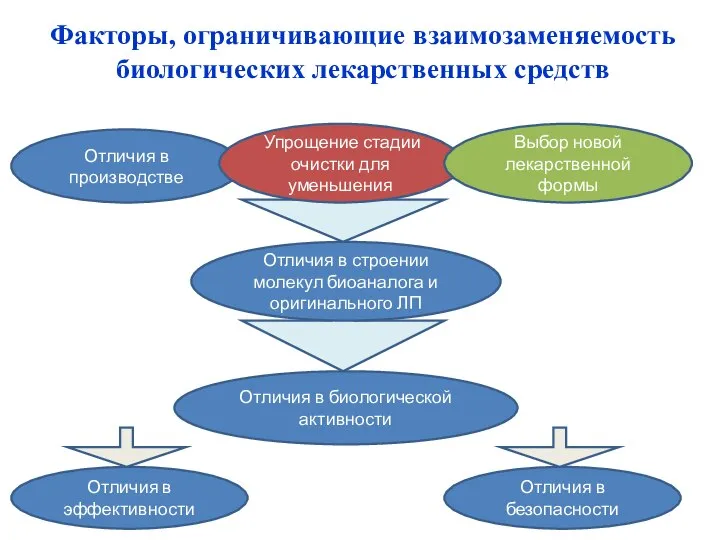
- 30. Отличия в производстве Упрощение стадии очистки для уменьшения Выбор новой лекарственной формы Отличия в строении молекул
- 31. Регулирование взаимозаменяемости биологических лекарственных средств в Российском законодательстве При отпуске препарата по рецепту врача разрешается отпуск
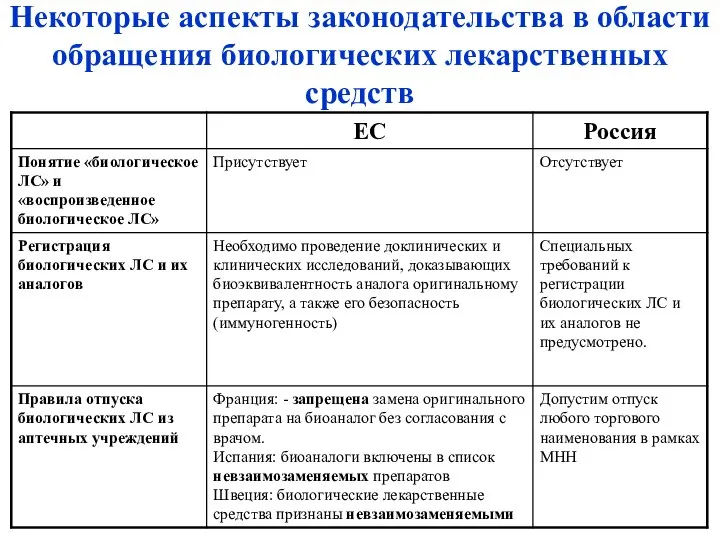
- 32. Некоторые аспекты законодательства в области обращения биологических лекарственных средств
- 33. Выводы: Гармонизация российского законодательства в области обращения биологических ЛС с законодательством стран Европы Внесение определения «биологические
- 34. Существующие аспекты регулирования обращения препаратов биологической природы в РФ не гарантируют качества, эффективности безопасности оказываемой лекарственной
- 37. Скачать презентацию





























 Подцарство Одноклеточные или Простейшие Вводная характеристика простейших. Тип саркожгутиковых.
Подцарство Одноклеточные или Простейшие Вводная характеристика простейших. Тип саркожгутиковых.  Ядовитые растения. Омела белая
Ядовитые растения. Омела белая Презентация на тему "Формула здоровья" - скачать презентации по Биологии
Презентация на тему "Формула здоровья" - скачать презентации по Биологии Загадка человека
Загадка человека О тех, кого не любят (Многообразие пресмыкающихся) Урок – марафон
О тех, кого не любят (Многообразие пресмыкающихся) Урок – марафон Класс Пресмыкающиеся (Reptilia)
Класс Пресмыкающиеся (Reptilia) Типы межклеточной сигнализации
Типы межклеточной сигнализации Дидактическая игра Рыбы Вологодской области
Дидактическая игра Рыбы Вологодской области Клеточная теория
Клеточная теория Корень. Строение, функции. Видоизменения корней
Корень. Строение, функции. Видоизменения корней Покрытосеменные растения Семейства кл. Двудольные
Покрытосеменные растения Семейства кл. Двудольные Эволюция жизни
Эволюция жизни Анатомия органов пищеварения
Анатомия органов пищеварения Видовые особенности органов зрения
Видовые особенности органов зрения МИКРОБИОЛОГИЯ С ОСНОВАМИ ЭПИДЕМИОЛОГИИ И МЕТОДАМИ МИКРОБИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ ЛЕКЦИЯ: МИКРОБИОЛОГИЯ КАК НАУКА,
МИКРОБИОЛОГИЯ С ОСНОВАМИ ЭПИДЕМИОЛОГИИ И МЕТОДАМИ МИКРОБИОЛОГИЧЕСКИХ ИССЛЕДОВАНИЙ ЛЕКЦИЯ: МИКРОБИОЛОГИЯ КАК НАУКА,  Презентация на тему "Моногибридное скрещивание" - скачать бесплатно презентации по Биологии
Презентация на тему "Моногибридное скрещивание" - скачать бесплатно презентации по Биологии Генотип – целостная система Сахаров Н.Н. – учитель биологии МОУ Нехаевская СОШ Волгоградская область
Генотип – целостная система Сахаров Н.Н. – учитель биологии МОУ Нехаевская СОШ Волгоградская область Гіпоталамо-гіпофізарна система
Гіпоталамо-гіпофізарна система Функции органов дыхания. Дыхательная система
Функции органов дыхания. Дыхательная система Роль воды в прорастании семян гороха
Роль воды в прорастании семян гороха Собака моей мечты. Карело-финская лайка
Собака моей мечты. Карело-финская лайка Животный мир Арктики
Животный мир Арктики Тип кольчатые черви
Тип кольчатые черви Презентация на тему "Региональные стволовые клетки: определение понятия, история открытия и изучения, классификация, характери
Презентация на тему "Региональные стволовые клетки: определение понятия, история открытия и изучения, классификация, характери Презентация на тему Антропосоциогенез
Презентация на тему Антропосоциогенез  Ткани организма человека. Эпителиальные ткани
Ткани организма человека. Эпителиальные ткани Обмен белков
Обмен белков Класс Брюхоногие моллюски
Класс Брюхоногие моллюски