Содержание
- 2. Вопросы лекции: Пути распада аминокислот в тканях и использование продуктов распада в организме. Виды дезаминирования: прямое,
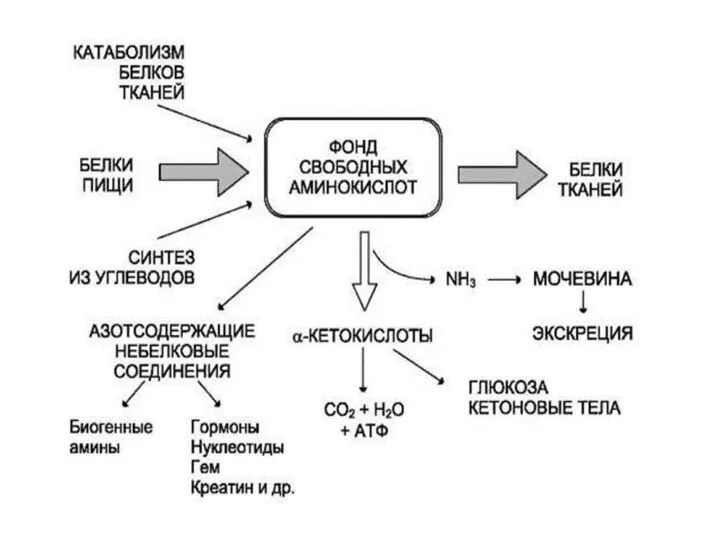
- 3. Судьба всосавшихся аминокислот Синтез белка и белковых соединений Синтез ферментов Синтез гормонов Декарбоксилирование аминокислот и оборазование
- 5. Внутриклеточный протеолиз Тотальный протеолиз: Распад собственных белков происходит в лизосомах под действием катепсинов. Основной распад белков
- 6. Метаболические превращения АК (катаболизм) Аминокислота теряет α-аминогруппу в результате двух типов реакций: дезаминирования и трансаминирования. Существует
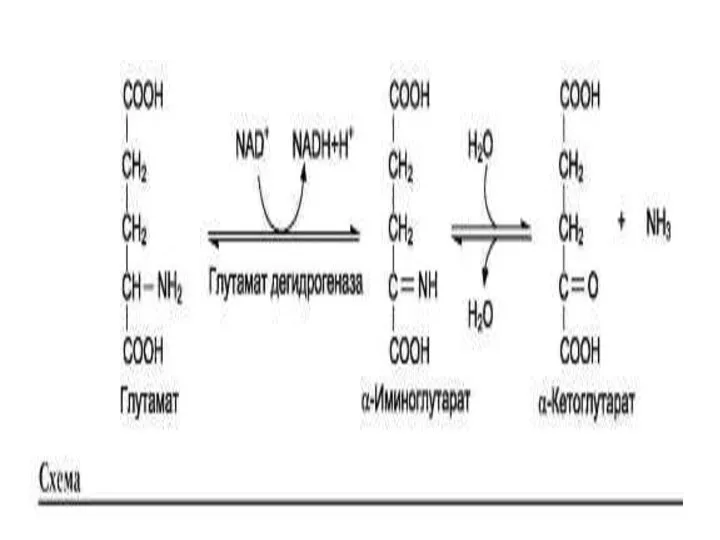
- 7. Реакции прямого дезаминирования Дезаминирование: реакция отщепления α-аминогруппы от аминокислоты, в результате чего образуется соответствующая α-кетокислота (безазотистый
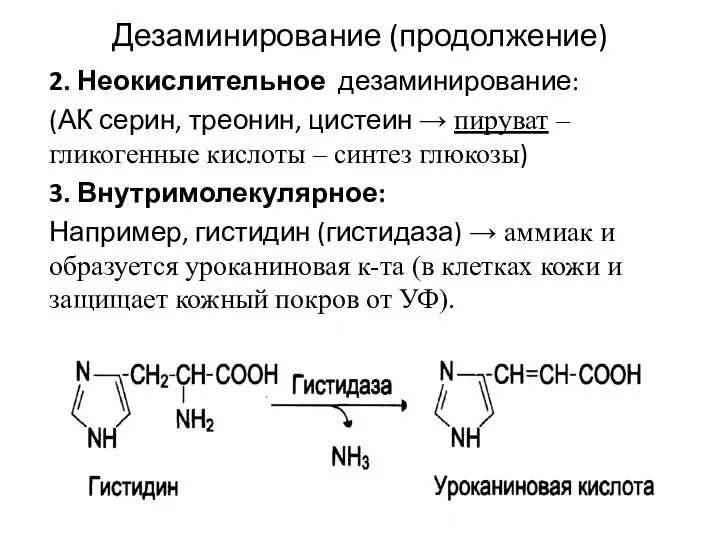
- 9. Дезаминирование (продолжение) 2. Неокислительное дезаминирование: (АК серин, треонин, цистеин → пируват – гликогенные кислоты – синтез
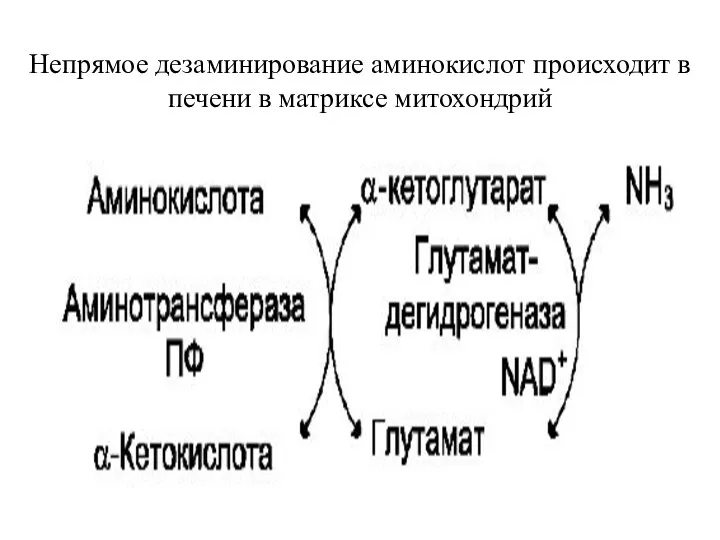
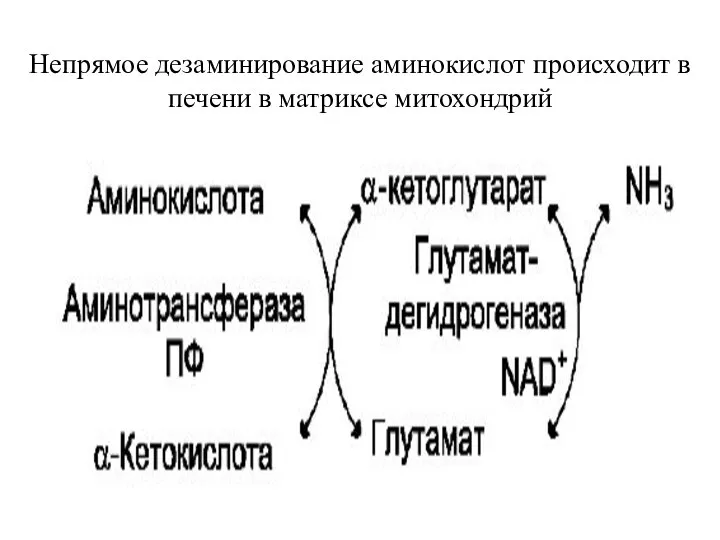
- 10. Непрямое дезаминирование Непрямое дезаминирование проходит в 2 стадии: 1. Реакция трансаминирования (интенсивно протекают в печени и
- 11. Непрямое дезаминирование аминокислот происходит в печени в матриксе митохондрий
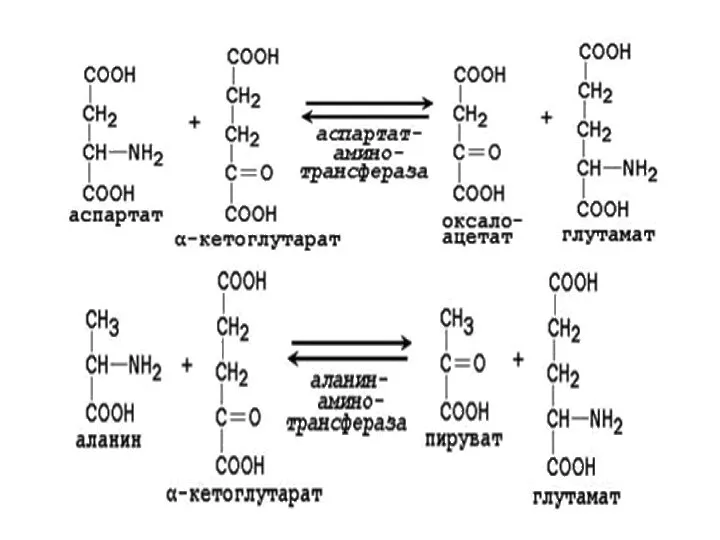
- 12. Ферменты трансаминирования По названию субстрата: Аланин – аланинаминотрансфераза (АЛТ) + 2-оксоглутарат → глутамат + пируват. Ала
- 13. Коэффициент де Ритиса Соотношение активностей ACT/АЛТ называют "коэффициент де Ритиса". В норме этот коэффициент равен 1,33±0,42.
- 14. Примеры реакций трансаминирования:
- 15. Кислоты, катаболиз которых приводит к образованию пирувата называются гликогенными (синтез глюкозы через процесс глюконеогенеза): серин, аланин,
- 16. Ферменты аминотрансферазы функционируют в процессах катаболизма. При участии трансаминаз из α-кетокислот синтезируются необходимые организму заменимые аминокислоты,
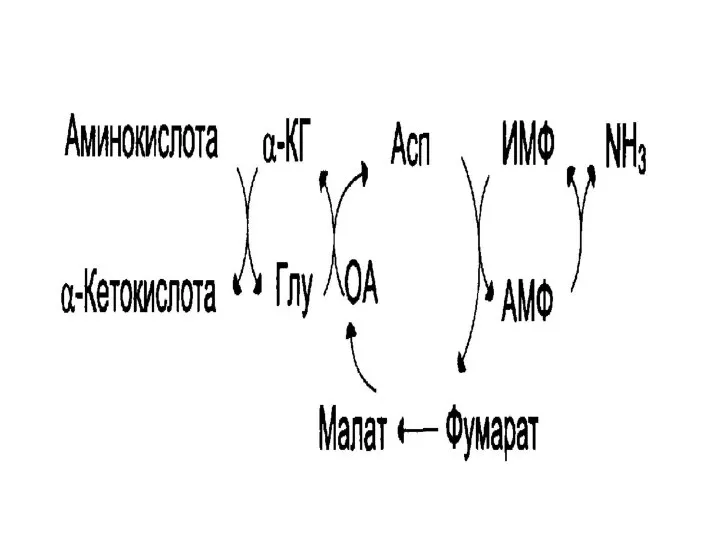
- 17. Непрямое дезаминирование аминокислот происходит в печени в матриксе митохондрий
- 18. Непрямое дезаминирования цикла ИМФ-АМФ В мозге и мышцах фермента глутаматдегидрогеназы недостаточно, и процесс идет через аспартат
- 20. В результате работы аминотрансфераз аминный азот многих аминокислот переходит в состав глутамата. Накопление аминогрупп в форме
- 21. Образование аммиака Часть аммиака образуется в кишечнике в результате действия бактерий на пищевые белки (гниение белков
- 22. Основные источники образования аммиака: Дезаминирование аминокислот Распад биогенных аминов Распад азотистых оснований.
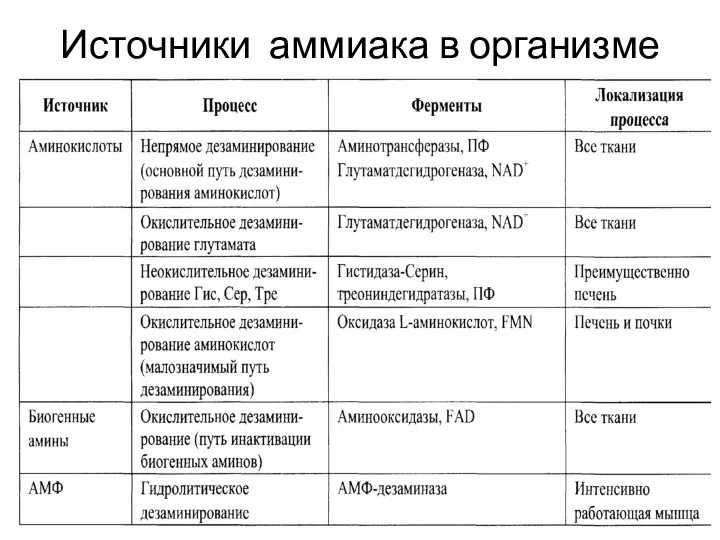
- 23. Источники аммиака в организме
- 24. Пути обезвреживания аммиака Синтез мочевины: в печени в матриксе митохондрий (1-я и 2-я реакции), затем процесс
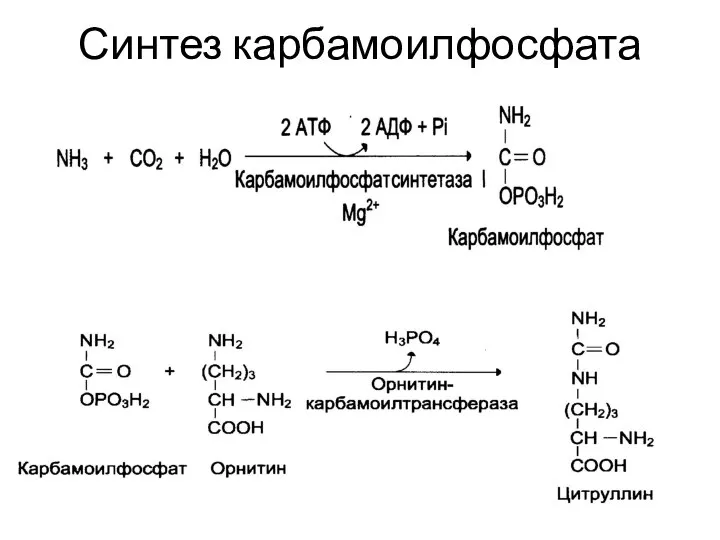
- 25. Синтез карбамоилфосфата
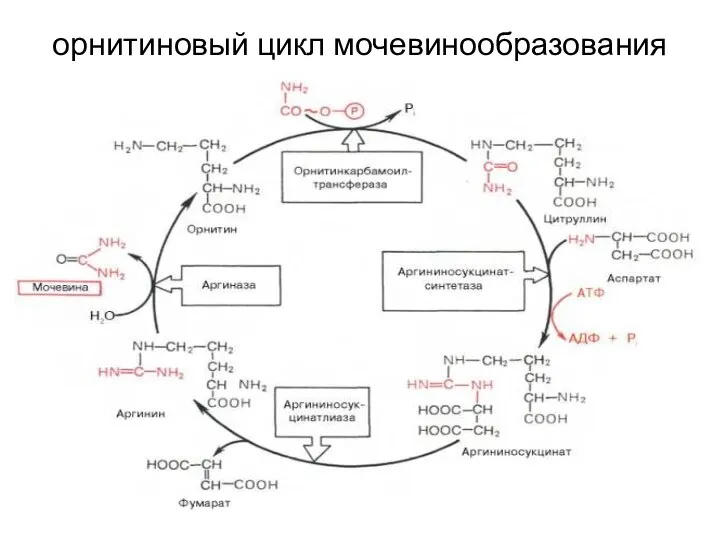
- 26. орнитиновый цикл мочевинообразования
- 27. Адольф Кребс Ханс английский биохимик немецкого происхождения, удостоенный в 1953 (совместно с Ф.Липманом) Нобелевской премии по
- 28. Орнитиновый цикл в печени выполняет следующие функции: Большая часть образовавшегося аммиака обезвреживается в орнитиновом цикле в
- 29. (Продолжение) Образованный фумарат возвращается в матрикс митохондрий и включается в цикл трикарбоновых кислот (ЦТК), где превращается
- 30. Регуляция синтеза мочевины В качестве главного регулятора синтеза выступает количество аммиака. При избыточном белковом питании количество
- 31. (Продолжение регуляции синтеза мочевины) Увеличение скорости распада белка, избыток белкового питания и увеличение аммиака сопровождается индукцией
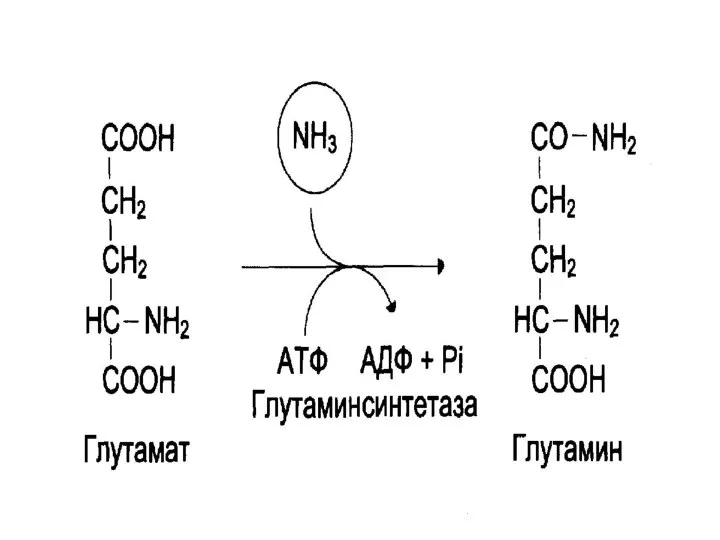
- 32. Обезвреживание аммиака 2. Одной из основной реакцией обезвреживания аммиака в тканях является синтез глутамина из глутамата
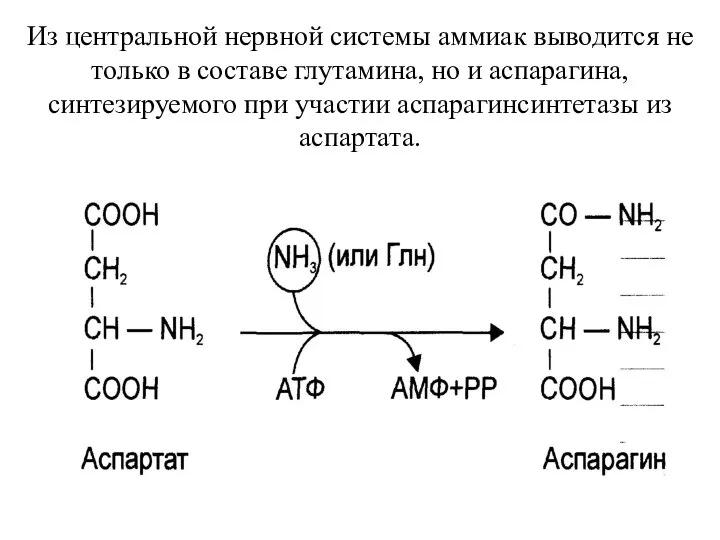
- 34. Из центральной нервной системы аммиак выводится не только в составе глутамина, но и аспарагина, синтезируемого при
- 35. Свободный аммиак, связывая протоны превращается в ион аммония (NH4+), что делает невозможным его обратное поступление в
- 36. Обезвреживание аммиака (продолжение) Повышение концентрации аммиака м.б. за счет избытка белковых продуктов, протеолиз (распад собственных белков),
- 37. Нарушение синтеза мочевины Связано с недостаточностью количества или активности ферментов синтеза. Это может быть при гепатите
- 38. Гипераммониемия Повышение концентрации аммиака в крови сдвигает рН в щелочную сторону (вызывает алкалоз). Это, в свою
- 39. Обезвреживание аммиака
- 41. Скачать презентацию

























 Мнемозина помнит все
Мнемозина помнит все Биология 7класс. Тема: Тип Членистоногие. Класс Ракообразные. МОУ «Каракульская ООШ» Учитель биологии Ананьева Людмила Владимиро
Биология 7класс. Тема: Тип Членистоногие. Класс Ракообразные. МОУ «Каракульская ООШ» Учитель биологии Ананьева Людмила Владимиро Взаимодействие аллельных генов
Взаимодействие аллельных генов Презентация на тему "Основные методы селекции растений" - скачать презентации по Биологии
Презентация на тему "Основные методы селекции растений" - скачать презентации по Биологии Субкультуры. История
Субкультуры. История Органы дыхания и газообмен. 7класс.
Органы дыхания и газообмен. 7класс. Паразитология. Биоосновы паразитизма
Паразитология. Биоосновы паразитизма Историческое прошлое людей
Историческое прошлое людей Презентация на тему Взаимоотношения между организмами
Презентация на тему Взаимоотношения между организмами  Гормоны средней и задней доли гипофиза и их физиологическая роль. Роль гипоталамуса в регуляции функции нейрогипофиза
Гормоны средней и задней доли гипофиза и их физиологическая роль. Роль гипоталамуса в регуляции функции нейрогипофиза Красная книга Нижегородской области
Красная книга Нижегородской области Частная гистология. Строение, функции и взаимодействие тканей в составе органов
Частная гистология. Строение, функции и взаимодействие тканей в составе органов Строение нервной ткани. (Лекция 2)
Строение нервной ткани. (Лекция 2) Фрукты и овощи
Фрукты и овощи Высота и долговечность древесных растений
Высота и долговечность древесных растений § 41. Значение кожи и ее строение 8 класс биология
§ 41. Значение кожи и ее строение 8 класс биология Переломи і вивихи
Переломи і вивихи  Анализирующее скрещивание
Анализирующее скрещивание Глід. Ліки з плодів гльоду
Глід. Ліки з плодів гльоду Среды жизни и места обитания животных Взаимосвязи животных в природе 7 класс. Биология. 2 урок.
Среды жизни и места обитания животных Взаимосвязи животных в природе 7 класс. Биология. 2 урок.  Презентация на тему "«Батьки і діти»" - скачать бесплатно презентации по Биологии
Презентация на тему "«Батьки і діти»" - скачать бесплатно презентации по Биологии Перелетные птицы (для средней группы)
Перелетные птицы (для средней группы) Физиология пищеварения
Физиология пищеварения Развитие основных физических качеств юношей
Развитие основных физических качеств юношей Клеточная мембрана. Диффузия и транспорт веществ в мембране
Клеточная мембрана. Диффузия и транспорт веществ в мембране Строение и деятельность внутренних органов Земноводных
Строение и деятельность внутренних органов Земноводных Биологиялық ырғақтар
Биологиялық ырғақтар Окружающий мир. 4 класс
Окружающий мир. 4 класс