Биохимия и молекулярная биология. Ферменты, строение, механизм действия, свойства, регуляция. Лекция 3
Содержание
- 2. План лекции Ферменты – биокатализаторы. Сходство и отличия с небиологическими катализаторами Структурная организация ферментов Кофакторы Активные
- 3. Ферменты - биокатализаторы Практически все реакции в живом организме протекают с участием природных биокатализаторов, называемых ферментами,
- 4. Ферменты - биокатализаторы Ферменты, энзимы – это белки, действующие как специфические высокоэффективные катализаторы химических реакций, протекающих
- 5. Ферменты - биокатализаторы Ферменты - строение, механизм действия, свойства, регуляция Рибозимы – рибонуклеиновые кислоты, Проявляющие свойства
- 6. Ферменты - биокатализаторы 1. катализируют только энергетически возможные реакции, т.е. те реакции которые могут протекать и
- 7. Ферменты - биокатализаторы 1. скорость ферментативных реакций выше, чем реакций, катализируемых небелковыми катализаторами (эффективность действия ферментов).
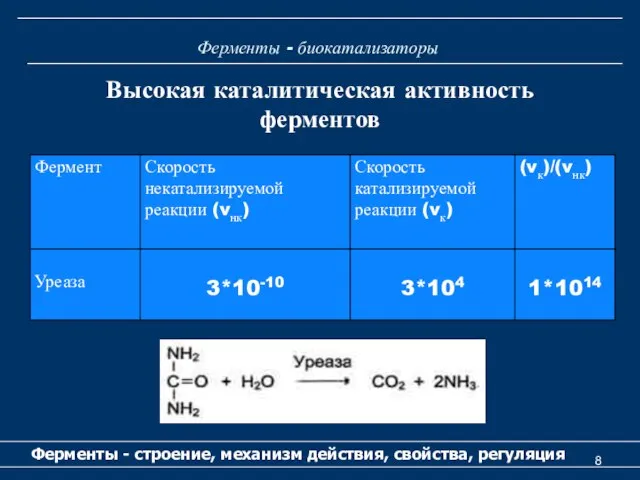
- 8. Ферменты - биокатализаторы Ферменты - строение, механизм действия, свойства, регуляция Высокая каталитическая активность ферментов
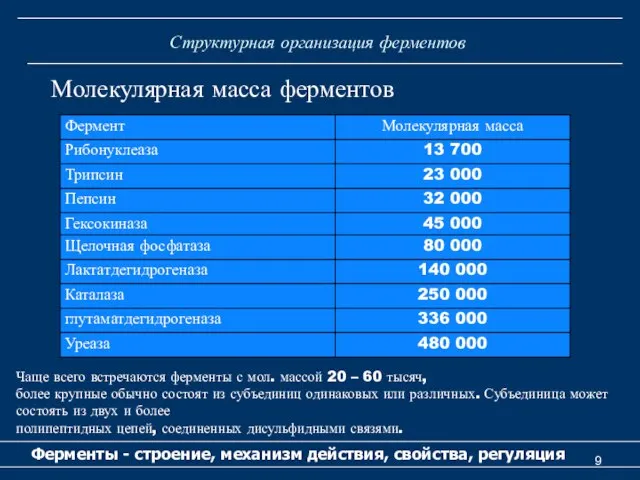
- 9. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, регуляция Молекулярная масса ферментов Чаще всего встречаются
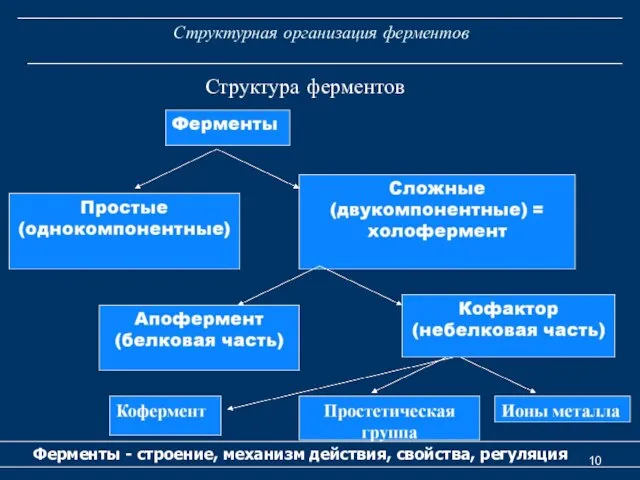
- 10. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, регуляция Структура ферментов
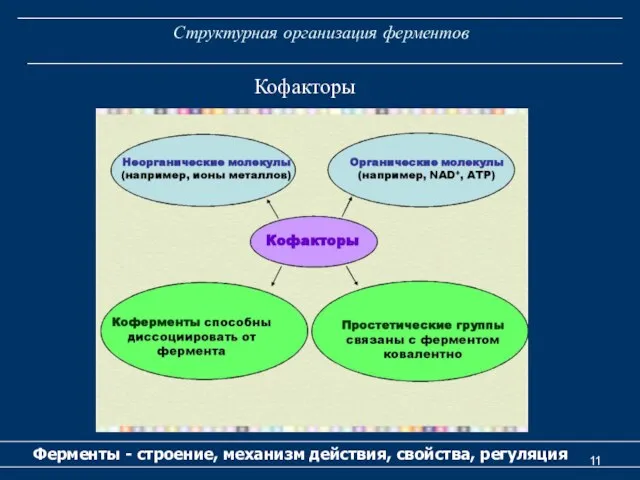
- 11. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, регуляция Кофакторы
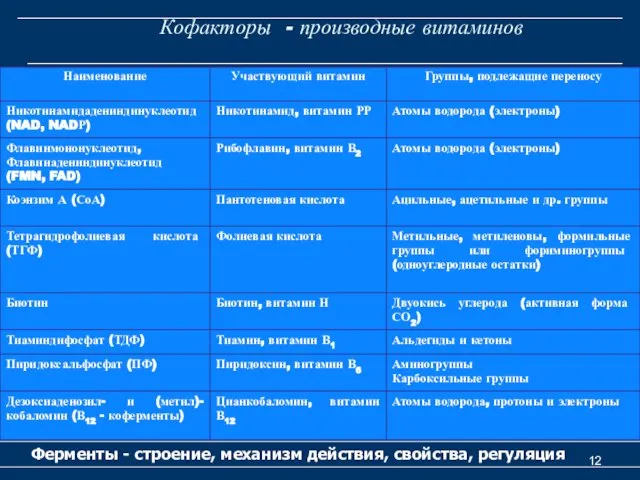
- 12. Кофакторы - производные витаминов Ферменты - строение, механизм действия, свойства, регуляция
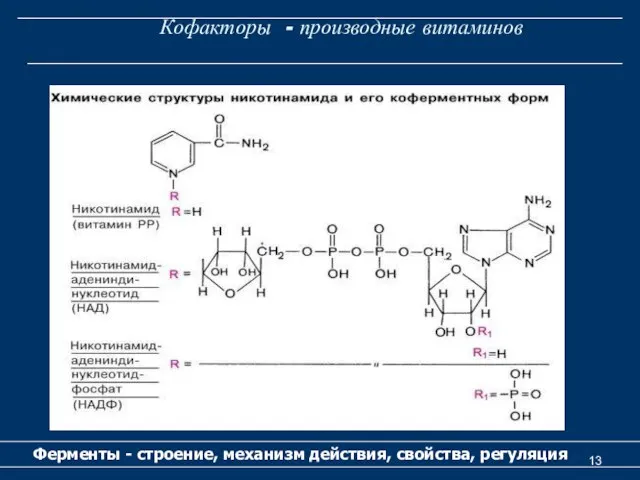
- 13. Кофакторы - производные витаминов Ферменты - строение, механизм действия, свойства, регуляция
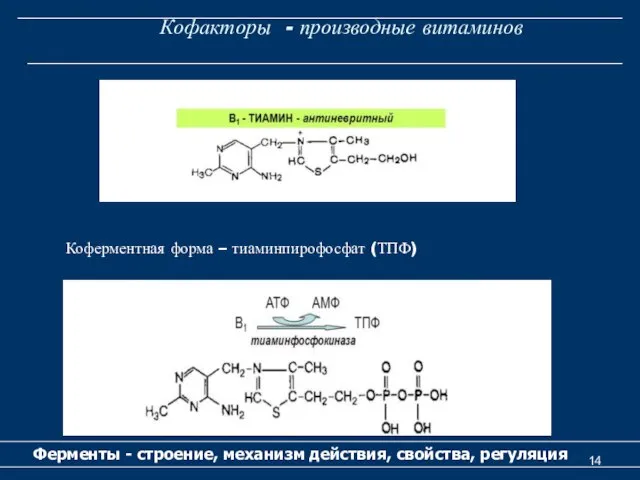
- 14. Кофакторы - производные витаминов Ферменты - строение, механизм действия, свойства, регуляция Коферментная форма – тиаминпирофосфат (ТПФ)
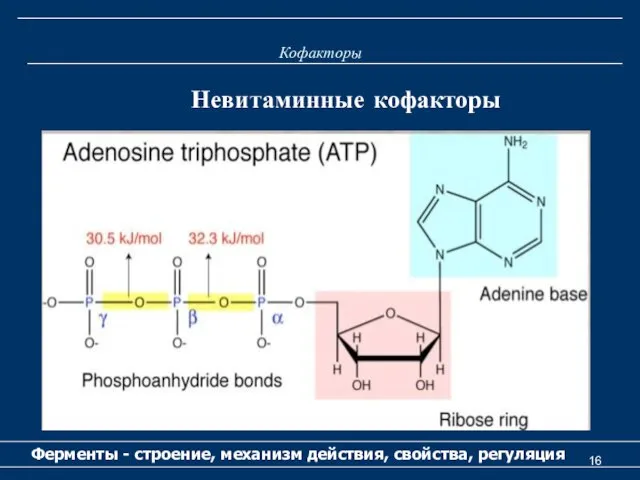
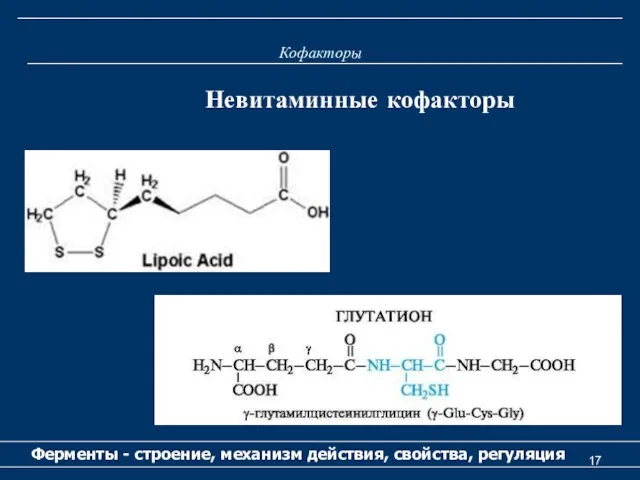
- 15. Кофакторы Ферменты - строение, механизм действия, свойства, регуляция Невитаминные кофакторы К невитаминным кофакторам относятся следующие соединения:
- 16. Кофакторы Ферменты - строение, механизм действия, свойства, регуляция Невитаминные кофакторы
- 17. Кофакторы Ферменты - строение, механизм действия, свойства, регуляция Невитаминные кофакторы
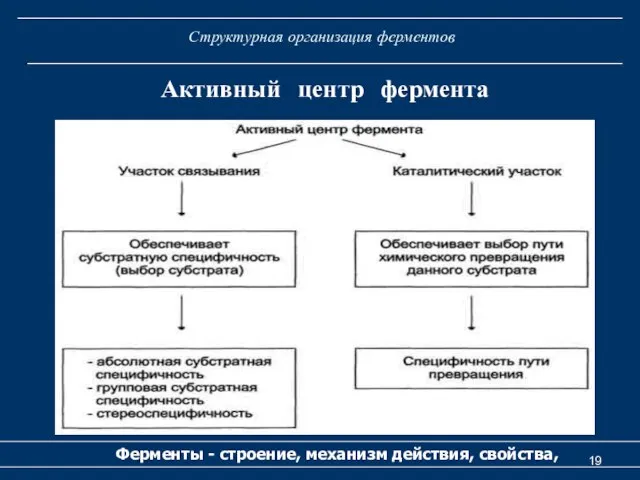
- 18. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, Активный центр фермента Активный центр - участок
- 19. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, Активный центр фермента
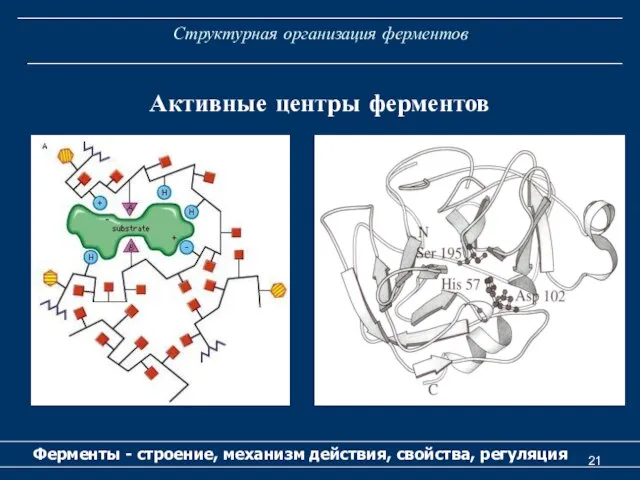
- 20. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, регуляция Активный центр у простых ферментов образует
- 21. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, регуляция Активные центры ферментов
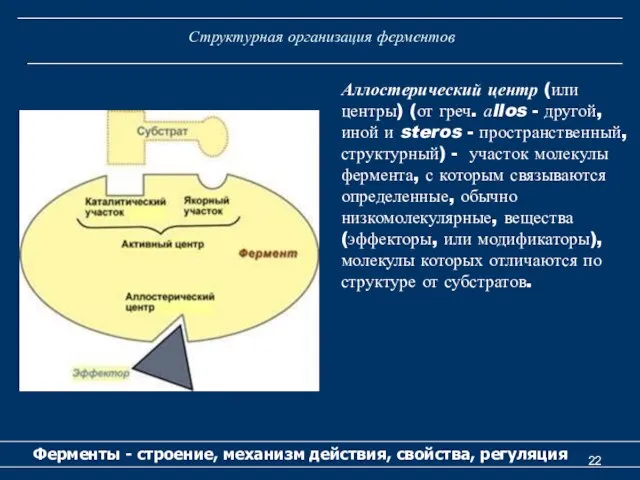
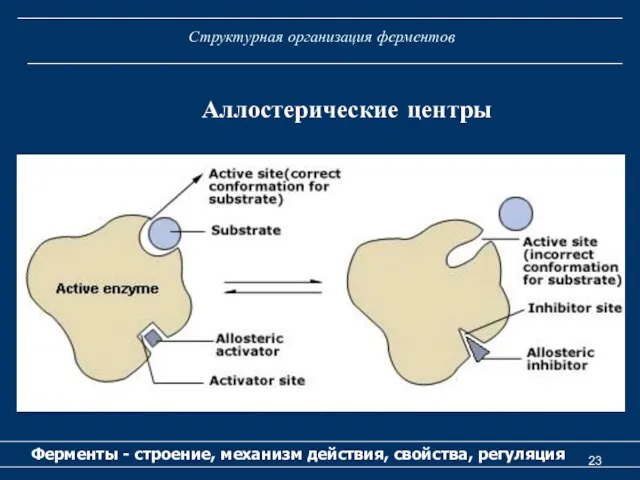
- 22. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, регуляция Аллостерический центр (или центры) (от греч.
- 23. Структурная организация ферментов Ферменты - строение, механизм действия, свойства, регуляция Аллостерические центры
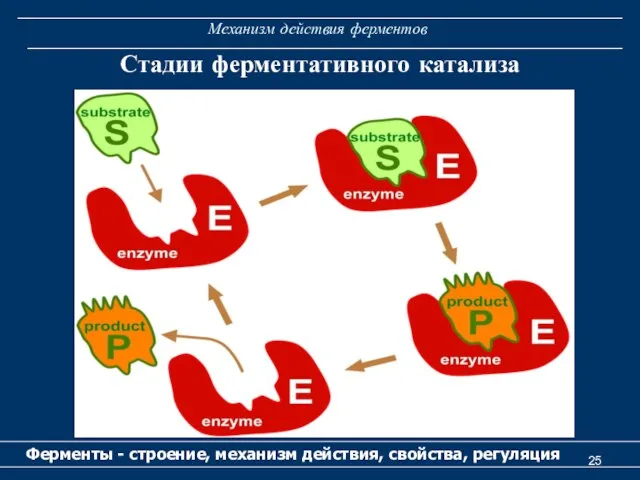
- 24. Механизм действия ферментов Ферменты - строение, механизм действия, свойства, регуляция I. Диффузия субстрата к ферменту и
- 25. Механизм действия ферментов Ферменты - строение, механизм действия, свойства, регуляция Стадии ферментативного катализа
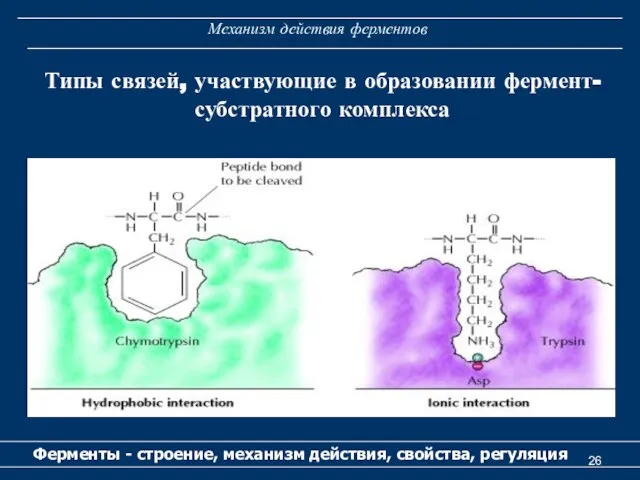
- 26. Механизм действия ферментов Ферменты - строение, механизм действия, свойства, регуляция Типы связей, участвующие в образовании фермент-субстратного
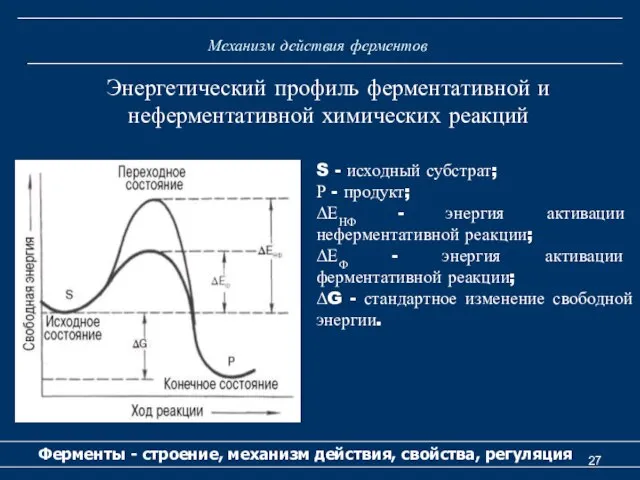
- 27. Механизм действия ферментов Ферменты - строение, механизм действия, свойства, регуляция Энергетический профиль ферментативной и неферментативной химических
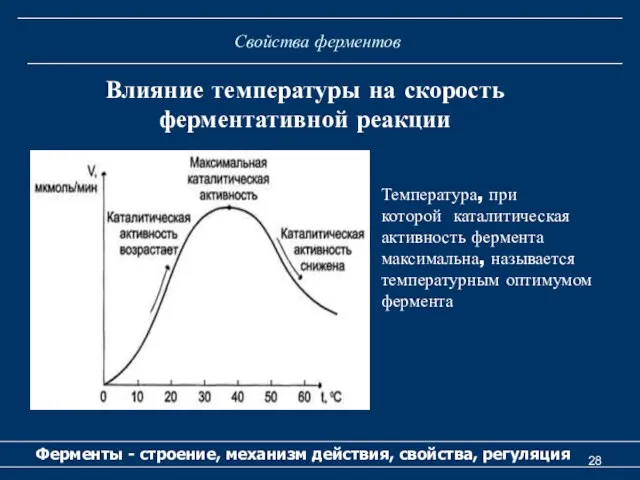
- 28. Свойства ферментов Ферменты - строение, механизм действия, свойства, регуляция Влияние температуры на скорость ферментативной реакции Температура,
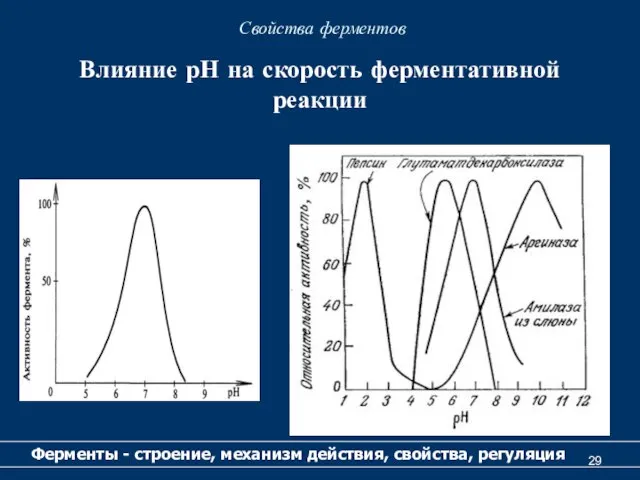
- 29. Свойства ферментов Ферменты - строение, механизм действия, свойства, регуляция Влияние рН на скорость ферментативной реакции
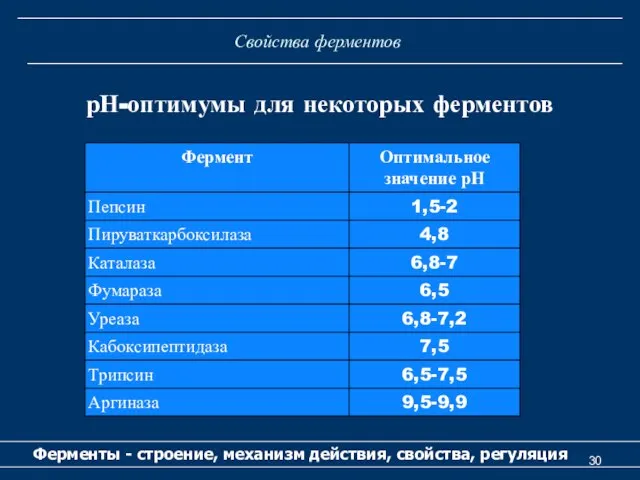
- 30. Свойства ферментов Ферменты - строение, механизм действия, свойства, регуляция рН-оптимумы для некоторых ферментов
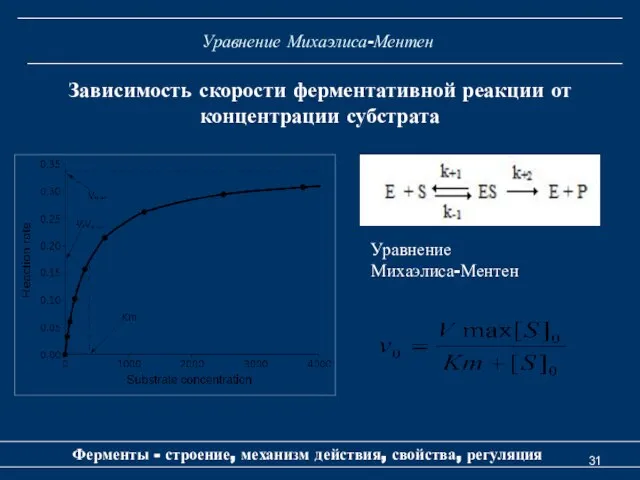
- 31. Уравнение Михаэлиса-Ментен Ферменты - строение, механизм действия, свойства, регуляция Зависимость скорости ферментативной реакции от концентрации субстрата
- 32. Уравнение Михаэлиса-Ментен Ферменты - строение, механизм действия, свойства, регуляция Ученые – основоположники ферментативной кинетики Браун А.,
- 33. Ферменты - строение, механизм действия, свойства Уравнение Михаэлиса-Ментен Км и Vmax - важнейшие характеристики ферментов Км
- 34. Уравнение Михаэлиса-Ментен Ферменты - строение, механизм действия, свойства, регуляция Для большинства ферментативных реакций Км колеблется в
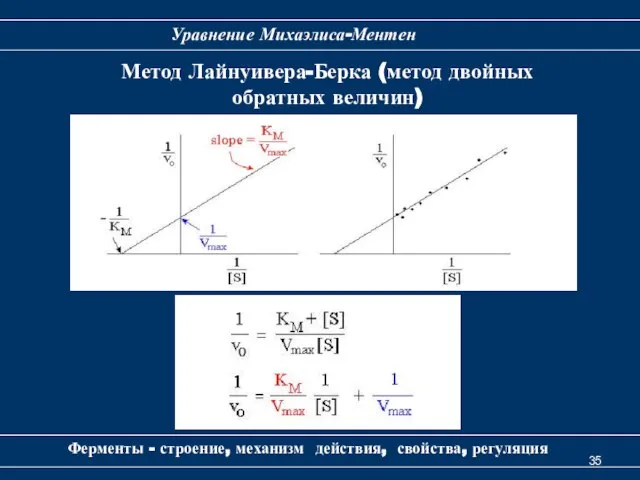
- 35. Ферменты - строение, механизм действия, свойства, регуляция Уравнение Михаэлиса-Ментен Метод Лайнуивера-Берка (метод двойных обратных величин)
- 36. Единицы ферментов Ферменты - строение, механизм действия, свойства, регуляция - О количестве ферментов судят по скорости
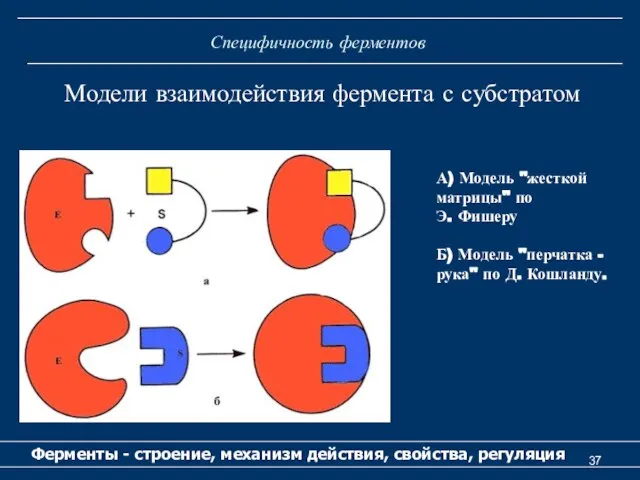
- 37. Специфичность ферментов Ферменты - строение, механизм действия, свойства, регуляция Модели взаимодействия фермента с субстратом А) Модель
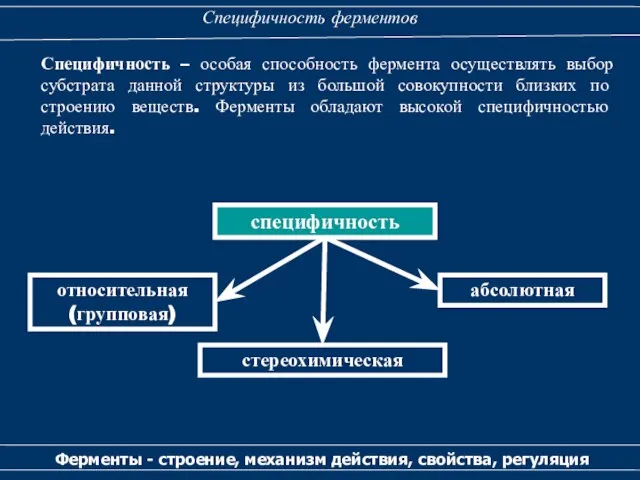
- 38. Специфичность ферментов Ферменты - строение, механизм действия, свойства, регуляция Специфичность – особая способность фермента осуществлять выбор
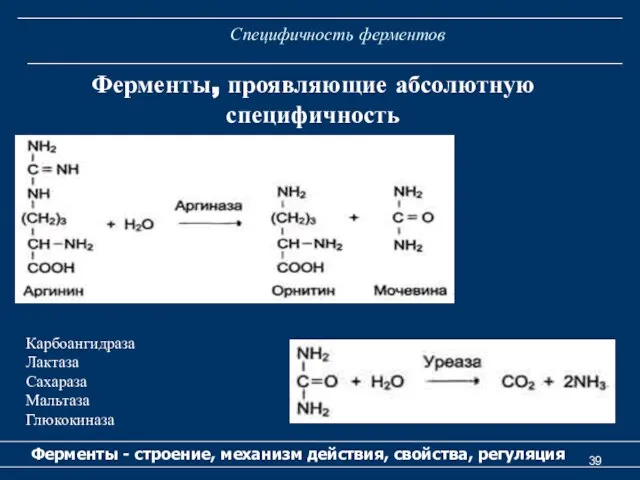
- 39. Специфичность ферментов Ферменты - строение, механизм действия, свойства, регуляция Ферменты, проявляющие абсолютную специфичность Карбоангидраза Лактаза Сахараза
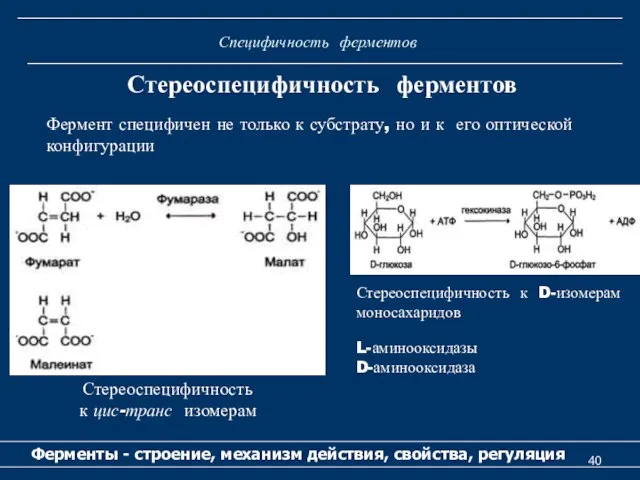
- 40. Специфичность ферментов Ферменты - строение, механизм действия, свойства, регуляция Стереоспецифичность ферментов Стереоспецифичность к цис-транс изомерам Стереоспецифичность
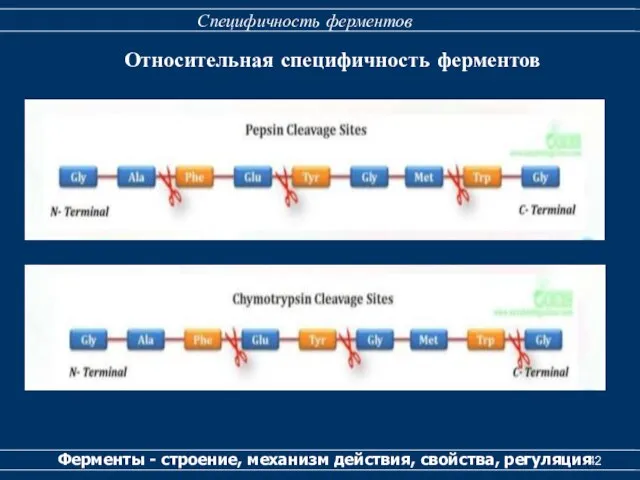
- 41. Специфичность ферментов Ферменты - строение, механизм действия, свойства, регуляция Относительная специфичность ферментов
- 42. Специфичность ферментов Ферменты - строение, механизм действия, свойства, регуляция Относительная специфичность ферментов
- 43. Активаторы и ингибиторы ферментов Активаторы ферментов Активаторами называют вещества, увеличивающие каталитическую активность ферментов. Среди активаторов встречаются
- 44. Активаторы ферментов Ферменты - строение, механизм действия, свойства, регуляция Примеры активаторов - Соляная кислота активирует действие
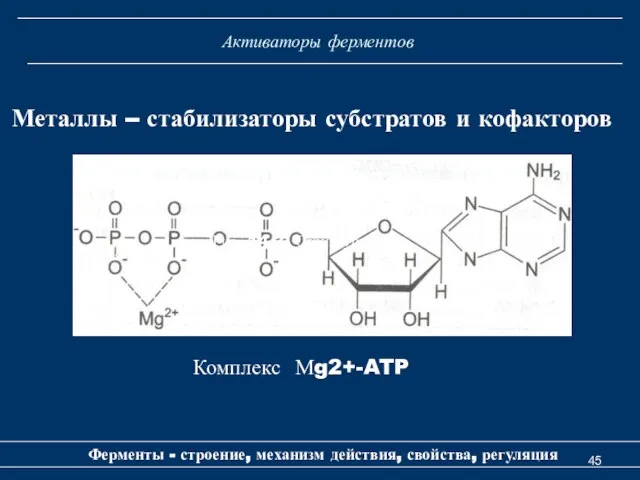
- 45. Активаторы ферментов Ферменты - строение, механизм действия, свойства, регуляция Металлы – стабилизаторы субстратов и кофакторов Рис.
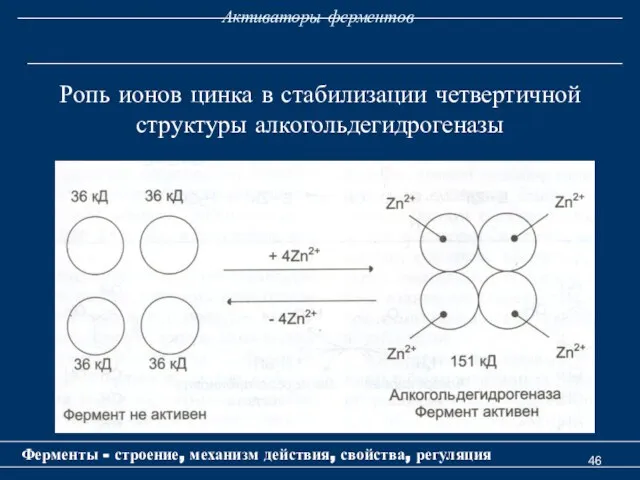
- 46. Активаторы ферментов Ферменты - строение, механизм действия, свойства, регуляция Ропь ионов цинка в стабилизации четвертичной структуры
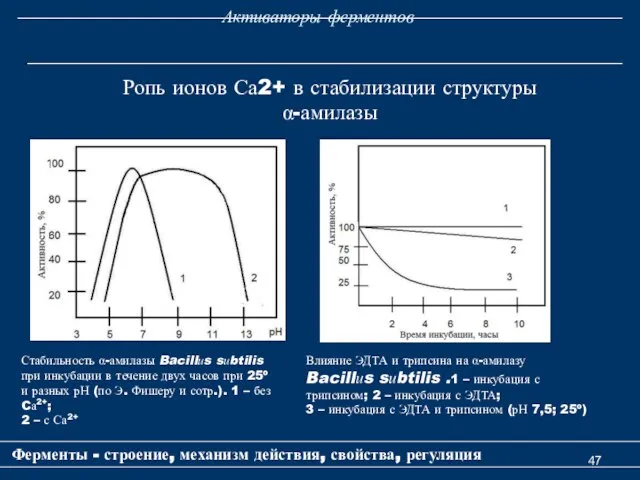
- 47. Активаторы ферментов Ферменты - строение, механизм действия, свойства, регуляция Ропь ионов Са2+ в стабилизации структуры α-амилазы
- 48. Ингибиторы ферментов Ингибиторы ферментов Ингибиторы - вещества, вызывающие снижение активности фермента. Если ингибитор вызывает стойкие изменения
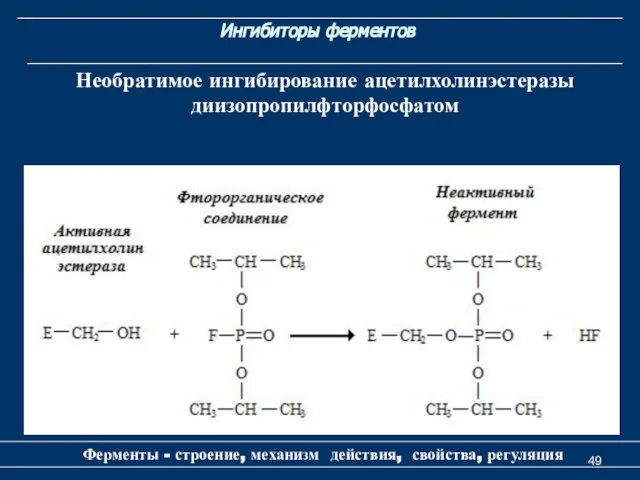
- 49. Ингибиторы ферментов Ферменты - строение, механизм действия, свойства, регуляция Необратимое ингибирование ацетилхолинэстеразы диизопропилфторфосфатом
- 50. Ингибиторы ферментов Ферменты - строение, механизм действия, свойства, регуляция Обратимое ингибирование В случае обратимого действия ингибитор
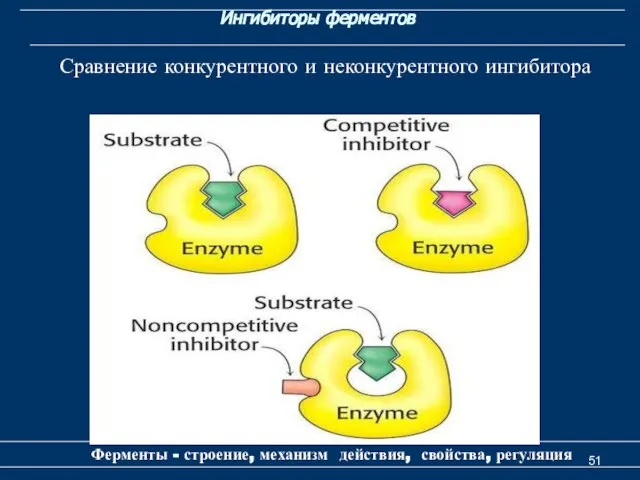
- 51. Ингибиторы ферментов Ферменты - строение, механизм действия, свойства, регуляция Сравнение конкурентного и неконкурентного ингибитора
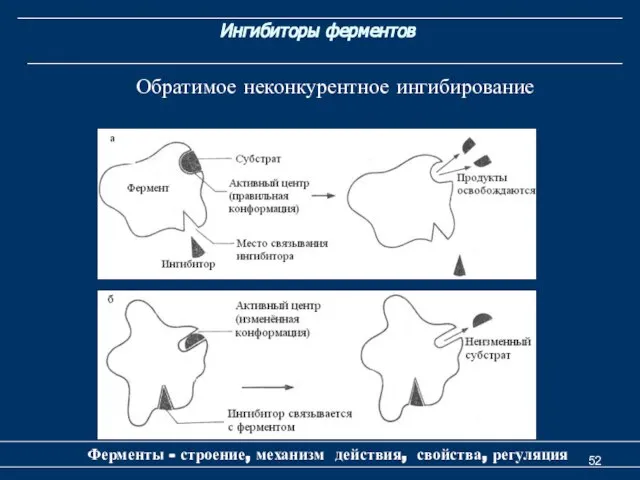
- 52. Ингибиторы ферментов Ферменты - строение, механизм действия, свойства, регуляция Обратимое неконкурентное ингибирование
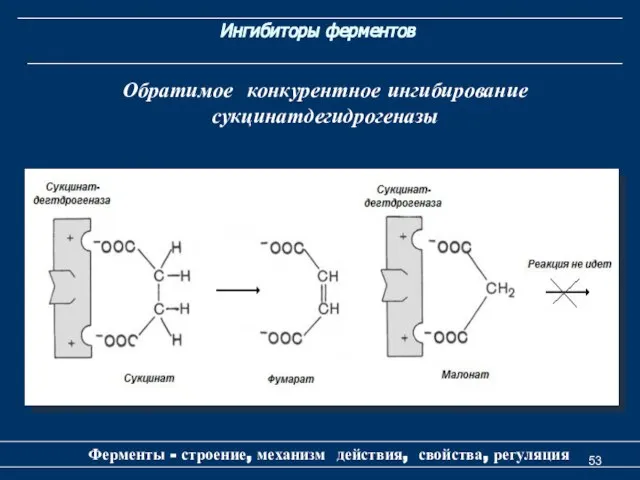
- 53. Ингибиторы ферментов Ферменты - строение, механизм действия, свойства, регуляция Обратимое конкурентное ингибирование сукцинатдегидрогеназы
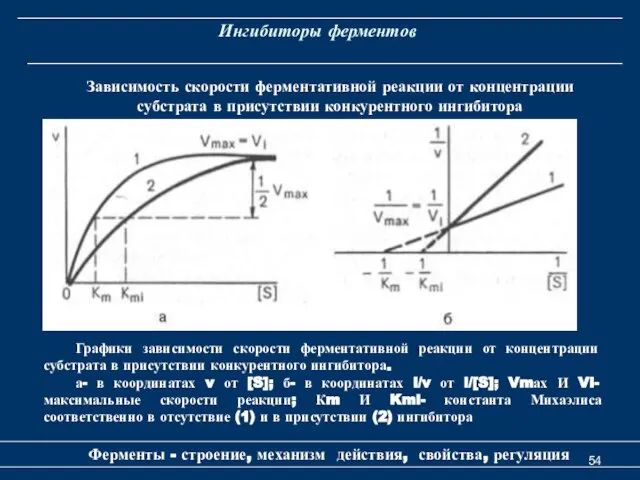
- 54. Ингибиторы ферментов Ферменты - строение, механизм действия, свойства, регуляция Зависимость скорости ферментативной реакции от концентрации субстрата
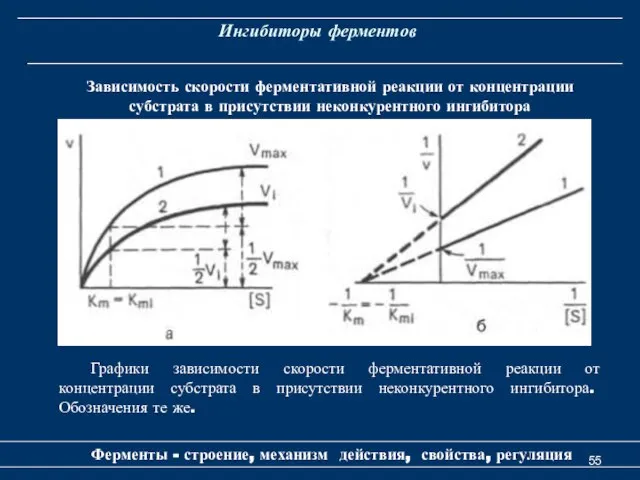
- 55. Ингибиторы ферментов Ферменты - строение, механизм действия, свойства, регуляция Зависимость скорости ферментативной реакции от концентрации субстрата
- 56. Регуляция активности ферментов 1. Изменение количества ферментного белка – индукция или репрессия синтеза ферментного белка. 2.
- 57. Регуляция активности ферментов Основные виды: аллостерическая регуляция; ковалентная (химическая) модификация; частичный (ограниченный) протеолиз. Ферменты - строение,
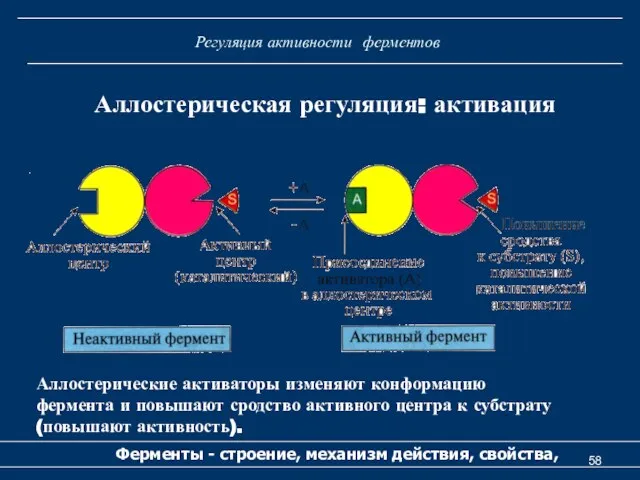
- 58. Регуляция активности ферментов Ферменты - строение, механизм действия, свойства, Аллостерическая регуляция: активация Аллостерические активаторы изменяют конформацию
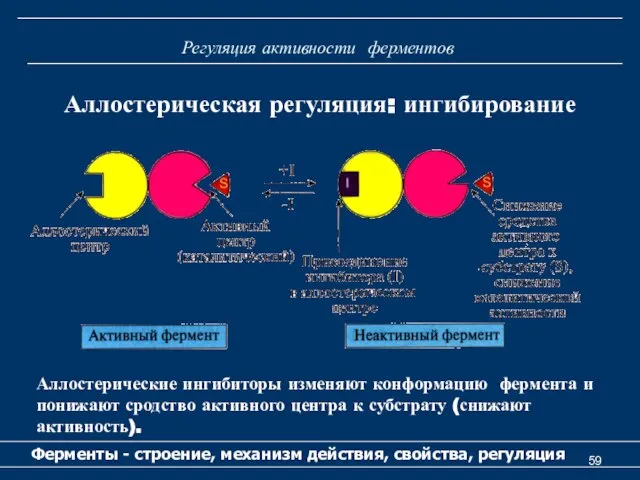
- 59. Регуляция активности ферментов Ферменты - строение, механизм действия, свойства, регуляция Аллостерическая регуляция: ингибирование Аллостерические ингибиторы изменяют
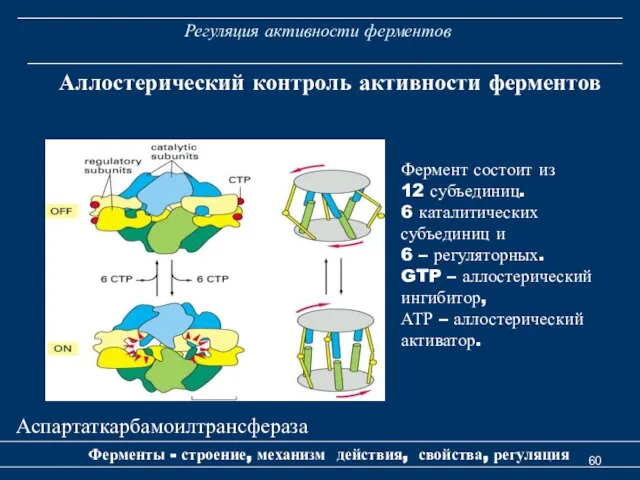
- 60. Регуляция активности ферментов Ферменты - строение, механизм действия, свойства, регуляция Аллостерический контроль активности ферментов Аспартаткарбамоилтрансфераза Фермент
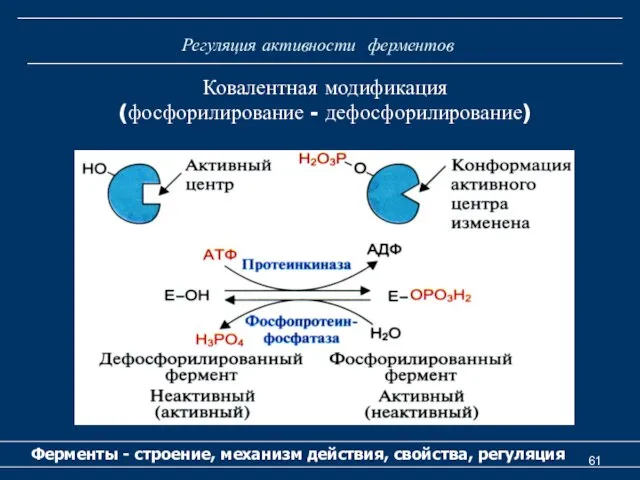
- 61. Регуляция активности ферментов Ферменты - строение, механизм действия, свойства, регуляция Ковалентная модификация (фосфорилирование - дефосфорилирование)
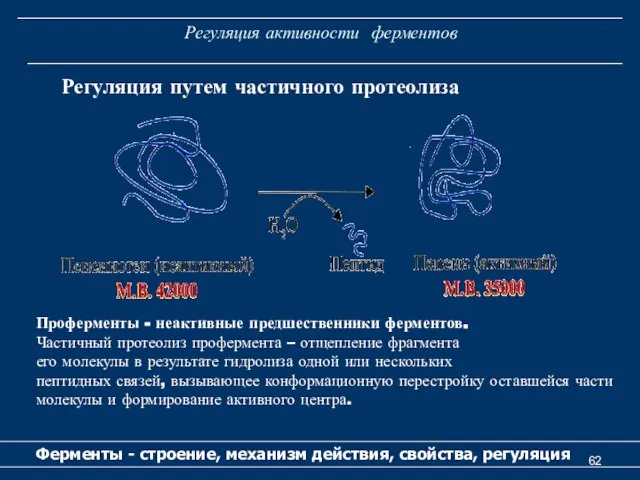
- 62. Регуляция активности ферментов Ферменты - строение, механизм действия, свойства, регуляция Регуляция путем частичного протеолиза Проферменты -
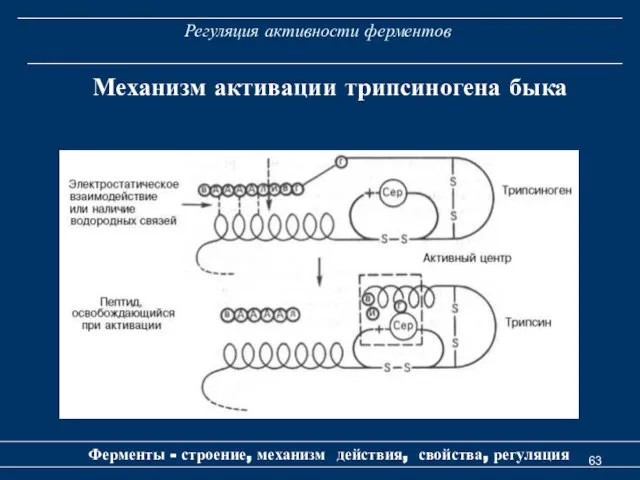
- 63. Регуляция активности ферментов Ферменты - строение, механизм действия, свойства, регуляция Механизм активации трипсиногена быка
- 64. Классификация ферментов Классификация и номенклатура ферментов 1. Оксидоредуктазы 2. Tрансферазы 3. Гидролазы 4. Лиазы 5. Изомеразы
- 65. Классификация ферментов Ферменты - строение, механизм действия, свойства, регуляция Международная классификация и номенклатура ферментов 6 классов
- 66. Номенклатура ферментов Классификация и номенклатура ферментов Каждому ферменту присвоен четырехзначный классификационный номер (шифр). КФ 1.1.1.37 –
- 68. Скачать презентацию
























 Рослинні жири Підготувала учениця 11-А класу Бойко Наталія
Рослинні жири Підготувала учениця 11-А класу Бойко Наталія  Насекомые
Насекомые История и методология космической биологии
История и методология космической биологии Презентация на тему Круговорот воды в природе
Презентация на тему Круговорот воды в природе Экология лесных насекомых. (Лекция 3)
Экология лесных насекомых. (Лекция 3) Отряд жесткокрылые
Отряд жесткокрылые Цветок – генеративный орган, его строение и значение
Цветок – генеративный орган, его строение и значение Презентация на тему "Природа Евразии" - скачать презентации по Биологии
Презентация на тему "Природа Евразии" - скачать презентации по Биологии Триггерные точки верхней части руки
Триггерные точки верхней части руки Огурец Герман F1
Огурец Герман F1 Матричные биосинтезы-2
Матричные биосинтезы-2 Физиология анализаторов. Часть 1
Физиология анализаторов. Часть 1 Стресс, стресс!
Стресс, стресс!  Органойды клетки
Органойды клетки Грибы. Съедобные грибы
Грибы. Съедобные грибы Примитивные организмы
Примитивные организмы Строение и функции белков
Строение и функции белков Деление клетки. Митоз
Деление клетки. Митоз Загадочный витамин В17
Загадочный витамин В17 Кроманьонец
Кроманьонец Презентация на тему "Размножение и оплодотворение у растений" - презентации по Биологии
Презентация на тему "Размножение и оплодотворение у растений" - презентации по Биологии Тритоны. Среда обитания
Тритоны. Среда обитания Наука биология
Наука биология Мы – такие разные. Расы
Мы – такие разные. Расы Инфузория - туфелька
Инфузория - туфелька Каталитическая активность ферментов
Каталитическая активность ферментов Почему листья зеленые?
Почему листья зеленые? В мире животных
В мире животных