Содержание
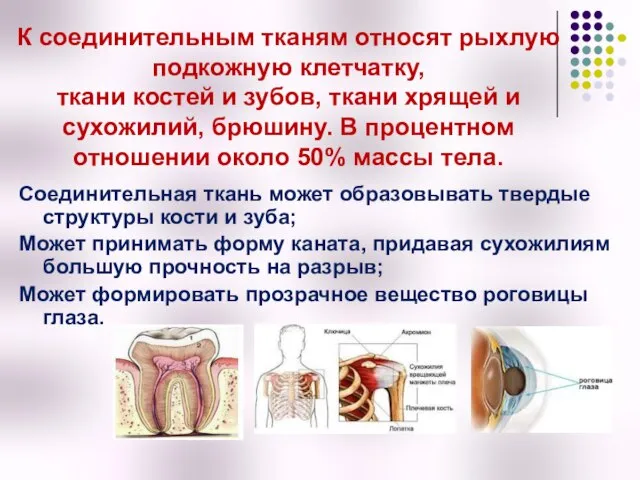
- 2. К соединительным тканям относят рыхлую подкожную клетчатку, ткани костей и зубов, ткани хрящей и сухожилий, брюшину.
- 3. Функции соединительной ткани 1. Опорная – образует каркас внутренних органов; 2. Трофическая – обеспечивает ткани питательными
- 4. Особенностью строения соединительной ткани является то, что внеклеточный матрикс занимает больше место, чем сами клетки. Внеклеточный
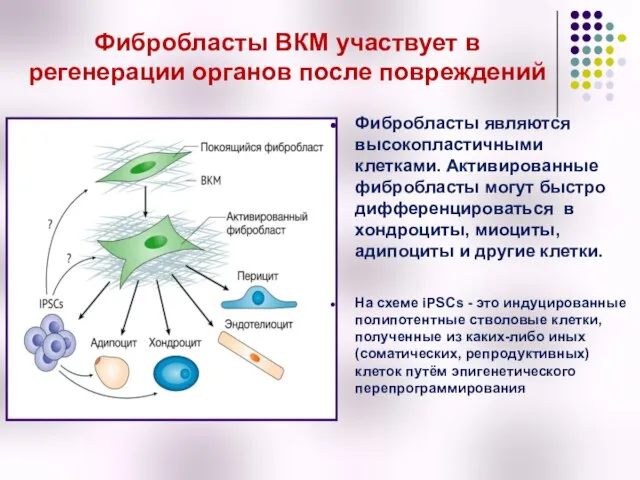
- 5. Фибробласты ВКМ участвует в регенерации органов после повреждений Фибробласты являются высокопластичными клетками. Активированные фибробласты могут быстро
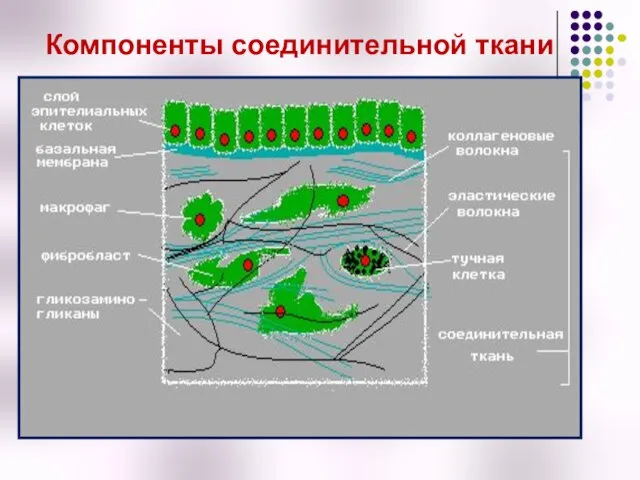
- 6. Компоненты соединительной ткани
- 7. Внеклеточный матрикс (ВКМ) соединительной ткани: 1. Имеет сложный химический состав, содержит разнообразные белки и полисахариды, в
- 8. Белки внеклеточного матрикса Среди белков внеклеточного матрикса выделяют белки двух функциональных типов - фибриллярные и адгезивные.
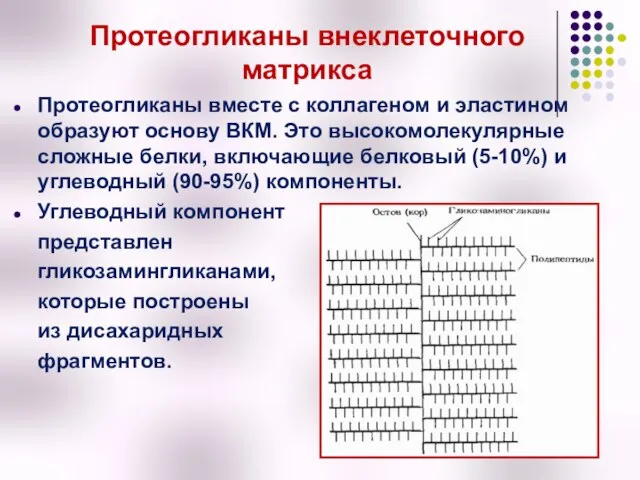
- 9. Протеогликаны внеклеточного матрикса Протеогликаны вместе с коллагеном и эластином образуют основу ВКМ. Это высокомолекулярные сложные белки,
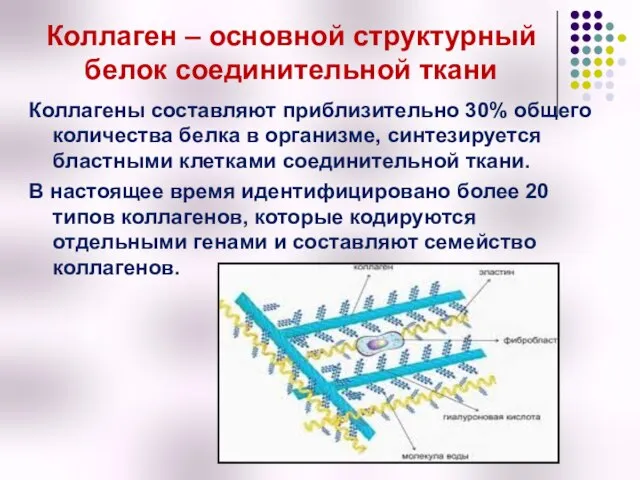
- 11. Коллаген – основной структурный белок соединительной ткани Коллагены составляют приблизительно 30% общего количества белка в организме,
- 12. Строение молекул коллагенов Молекулы коллагенов имеют трехспиральную структуру, полученную при скручивании трех полипептидных α – цепей.
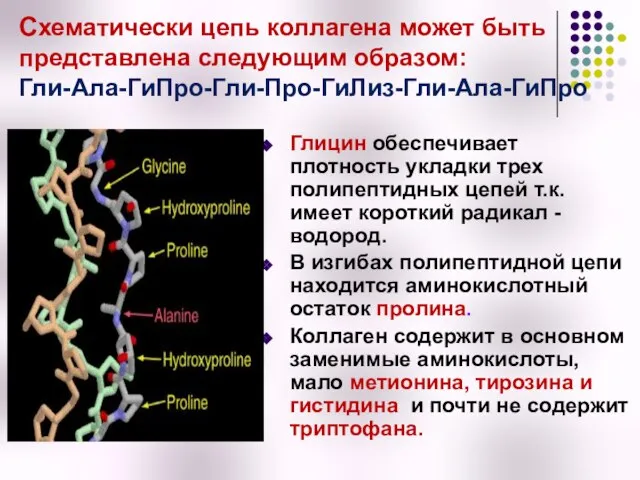
- 13. Особенности аминокислотного состава коллагена Полипептидная цепь коллагена состоит из повторяющихся триплетов: [Гли-Х-Y], где Гли – глицин,
- 14. Схематически цепь коллагена может быть представлена следующим образом: Гли-Ала-ГиПро-Гли-Про-ГиЛиз-Гли-Ала-ГиПро Глицин обеспечивает плотность укладки трех полипептидных цепей
- 15. Синтез коллагена Коллаген синтезируется внутри различных бластных клеток соединительной ткани в виде препроколлагена, содержащего на N
- 16. Созревание коллагена После синтеза цепи коллагена следует сложный многоступенчатый процесс - созревания коллагена Включает 2 этапа:
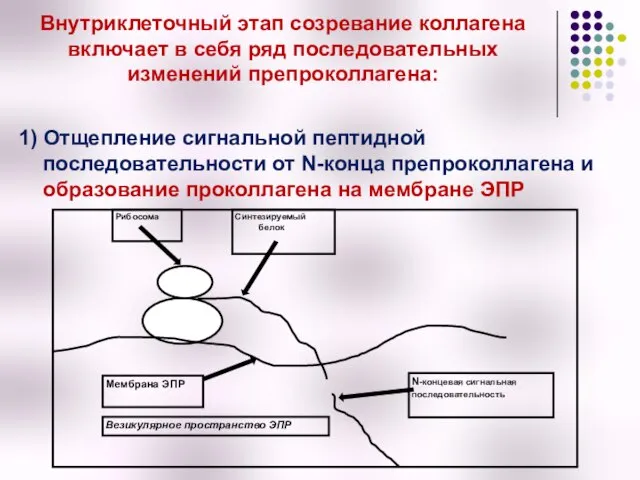
- 17. Внутриклеточный этап созревание коллагена включает в себя ряд последовательных изменений препроколлагена: 1) Отщепление сигнальной пептидной последовательности
- 18. 2) Гидроксилирование пролина и лизина проколлагена катализируют ферменты гидроксилазы Гидроксипролин (ГиПро) далее участвует в образовании водородных
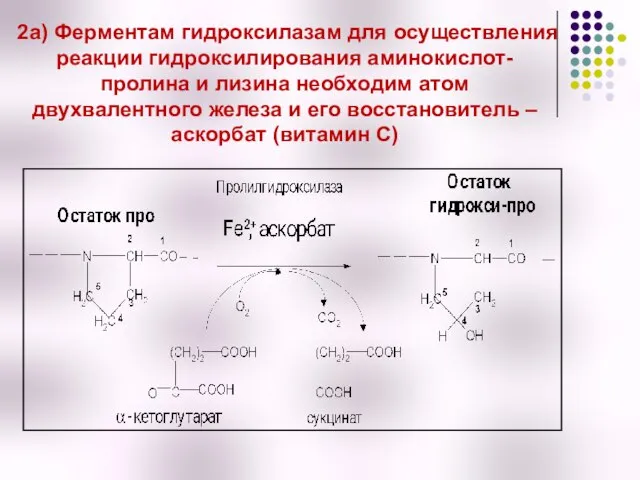
- 19. 2а) Ферментам гидроксилазам для осуществления реакции гидроксилирования аминокислот- пролина и лизина необходим атом двухвалентного железа и
- 20. 3) Гликозилирование гидроксилизина под действием гликозилтрансфераз (присоединение углеводного компонента) Углеводные компоненты связываются с гидроксилином О -
- 21. 4) Формирование тройной спирали проколлагена Каждая α – цепь проколлагена соединяется водородными связями с двумя другими
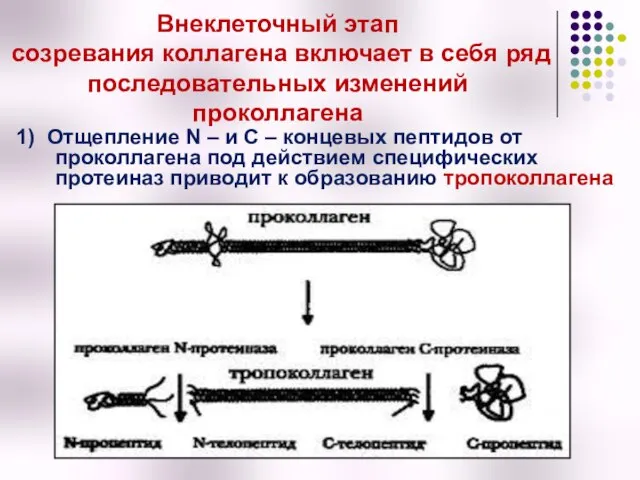
- 22. Внеклеточный этап созревания коллагена включает в себя ряд последовательных изменений проколлагена 1) Отщепление N – и
- 23. 2) Формирование фибрилл коллагена Из сформировавшихся молекул тропоколлагена происходит сборка коллагеновых фибрилл, в которых одна нить
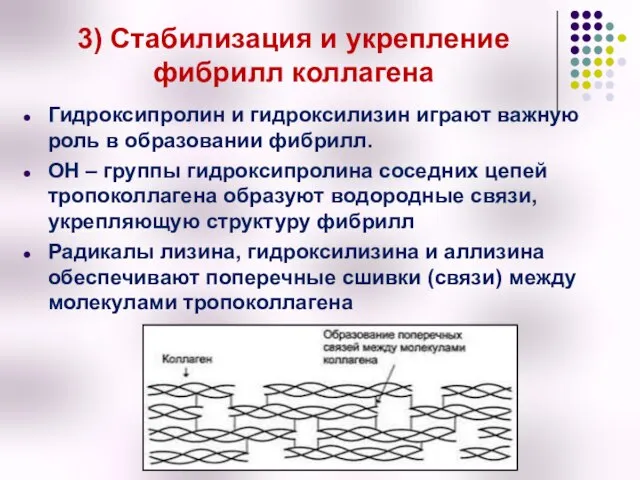
- 24. 3) Стабилизация и укрепление фибрилл коллагена Гидроксипролин и гидроксилизин играют важную роль в образовании фибрилл. ОН
- 25. Образование аллизина Для создания укрепляющих сшивок фермент лизилоксидаза катализирует реакцию превращения аминогрупп отдельных лизильных и гидроксилизильных
- 26. Возникшие альдегидные производные (аллизины) участвуют в образовании ковалентных связей, которые стабилизируют фибриллы коллагена. Альдольная сшивка –
- 28. На рисунке схематически представлены трехспиральные молекулы тропоколлагена после наложения внутри и межмолекулярных сшивок, которые изображены в
- 29. Общая схема внеклеточного этапа созревания коллагена
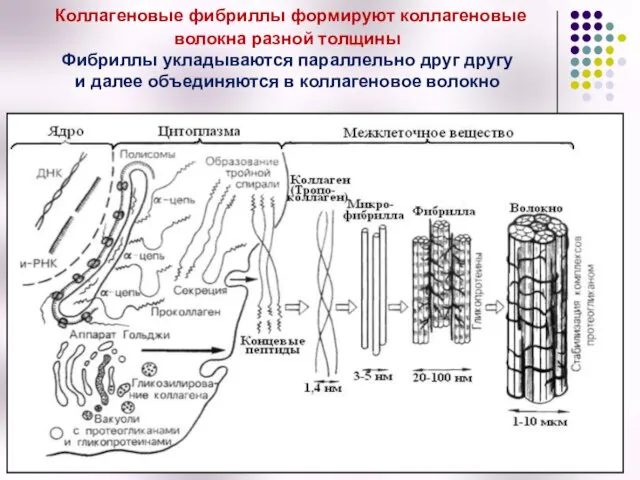
- 30. Коллагеновые фибриллы формируют коллагеновые волокна разной толщины Фибриллы укладываются параллельно друг другу и далее объединяются в
- 31. Уникальные свойства коллагенов Коллагеновые волокна обладают огромной прочностью и практически нерастяжимы. Они могут выдерживать нагрузку в
- 32. Катаболизм коллагена Распад нативного коллагена происходит медленно под действием коллагеназы (Zn-зависимой). Коллагеназа расщепляет пептидные связи между
- 33. Основной маркер распада коллагена Важнейший метаболитом характеризующим скорость распада коллагена является гидроксипролин. Повышение содержания гидроксипролина в
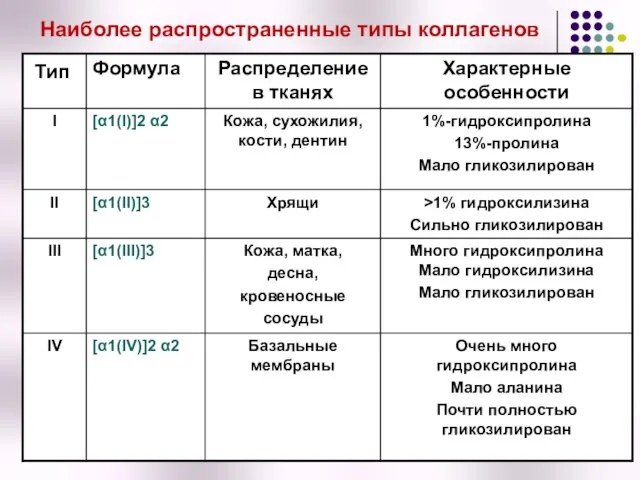
- 34. Типы коллагена В настоящее время известно около 20 различных типов коллагена, различающихся по первичной и пространственной
- 35. Наиболее распространенные типы коллагенов
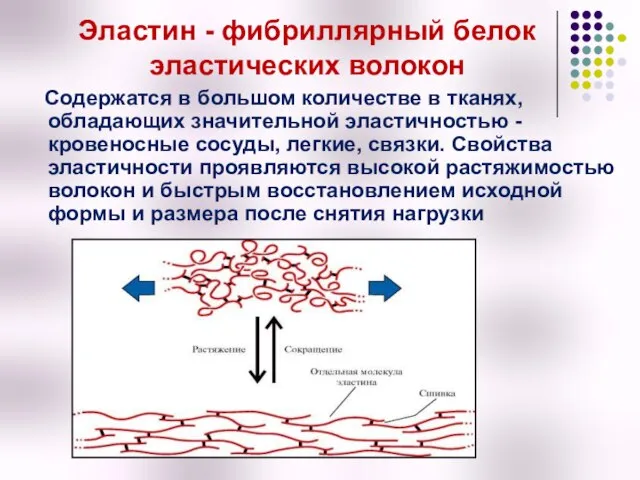
- 36. Эластин - фибриллярный белок эластических волокон Содержатся в большом количестве в тканях, обладающих значительной эластичностью -
- 37. Особенности аминокислотного состава эластина Эластин – гликопротеин с молекулярной массой 70 кД, содержит много гидрофобных аминокислот
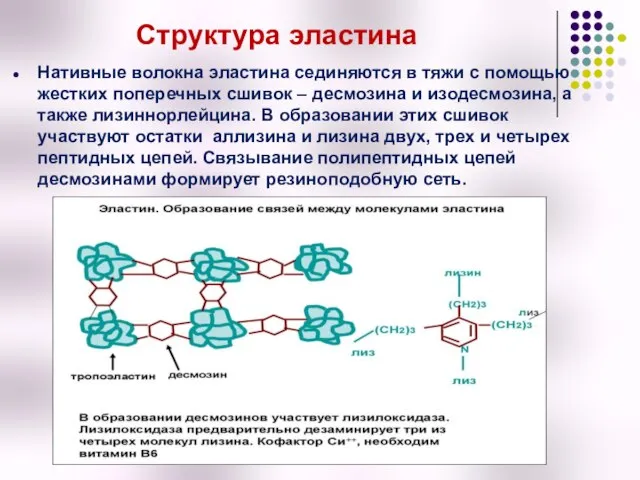
- 38. Структура эластина Нативные волокна эластина сединяются в тяжи с помощью жестких поперечных сшивок – десмозина и
- 39. Неколлагеновые белки межклеточного матрикса К этой группе белков относятся адгезивные белки, такие как фибронектин, ламинин, нидоген,
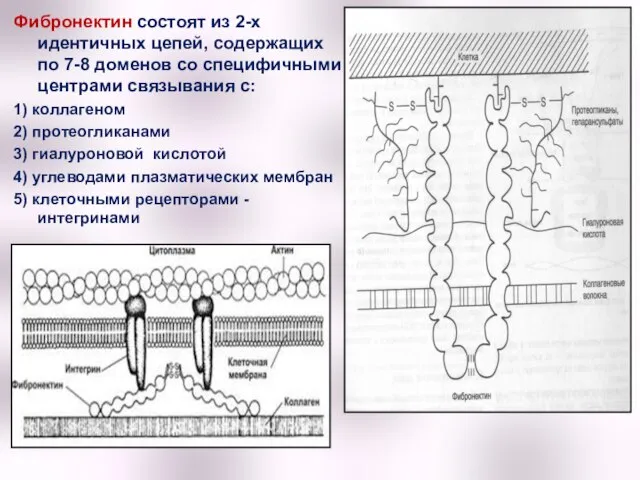
- 40. Фибронектин состоят из 2-х идентичных цепей, содержащих по 7-8 доменов со специфичными центрами связывания с: 1)
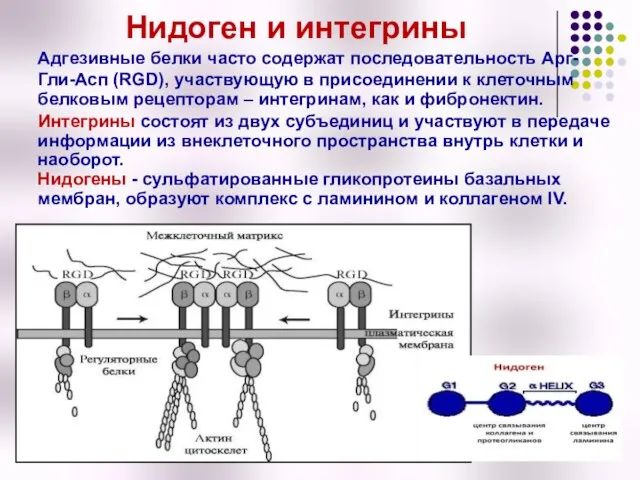
- 41. Нидоген и интегрины Адгезивные белки часто содержат последовательность Арг-Гли-Асп (RGD), участвующую в присоединении к клеточным белковым
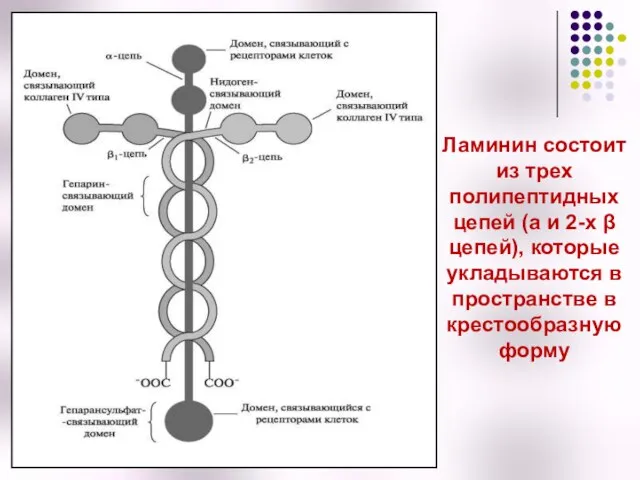
- 42. Ламинины – распространенные гликопротеины базальных мембран, отделяющих соединительную ткань от эпителия Ламинины содержит несколько центров связывания
- 43. Ламинин состоит из трех полипептидных цепей (a и 2-х β цепей), которые укладываются в пространстве в
- 44. Фибриллин Это гликопротеин , который необходим для образования эластичных волокон в соединительной ткани. Фибриллин секретируется во
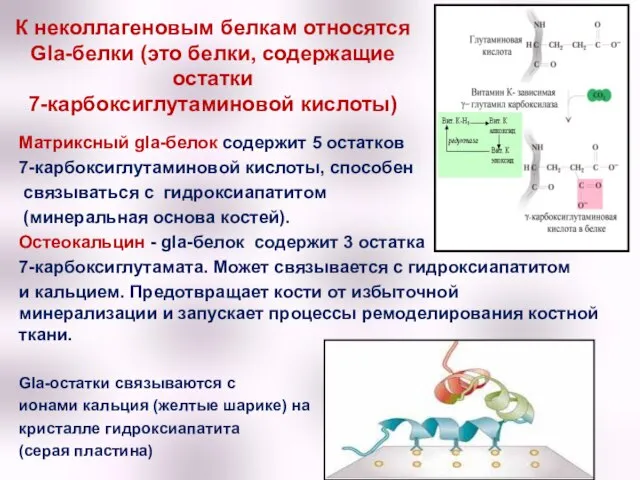
- 45. К неколлагеновым белкам относятся Gla-белки (это белки, содержащие остатки 7-карбоксиглутаминовой кислоты) Матриксный gla-белок содержит 5 остатков
- 46. Протеогликаны Молекулы протеогликанов участвуют в сборке межклеточного матрикса, облегчают фиксацию клеток и регулируют их рост. Протеогликаны
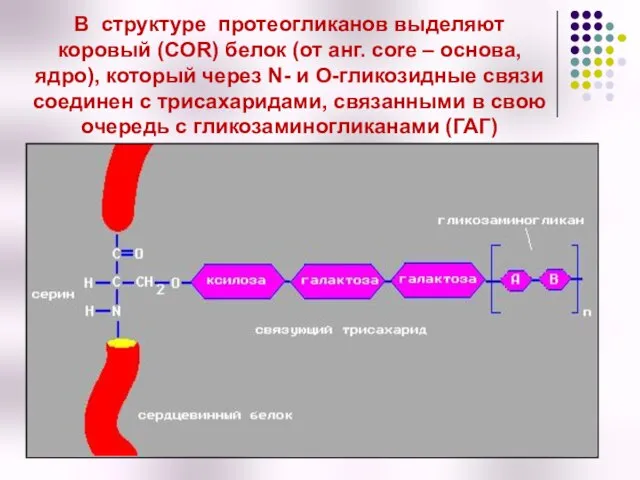
- 47. В структуре протеогликанов выделяют коровый (COR) белок (от анг. сore – основа, ядро), который через N-
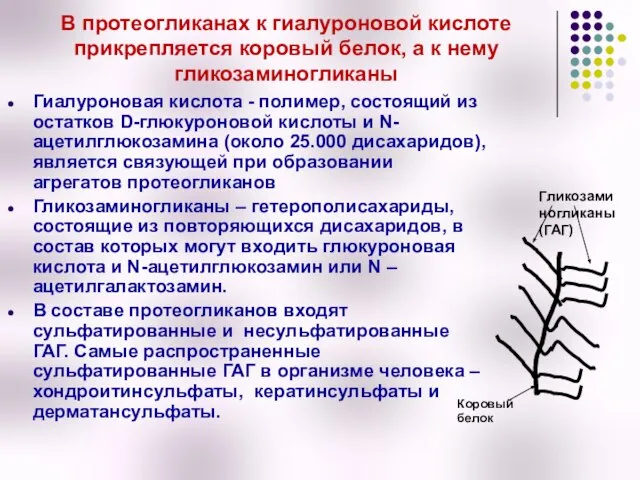
- 48. В протеогликанах к гиалуроновой кислоте прикрепляется коровый белок, а к нему гликозаминогликаны Гиалуроновая кислота - полимер,
- 49. Хондроитинсульфат построен из глюкуроновой кислоты и сульфатированного N–ацетилгалактозамина
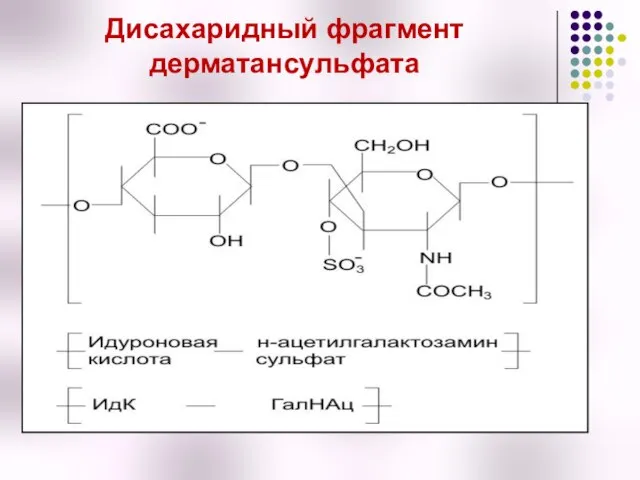
- 50. Дисахаридный фрагмент дерматансульфата
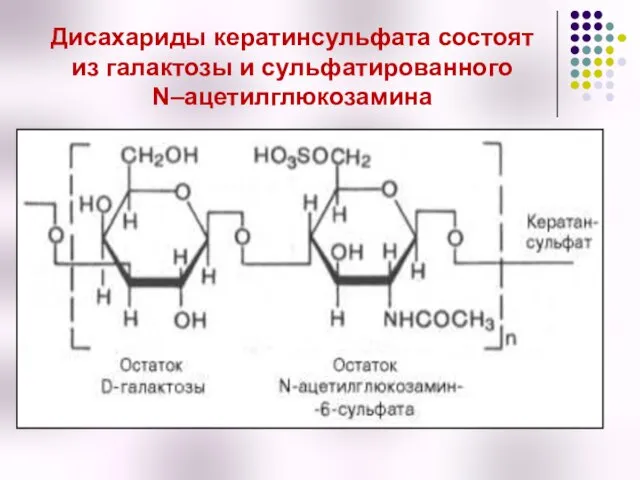
- 51. Дисахариды кератинсульфата состоят из галактозы и сульфатированного N–ацетилглюкозамина
- 52. Функции гликозаминогликанов - участвуют в организации межклеточного матрикса, являются основным скрепляющим веществом - взаимодействуют с клеточными
- 53. Метаболизм протеогликанов Синтез протеогликанов начинается с синтеза корового белка в клетках соединительной ткани, далее к нему
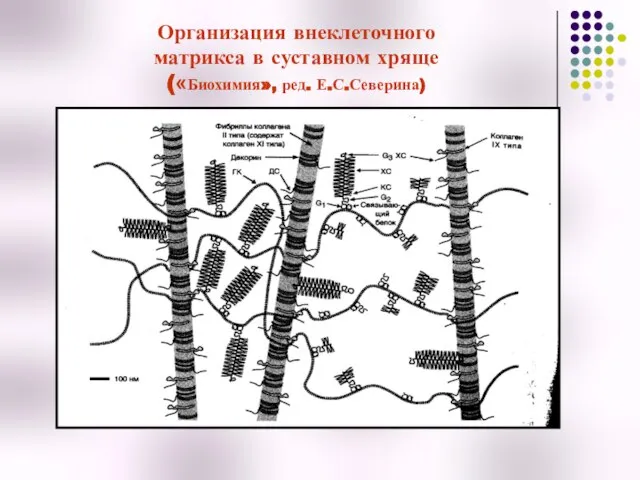
- 54. Организация внеклеточного матрикса в суставном хряще («Биохимия», ред. Е.С.Северина)
- 55. Коллагеновые болезни (нарушение обмена коллагена) Несовершенный остеогенез – мутации в гене, кодирующем синтез коллагена I. Самая
- 57. Скачать презентацию































 Фокина Ольга Степановна, учитель биологии
Фокина Ольга Степановна, учитель биологии Животные жарких стран
Животные жарких стран Размножение и развитие насекомых Разработал учитель химии и биологии Петреня Игорь Михайлович
Размножение и развитие насекомых Разработал учитель химии и биологии Петреня Игорь Михайлович Карагандинский Государственный Медицинский Университет Кафедра молекулярной биологии и медицинской генетики СРС Презентация
Карагандинский Государственный Медицинский Университет Кафедра молекулярной биологии и медицинской генетики СРС Презентация  Презентация на тему Лошади
Презентация на тему Лошади  Почему их так навали? 1 класс
Почему их так навали? 1 класс Пагін. Його будова, основні функції
Пагін. Його будова, основні функції Роль биологии в формировании современной естественно-научной картины мира и в практической деятельности людей
Роль биологии в формировании современной естественно-научной картины мира и в практической деятельности людей Презентация на тему "Нейроцитология" - скачать бесплатно презентации по Биологии
Презентация на тему "Нейроцитология" - скачать бесплатно презентации по Биологии Класс Земноводные
Класс Земноводные Насекомые Смоленской области Автор: Коляда Елена Владимировна учитель начальных классов МБОУ ЯСОШ№4 Г.Ярцево
Насекомые Смоленской области Автор: Коляда Елена Владимировна учитель начальных классов МБОУ ЯСОШ№4 Г.Ярцево  Насекомые рекордсмены
Насекомые рекордсмены Корни и корневые системы
Корни и корневые системы Влияние энергетических напитков на артериальное давление
Влияние энергетических напитков на артериальное давление АТМОСФЕРА, ЕЕ СОСТАВ, СТРОЕНИЕ И ЗНАЧЕНИЕ
АТМОСФЕРА, ЕЕ СОСТАВ, СТРОЕНИЕ И ЗНАЧЕНИЕ  Школа 6 – территория дружбы
Школа 6 – территория дружбы Класс Пресмыкающиеся, или Рептилии
Класс Пресмыкающиеся, или Рептилии Презентация на тему Хромосомы
Презентация на тему Хромосомы  Паспорт комнатных растений
Паспорт комнатных растений Класс Пресмыкающиеся
Класс Пресмыкающиеся About viruses. Quiz
About viruses. Quiz СКАТЫ Над презентацией работала ученица 7 класса МОУ СОШ №7 г. Ужура Красноярского края Арлачёва Екат
СКАТЫ Над презентацией работала ученица 7 класса МОУ СОШ №7 г. Ужура Красноярского края Арлачёва Екат Мир животных
Мир животных Этапы онтогенеза и факторы его регуляции. Морфогенез и рост растения
Этапы онтогенеза и факторы его регуляции. Морфогенез и рост растения Сенсорные системы
Сенсорные системы Определение чувствительности микроорганизмов к антибиотикам
Определение чувствительности микроорганизмов к антибиотикам Витамины. Дефицит витамина
Витамины. Дефицит витамина ОСНОВЫ БИОТЕХНОЛОГИИ ТРАНСГЕНЕЗ. РАСТЕНИЯ Лекция 6
ОСНОВЫ БИОТЕХНОЛОГИИ ТРАНСГЕНЕЗ. РАСТЕНИЯ Лекция 6