Содержание
- 2. Уникальные биологические функции белков Каталитическая функция 6 классов ферментов, всего в клетке насчитывают около 10 000
- 3. Уникальные биологические функции белков 25.02.2013 Биологическая роль белков. Лекция Сократительная функция Актин и миозин – специфические
- 4. Ферменты – биологические катализаторы 25.02.2013 Биологическая роль белков. Лекция Общие свойства ферментов (Ф) и химических катализаторов
- 5. Ферменты – биологические катализаторы 25.02.2013 Биологическая роль белков. Лекция Отличительные признаки ферментативного и химического катализа: Скорость
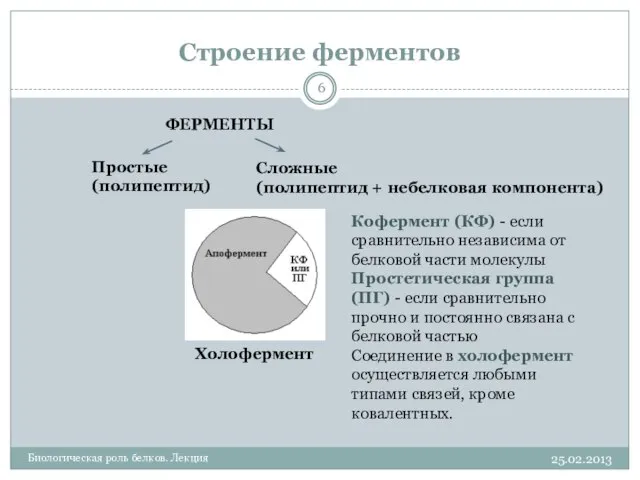
- 6. Строение ферментов 25.02.2013 Биологическая роль белков. Лекция ФЕРМЕНТЫ Простые (полипептид) Сложные (полипептид + небелковая компонента) Холофермент
- 7. ФУНКЦИИ КОФЕРМЕНТОВ (КФ) И ПРОСТЕТИЧЕСКИХ ГРУПП (ПГ) 25.02.2013 Биологическая роль белков. Лекция 1. Участие в акте
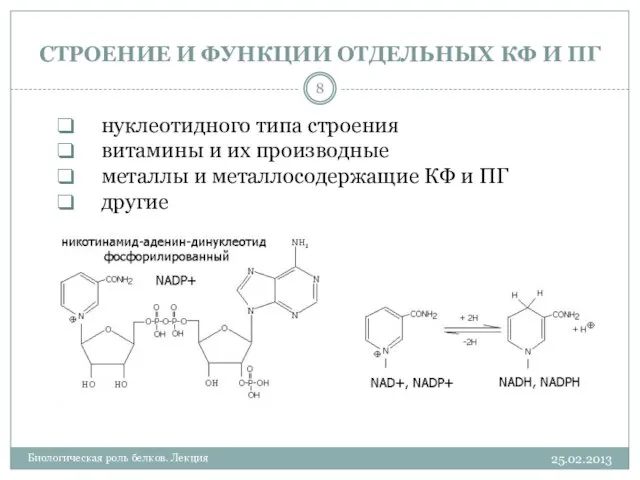
- 8. СТРОЕНИЕ И ФУНКЦИИ ОТДЕЛЬНЫХ КФ И ПГ 25.02.2013 Биологическая роль белков. Лекция нуклеотидного типа строения витамины
- 9. Классификация ферментов (КФ, EC) 25.02.2013 Биологическая роль белков. Лекция Четырех числовая система, первое число - класс
- 10. Внутри каждого класса происходит разделение на подклассы: Внутри каждого подкласса происходит разделение на подподклассы: 25.02.2013 Биологическая
- 11. Классификация ферментов (КФ, EC) 25.02.2013 Биологическая роль белков. Лекция Последнее число - номер конкретного фермента: EC
- 12. Номенклатура ферментов 25.02.2013 Биологическая роль белков. Лекция Ферменты имеют названия, которые разделяются на «рабочие» и систематические.
- 13. КЛАССЫ ФЕРМЕНТОВ (КФ, EC) 25.02.2013 Биологическая роль белков. Лекция 1. ОКСИДОРЕДУКТАЗЫ - катализируют реакции окисления-восстановления Лактатдегидрогеназа
- 14. КЛАССЫ ФЕРМЕНТОВ (КФ, EC) 25.02.2013 Биологическая роль белков. Лекция 4. ЛИАЗЫ (альдолазы, гидратазы-дегидратазы, синтазы, декарбоксилазы) –
- 15. КЛАССЫ ФЕРМЕНТОВ (КФ, EC) 25.02.2013 Биологическая роль белков. Лекция 6. ЛИГАЗЫ (синтетазы) - соединяют 2 части
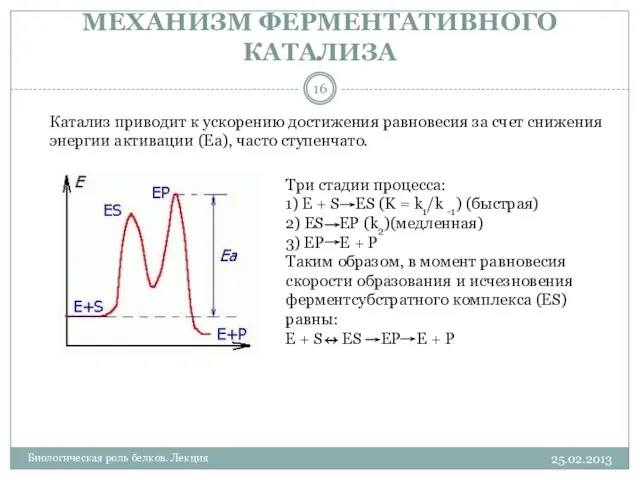
- 16. МЕХАНИЗМ ФЕРМЕНТАТИВНОГО КАТАЛИЗА 25.02.2013 Биологическая роль белков. Лекция Три стадии процесса: 1) E + S ES
- 17. ВЛИЯНИЕ НА НАЧАЛЬНУЮ СКОРОСТЬ РЕАКЦИИ КОНЦЕНТРАЦИЙ ФЕРМЕНТА [E] и СУБСТРАТА [S] 25.02.2013 Биологическая роль белков. Лекция
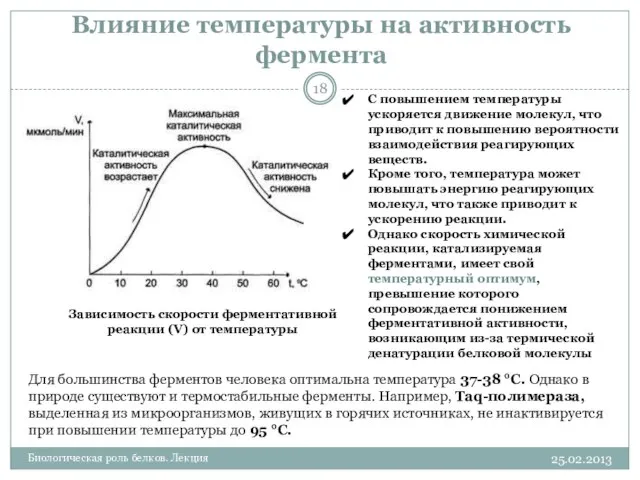
- 18. 25.02.2013 Биологическая роль белков. Лекция Влияние температуры на активность фермента Зависимость скорости ферментативной реакции (V) от
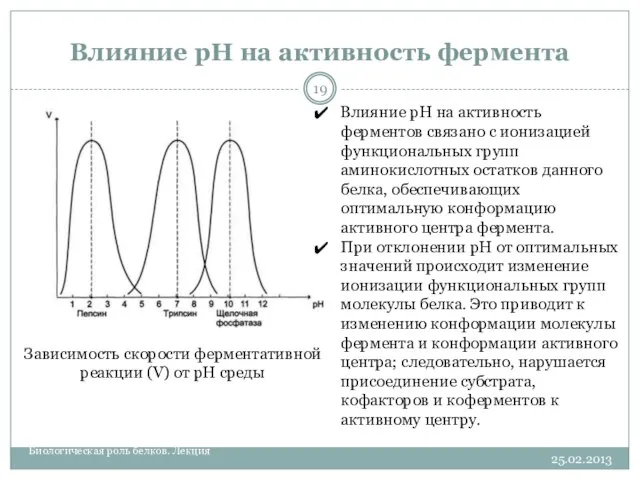
- 19. Влияние рН на активность фермента 25.02.2013 Биологическая роль белков. Лекция Зависимость скорости ферментативной реакции (V) от
- 20. 25.02.2013 Биологическая роль белков. Лекция
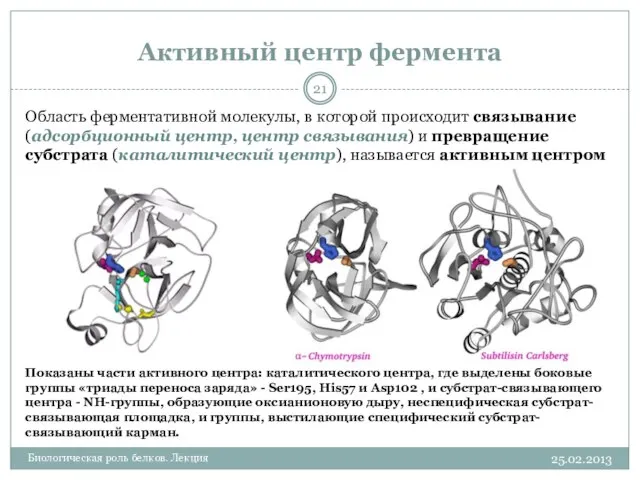
- 21. Активный центр фермента 25.02.2013 Биологическая роль белков. Лекция Область ферментативной молекулы, в которой происходит связывание (адсорбционный
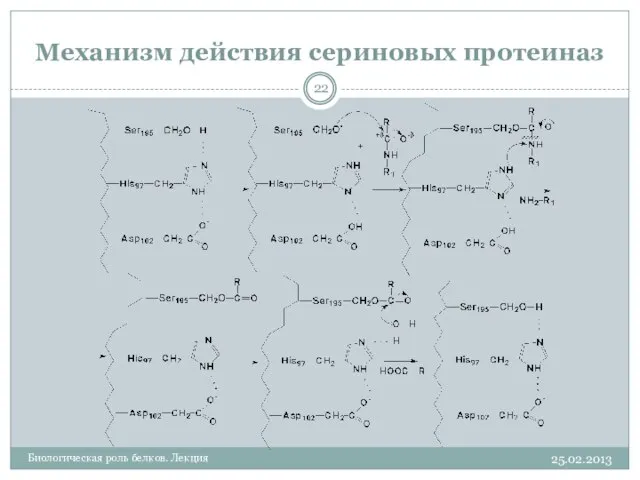
- 22. Механизм действия сериновых протеиназ 25.02.2013 Биологическая роль белков. Лекция
- 23. Специфичность ферментов 25.02.2013 Биологическая роль белков. Лекция Действие большинства ферментов высоко специфично Специфичность: - реакционная специфичность
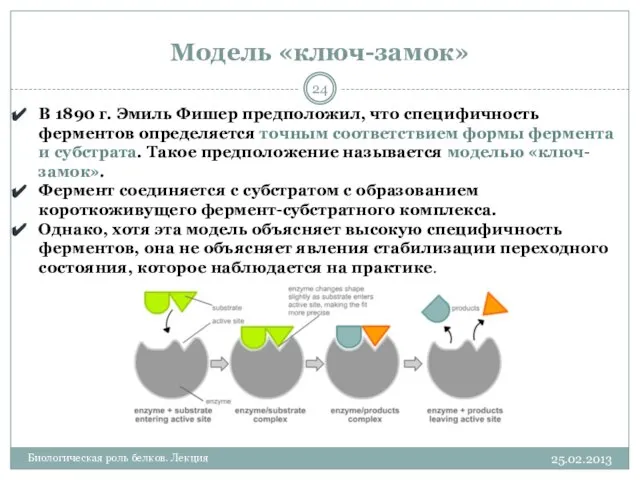
- 24. Модель «ключ-замок» 25.02.2013 Биологическая роль белков. Лекция В 1890 г. Эмиль Фишер предположил, что специфичность ферментов
- 25. Модель индуцированного соответствия 25.02.2013 Биологическая роль белков. Лекция В 1958 г. Дениел Кошланд предложил модификацию модели
- 26. Коллаген - главный опорный белок 25.02.2013 Биологическая роль белков. Лекция Коллагены — наиболее распространенные фибриллярные белки
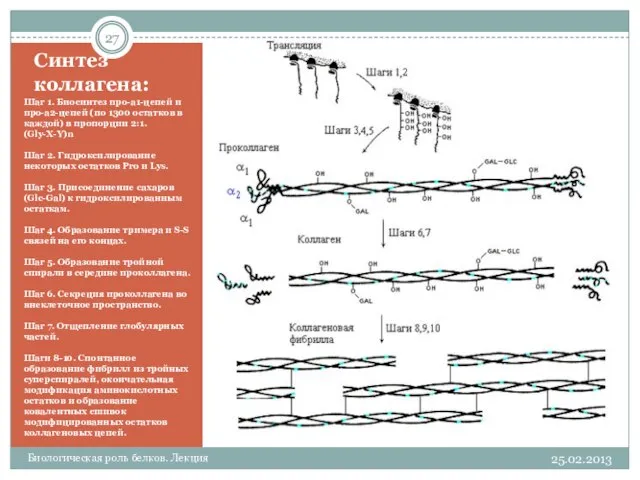
- 27. Синтез коллагена: Шаг 1. Биосинтез про-a1-цепей и про-a2-цепей (по 1300 остатков в каждой) в пропорции 2:1.
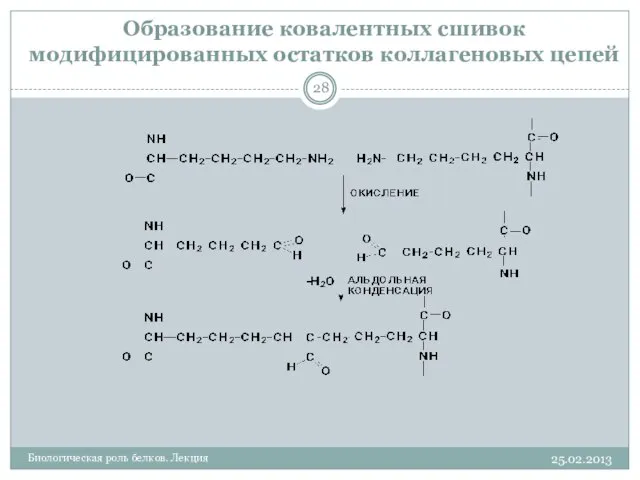
- 28. Образование ковалентных сшивок модифицированных остатков коллагеновых цепей 25.02.2013 Биологическая роль белков. Лекция
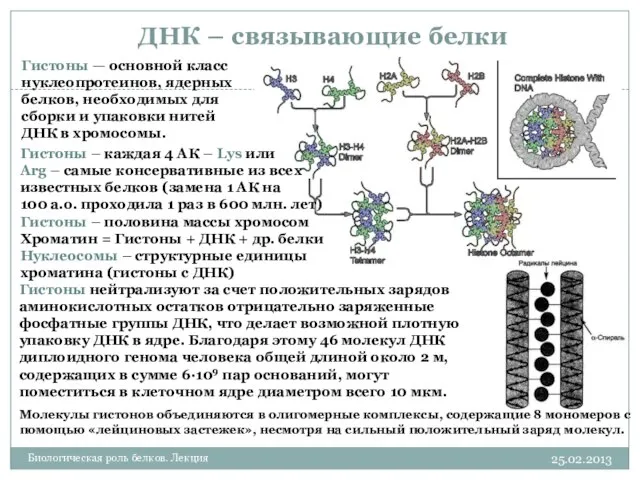
- 29. ДНК – связывающие белки 25.02.2013 Биологическая роль белков. Лекция Гистоны – каждая 4 АК – Lys
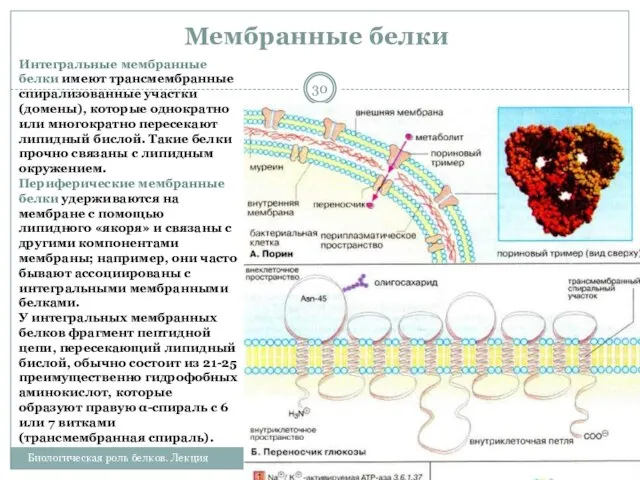
- 30. Мембранные белки 25.02.2013 Биологическая роль белков. Лекция Интегральные мембранные белки имеют трансмембранные спирализованные участки (домены), которые
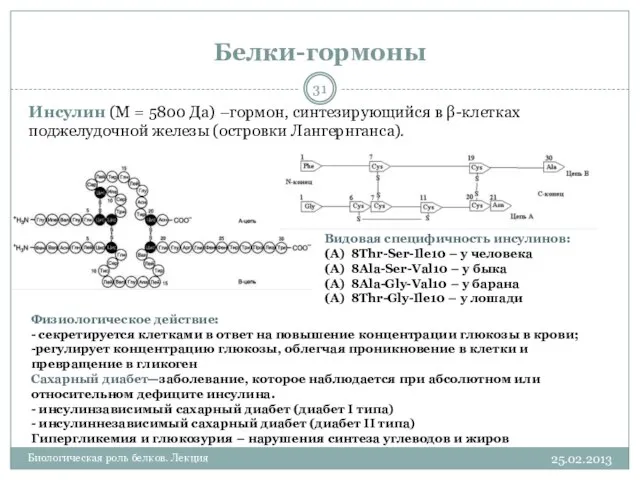
- 31. Белки-гормоны 25.02.2013 Биологическая роль белков. Лекция Инсулин (М = 5800 Да) –гормон, синтезирующийся в β-клетках поджелудочной
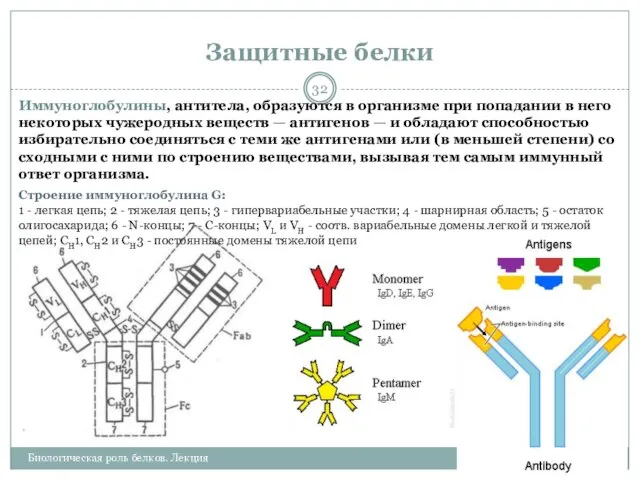
- 32. Защитные белки 25.02.2013 Биологическая роль белков. Лекция Иммуноглобулины, антитела, образуются в организме при попадании в него
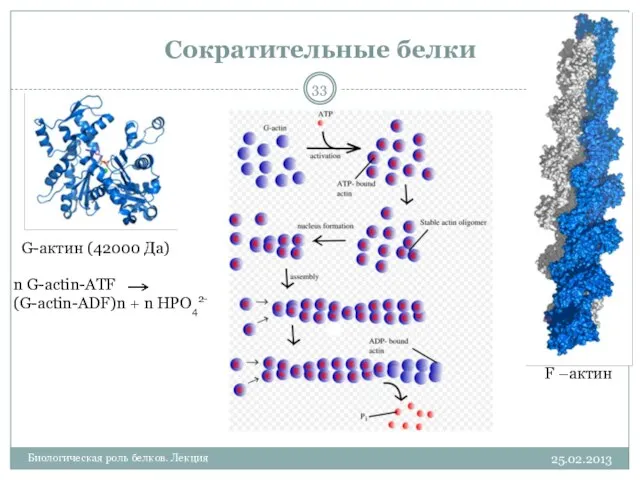
- 33. Сократительные белки 25.02.2013 Биологическая роль белков. Лекция G-актин (42000 Да) F –актин n G-actin-ATF (G-actin-ADF)n +
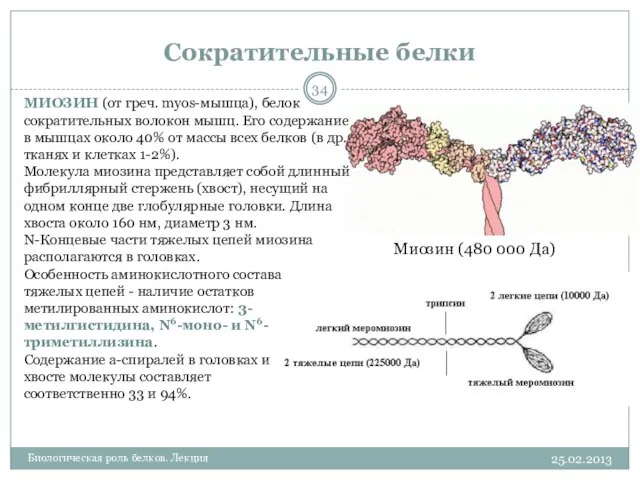
- 34. Сократительные белки 25.02.2013 Биологическая роль белков. Лекция Миозин (480 000 Да) МИОЗИН (от греч. myos-мышца), белок
- 36. Скачать презентацию












![ВЛИЯНИЕ НА НАЧАЛЬНУЮ СКОРОСТЬ РЕАКЦИИ КОНЦЕНТРАЦИЙ ФЕРМЕНТА [E] и СУБСТРАТА [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/513746/slide-16.jpg)




 Задачи: Задачи: расширить и углубить знания об оплодотворении у цветковых растений; об оплодотворении вообще и его значении. Об
Задачи: Задачи: расширить и углубить знания об оплодотворении у цветковых растений; об оплодотворении вообще и его значении. Об Презентация на тему Современные представления о возникновении жизни
Презентация на тему Современные представления о возникновении жизни  Тема уроку: Вітаміни. Задачі: сформулювати загальне уявлення про вітаміни, дати поняття про авітаміноз, гіпо- та гіперв
Тема уроку: Вітаміни. Задачі: сформулювати загальне уявлення про вітаміни, дати поняття про авітаміноз, гіпо- та гіперв Человек прошлого и человек будущего
Человек прошлого и человек будущего Презентация на тему "Строение кожи" - скачать презентации по Биологии
Презентация на тему "Строение кожи" - скачать презентации по Биологии Химическая организация клетки. Лекция 2
Химическая организация клетки. Лекция 2 Корисні Бактерії (6 клас)
Корисні Бактерії (6 клас) Презентация на тему "Взаимодействие неаллельных генов" - скачать презентации по Биологии
Презентация на тему "Взаимодействие неаллельных генов" - скачать презентации по Биологии Двудольные растения
Двудольные растения Женская выделительная система
Женская выделительная система ТЕМА ПРОЕКТА: «Ранняя половая связь- это половой инстинкт или распущенность?»
ТЕМА ПРОЕКТА: «Ранняя половая связь- это половой инстинкт или распущенность?»  Нервная ткань
Нервная ткань Гранат - король всех плодов (окружающий мир, 2 класс)
Гранат - король всех плодов (окружающий мир, 2 класс) Презентация на тему "Класс Млекопитающие или звери" - скачать презентации по Биологии
Презентация на тему "Класс Млекопитающие или звери" - скачать презентации по Биологии Презентация на тему ЖИВОТНЫЕ ЖАРКИХ СТРАН
Презентация на тему ЖИВОТНЫЕ ЖАРКИХ СТРАН Презентация на тему Парниковый эффект
Презентация на тему Парниковый эффект Развитие жизни на Земле. Эволюция человека
Развитие жизни на Земле. Эволюция человека Самые красивые попугаи Попугаи, пожалуй, самые распространенные домашние пернатые. Они привлекают ярким красивым оперением, с
Самые красивые попугаи Попугаи, пожалуй, самые распространенные домашние пернатые. Они привлекают ярким красивым оперением, с Деление клетки. Митоз. Подготовила учитель химии и биологии Родионова Н.Г. МОБУ «Лобасковская ООШ»
Деление клетки. Митоз. Подготовила учитель химии и биологии Родионова Н.Г. МОБУ «Лобасковская ООШ»  Весна в природе. Наблюдение
Весна в природе. Наблюдение Презентация Обмен веществ – основа жизни
Презентация Обмен веществ – основа жизни Брюхоногие моллюски. Виноградная улитка
Брюхоногие моллюски. Виноградная улитка Наблюдение клеток растений и животных под микроскопом на готовых микропрепаратах, их описание. Практическое занятие № 1
Наблюдение клеток растений и животных под микроскопом на готовых микропрепаратах, их описание. Практическое занятие № 1 Природа человека Обществознание, 10 класс Бриченко Л.В., ГБОУ СОШ №262 Санкт-Петербурга
Природа человека Обществознание, 10 класс Бриченко Л.В., ГБОУ СОШ №262 Санкт-Петербурга Насекомые (Дыбка степная)
Насекомые (Дыбка степная) Биосфера в вендского периода
Биосфера в вендского периода Высшие споровые растения
Высшие споровые растения Презентация на тему Многообразие птиц
Презентация на тему Многообразие птиц