Содержание
- 2. pH крови
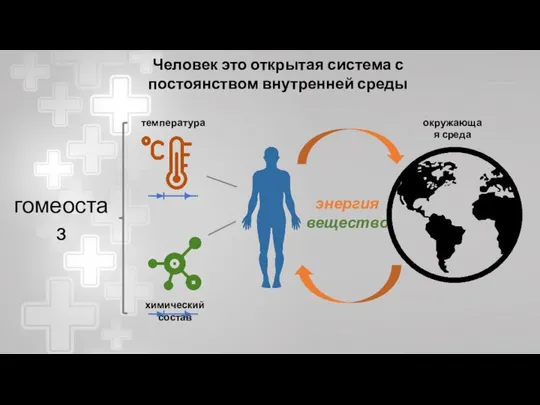
- 3. Человек это открытая система с постоянством внутренней среды гомеостаз
- 5. Показатели КОС Абсолютные Относительный pH
- 6. Показатель кислотности pH
- 8. pH введён датским физиком-химиком Сёренсеном в 1909 году Søren Peter Lauritz Sørensen
- 9. Potencia Hydrogenii (лат.) – сила водорода или Pondus Hydrogenii – вес водорода Показатель кислотности pH
- 11. Согласно теории Брёнстеда-Лоури (1923 год) Кислота это молекула или ион - донор протонов (или ядер водорода,
- 12. Кислота донор протонов Основание акцептор протонов
- 14. Рассмотрим … воду
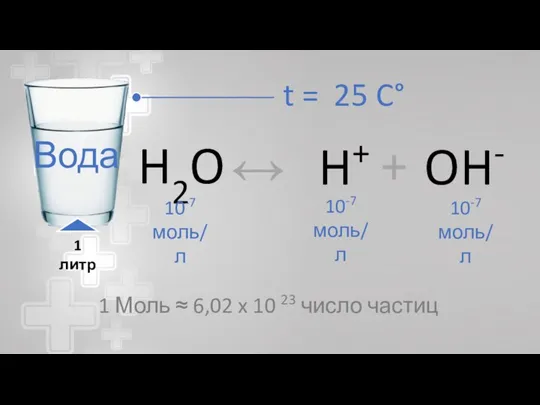
- 15. Вода
- 16. t = 25 C° Вода 1 литр 1 Моль ≈ 6,02 x 10 23 число частиц
- 17. Вода H3O+; H5O2+ …
- 18. t = 25 C° Вода 1 литр
- 19. Подходим к определению pH pH = - Lg [H+] Введён для удобства счёта в оценке кислотности
- 20. Подходим к определению pH pH = - Lg (10-7) = - (-7) Lg 10 = 7
- 21. Определение pH pH – это отрицательный десятичный логарифм концентрации ионов водорода в растворе pH = -
- 23. pH = 7 t = 25 C° [H+] = 10-7 pOH = 7 [OH-] = 10-7
- 24. p[H+] = 7 t = 25 C° [H+] = 10-7 p[OH-] = 7 [OH-] = 10-7
- 25. Нейтральный и физиологичный pH в человеческом организме Центральная температура – температура центральной нервной системы, внутренних органов
- 26. Нарушения физиологичного pH pH pH > 7,45 - алкалоз лат. acidus кислый позднелат. alcali щелочь
- 27. Буферные системы крови
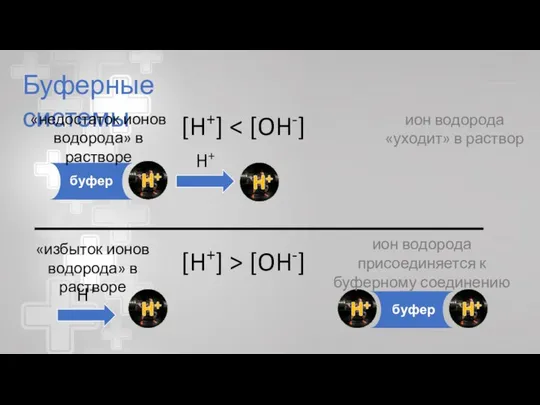
- 28. Буферные системы «Буфер» от английского «to buff» смягчать толчки. В химии «буферная система» - раствор, сохраняющий
- 29. Буферные системы «недостаток ионов водорода» в растворе «избыток ионов водорода» в растворе H+ буфер ион водорода
- 30. Закрепим стихом PH есть водородный показатель, Что в Дании В далёком 1909 Сёренсен химик изобрел Он
- 31. https://vk.com/biomedtechnology Биологические исследования в медицине Молекулярная биология и биохимия Медицинские технологии ВК-сообщество Биология и биомедицина
- 32. Учебный фильм Medfors Урок 1 - рН - КЩС под силу каждому https://www.youtube.com/watch?v=LK0NCfOR_NM Введение в буферные
- 34. Скачать презентацию















![Подходим к определению pH pH = - Lg [H+] Введён для удобства счёта в оценке кислотности](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/714005/slide-18.jpg)



![pH = 7 t = 25 C° [H+] = 10-7 pOH](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/714005/slide-22.jpg)
![p[H+] = 7 t = 25 C° [H+] = 10-7 p[OH-]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/714005/slide-23.jpg)







 Презентация на тему Ферменты
Презентация на тему Ферменты  Презентация на тему "Вкусовые предпочтения и болезни" - скачать бесплатно презентации по Биологии
Презентация на тему "Вкусовые предпочтения и болезни" - скачать бесплатно презентации по Биологии Архей и протерозой. Возникновение жизни на Земле
Архей и протерозой. Возникновение жизни на Земле Пряные растения
Пряные растения Здоровье ногтей. Средства для ногтей
Здоровье ногтей. Средства для ногтей Гипотеза возникновения жизни на Земле
Гипотеза возникновения жизни на Земле Царство Животные
Царство Животные Водка с молокам
Водка с молокам Распространение плодов и семян
Распространение плодов и семян Слезы. Вред или польза для человека?
Слезы. Вред или польза для человека? Хищники
Хищники Презентация на тему Распространенные заболевания человека
Презентация на тему Распространенные заболевания человека Биоэтика: возникновение, структура, принципы
Биоэтика: возникновение, структура, принципы Возникновение жизни или абиогенез
Возникновение жизни или абиогенез Клеточный инструментарий для репарации ДНК
Клеточный инструментарий для репарации ДНК Видовое разнообразие птиц, обитающих в природном парке Сходненский ковш
Видовое разнообразие птиц, обитающих в природном парке Сходненский ковш Тип Кишечнополостные Гидра
Тип Кишечнополостные Гидра  О пользе питьевой воды
О пользе питьевой воды Эмбриональное развитие ланцетника (Branchiostoma)
Эмбриональное развитие ланцетника (Branchiostoma) Теплорегуляция Интегрированный урок (физики и биологии)
Теплорегуляция Интегрированный урок (физики и биологии) Многообразие одноклеточных организмов
Многообразие одноклеточных организмов Пневмония или Воспаление легких
Пневмония или Воспаление легких Презентация на тему «Женские» и «мужские» города России
Презентация на тему «Женские» и «мужские» города России  Клапанный аппарат сердца и его работа
Клапанный аппарат сердца и его работа Производственные процессы и определение состава МТП в ООО Агрофирма Савали с разработкой технологии культиваций почвы
Производственные процессы и определение состава МТП в ООО Агрофирма Савали с разработкой технологии культиваций почвы Леса Беларуси
Леса Беларуси Скелетные ткани. Костная ткань
Скелетные ткани. Костная ткань Формирование парков на нарушенных территориях. Геопластика
Формирование парков на нарушенных территориях. Геопластика