Содержание
- 2. М'язи Складають 40-45% від маси тіла М'язи: посмуговані (скелетні та серцевий) і гладенькі Перетворюють хімічну енергію
- 3. Функції м'язової тканини Рухова Опорна Захисна Теплообмінна Рух крові та лімфи Дихальні рухи Комунікаційна Гладенькі м'язи
- 4. Властивості м'язової тканини Збудливість – сприймають та відповідають на стимул генерацією потенціалу дії Скоротливість – здатність
- 5. Типи м'язових волокон 1 — посмуговані; 2 — гладенькі; 3 — серцеві
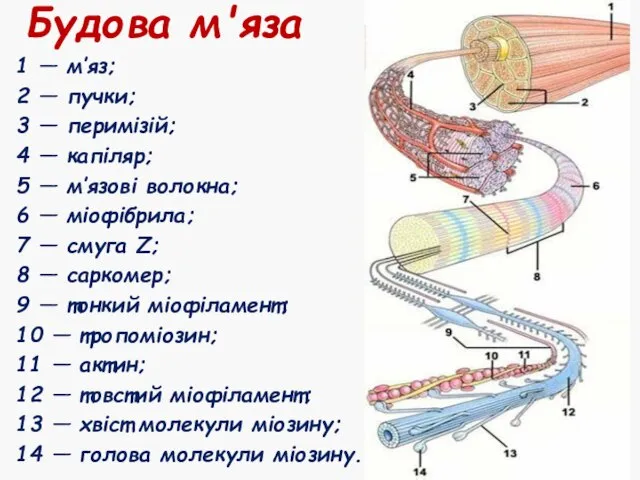
- 6. Будова м'яза 1 — м’яз; 2 — пучки; 3 — перимізій; 4 — капіляр; 5 —
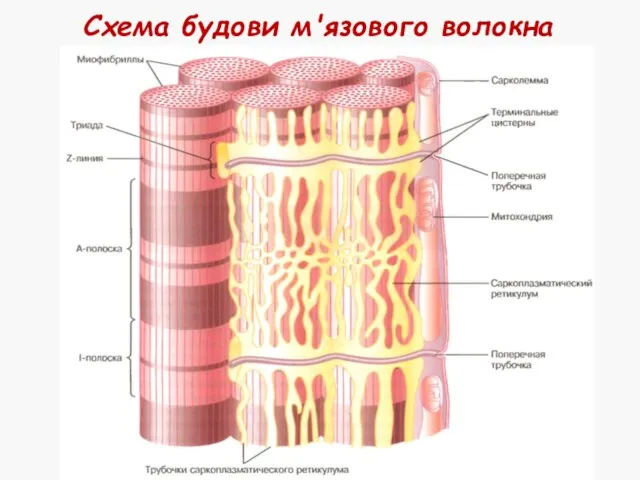
- 7. Схема будови м'язового волокна
- 8. Сарколема Клітинна мембрана м'язових волокон Сполучена з мотонейронами Проводить сигнали для скорочення Саркоплазма Цитоплазма м'язів, містить:
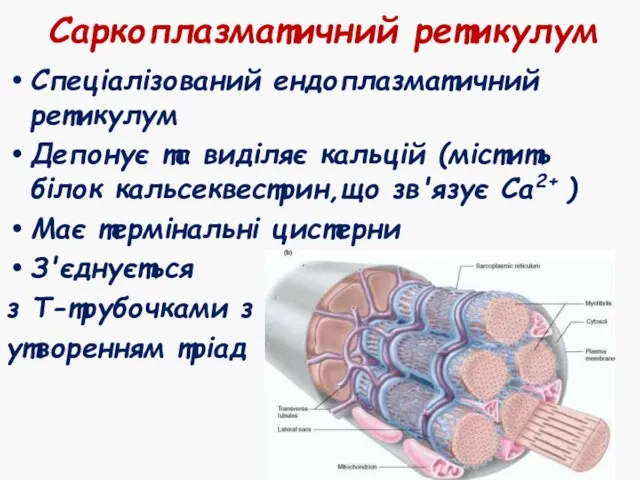
- 9. Саркоплазматичний ретикулум Спеціалізований ендоплазматичний ретикулум Депонує та виділяє кальцій (містить білок кальсеквестрин,що зв'язує Са2+ ) Має
- 10. Поперечні трубочки Інвагінації сарколеми всередину клітини Сполучають усі міофібрили Проводять потенціал дії в клітину Координують м'язове
- 11. Хімічний склад посмугованих м’язів
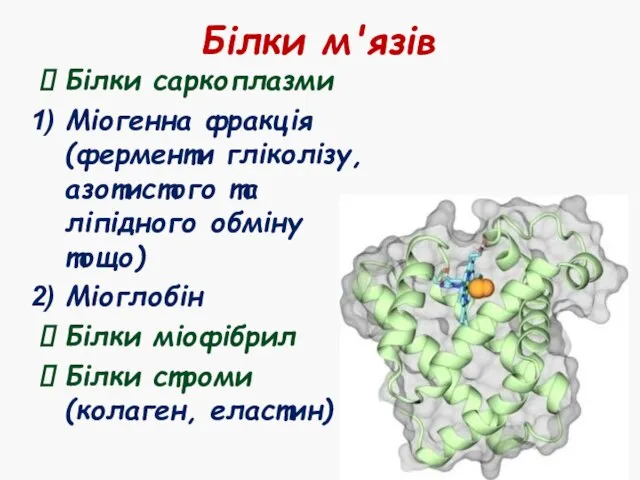
- 12. Білки м'язів Білки саркоплазми Міогенна фракція (ферменти гліколізу, азотистого та ліпідного обміну тощо) Міоглобін Білки міофібрил
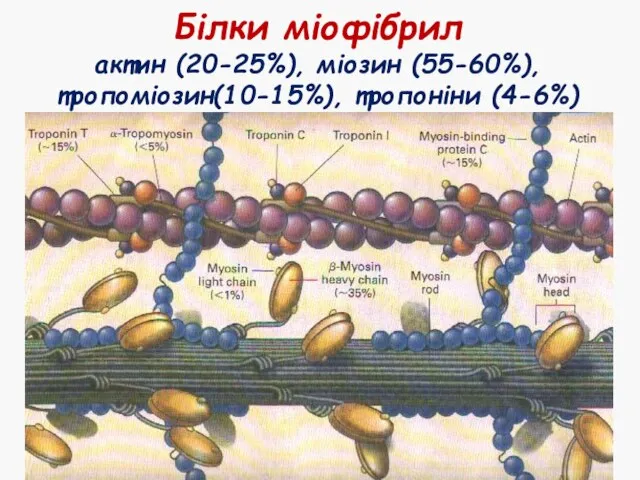
- 13. Білки міофібрил актин (20-25%), міозин (55-60%), тропоміозин(10-15%), тропоніни (4-6%)
- 14. Інші структурні білки м'язів Тітин (коннектин) – з'єднує M-лінію та Z-лінію, тримає міозин в центрі саркомеру,
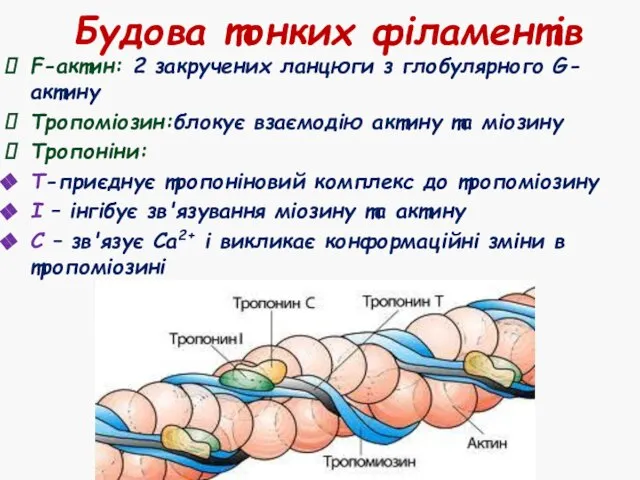
- 15. Будова тонких філаментів F-актин: 2 закручених ланцюги з глобулярного G-актину Тропоміозин:блокує взаємодію актину та міозину Тропоніни:
- 16. Будова товстих філаментів Побудовані з білка міозину, молекула якого складається з хвоста та 2 голівок Хвіст:
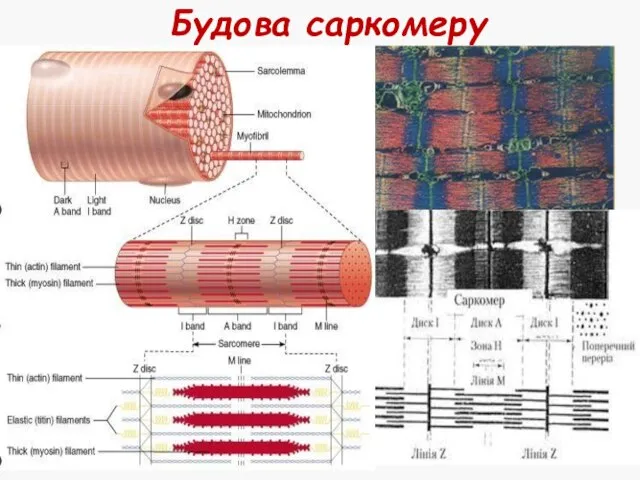
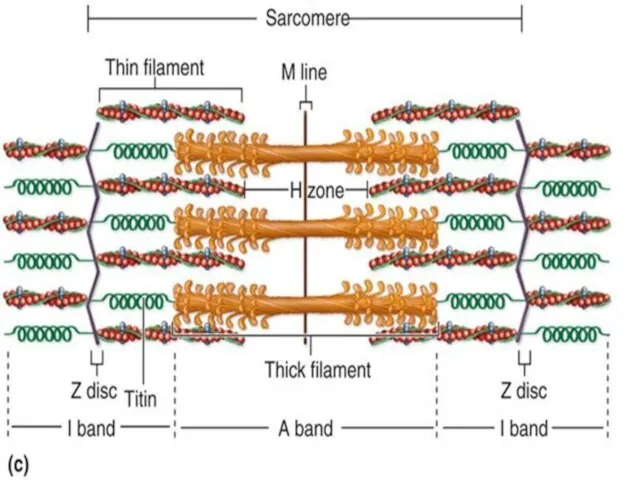
- 17. Саркомер Найменша скорочувальна (функціональна) одиниця м'язового волокна Сегмент міофібрили між двома Z-лініями Містить тонкі та товсті
- 18. Будова саркомеру
- 20. Положення теорії Гакслі-Генсона Скорочення міофібрил відбувається внаслідок скорочення великої кількості саркомерів Під час скорочення довжина тонких
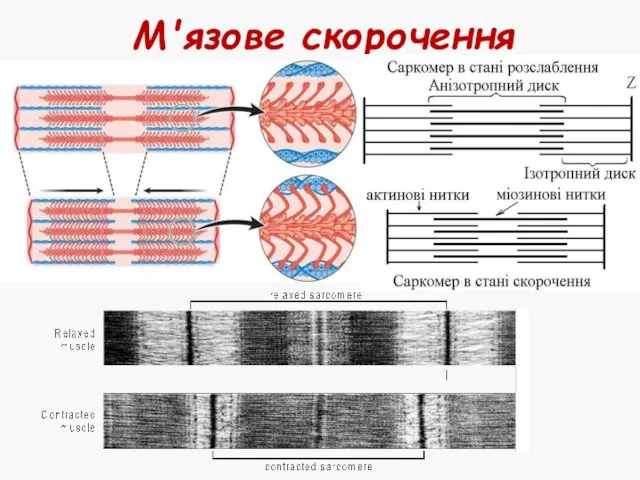
- 21. М'язове скорочення
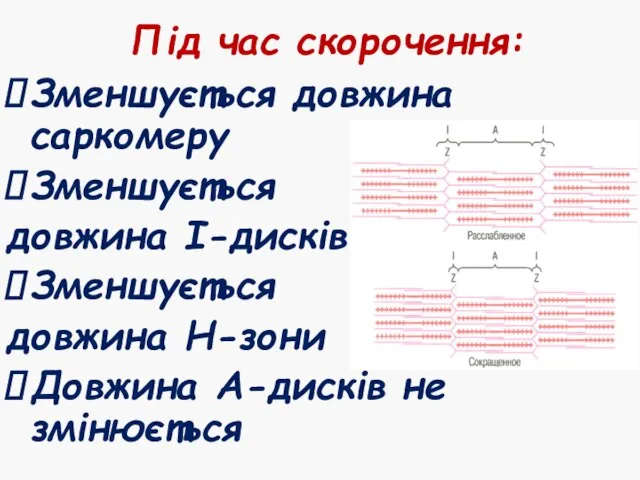
- 22. Під час скорочення: Зменшується довжина саркомеру Зменшується довжина І-дисків Зменшується довжина Н-зони Довжина А-дисків не змінюється
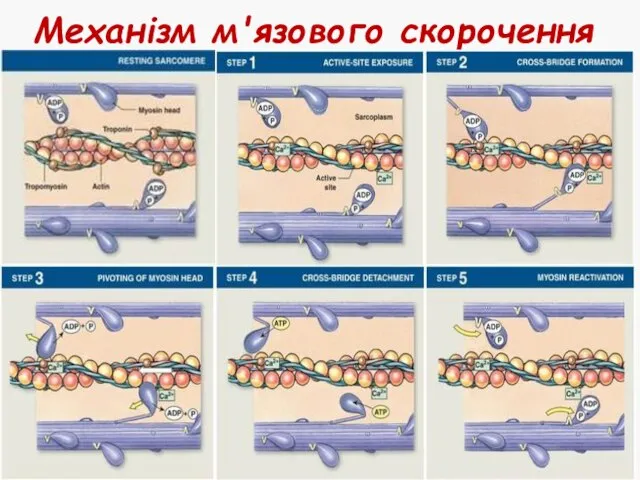
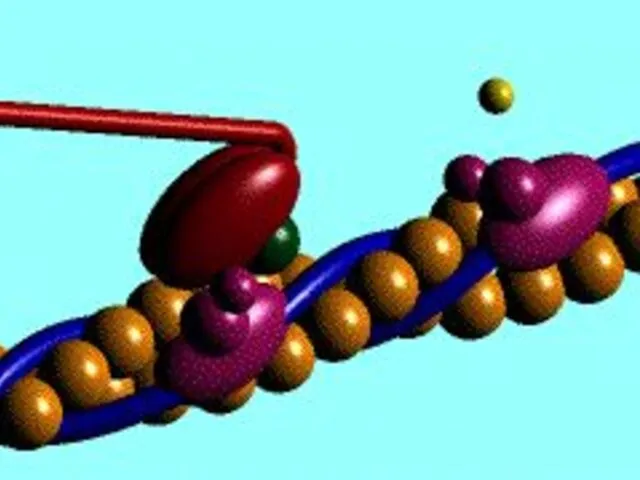
- 23. Механізм м'язового скорочення Генерація потенціалу дії у м'язовому волокні Поширення потенціалу дії по сарколемі та всередину
- 24. Механізм м'язового скорочення
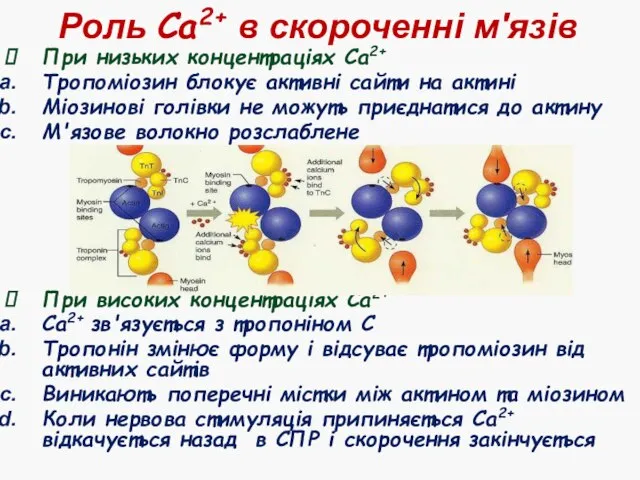
- 26. Роль Са2+ в скороченні м'язів При низьких концентраціях Са2+ Тропоміозин блокує активні сайти на актині Міозинові
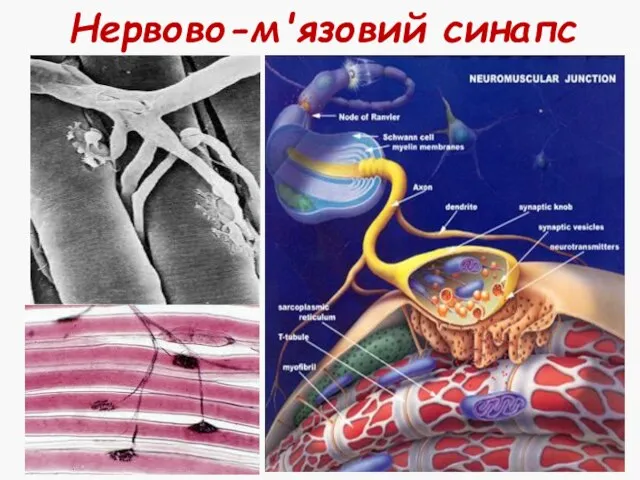
- 27. Нервово-м'язовий синапс
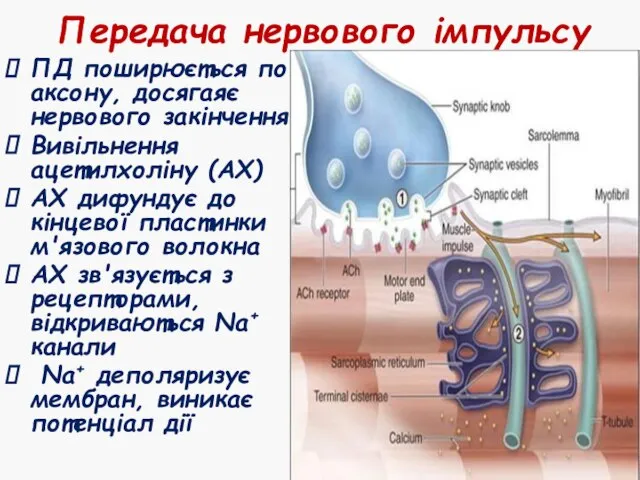
- 28. Передача нервового імпульсу ПД поширюється по аксону, досягаяє нервового закінчення Вивільнення ацетилхоліну (АХ) АХ дифундує до
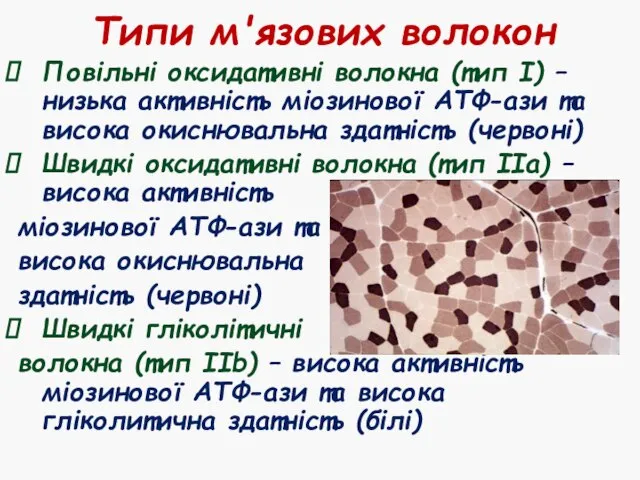
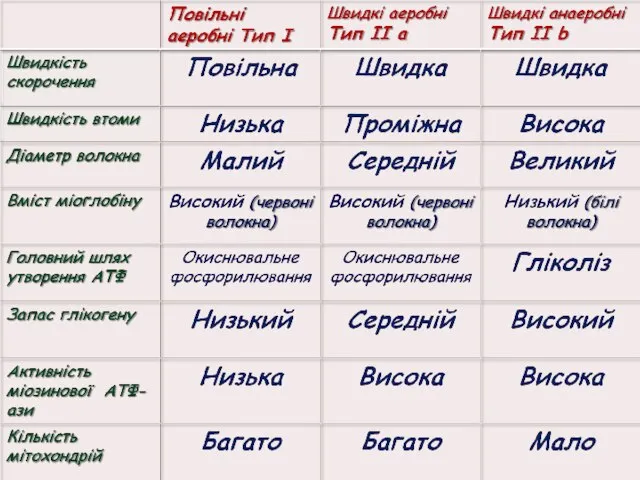
- 29. Типи м'язових волокон Повільні оксидативні волокна (тип І) – низька активність міозинової АТФ-ази та висока окиснювальна
- 31. Біоенергетика м'язової тканини М'язи потребують енергії АТФ Запасів АТФ вистачає на 2-4 секунди роботи М'язи перетворюють
- 32. Джерела енергії у м'язах Креатинфосфат Глікогеноліз Анаеробний гліколіз Окиснювальне фосфорилювання Окиснення жирних кислот
- 33. Анаеробний гліколіз Використовується глюкоза крові та глікогену Не потребує кисню Продукти: лактат та 2 АТФ Запас
- 34. М'язова втома - фізіологічна нездатність м'яза скорочуватись Нестача АТФ призводить до контрактур (не руйнуються поперечні містки
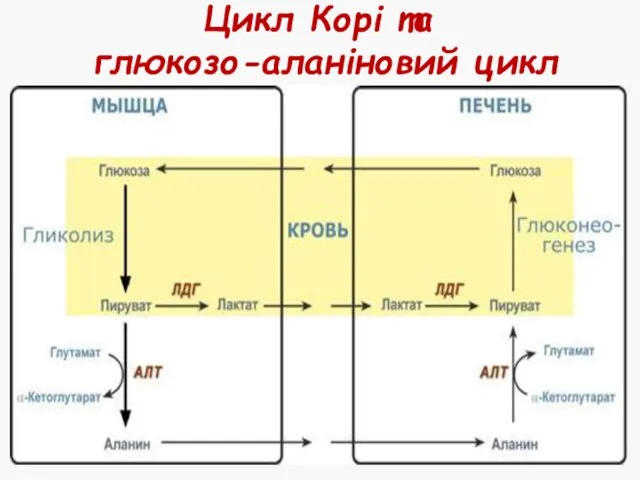
- 35. Цикл Корі та глюкозо-аланіновий цикл
- 36. Роль креатинфосфату Креатинфосфат – “депо” макроергічних зв'язків, забезпечує ресинтез АТФ в перші секунди роботи (5-10 сек),
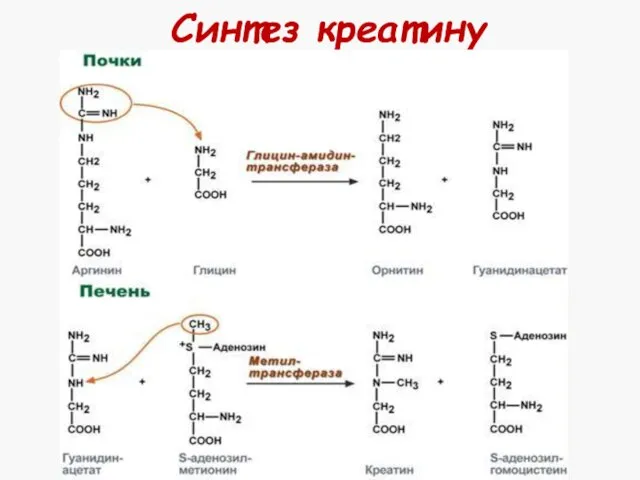
- 37. Синтез креатину
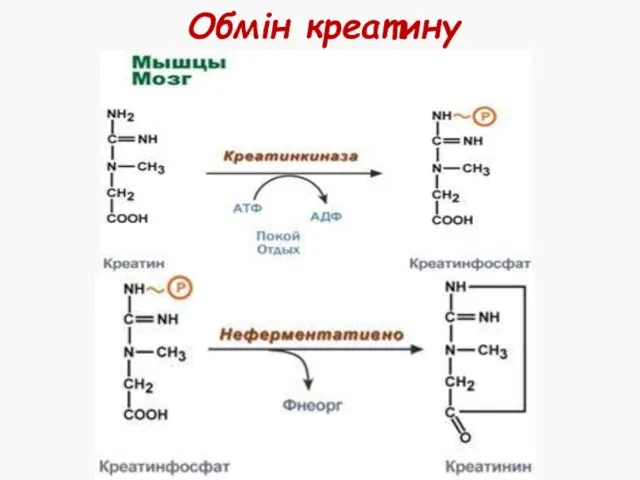
- 38. Обмін креатину
- 39. Креатинфосфокіназа N у жінок до 145 Од/л, у чоловіків – до 190 Од/л КФК (КФ 2.7.3.2.)
- 40. Міопатії - група спадкових та набутих захворювань, що характеризуються руйнуванням м'язової тканини та атрофією м'язових волокон
- 41. Міопатії Спадкові Прогресуючі м'язові дистрофії (Дюшена, Ландузі-Дежерина) Непрогресуючі м'язові (структурні) міопатії Мітохондріальні Міопатії при спадкових порушеннях
- 42. Клінічні ознаки міопатій М'язова слабкість Швидка втомлюваність Атрофія м'язів та псевдогіпертрофія окремих м'язів (наприклад, литкових) Знижені
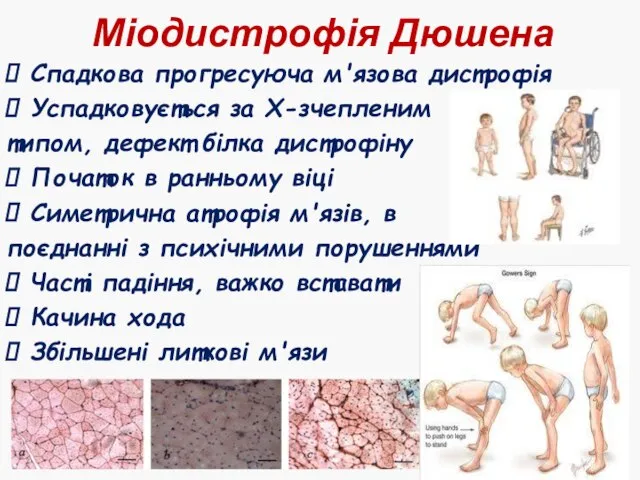
- 43. Міодистрофія Дюшена Спадкова прогресуюча м'язова дистрофія Успадковується за Х-зчепленим типом, дефект білка дистрофіну Початок в ранньому
- 44. Біохімічна діагностика міопатій Визначення КФК у крові Міоглобін у крові Екскреція креатину та креатиніну з сечею
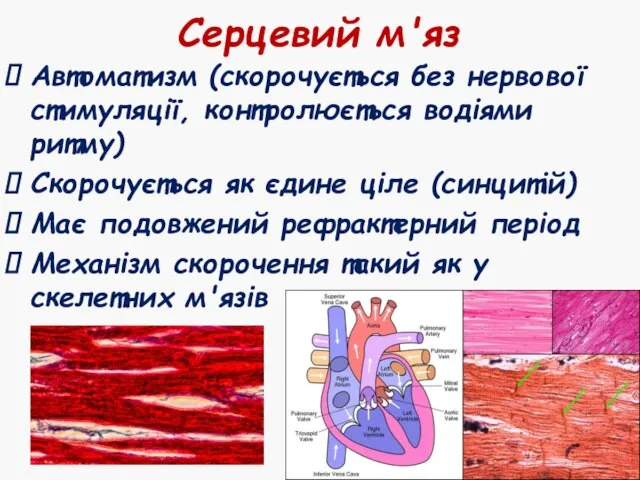
- 45. Серцевий м'яз Автоматизм (скорочується без нервової стимуляції, контролюється водіями ритму) Скорочується як єдине ціле (синцитій) Має
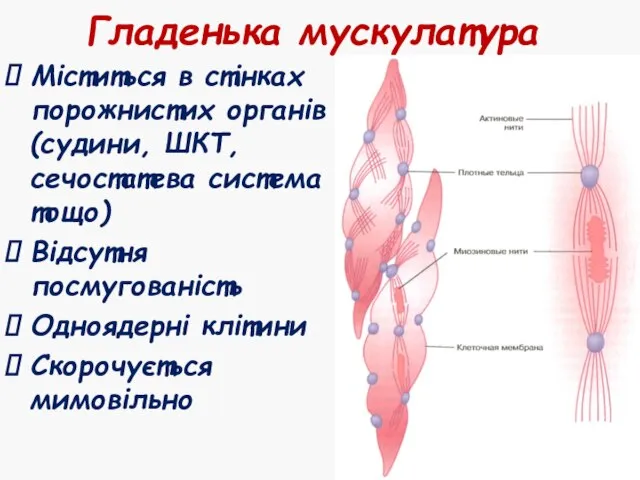
- 46. Гладенька мускулатура Міститься в стінках порожнистих органів (судини, ШКТ, сечостатева система тощо) Відсутня посмугованість Одноядерні клітини
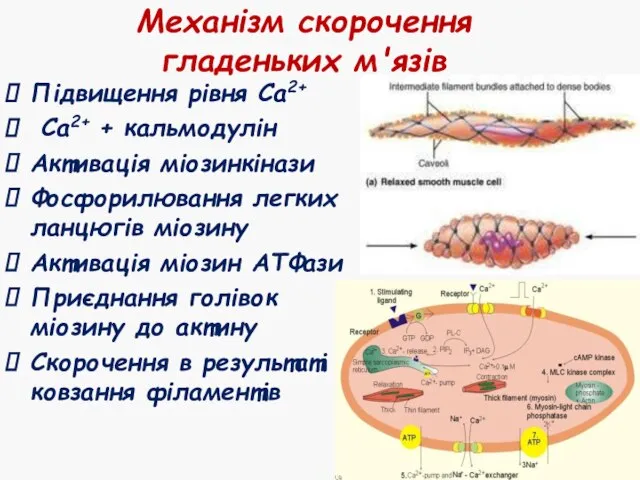
- 47. Механізм скорочення гладеньких м'язів Підвищення рівня Са2+ Са2+ + кальмодулін Активація міозинкінази Фосфорилювання легких ланцюгів міозину
- 49. Скачать презентацию






















 Животная и растительная клетки
Животная и растительная клетки Органойды клетки
Органойды клетки Растения-переселенцы
Растения-переселенцы Анатомо-физиологические аспекты высшей нервной деятельности
Анатомо-физиологические аспекты высшей нервной деятельности Защитные структуры ЦНС
Защитные структуры ЦНС ДНК Підготував: Учень 11-А класу Долинка Ігор
ДНК Підготував: Учень 11-А класу Долинка Ігор  Презентация на тему Папоротники
Презентация на тему Папоротники  Ми бөліктері
Ми бөліктері Как животные передвигаются Выполнила: Собенина Н.А. учитель начальных классов МКОУ СОШ № 19 ГО Верхняя Тура
Как животные передвигаются Выполнила: Собенина Н.А. учитель начальных классов МКОУ СОШ № 19 ГО Верхняя Тура Презентация на тему "Исчезающие и редкие растения Даниловского края" - скачать презентации по Биологии
Презентация на тему "Исчезающие и редкие растения Даниловского края" - скачать презентации по Биологии Прокариотические микроорганизмы
Прокариотические микроорганизмы волосатики Выполнила: Попова Анастасия
волосатики Выполнила: Попова Анастасия Органоиды. Виды органоидов
Органоиды. Виды органоидов Ятрышник шлемоносный
Ятрышник шлемоносный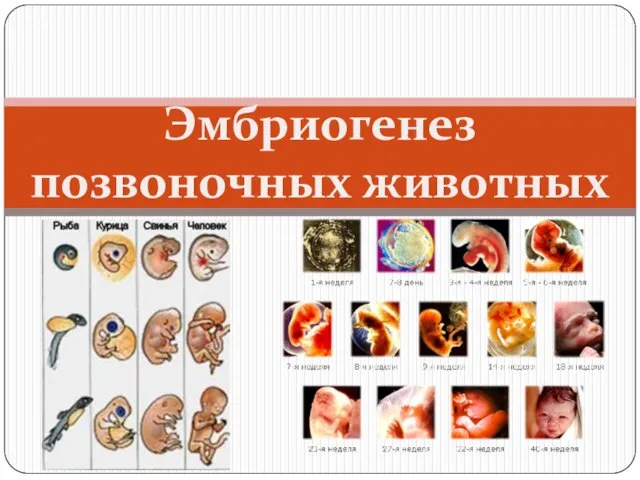 Эмбриогенез позвоночных животных
Эмбриогенез позвоночных животных Топографическая анатомия области груди. Границы, внешние ориентиры
Топографическая анатомия области груди. Границы, внешние ориентиры Класс Пресмыкающиеся. Отряд Чешуйчатые
Класс Пресмыкающиеся. Отряд Чешуйчатые Презентация на тему Человек – часть живой природы
Презентация на тему Человек – часть живой природы Презентация на тему "Ткани животных и человека" - скачать презентации по Биологии
Презентация на тему "Ткани животных и человека" - скачать презентации по Биологии Презентация на тему "АНТИ-СПИД." - скачать бесплатно презентации по Биологии
Презентация на тему "АНТИ-СПИД." - скачать бесплатно презентации по Биологии Презентация на тему "КЕМБРІЙСЬКИЙ ПЕРІОД" - скачать бесплатно презентации по Биологии
Презентация на тему "КЕМБРІЙСЬКИЙ ПЕРІОД" - скачать бесплатно презентации по Биологии Кинология − наука о собаках
Кинология − наука о собаках Скелет человека
Скелет человека Мої квіти
Мої квіти Субкультуры. История
Субкультуры. История Презентація на тему: «Укуси змій»
Презентація на тему: «Укуси змій»  Прорастание семян
Прорастание семян Функциональная анатомия. Введение. Описание поз и движений человека
Функциональная анатомия. Введение. Описание поз и движений человека