Содержание
- 2. Катализ Возможность протекания хим.реакций обусловлена разницей свободной энергии исх. веществ и продуктов. Самопроизвольное течение реакции возможно,
- 3. Ферменты = Энзимы Fermentum – закваска; enzyme – в дрожжах. Ферменты – катализаторы белковой природы. Катализ
- 4. Ферменты 1) простые белки 2) сложные белки (холоферменты) апофермент кофермент (протеин) (простетическая группа) 3) рибозимы
- 5. Молекулярная масса РИБОНУКЛЕАЗА ……………....………………..……………………..13700 ТРИПСИН ………………………………………………………………23800 ГЕКСОКИНАЗА ……………………...………………….……………..45000 АЛЬДОЛАЗА ………………………………………………...………..142000 УРЕАЗА ………………………………………………………………..480000 ПИРУВАТДЕГИДРОГЕНАЗА ………………………………...……4500000
- 6. Кофакторы и коферменты 1. Небелковые части нуклеотидного типа. 2. Нуклеотид три- и дифосфаты ( АТФ, ТТФ,
- 7. К коферментам относят следующие соединения: производные витаминов; гемы, входящие в состав цитохромов, ката- лазы, пероксидазы, гуанилатциклазы,
- 8. Аминокислоты, образующие каталитические центры Серин – ОН Треонин – ОН Тирозин – ОН Цистеин – SH
- 10. Роль металлов в присоединении субстрата в активном центре фермента. Ионы металла выполняют функцию стабилизаторов молекулы субстрата,
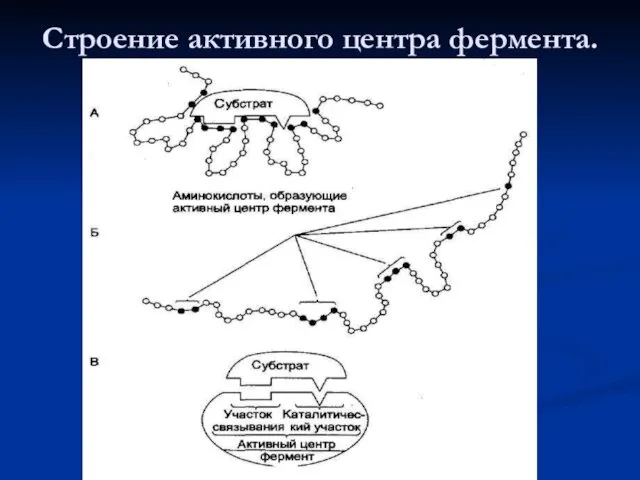
- 11. Организация ферментов 1. Активный центр Контактный участок Каталитический участок 2. Регуляторный (аллостерический) центр.
- 12. Функциональная значимость отдельных участков активного центра фермента
- 13. Строение активного центра фермента.
- 14. Сходство и отличия между биологическими и небиологическими катализаторами
- 15. Общие свойства ферментов 1. Очень высокая эффективность. 2. Очень высокая специфичность. 3. Регулируемость, это позволяет контролировать
- 16. АКТИВНОСТЬ ФЕРМЕНТОВ Активность ферментов определяют косвенно: по количеству образующегося продукта (Р), по количеству потребляемого субстрата (S).
- 17. Для оценки количества молекул фермента среди других белков данной ткани определяют удельную активность фермента, численно равную
- 18. Каталитическая эффективность. Большинство катализируемых ферментами реакций высокоэффективны, они протекают в 10—10¹ раз быстрее, чем не катализируемые
- 19. Специфичность. Специфичность — наиболее важное свойство ферментов, определяющее биологическую значимость этих молекул. Различают субстратную и каталитическую
- 20. Субстратная специфичность ферментов В основе лежит строгое соответствие размеров и структуры субстратов активному центру. 1. Абсолютная
- 21. Каталитическая специфичность Биологическая функция фермента, как и любого белка, обусловлена наличием в его структуре активного центра.
- 22. Полиферментные системы 1. Каждая клетка имеет специфичный состав ферментов. 2. Некоторые ферменты содержатся во всех клетках,
- 23. Ферментные ансамбли или мультиферменты – комплекс ферментов, катализирующих последовательные реакции при превращении одного вещества.
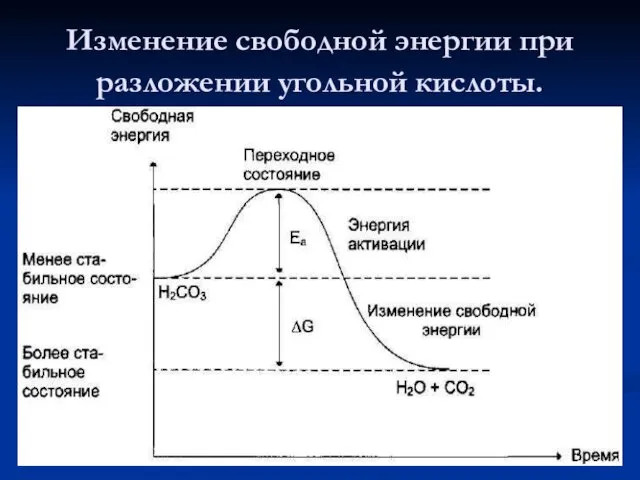
- 24. Энергетические изменения ПРИ ХИМИЧЕСКИХ РЕАКЦИЯХ. Любые химические реакции протекают, подчиняясь двум основным законам термодинамики: закону сохранения
- 25. Изменение свободной энергии при разложении угольной кислоты.
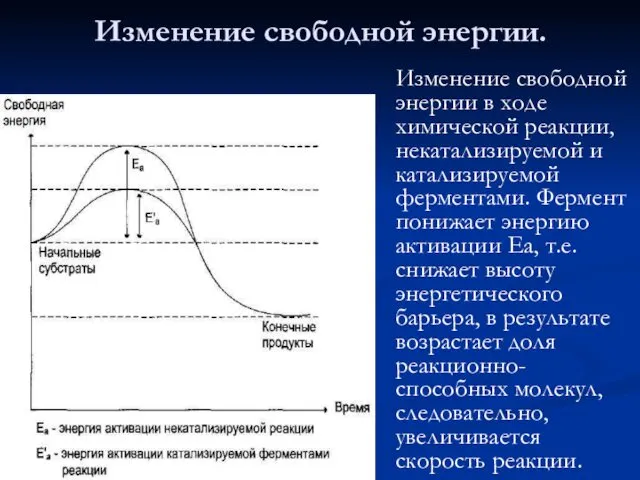
- 26. Изменение свободной энергии в ходе химической реакции, некатализируемой и катализируемой ферментами. Фермент понижает энергию активации Еа,
- 27. Механизм ферментативного катализа. В механизме ферментативного катализа решающее значение имеет образование нестойких промежуточных соединений — фермент-субстратный
- 28. Эффект деформации. Активный центр фермента также способствует дестабилизации межатомных связей в молекуле субстрата, что облегчает протекание
- 29. В участке связывания субстрат при помощи нековалентных связей взаимодействует (связывается) с ферментом, формируя фермент-субстратный комплекс. В
- 30. Механизм действия ферментов 1. Стадия: диффузия, связывание S ферментом Е и образование фермент – субстратного комплекса
- 31. Образование фермент-субстратного комплекса. где Е — фермент (энзим), 3 — субстрат, Р — продукт. Данные обозначения
- 32. Мультисубстратные реакции: Большинство ферментов катализирует реакции, в которых участвует более чем один субстрат. В случае если
- 33. Механизм упорядоченного взаимодействия субстрата с активным центром фермента: Первым в активный центр фермента присоединяется субстрат А,
- 34. Этапы ферментативного катализа. I - этап сближения и ориентации субстрата относительно активного центра фермента; II -
- 35. Молекулярные механизмы ферментативного катализа 1. Эффект ориентации реагентов снижает энтропию и энергию активации, ускоряет реакцию в
- 36. Снижение энергетического барьера происходит за счет: 1. Повышения вероятности столкновения субстратов. 2. Строгая ориентация взаимодействия молекул
- 37. Ферментативная кинетика Раздел биохимии, который изучает ферментативную активность в зависимости от условий протекания реакций. В частности,
- 38. Зависимость скорости ферментативной реакции (V) от концентрации фермента.
- 39. Зависимость скорости ферментативной реакции (V) от температуры.
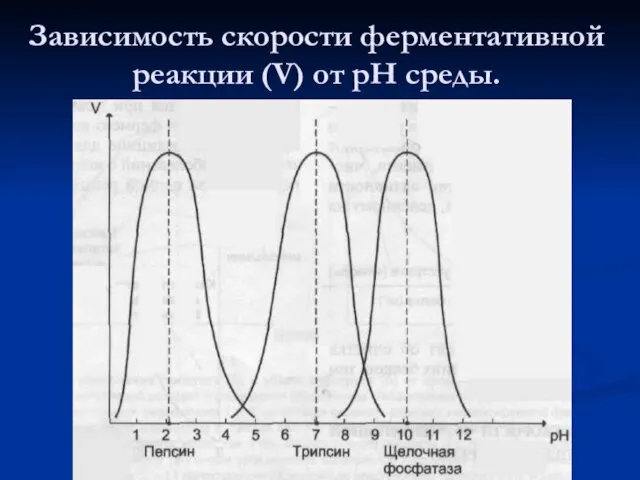
- 40. Зависимость скорости ферментативной реакции (V) от рН среды.
- 41. Оптимальные значения рН для некоторых ферментов.
- 42. Зависимость скорости реакции (V) от концентрации субстрата S. Vmax — максимальная скорость реакции при данной концентрации
- 43. Схема конкурентного ингибирования активности фермента.
- 44. Схема неконкурентного ингибирования активности фермента.
- 45. Механизм действия ионов ртути как необратимого ингибитора. Ионы ртути в малых концентрациях блокируют сульфгидрильные группы активного
- 46. Основные способы регуляции активности ферментов: аллостерическая регуляция; регуляция с помощью белок-белковых взаимодействий; регуляция путём фосфорилирования/дефос-форилирования молекулы
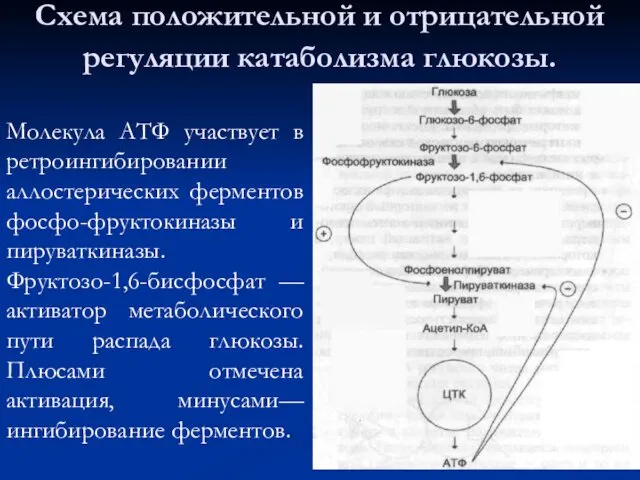
- 47. Схема положительной и отрицательной регуляции катаболизма глюкозы. Молекула АТФ участвует в ретроингибировании аллостерических ферментов фосфо-фруктокиназы и
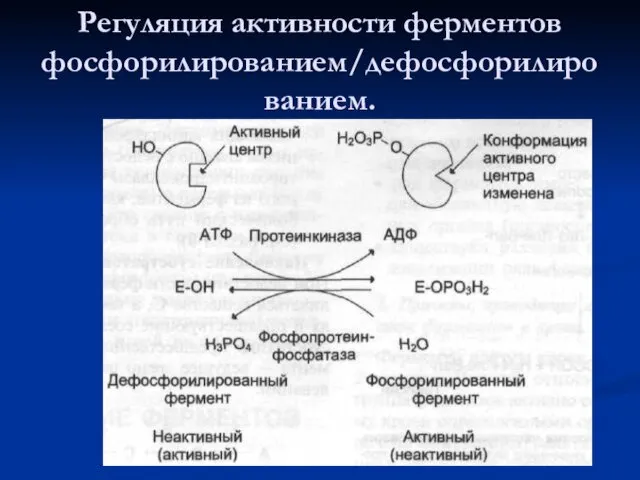
- 48. Регуляция активности ферментов фосфорилированием/дефосфорилированием.
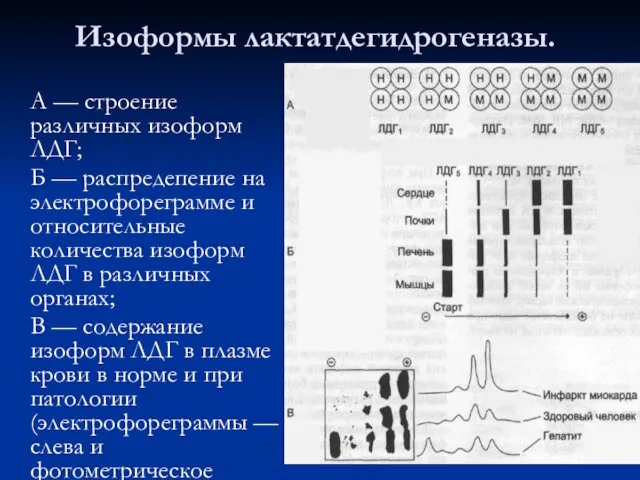
- 49. Изоформы лактатдегидрогеназы. А — строение различных изоформ ЛДГ; Б — распредепение на электрофореграмме и относительные количества
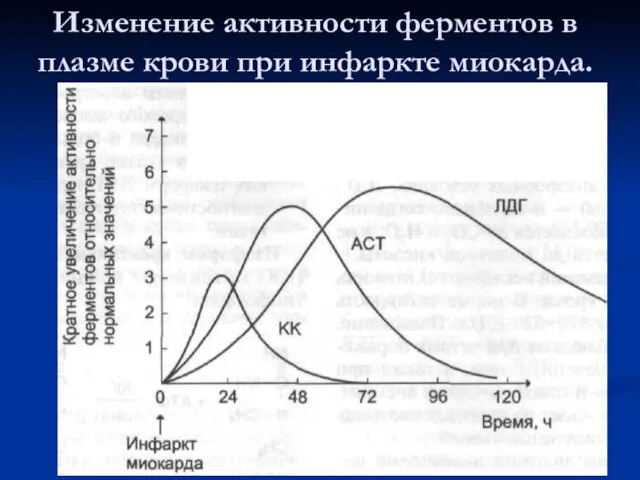
- 50. Изменение активности ферментов в плазме крови при инфаркте миокарда.
- 51. Лабильность ферментов Каталитическая эффективность фермента, как и любой белковой молекулы, зависит от его конформации, и в
- 52. Возможные пути преобразования глюкозы-6-фосфата.
- 53. Известно 6 классов ферментов: Оксидоредуктазы Трансферазы Гидролазы Лиазы Изомеразы Лигазы Каждый фермент имеет 2 названия. Первое
- 54. 1. Оксидоредуктазы.
- 55. Дегидрогеназы. В этот подкласс входят ферменты, катализирующие реакции дегидрирования (отщепления водорода). В качестве акцепторов электронов используются
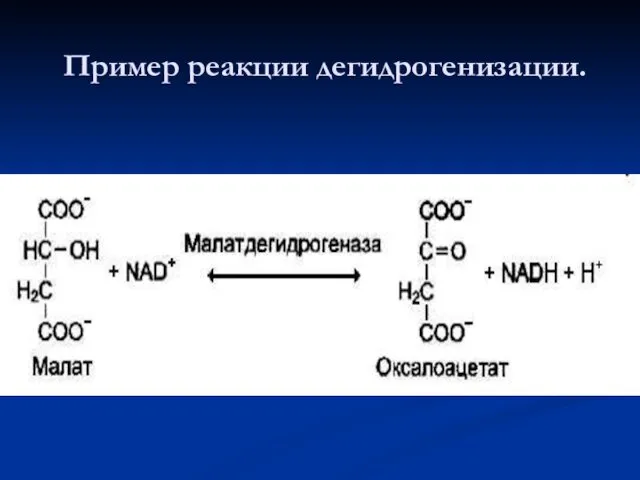
- 56. Пример реакции дегидрогенизации.
- 57. Оксидазы. Акцептором электрона служит молекулярный кислород. Пример реакции, катализируемой цитохромоксидазой:
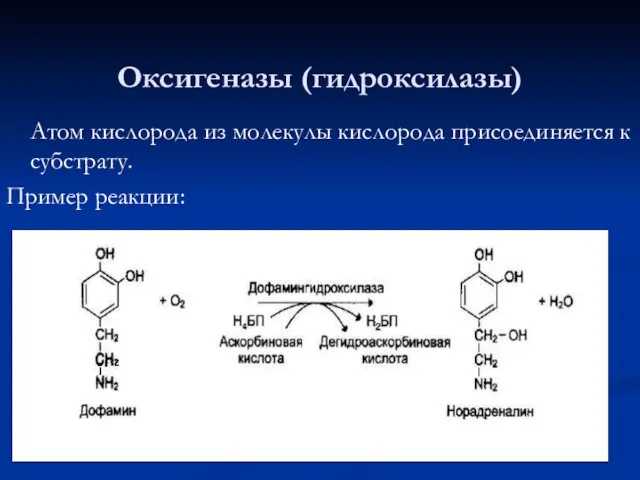
- 58. Оксигеназы (гидроксилазы) Атом кислорода из молекулы кислорода присоединяется к субстрату. Пример реакции:
- 59. 2. Трансферазы. Катализируют перенос функциональных групп от одного соединения к другому. Подразделяют в зависимости от переносимой
- 60. Примеры реакций с участием трансфераз.
- 61. 3. Гидролазы Катализируют реакции гидролиза (расщепления ковалентной связи с присоединением молекулы воды по месту разрыва). Подразделяют
- 62. Пример реакции гидролиза белка.
- 63. 4. Лиазы К лиазам относят ферменты, отщепляющие от субстратов негидролитическим путём определённую группу (при этом могут
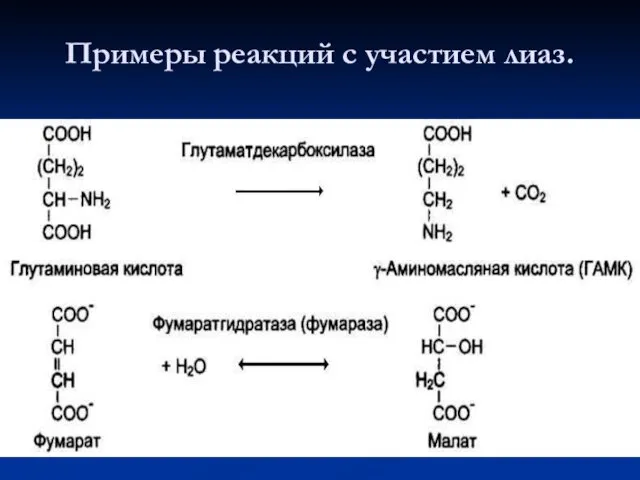
- 64. Примеры реакций с участием лиаз.
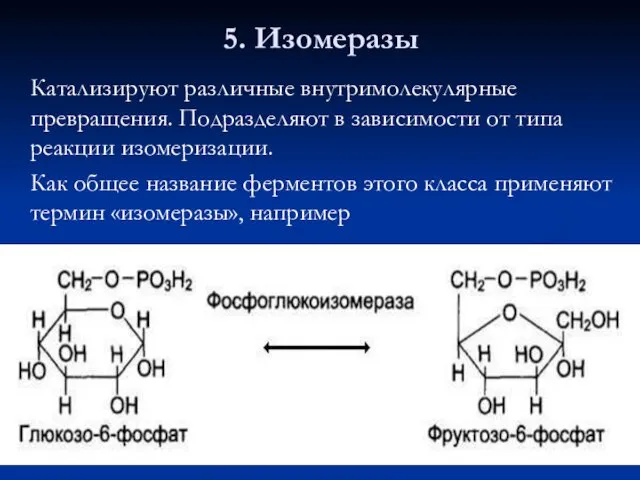
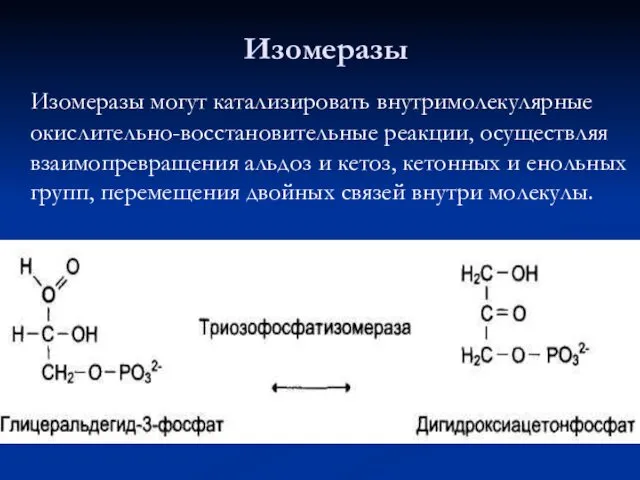
- 65. 5. Изомеразы Катализируют различные внутримолекулярные превращения. Подразделяют в зависимости от типа реакции изомеризации. Как общее название
- 66. Изомеразы могут катализировать внутримолекулярные окислительно-восстановительные реакции, осуществляя взаимопревращения альдоз и кетоз, кетонных и енольных групп, перемещения
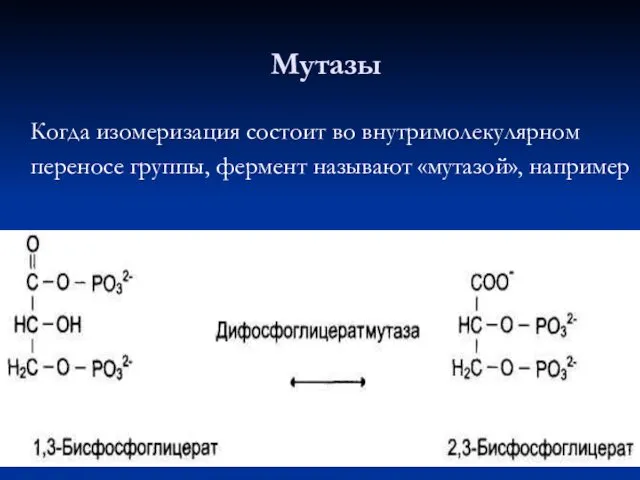
- 67. Когда изомеризация состоит во внутримолекулярном переносе группы, фермент называют «мутазой», например Мутазы
- 68. 6. Лигазы (синтетазы) Катализируют реакции присоединения друг к другу двух молекул с образованием ковалентной связи.
- 69. Этот процесс сопряжён с разрывом фосфоэфирной связи в молекуле АТФ (или других нуклеозидтрифосфатов) или с разрывом
- 70. В случае, когда источником энергии служит любое другое макроэргическое соединение (не АТФ), ферменты называют синтазами. Механизм
- 71. Гексокиназа катализирует перенос концевого, у-фосфатного остатка молекулы АТФ на глюкозу с образованием глюкозо-6-фосфата: Гексокиназы
- 72. Участие ионов магния в присоединении субстрата в активном центре гексокиназы: В активном центре гексокиназы есть участки
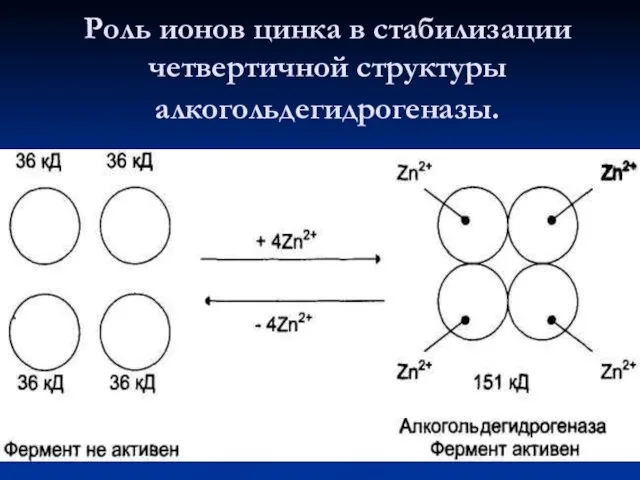
- 73. Роль ионов цинка в стабилизации четвертичной структуры алкогольдегидрогеназы.
- 74. Участие металлов в окислительно-восстановительных реакциях: Ионы металлов с переменной валентностью могут также участвовать в переносе электронов.
- 75. Схема реакции дегидрирования: Где АН2 — донор водорода, окисляемый субстрат 1; А — окисленная форма субстрата
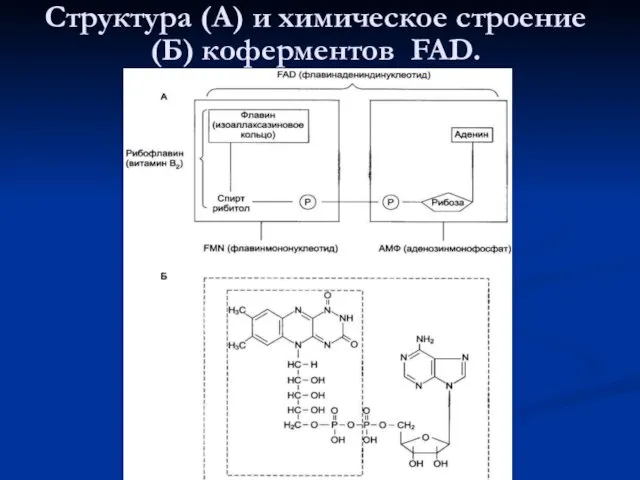
- 76. Структура (А) и химическое строение (Б) коферментов FAD.
- 78. Скачать презентацию



























































 Презентация на тему Ферменты
Презентация на тему Ферменты  Презентация на тему "Вкусовые предпочтения и болезни" - скачать бесплатно презентации по Биологии
Презентация на тему "Вкусовые предпочтения и болезни" - скачать бесплатно презентации по Биологии Архей и протерозой. Возникновение жизни на Земле
Архей и протерозой. Возникновение жизни на Земле Пряные растения
Пряные растения Здоровье ногтей. Средства для ногтей
Здоровье ногтей. Средства для ногтей Гипотеза возникновения жизни на Земле
Гипотеза возникновения жизни на Земле Царство Животные
Царство Животные Водка с молокам
Водка с молокам Распространение плодов и семян
Распространение плодов и семян Слезы. Вред или польза для человека?
Слезы. Вред или польза для человека? Хищники
Хищники Презентация на тему Распространенные заболевания человека
Презентация на тему Распространенные заболевания человека Биоэтика: возникновение, структура, принципы
Биоэтика: возникновение, структура, принципы Возникновение жизни или абиогенез
Возникновение жизни или абиогенез Клеточный инструментарий для репарации ДНК
Клеточный инструментарий для репарации ДНК Видовое разнообразие птиц, обитающих в природном парке Сходненский ковш
Видовое разнообразие птиц, обитающих в природном парке Сходненский ковш Тип Кишечнополостные Гидра
Тип Кишечнополостные Гидра  О пользе питьевой воды
О пользе питьевой воды Эмбриональное развитие ланцетника (Branchiostoma)
Эмбриональное развитие ланцетника (Branchiostoma) Теплорегуляция Интегрированный урок (физики и биологии)
Теплорегуляция Интегрированный урок (физики и биологии) Многообразие одноклеточных организмов
Многообразие одноклеточных организмов Пневмония или Воспаление легких
Пневмония или Воспаление легких Презентация на тему «Женские» и «мужские» города России
Презентация на тему «Женские» и «мужские» города России  Клапанный аппарат сердца и его работа
Клапанный аппарат сердца и его работа Производственные процессы и определение состава МТП в ООО Агрофирма Савали с разработкой технологии культиваций почвы
Производственные процессы и определение состава МТП в ООО Агрофирма Савали с разработкой технологии культиваций почвы Леса Беларуси
Леса Беларуси Скелетные ткани. Костная ткань
Скелетные ткани. Костная ткань Формирование парков на нарушенных территориях. Геопластика
Формирование парков на нарушенных территориях. Геопластика