Содержание
- 2. Ферменты Ферменты - это белковые вещества, играющие очень важную роль в различных биохимических процессах в организме.
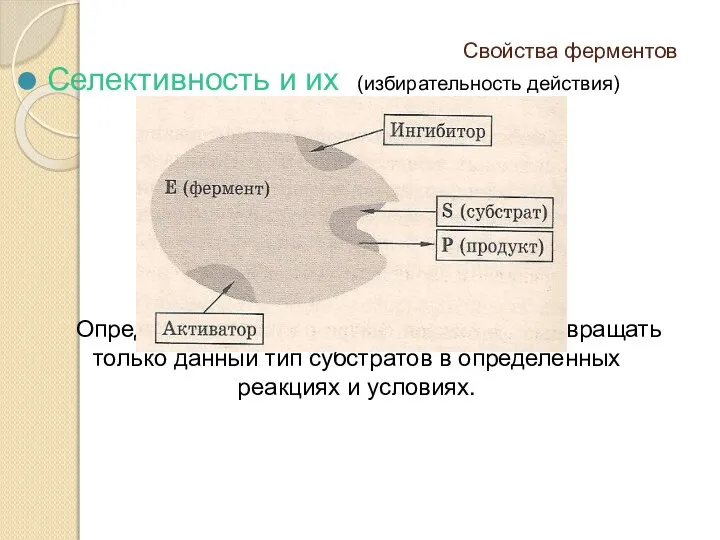
- 3. Свойства ферментов Селективность и их (избирательность действия) Определяется способностью фермента превращать только данный тип субстратов в
- 4. Высокая каталитическая активность Добавка незначительной концентрации фермента ускоряет превращение субстрата в 10 8 - 1012 раз.
- 5. Зависимость от температуры Многие ферменты обладают наибольшей эффективностью при температуре человеческого тела, т.е. приблизительно при этом
- 6. Важным свойством является то, что ферменты находятся в тканях и клетках в неактивной форме (проферменте). Классическими
- 7. Ферменты В зависимости от того, какие виды реакций организма катализируют ферменты, они выполняют различные функции. Чаще
- 8. Пищеварительные ферменты Различают три основные категории таких ферментов: амилаза, протеазы, липаза. Амилаза расщепляет углеводы и находится
- 9. Классификация ферментов На Международном биохимическом съезде было принято, что ферменты должны классифицироваться по типу реакции и
- 10. Классификация ферментов 1.Оксидоредуктазы - это ферменты, катализирующие окислительно-восстановительные реакции, например каталаза: 2 H2O2-->O2+2 H2O 2.Трансферазы -
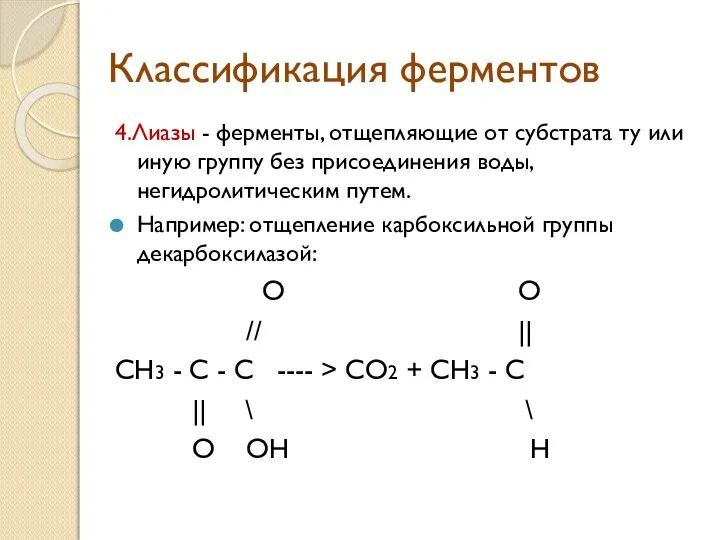
- 11. Классификация ферментов 4.Лиазы - ферменты, отщепляющие от субстрата ту или иную группу без присоединения воды, негидролитическим
- 12. 5.Изомеразы - ферменты, катализирующие превращение одного изомера в другой называются: глюкозо-6-фосфат --> глюкозо-1-фосфат 6.Синтетазы - ферменты,
- 13. Амилаза
- 14. Амилаза, расщепляя крахмал и другие углеводы, обеспечивает переваривание углеводов пищи. Из организма амилазу выводят почки вместе
- 15. Увеличение активности амилазы более чем в 10 раз: При остром панкреатите активность амилазы в крови и
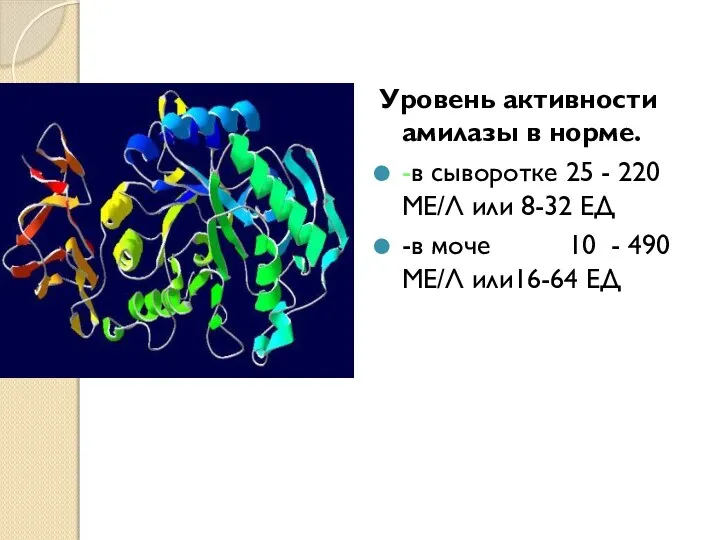
- 16. Уровень активности амилазы в норме. -в сыворотке 25 - 220 МЕ/Л или 8-32 ЕД -в моче
- 17. Применение ферментов Ферменты используют для смягчения кожи в кожевенной промышленности. Ферменты входят в состав стиральных порошков,
- 18. Применение ферментов Ферменты получили широкое применение в легкой, пищевой и химической промышленности, а также в медицине.
- 20. Скачать презентацию













 Презентация на тему Как не поссориться с медведем!?
Презентация на тему Как не поссориться с медведем!? Презентация на тему "Обмен веществ. Этапы и особенности метаболизма" - скачать презентации по Биологии
Презентация на тему "Обмен веществ. Этапы и особенности метаболизма" - скачать презентации по Биологии Презентация на тему "Ткани растений (6 класс)" - скачать бесплатно презентации по Биологии
Презентация на тему "Ткани растений (6 класс)" - скачать бесплатно презентации по Биологии Презентация на тему "Мир динозавров" - скачать презентации по Биологии
Презентация на тему "Мир динозавров" - скачать презентации по Биологии Ялина сербська
Ялина сербська Зрелый возраст: здоровые женщина и мужчина
Зрелый возраст: здоровые женщина и мужчина Презентация по биологии Отряд Стрекозы
Презентация по биологии Отряд Стрекозы  Половое воспитание Материал для воспитателей. Семенищева И. А.
Половое воспитание Материал для воспитателей. Семенищева И. А. Неживая и живая природа (2 класс)
Неживая и живая природа (2 класс) Презентация на тему Абиотические факторы среды и их влияние на живые организмы
Презентация на тему Абиотические факторы среды и их влияние на живые организмы  Отряды насекомых с полным превращением
Отряды насекомых с полным превращением Бактерии – древнейшая группа организмов Бактерии – древнейшая группа организмов учитель биологии МБОУ СОШ №19 Шадрина Натал
Бактерии – древнейшая группа организмов Бактерии – древнейшая группа организмов учитель биологии МБОУ СОШ №19 Шадрина Натал Домашние питомцы коты
Домашние питомцы коты Происхождение млекопитающих. Первозвери и настоящие звери
Происхождение млекопитающих. Первозвери и настоящие звери Органические вещества клетки. Углеводы и липиды
Органические вещества клетки. Углеводы и липиды Лекарственные растения Работу выполнил: Ученик 8 «б» класса Юрин Владимир
Лекарственные растения Работу выполнил: Ученик 8 «б» класса Юрин Владимир Тип Членистоногие, класс Паукообразные
Тип Членистоногие, класс Паукообразные Половое размножение живых организмов
Половое размножение живых организмов Мезозойская эра Земли. www.themegallery.com
Мезозойская эра Земли. www.themegallery.com Филогенез дыхательной системы хордовых
Филогенез дыхательной системы хордовых Дыхание человека
Дыхание человека  Таёжные ландшафты
Таёжные ландшафты Влияние магнитных полей на живые организмы
Влияние магнитных полей на живые организмы Готовимся к ЕГЭ по биологии. Презентация – практикум по подготовке к успешному выполнению задания С5 Титова Марина Сергеевна
Готовимся к ЕГЭ по биологии. Презентация – практикум по подготовке к успешному выполнению задания С5 Титова Марина Сергеевна  Животные пресного водоёма
Животные пресного водоёма Развитие популяции Сизого голубя в условиях субарктического климата
Развитие популяции Сизого голубя в условиях субарктического климата Полезные и ядовитые домашние растения
Полезные и ядовитые домашние растения Загальна характеристика та представники папоротеподібних
Загальна характеристика та представники папоротеподібних