Содержание
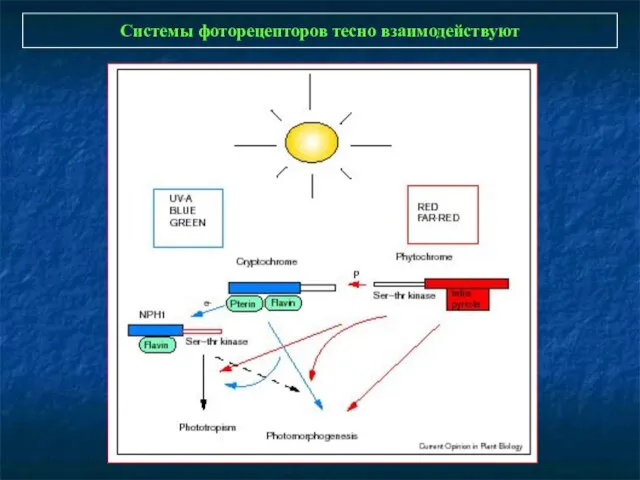
- 2. Системы фоторецепторов тесно взаимодействуют
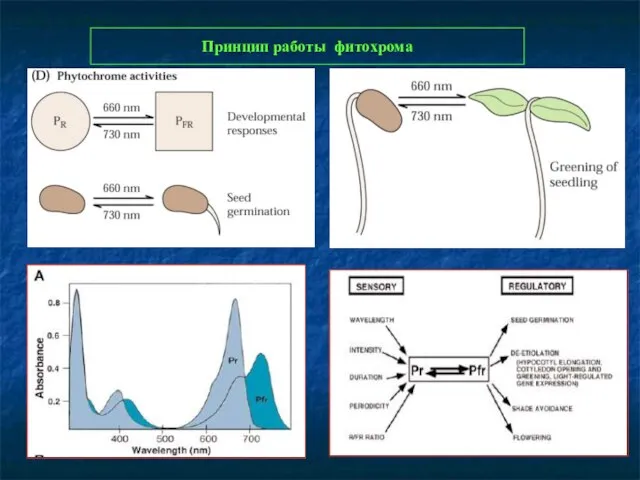
- 3. Принцип работы фитохрома
- 4. Фотообращаемые эффекты фитохромов. Покрытосеменные салат-латук семена Стимуляция прорастания овес этиолированные Стимуляция деэтиоляции проростки горчица проростки Стимуляция
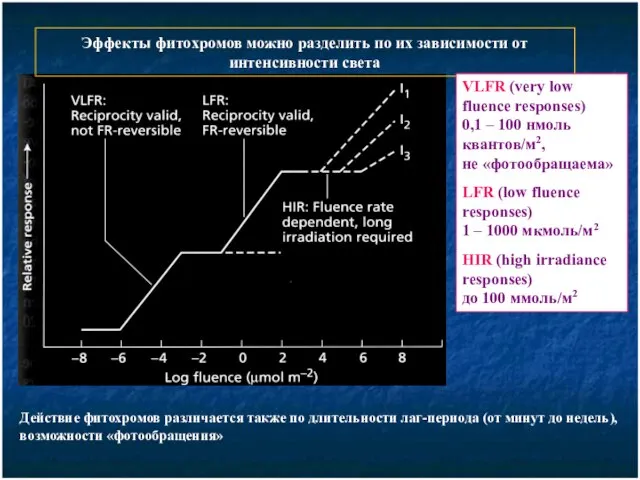
- 5. Эффекты фитохромов можно разделить по их зависимости от интенсивности света VLFR (very low fluence responses) 0,1
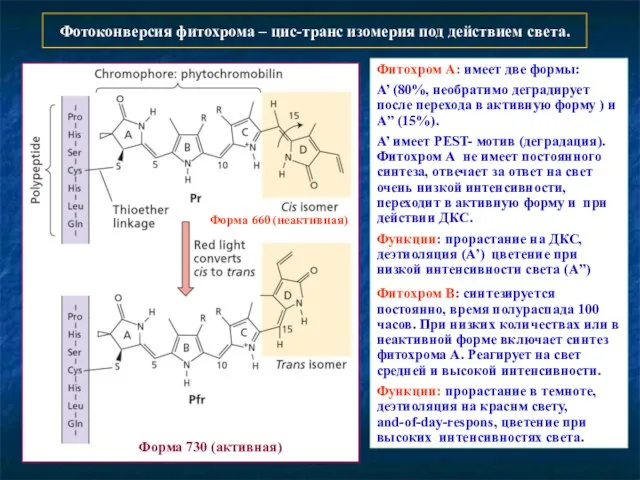
- 6. Фотоконверсия фитохрома – цис-транс изомерия под действием света. Форма 660 (неактивная) Форма 730 (активная) Фитохром А:
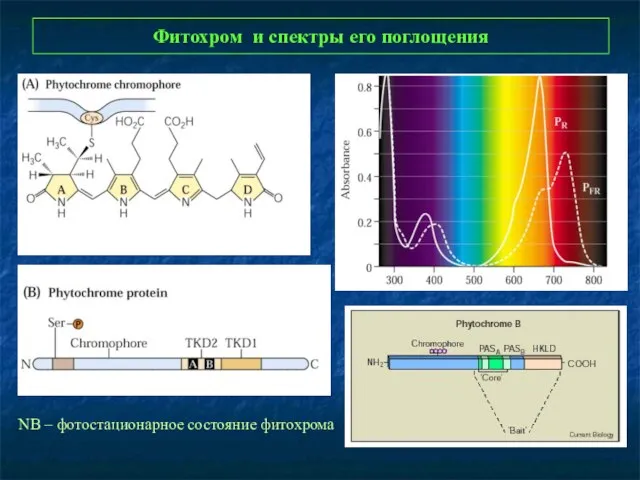
- 7. Фитохром и спектры его поглощения NB – фотостационарное состояние фитохрома
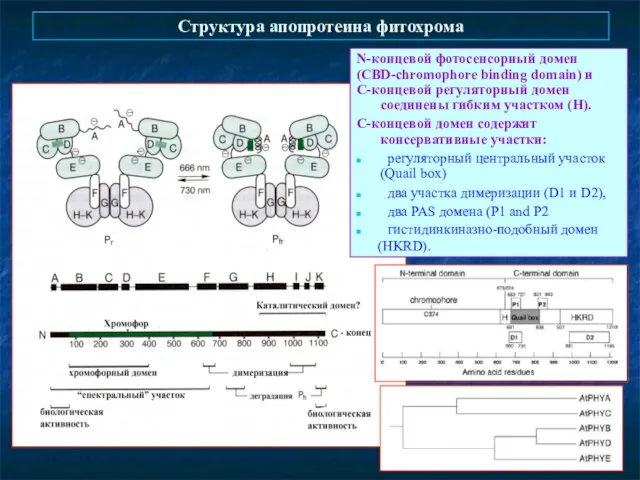
- 8. Структура апопротеина фитохрома N-концевой фотосенсорный домен (CBD-chromophore binding domain) и С-концевой регуляторный домен соединены гибким участком
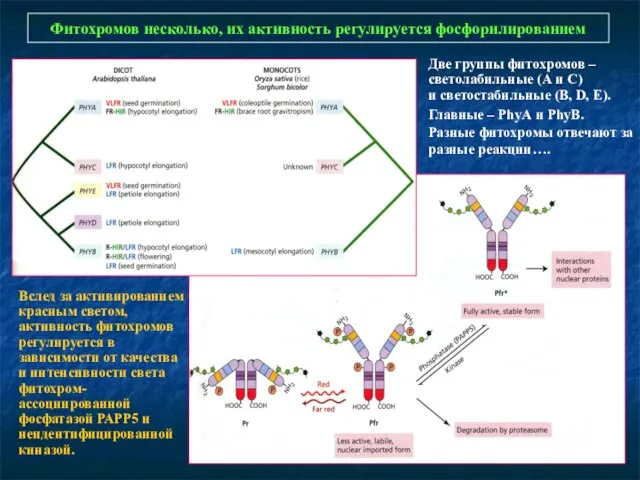
- 9. Фитохромов несколько, их активность регулируется фосфорилированием Вслед за активированием красным светом, активность фитохромов регулируется в зависимости
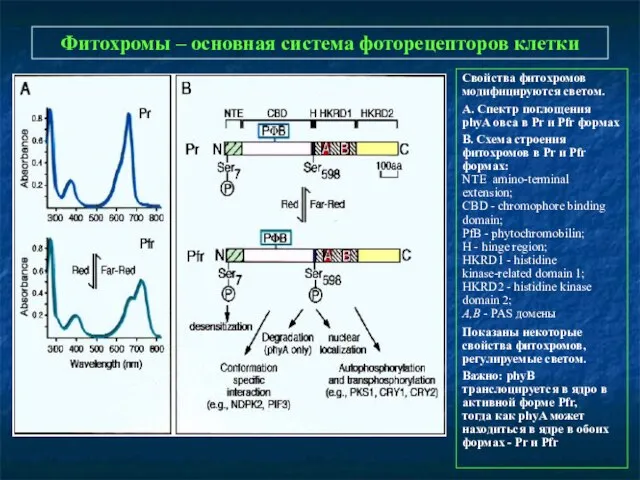
- 10. Фитохромы – основная система фоторецепторов клетки Свойства фитохромов модифицируются светом. А. Спектр поглощения phyA овса в
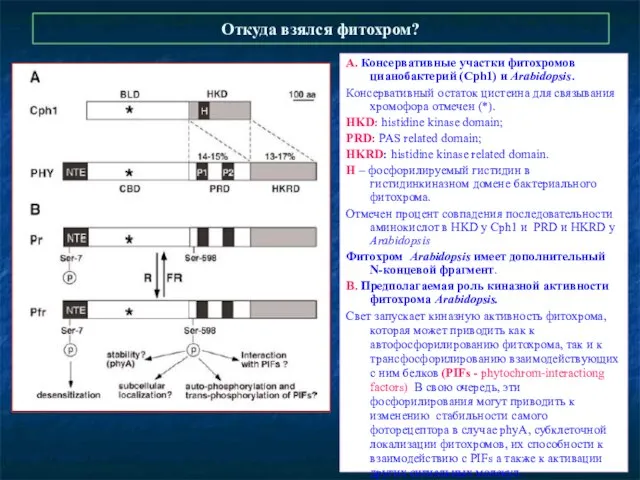
- 11. Откуда взялся фитохром? А. Консервативные участки фитохромов цианобактерий (Cph1) и Arabidopsis. Консервативный остаток цистеина для связывания
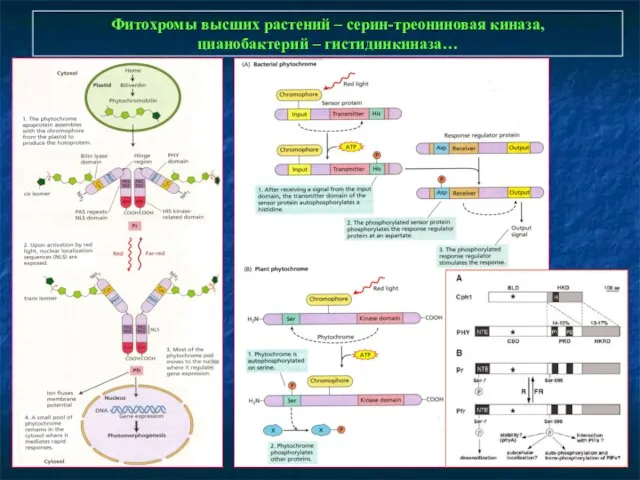
- 12. Фитохромы высших растений – серин-треониновая киназа, цианобактерий – гистидинкиназа…
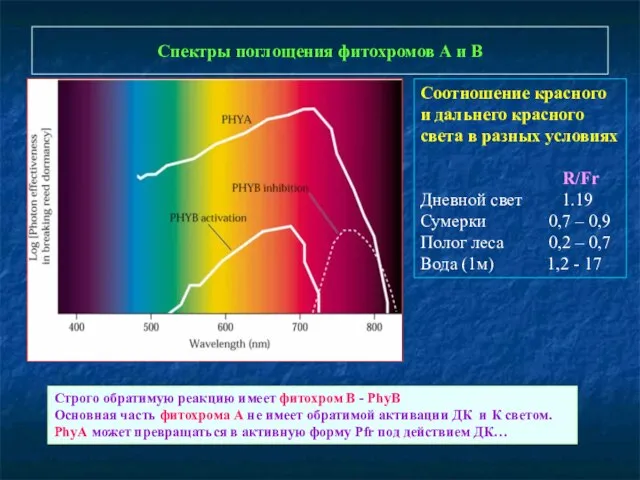
- 13. Спектры поглощения фитохромов А и В Соотношение красного и дальнего красного света в разных условиях R/Fr
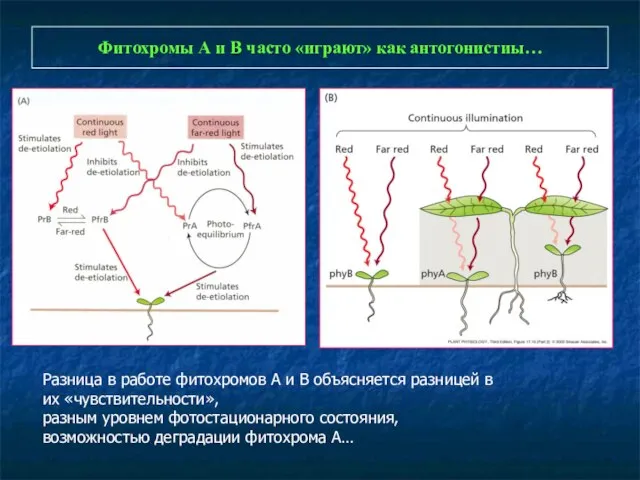
- 14. Фитохромы А и В часто «играют» как антогонистиы… Разница в работе фитохромов А и В объясняется
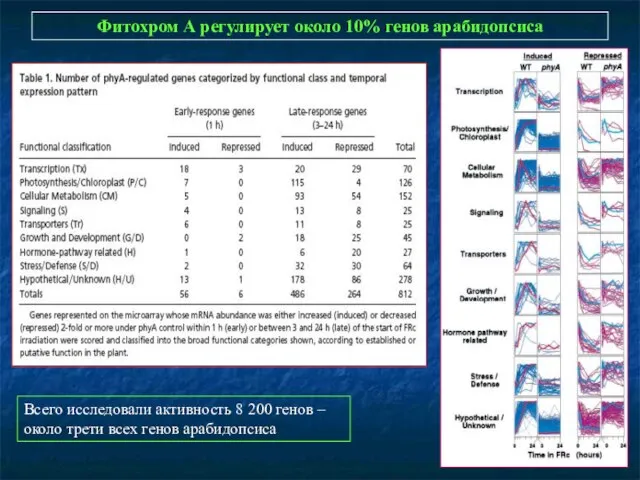
- 15. Фитохром А регулирует около 10% генов арабидопсиса Всего исследовали активность 8 200 генов – около трети
- 16. Сигналинг фитохромов. Общие положения Два типа ответов – быстрые (секунды) и «глобалные». Быстрые ответы связаны с
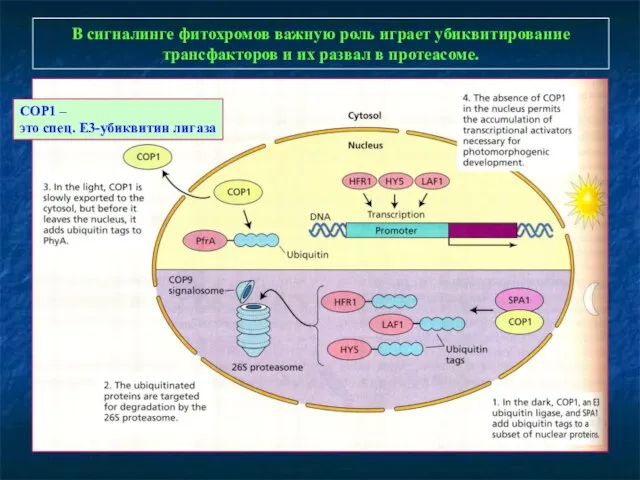
- 17. В сигналинге фитохромов важную роль играет убиквитирование трансфакторов и их развал в протеасоме. COP1 – это
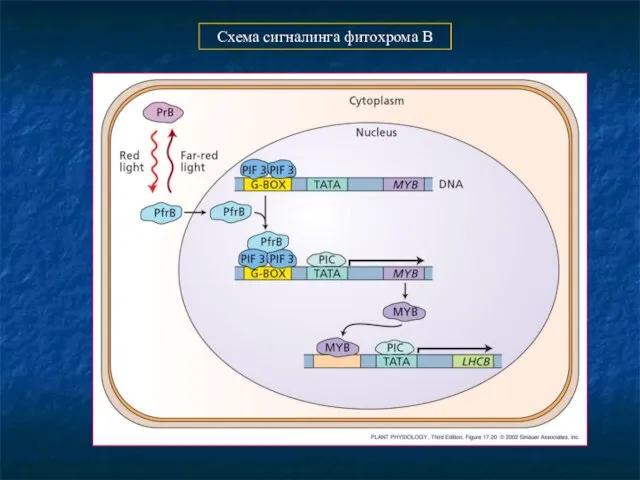
- 18. Схема сигналинга фитохрома В
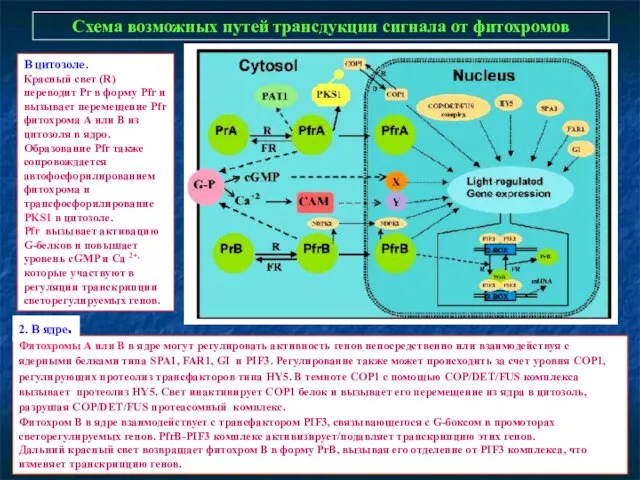
- 19. Схема возможных путей трансдукции сигнала от фитохромов Фитохромы А или В в ядре могут регулировать активность
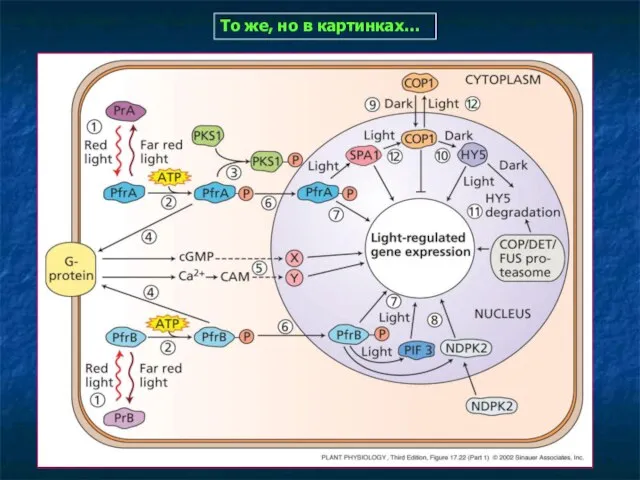
- 20. То же, но в картинках…
- 21. Рецепторы синего света отвечают за многое… Реакция фототропизма Движение хлоропластов Циркадные ритмы: открытие устьиц «сонные» движения
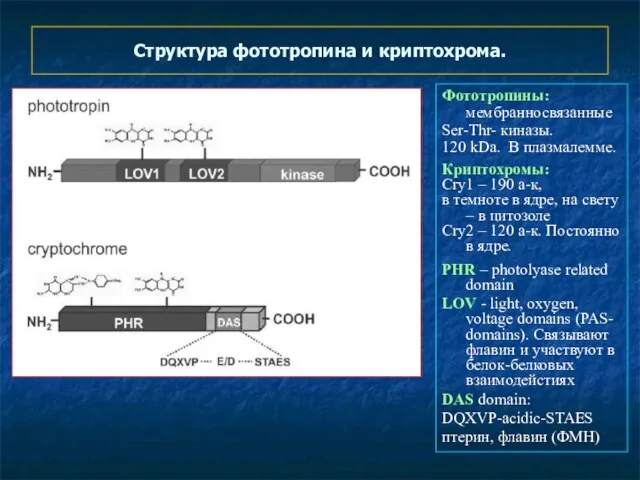
- 22. Структура фототропина и криптохрома. Фототропины: мембранносвязанные Ser-Thr- киназы. 120 kDa. В плазмалемме. Криптохромы: Cry1 – 190
- 23. Фототропины участвуют в регуляции разных фотодвижений Изгибание колеоптиля Движение хлоропластов Открывание устьиц У Arabidopsis работают два
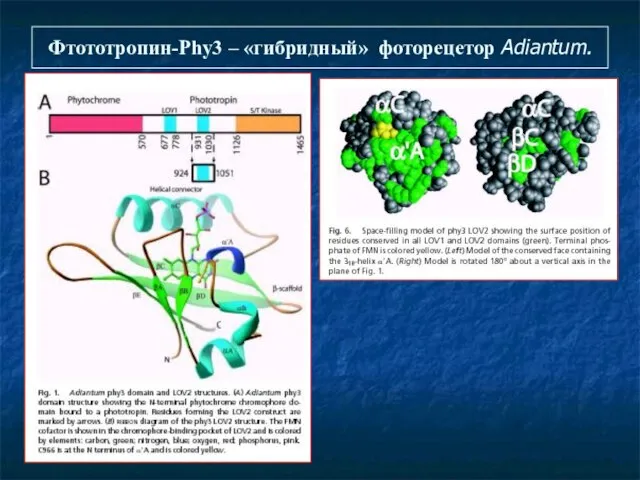
- 24. Фтототропин-Phy3 – «гибридный» фоторецетор Adiantum.
- 25. Схема строения фоторецепторов и их взаимодйствие
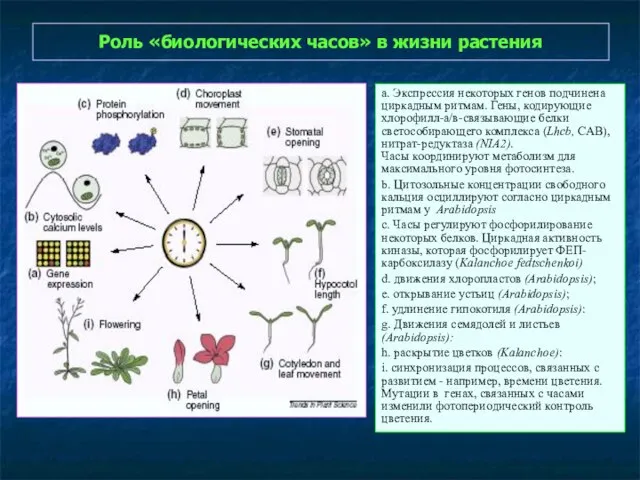
- 26. Роль «биологических часов» в жизни растения а. Экспрессия некоторых генов подчинена циркадным ритмам. Гены, кодирующие хлорофилл-а/в-связывающие
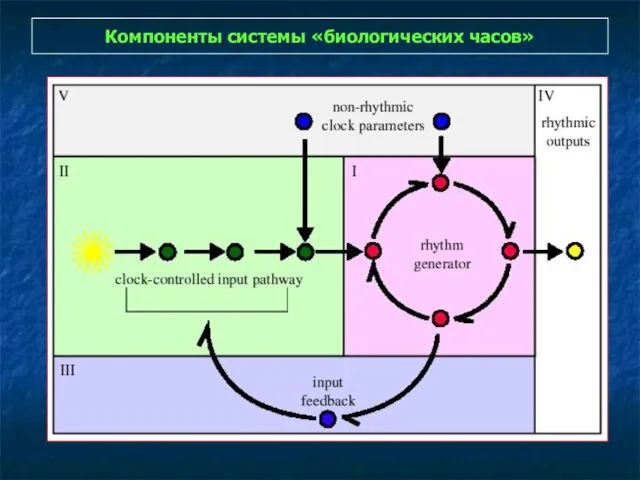
- 27. Компоненты системы «биологических часов»
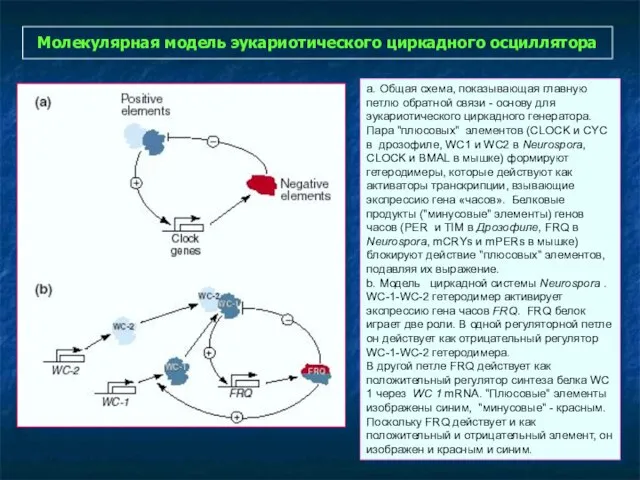
- 28. Молекулярная модель эукариотического циркадного осциллятора a. Общая схема, показывающая главную петлю обратной связи - основу для
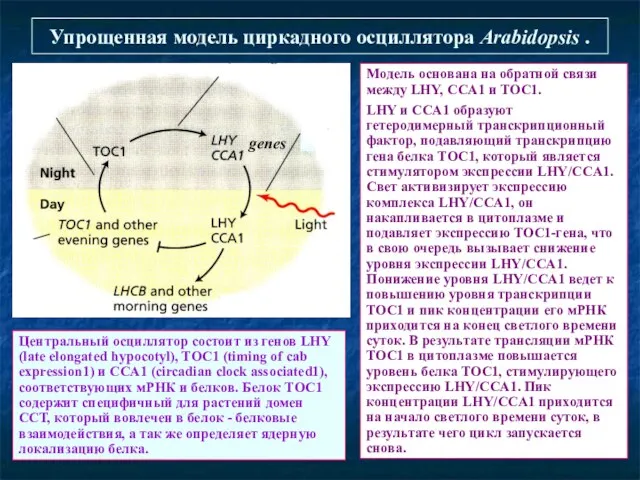
- 29. Упрощенная модель циркадного осциллятора Arabidopsis . Модель основана на обратной связи между LHY, CCA1 и TOC1.
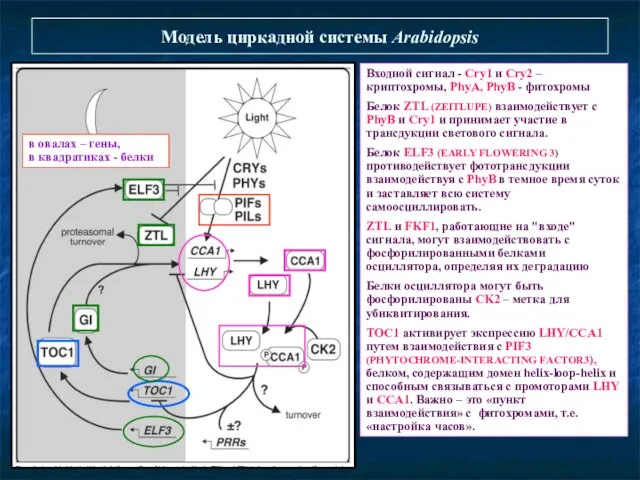
- 30. Модель циркадной системы Arabidopsis Входной сигнал - Сry1 и Сry2 – криптохромы, PhyA, PhyB - фитохромы
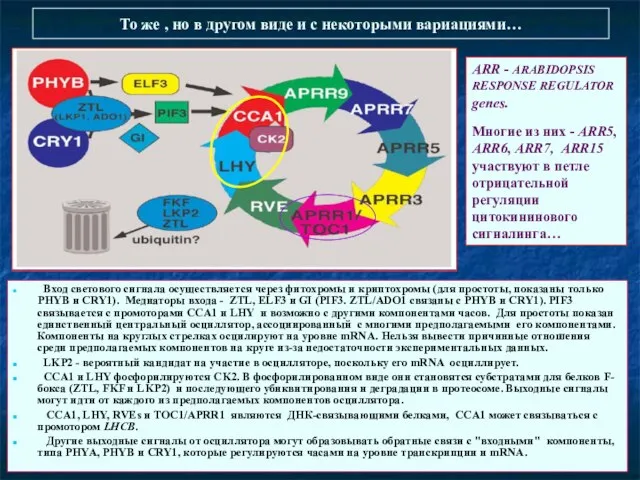
- 31. То же , но в другом виде и с некоторыми вариациями… Вход светового сигнала осуществляется через
- 32. Стратегии развития животных и растений различны. У животных: развитие – серия сложных преобразований, которые ведут к
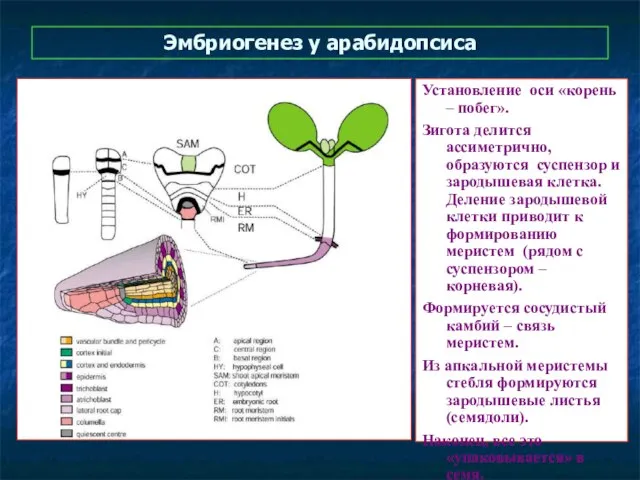
- 33. Эмбриогенез у арабидопсиса Установление оси «корень – побег». Зигота делится ассиметрично, образуются суспензор и зародышевая клетка.
- 34. Особенности и механизмы эмбрионального развития растений Формирование зародыша у растений происходит за счет изменения скорости и
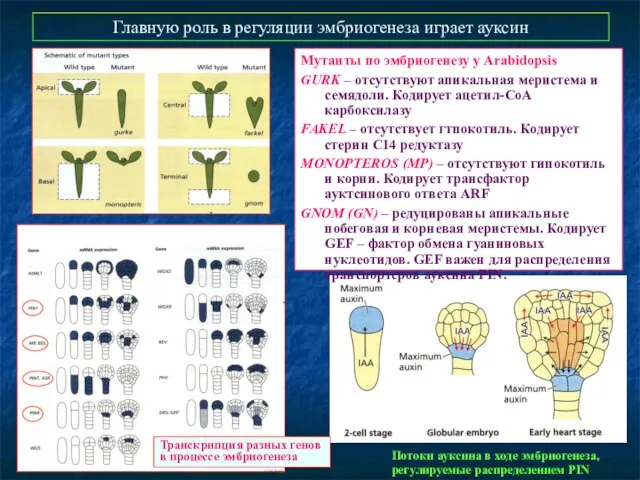
- 35. Главную роль в регуляции эмбриогенеза играет ауксин Мутанты по эмбриогенезу у Arabidopsis GURK – отсутствуют апикальная
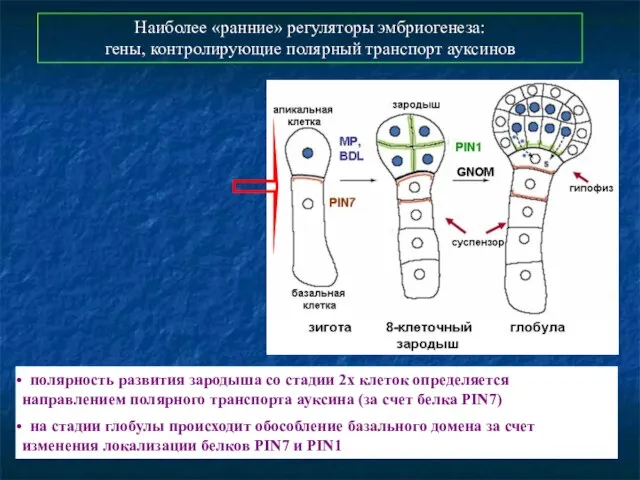
- 36. Наиболее «ранние» регуляторы эмбриогенеза: гены, контролирующие полярный транспорт ауксинов полярность развития зародыша со стадии 2х клеток
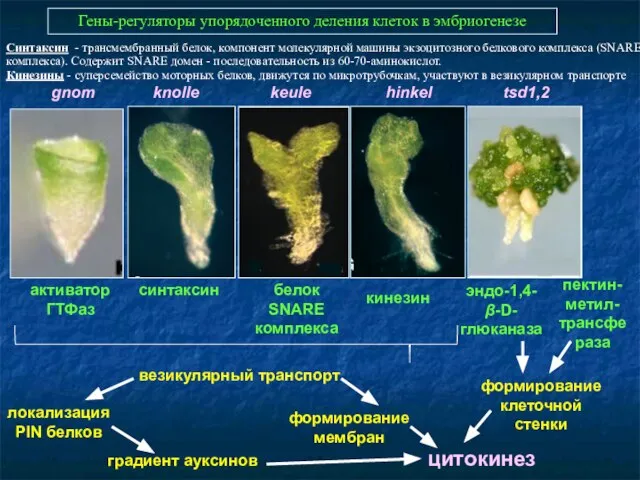
- 37. Гены-регуляторы упорядоченного деления клеток в эмбриогенезе gnom knolle keule hinkel tsd1,2 эндо-1,4-β-D-глюканаза синтаксин кинезин белок SNARE
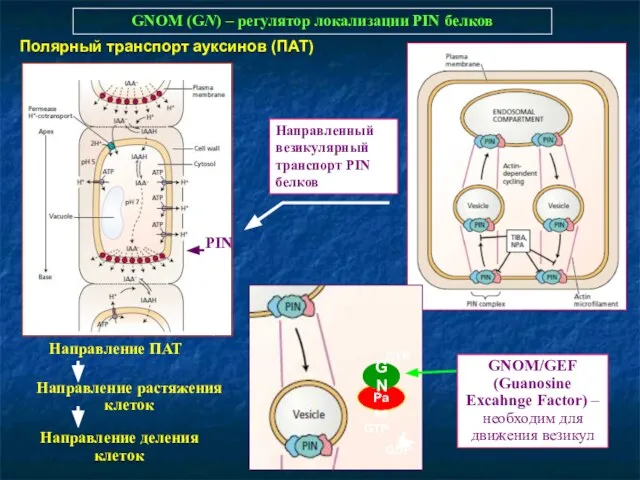
- 38. GNOM (GN) – регулятор локализации PIN белков PIN Направление ПАТ Направление растяжения клеток Направление деления клеток
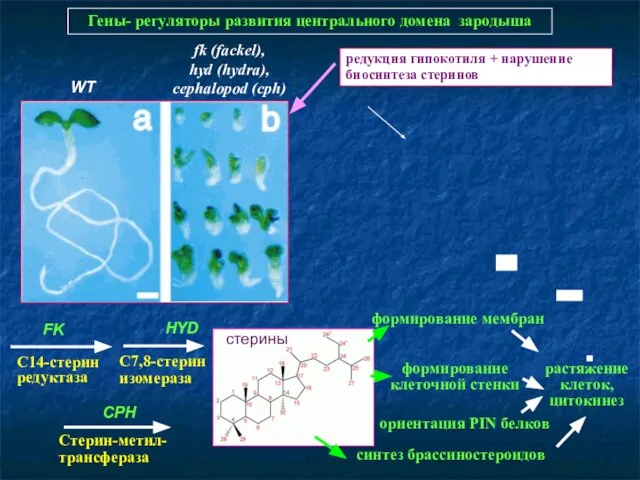
- 39. Гены- регуляторы развития центрального домена зародыша WT fk (fackel), hyd (hydra), cephalopod (cph) редукция гипокотиля +
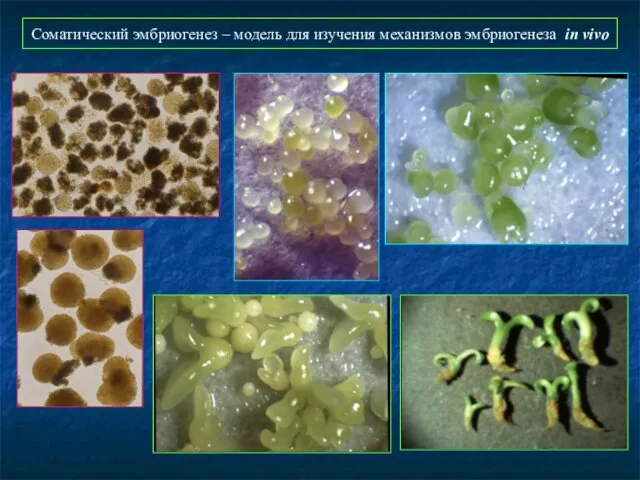
- 40. Соматический эмбриогенез – модель для изучения механизмов эмбриогенеза in vivo
- 42. Скачать презентацию







 В течение тысячелетий человек, употребляя в основном растительную пищу, получал вместе с ней антимикробные, противопаразитарн
В течение тысячелетий человек, употребляя в основном растительную пищу, получал вместе с ней антимикробные, противопаразитарн Ферменты. Уравнение Михаэлиса-Ментен
Ферменты. Уравнение Михаэлиса-Ментен Мышечная система
Мышечная система Классификация. Систематика
Классификация. Систематика Презентация на тему "Как бороться с неправильной осанкой" - скачать презентации по Биологии
Презентация на тему "Как бороться с неправильной осанкой" - скачать презентации по Биологии Николай Иванович Вавилов. (13(25)ноября – 26 января 1943г) Подготовила Карпова Вероника 11б
Николай Иванович Вавилов. (13(25)ноября – 26 января 1943г) Подготовила Карпова Вероника 11б  Презентация на тему "БІОСФЕРА" - скачать бесплатно презентации по Биологии
Презентация на тему "БІОСФЕРА" - скачать бесплатно презентации по Биологии Каустобиолиты. Эволюция и периодичность
Каустобиолиты. Эволюция и периодичность Комнатные растения
Комнатные растения Н а с е к о м ы е
Н а с е к о м ы е Память животных
Память животных Вымершие летающие рептилии. Птеродактиль
Вымершие летающие рептилии. Птеродактиль Природоведение 5 класс Звёзды. Созвездия.
Природоведение 5 класс Звёзды. Созвездия. Урок 22. Покрытосеменные (Цветковые) растения. Происхождение и особенности организации.
Урок 22. Покрытосеменные (Цветковые) растения. Происхождение и особенности организации. Презентация на тему "Подцарство многоклеточные животные. Общая характеристика" - скачать презентации по Биологии
Презентация на тему "Подцарство многоклеточные животные. Общая характеристика" - скачать презентации по Биологии Лекция 4-5
Лекция 4-5 Презентація на тему: “Захворювання дихальної системи”
Презентація на тему: “Захворювання дихальної системи”  Роботизированный электроотпугивателей лосей
Роботизированный электроотпугивателей лосей Огневая подготовка Учитель ОБЖ МБОУ СОШ № 6 Брайт Елена Николаевна
Огневая подготовка Учитель ОБЖ МБОУ СОШ № 6 Брайт Елена Николаевна Гуморальная регуляция адаптации
Гуморальная регуляция адаптации Презентация на тему Физиология почки
Презентация на тему Физиология почки Тип Членистоногие. Разнообразие ракообразных
Тип Членистоногие. Разнообразие ракообразных Презентация на тему "внимание" - скачать бесплатно презентации по Биологии
Презентация на тему "внимание" - скачать бесплатно презентации по Биологии Презентация на тему Царство бактерии
Презентация на тему Царство бактерии Отдел Зелёные водоросли
Отдел Зелёные водоросли Мои любимые цветы
Мои любимые цветы Морфо-функциональные особенности вегетативной неврной системы
Морфо-функциональные особенности вегетативной неврной системы КЛАСС ДВУДОЛЬНЫЕ. СЕМЕЙСТВО ПАСЛЁНОВЫЕ. БИОЛОГИЯ 6 КЛАСС. ПРЕЗЕНТАЦИЯ К УРОКУ. Выполнила учитель биологии МОУ «Мирненская средня
КЛАСС ДВУДОЛЬНЫЕ. СЕМЕЙСТВО ПАСЛЁНОВЫЕ. БИОЛОГИЯ 6 КЛАСС. ПРЕЗЕНТАЦИЯ К УРОКУ. Выполнила учитель биологии МОУ «Мирненская средня