Содержание
- 2. Строение мышц. Главные компоненты сократительных систем. Мышцы составляют около половины массы всего тела. Основная динамическая функция
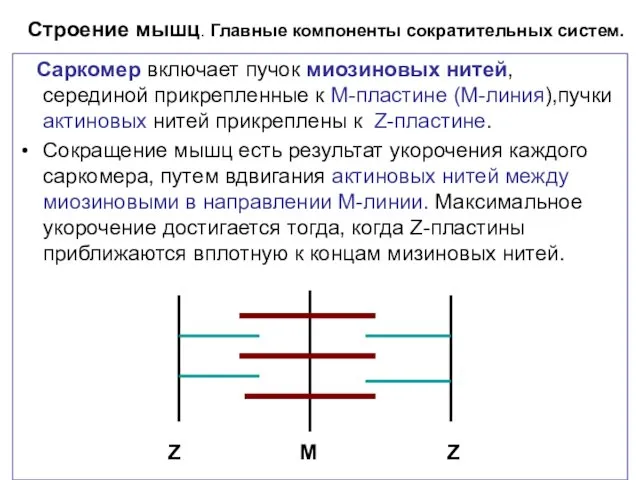
- 3. Строение мышц. Главные компоненты сократительных систем. Саркомер включает пучок миозиновых нитей, серединой прикрепленные к М-пластине (М-линия),пучки
- 4. Механизм сокращения Миозин – белок миозиновых нитей содержит две идентичные цепи, скрученные между собой, N –концы
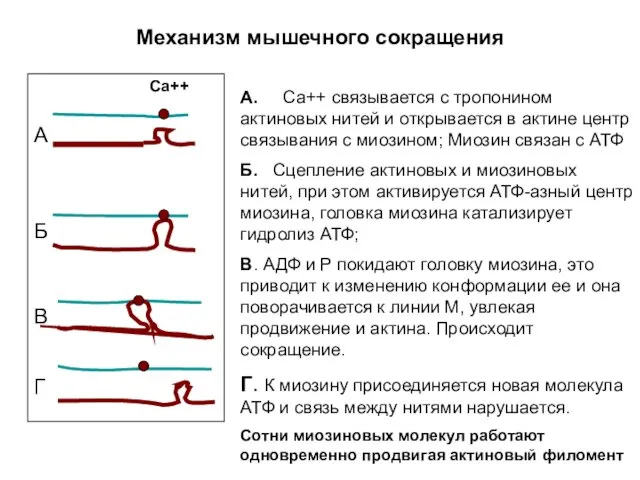
- 5. Механизм мышечного сокращения А. Са++ связывается с тропонином актиновых нитей и открывается в актине центр связывания
- 6. Мышечное сокращения. Условия. Сила сокращения зависит от количества миозиновых головок, включенных в работу, а значит, и
- 7. Источники энергии (АТФ)для мышечного сокращения. Мышца, работающая с максимальной активностью потребляет энергии в сотни раз больше,
- 8. Источники энергии для мышечного сокращения Креатинфосфат образуется из креатина и АТФ. Креатин - трипептид синтезируется в
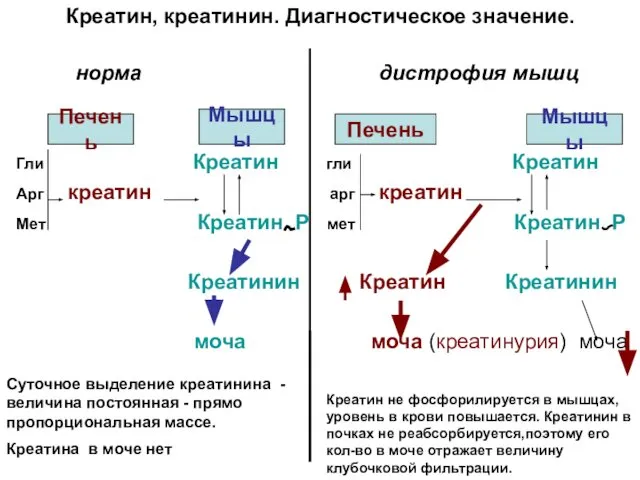
- 9. Креатин, креатинин. Диагностическое значение. норма дистрофия мышц Мышцы Печень Мышцы Гли Креатин гли Креатин Арг креатин
- 10. Функциональная биохимия печени Печень занимает центральное место в обмене веществ, что определяется своеобразием топографии и кровоснабжением
- 11. Метаболическая и гомеостатическая функция Выполнение этой функции обусловлено участием печени в обмене углеводов, липидов, белков, пигментном
- 12. Роль печени в липидном обмене Печень участвует во всех этапах обмена липидов, включая переваривание и всасывание
- 13. Роль печени в белковом обмене. Около половины белков организма синтезируется в печени как для собственных нужд,
- 14. Желчеобразовательная и экскреторная функция. В печени образуются желчные кислоты из холестерола под действием фермента 7α-холестеролгидроксилазы. Активность
- 15. Обезвреживающая функция печени. В организме в процессе жизнедеятельности образуются токсичные метаболиты как собственных соединений, так и
- 16. Этап химической модификации Этап химической модификации обеспечивает повышение гидрофильности вещества и обязателен для всех гидрофобных соединеий.
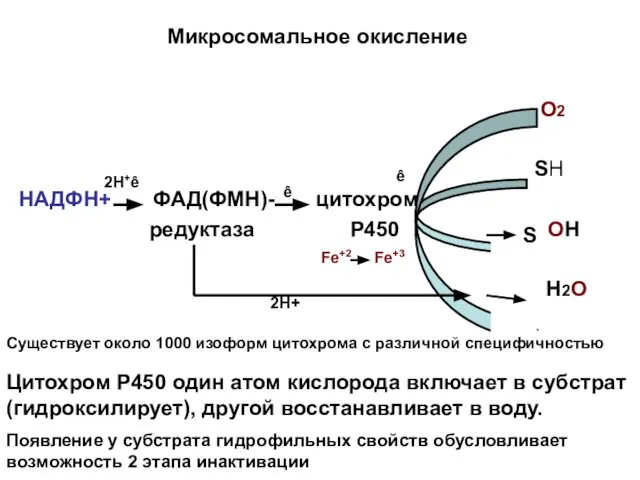
- 17. Микросомальное окисление О2 SH НАДФН+ ФАД(ФМН)- цитохром редуктаза Р450 OH Н2О S Fe+2 Fe+3 2H+ 2Н+ê
- 18. Этап конъюгации Коньюгация с с гидрофильными молекулами: УДФ-глюкуроновая кислота, фосфоаденозинфосфосульфат (ФАФС) и др. Примеры: образование глюкуронида
- 20. Скачать презентацию













 Презентация на тему Естественный отбор – направляющий фактор эволюции.
Презентация на тему Естественный отбор – направляющий фактор эволюции.  Зоология - наука о животных
Зоология - наука о животных Жизненный цикл клетки
Жизненный цикл клетки Каракал
Каракал Игра-путешествие Наши зелёные друзья
Игра-путешествие Наши зелёные друзья Перелетные и зимующие птицы. Конспект занятий в старшей группе
Перелетные и зимующие птицы. Конспект занятий в старшей группе Ткани человека
Ткани человека Қолдан сұрыптау
Қолдан сұрыптау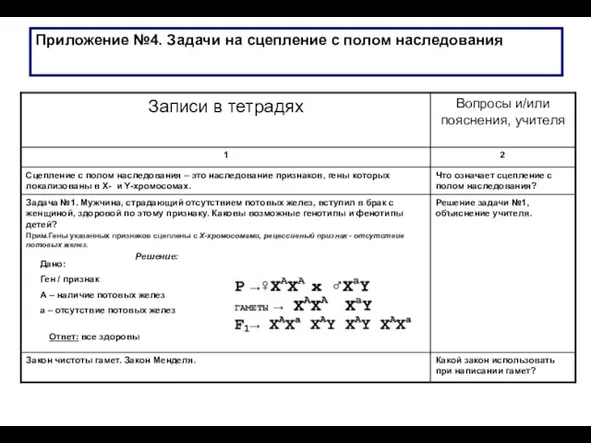 Задачи на сцепление с полом наследования. (Приложение 4)
Задачи на сцепление с полом наследования. (Приложение 4) Нәсілдердің қалыптасуы
Нәсілдердің қалыптасуы Человек
Человек Основные направления эволюции
Основные направления эволюции Плесневые грибы. Дрожжи
Плесневые грибы. Дрожжи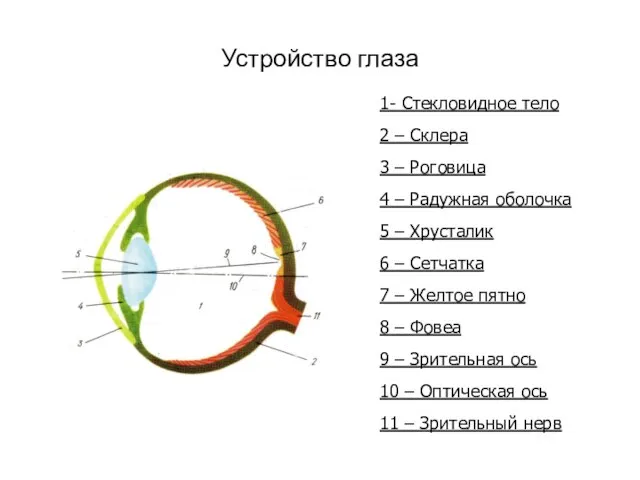 Устройство глаза
Устройство глаза Презентация на тему СТРУКТУРА И ФУНКЦИИ ХРОМОСОМ
Презентация на тему СТРУКТУРА И ФУНКЦИИ ХРОМОСОМ Общая вирусология. Бактериофаги
Общая вирусология. Бактериофаги Бесполое и половое размножение. Мужская и женская половые системы
Бесполое и половое размножение. Мужская и женская половые системы Электрофорез. Введение в теорию электрофореза
Электрофорез. Введение в теорию электрофореза Презентация на тему "Нарушения речи" - скачать бесплатно презентации по Биологии
Презентация на тему "Нарушения речи" - скачать бесплатно презентации по Биологии Презентация Природные ресурсы и охрана природы
Презентация Природные ресурсы и охрана природы Многоклеточные (Metazoa)
Многоклеточные (Metazoa) Викторина Зимушка-зима
Викторина Зимушка-зима Жидкое, а не вода, Белое, а не снег. Выполнила: Никулина Галина Ивановна Учитель начальных классов МОУ «СОШ №4» г.Энгельс
Жидкое, а не вода, Белое, а не снег. Выполнила: Никулина Галина Ивановна Учитель начальных классов МОУ «СОШ №4» г.Энгельс Ботаника. ОГЭ по биологии
Ботаника. ОГЭ по биологии Анатомо-физиологические особенности органа зрения у собак и кошек
Анатомо-физиологические особенности органа зрения у собак и кошек Стандартизация и оценка соответствия малины и ежевики
Стандартизация и оценка соответствия малины и ежевики Бронхи и лёгкие человека
Бронхи и лёгкие человека ГМО Генетически модифицированный организм
ГМО Генетически модифицированный организм