Изучение влияния ЭМИ РЧ (2,4 ггц) от роутера системы беспроводной связи на репродуктивные показатели клеточной гибели в яичниках
- Главная
- Биология
- Изучение влияния ЭМИ РЧ (2,4 ггц) от роутера системы беспроводной связи на репродуктивные показатели клеточной гибели в яичниках

Содержание
- 2. Использование источников электромагнитного излучения: сотовая связь, компьютеры беспроводные средства доступа в интернет и других, максимально приближенных
- 3. Материалы и методы Эксперименты были проведены на лабораторных линиях Drosophila melanogaster. Drosophila melanogaster была выбрана как
- 4. Hsp22 содержит ген белка GFP под контролем эндогенных промоторов генов стресс-ответа, что позволяет проводить детекцию неблагоприятных
- 5. Схема исследования воздействия ЭМИ на репродуктивные показатели дрозофил первого-третьего поколений (F1-F3) После синхронизации популяций D. melanogaster
- 6. Для анализа динамики вылета проводилось ежедневное отслеживание состояния мух в определенное время суток. При разделении дрозофил
- 7. Морфология яйцевых трубок Drosophila melanogaster линии Hsp22, содержащихся в условиях постоянного воздействия ЭМИ роутера Wi-Fi; стрелки
- 8. Результаты При анализе облученных дрозофил линии Canton-S потомства F1 было отмечено достоверное увеличение количества куколок на
- 9. В поколении F1 дрозофил линии Hsp22 количество апоптотических клеток в яичниках дрозофил группы «облучение» превысило контрольные
- 10. Заключение В ходе научно-исследовательской работы проведены эксперименты по оценке репродуктивных показателей двух линий D. Melanogaster ,
- 12. Скачать презентацию
Использование источников электромагнитного излучения: сотовая связь, компьютеры беспроводные средства доступа в
Использование источников электромагнитного излучения: сотовая связь, компьютеры беспроводные средства доступа в
Цель: изучение влияния ЭМИ РЧ (2,4 ГГц) от роутера системы беспроводной связи Wi-Fi на репродуктивные показатели и уровень клеточной гибели в яичниках D. melanogaster.
Материалы и методы
Эксперименты были проведены на лабораторных линиях Drosophila melanogaster.
Drosophila
Материалы и методы
Эксперименты были проведены на лабораторных линиях Drosophila melanogaster.
Drosophila
имеет идентичные клеточные функции в клетках насекомых и в клетках млекопитающих;
геном Drosophila melanogaster полностью отсеквенирован, причем значительная часть генов является ортологами генов млекопитающих, что предполагает общность механизмов ответных реакций на воздействие стресс – факторов у насекомых и человека;
насекомые, а особенно Drosophila melanogaster более устойчивы к определенным видам стресса (таким, как, например, ЭМИ);
имеет короткий жизненный цикл, чем млекопитающие (около 12 суток);
можем наблюдать влияние стрессового фактора на потомство в течении нескольких дней, что является явным преимуществом использования Drosophila melanogaster в экспериментах в сравнении с другими биологическими моделями;
небольшая продолжительность жизни (до 3 месяцев) позволяет исследователям получать достаточно большое количество данных за сравнительно небольшой период времени.
Hsp22
содержит ген белка GFP под контролем эндогенных промоторов генов стресс-ответа, что
Hsp22
содержит ген белка GFP под контролем эндогенных промоторов генов стресс-ответа, что
Canton-S
Линия Canton-S является диким типом и более конкурентоспособной по сравнению с трансгенными линиями. Помимо этого, особи данной линии быстрее вступают в спаривание и дольше спариваются, а также имеют более высокую двигательную активность .
В качестве экспериментальных групп были выбраны линии
Схема исследования воздействия ЭМИ на репродуктивные показатели дрозофил первого-третьего поколений (F1-F3)
Схема исследования воздействия ЭМИ на репродуктивные показатели дрозофил первого-третьего поколений (F1-F3)
После синхронизации популяций D. melanogaster линий Canton-S и Hsp22 вылетевших мух подсчитывали, разделяли по полу. Формировали контрольную и экспериментальную группы. Контрольная группа содержалась в стандартных комнатных условиях.
Экспериментальная группа подвергалась постоянному (на протяжении получения поколения мух F1-F3) влиянию ЭМИ РЧ 2,4 ГГц от роутера Wi-Fi в стандартных комнатных условиях.
Для анализа динамики вылета проводилось ежедневное отслеживание состояния мух в определенное
Для анализа динамики вылета проводилось ежедневное отслеживание состояния мух в определенное
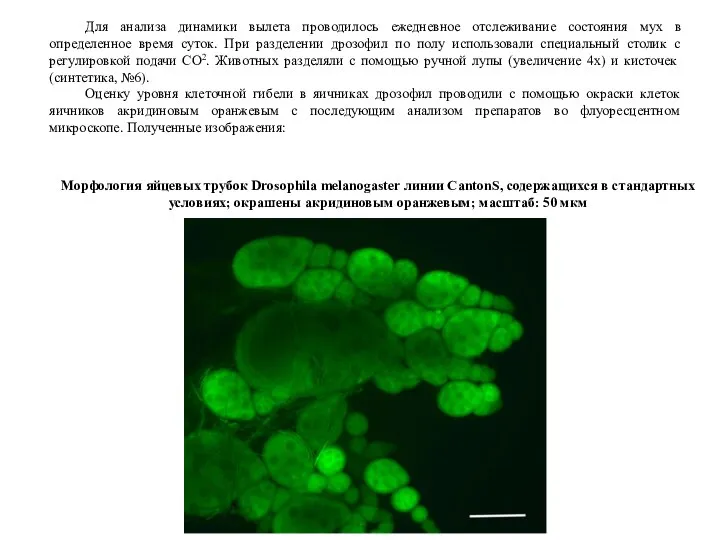
Оценку уровня клеточной гибели в яичниках дрозофил проводили с помощью окраски клеток яичников акридиновым оранжевым с последующим анализом препаратов во флуоресцентном микроскопе. Полученные изображения:
Морфология яйцевых трубок Drosophila melanogaster линии CantonS, содержащихся в стандартных условиях; окрашены акридиновым оранжевым; масштаб: 50 мкм
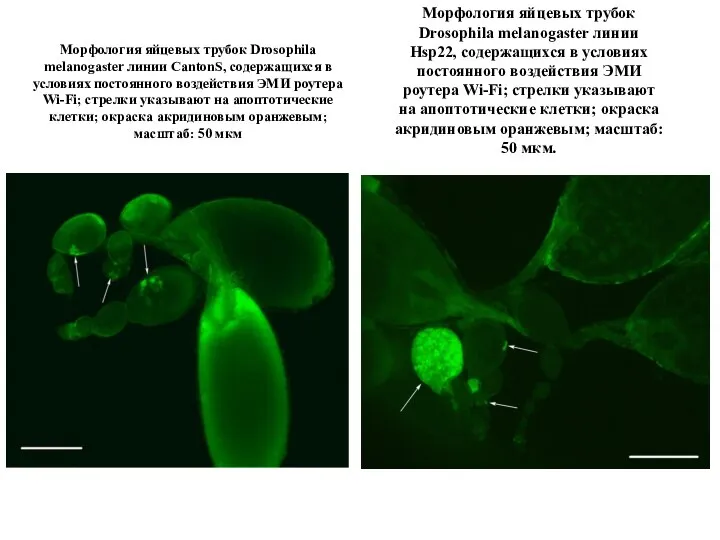
Морфология яйцевых трубок Drosophila melanogaster линии Hsp22, содержащихся в условиях постоянного
Морфология яйцевых трубок Drosophila melanogaster линии Hsp22, содержащихся в условиях постоянного
Морфология яйцевых трубок Drosophila melanogaster линии CantonS, содержащихся в условиях постоянного воздействия ЭМИ роутера Wi-Fi; стрелки указывают на апоптотические клетки; окраска акридиновым оранжевым; масштаб: 50 мкм
Результаты
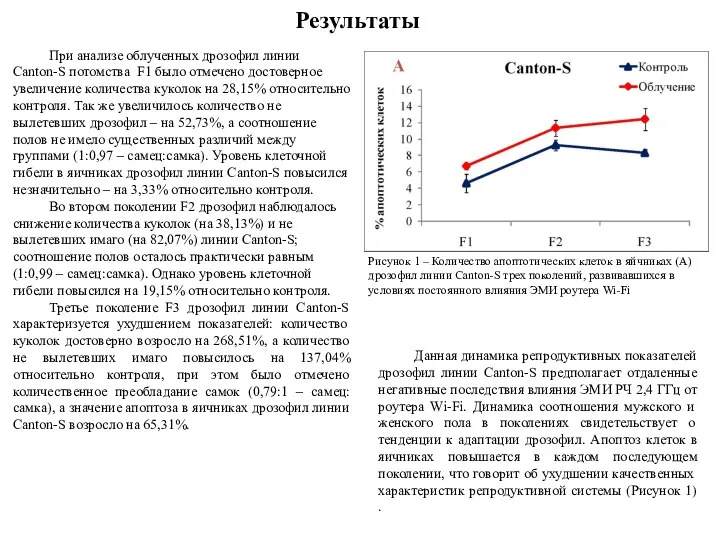
При анализе облученных дрозофил линии Canton-S потомства F1 было отмечено достоверное
Результаты
При анализе облученных дрозофил линии Canton-S потомства F1 было отмечено достоверное
Во втором поколении F2 дрозофил наблюдалось снижение количества куколок (на 38,13%) и не вылетевших имаго (на 82,07%) линии Canton-S; соотношение полов осталось практически равным (1:0,99 – самец:самка). Однако уровень клеточной гибели повысился на 19,15% относительно контроля.
Третье поколение F3 дрозофил линии Canton-S характеризуется ухудшением показателей: количество куколок достоверно возросло на 268,51%, а количество не вылетевших имаго повысилось на 137,04% относительно контроля, при этом было отмечено количественное преобладание самок (0,79:1 – самец:самка), а значение апоптоза в яичниках дрозофил линии Canton-S возросло на 65,31%.
Рисунок 1 – Количество апоптотических клеток в яйчниках (А) дрозофил линии Canton-S трех поколений, развивавшихся в условиях постоянного влияния ЭМИ роутера Wi-Fi
Данная динамика репродуктивных показателей дрозофил линии Canton-S предполагает отдаленные негативные последствия влияния ЭМИ РЧ 2,4 ГГц от роутера Wi-Fi. Динамика соотношения мужского и женского пола в поколениях свидетельствует о тенденции к адаптации дрозофил. Апоптоз клеток в яичниках повышается в каждом последующем поколении, что говорит об ухудшении качественных характеристик репродуктивной системы (Рисунок 1) .
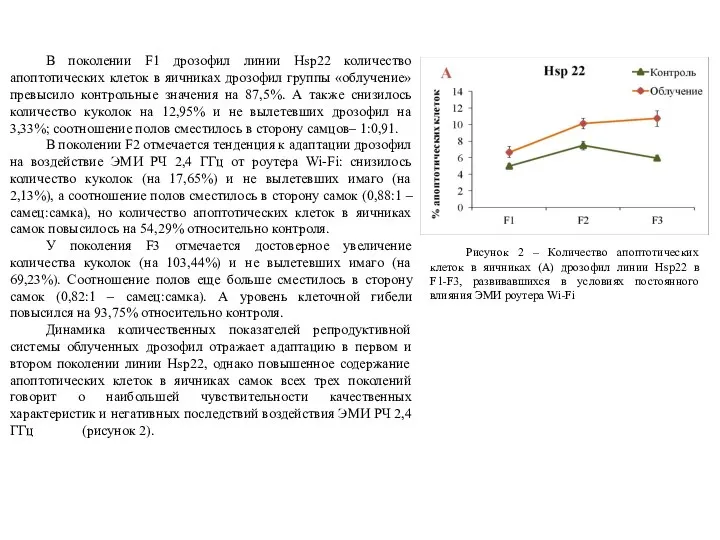
В поколении F1 дрозофил линии Hsp22 количество апоптотических клеток в яичниках
В поколении F1 дрозофил линии Hsp22 количество апоптотических клеток в яичниках
В поколении F2 отмечается тенденция к адаптации дрозофил на воздействие ЭМИ РЧ 2,4 ГГц от роутера Wi-Fi: снизилось количество куколок (на 17,65%) и не вылетевших имаго (на 2,13%), а соотношение полов сместилось в сторону самок (0,88:1 – самец:самка), но количество апоптотических клеток в яичниках самок повысилось на 54,29% относительно контроля.
У поколения F3 отмечается достоверное увеличение количества куколок (на 103,44%) и не вылетевших имаго (на 69,23%). Соотношение полов еще больше сместилось в сторону самок (0,82:1 – самец:самка). А уровень клеточной гибели повысился на 93,75% относительно контроля.
Динамика количественных показателей репродуктивной системы облученных дрозофил отражает адаптацию в первом и втором поколении линии Hsp22, однако повышенное содержание апоптотических клеток в яичниках самок всех трех поколений говорит о наибольшей чувствительности качественных характеристик и негативных последствий воздействия ЭМИ РЧ 2,4 ГГц (рисунок 2).
Рисунок 2 – Количество апоптотических клеток в яичниках (А) дрозофил линии Hsp22 в F1-F3, развивавшихся в условиях постоянного влияния ЭМИ роутера Wi-Fi
Заключение
В ходе научно-исследовательской работы проведены эксперименты по оценке репродуктивных показателей двух
Заключение
В ходе научно-исследовательской работы проведены эксперименты по оценке репродуктивных показателей двух
Динамика репродуктивных показателей дрозофил линии Canton-S предполагает отдаленные негативные последствия влияния ЭМИ РЧ 2,4 ГГц от роутера Wi-Fi. Значительное повышение уровня клеточной гибели в яичниках было отмечено у дрозофил линии Hsp22. Количество апоптотических клеток в яичниках повышается в каждом последующем поколении, что говорит об ухудшении качественных характеристик репродуктивной системы.
Гибель клеток имеет большое значение в процессе эмбрионального развития, так как активно включается в формирование морфофункциональных систем организма. Апоптозу принадлежит ведущая роль в ремоделировании тканей в процессе эмбриогенеза, при котором клеток образуется намного больше, чем требуется. Это обуславливает адаптационный процесс – избавление организма от поврежденных клеток, восстановление качественного состава популяции.
В подтверждение теории о сохранении популяции, находящейся в негативных условиях, во втором и третьем поколениях дрозофил всех экспериментальных линий наблюдается тенденция к увеличению количества самок в потомстве.
При анализе взаимосвязи изменения уровня апоптоза в клетках яичников и репродуктивных показателей особей D. melanogaster, содержащихся в условиях постоянного влияния ЭМИ РЧ (2,4 ГГц) была отмечена прямая зависимость повышения плодовитости и смертности потомства на стадии развития куколки с увеличением количества апоптотических клеток в яичниках самок дрозофил.




 Кто такие насекомые
Кто такие насекомые Өсімдік ауруын анықтау
Өсімдік ауруын анықтау Создай свой питомник
Создай свой питомник Sex Dimorphism of C. aurantimaculata
Sex Dimorphism of C. aurantimaculata Вирусы. Строение, жизненные циклы и значение вирусов
Вирусы. Строение, жизненные циклы и значение вирусов Dierentuin van Antwerpen
Dierentuin van Antwerpen Презентация по биологии Органы пищеварения
Презентация по биологии Органы пищеварения  Рост и развитие животных
Рост и развитие животных МБОУ «Самусьский лицей» ЗАТО Северск Томская область Урок биологии в 6 классе учитель Борзунова Ольга Анатольевна
МБОУ «Самусьский лицей» ЗАТО Северск Томская область Урок биологии в 6 классе учитель Борзунова Ольга Анатольевна Керунг
Керунг Зоогигиенические условия содержания животных в неволе 1
Зоогигиенические условия содержания животных в неволе 1 3D-био принтирование. НИО (медико-биологических исследований)
3D-био принтирование. НИО (медико-биологических исследований) Кормление яичных кур
Кормление яичных кур Тема «Общая характеристика грибов» Цель:определить место грибов в системе органического мира
Тема «Общая характеристика грибов» Цель:определить место грибов в системе органического мира Происхождение растений. Основные этапы развития растительного мира
Происхождение растений. Основные этапы развития растительного мира Билатеральные. Первичноротые
Билатеральные. Первичноротые Предмет и методы генетики
Предмет и методы генетики Строение и жизнедеятельность бактерий
Строение и жизнедеятельность бактерий 3. Тканини
3. Тканини Мейоз
Мейоз Задачи, методы и достижения БИОТЕХНОЛОГИИ
Задачи, методы и достижения БИОТЕХНОЛОГИИ  Соколоподібні
Соколоподібні Виды рыб
Виды рыб Тема урока: «Способы добывания пищи» разработка Жарковой Валентины Петровны МОУ СОШ №1 р.п. Лысые Горы Саратовской области
Тема урока: «Способы добывания пищи» разработка Жарковой Валентины Петровны МОУ СОШ №1 р.п. Лысые Горы Саратовской области  Молекулярный уровень организации жизни
Молекулярный уровень организации жизни «Коацерватная теория» (авторы теории) Александр Опарин
«Коацерватная теория» (авторы теории) Александр Опарин  Мочекаменная болезнь
Мочекаменная болезнь  «Архимед» в изучении биологии и химии
«Архимед» в изучении биологии и химии