Культивирование клеточных культур(растений и животных). Методы, виды и типы сред для культивирования
- Главная
- Биология
- Культивирование клеточных культур(растений и животных). Методы, виды и типы сред для культивирования

Содержание
- 2. Клеточная культура — это клетки (как правило, клетки животных или человека, принадлежащие одной ткани), выращиваемые обычно
- 4. Выделение клеток из тканей
- 5. Основное оборудование для культуральных работ Ламинарный шкаф CO2-инкубатор
- 6. Разновидности клеточных культур В лабораторной практике наиболее распространены раковые клетки. Они не имеют предела числа делений,
- 7. Для получения культуры «нормальных» клеток Леонард Хейфлик выделял клетки из абортивного материала и обнаружил наличие предела
- 8. Некоторым компромиссом между раковыми и нормальными являются иммортализованные клетки: полученные из нормальной ткани, они приобрели способность
- 9. Наиболее распространенными культурами дифференцированных клеток являются первичные клеточные культуры — клетки, выделенные из зрелой ткани и
- 10. Биобанки
- 11. Методы трансфекции и трансдукции
- 12. Схема получения и микрофотография колонии эмбриональных стволовых клеток (ЭСК) Эмбриональные клетки (~100 шт) получают на 5–9
- 13. Индуцированные плюрипотентные стволовые клетки (ИПСК) Клетки взрослого организма получают путем биопсии, после чего их трансфецируют набором
- 14. Применение Схема технологического процесса производства вакцин. Для биореактора клетки из флакона сначала размножают, для чего обычно
- 15. Биотехнологическое производство белков Аналогично вирусам клетки могут производить и отдельные белки, но, в отличие от вирусов,
- 16. Схема процесса производства антител — гибридомная технология. B-клетки, производящие антитела, получают из селезенки иммунизированных мышей. Далее
- 17. Клеточная терапия Схема трансплантации аутологичных (своих) кроветворных СК из костного мозга (КМ) и периферической крови. СК
- 18. Среды для культивирования клеток Метод культивирования клеток и тканей находит применение в биотехнологии, молекулярной и клеточной
- 19. Основные компоненты культуральной среды Компоненты, обеспечивающие буферную систему культуральной среды. Культивируемые клетки сильно реагируют на изменение
- 20. Белки и пептиды Наиболее часто используемыми белками и пептидами является альбумин, трансферрин и фибронектин; они особенно
- 21. Среда MEM (Minimum Essential Medium), или среда Игла была разработана Гари Иглом и является наиболее распространенной
- 23. Скачать презентацию
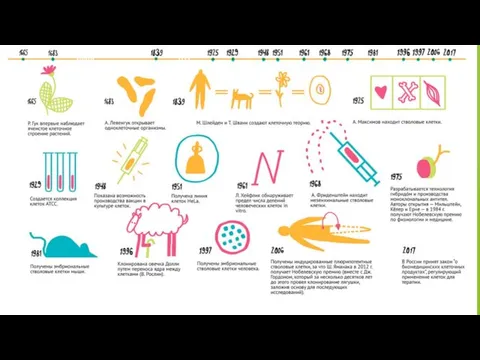
Клеточная культура — это клетки (как правило, клетки животных или человека,
Клеточная культура — это клетки (как правило, клетки животных или человека,
Большая часть медико-биологических исследований проводится на клетках in vitro (то есть, не на живом организме, а на клетках «в пробирке»). Клетки используют в качестве модельного биологического объекта в научных исследованиях, при тестировании и производстве лекарств. Кроме этого, ученые научились исправлять генетические ошибки в клетках и наделять их способностью противостоять некоторым заболеваниям, что служит основой для медицинских технологий будущего — генной и клеточной терапий.
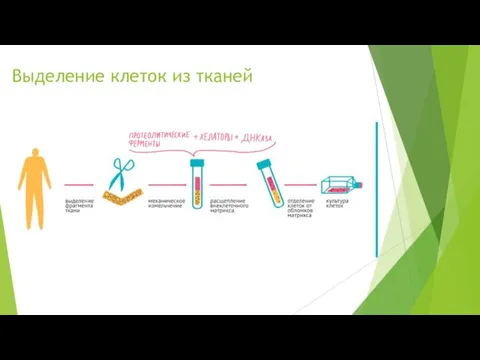
Выделение клеток из тканей
Выделение клеток из тканей
Основное оборудование для культуральных работ
Ламинарный шкаф
CO2-инкубатор
Основное оборудование для культуральных работ
Ламинарный шкаф
CO2-инкубатор
Разновидности клеточных культур
В лабораторной практике наиболее распространены раковые клетки. Они не
Разновидности клеточных культур
В лабораторной практике наиболее распространены раковые клетки. Они не
Для получения культуры «нормальных» клеток Леонард Хейфлик выделял клетки из абортивного
Для получения культуры «нормальных» клеток Леонард Хейфлик выделял клетки из абортивного
Некоторым компромиссом между раковыми и нормальными являются иммортализованные клетки: полученные из
Некоторым компромиссом между раковыми и нормальными являются иммортализованные клетки: полученные из
Дифференцированные клетки (которые приобрели свою конечную специализацию) составляют бoльшую часть клеток организма и практически не делятся. Будучи основными составляющими и «рабочими лошадками» во всех органах и тканях, они служат мишенью действия большинства лекарств, что делает их весьма востребованными для исследований. В культуре их можно получить путем направленной дифференцировки плюрипотентых стволовых клеток в нужный тип клеток, однако этот путь имеет существенные технические и, в случае человеческих клеток, еще и этические сложности.
Наиболее распространенными культурами дифференцированных клеток являются первичные клеточные культуры — клетки,
Наиболее распространенными культурами дифференцированных клеток являются первичные клеточные культуры — клетки,
Биобанки
Биобанки
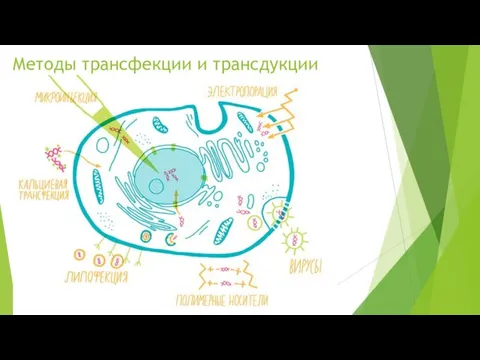
Методы трансфекции и трансдукции
Методы трансфекции и трансдукции
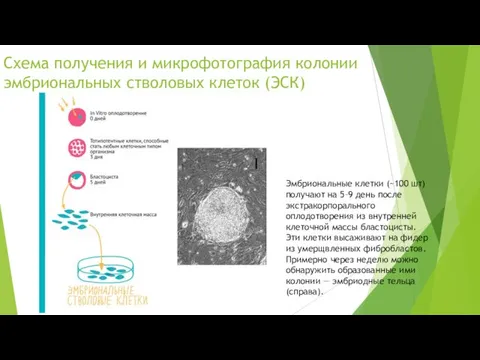
Схема получения и микрофотография колонии эмбриональных стволовых клеток (ЭСК)
Эмбриональные клетки (~100
Схема получения и микрофотография колонии эмбриональных стволовых клеток (ЭСК)
Эмбриональные клетки (~100
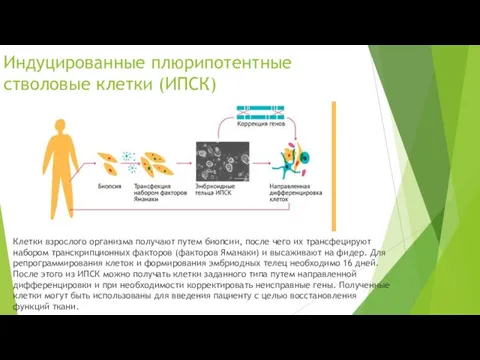
Индуцированные плюрипотентные стволовые клетки (ИПСК)
Клетки взрослого организма получают путем биопсии, после
Индуцированные плюрипотентные стволовые клетки (ИПСК)
Клетки взрослого организма получают путем биопсии, после
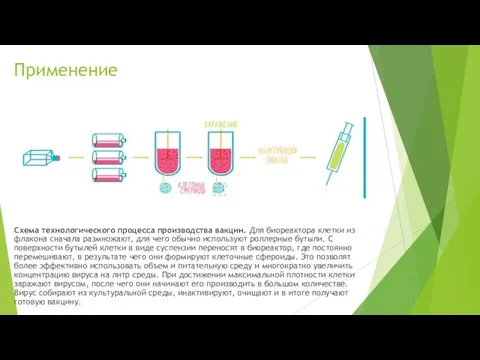
Применение
Схема технологического процесса производства вакцин. Для биореактора клетки из флакона
Применение
Схема технологического процесса производства вакцин. Для биореактора клетки из флакона
Биотехнологическое производство белков
Аналогично вирусам клетки могут производить и отдельные белки, но,
Биотехнологическое производство белков
Аналогично вирусам клетки могут производить и отдельные белки, но,
Схема процесса производства антител — гибридомная технология. B-клетки, производящие антитела, получают
Схема процесса производства антител — гибридомная технология. B-клетки, производящие антитела, получают
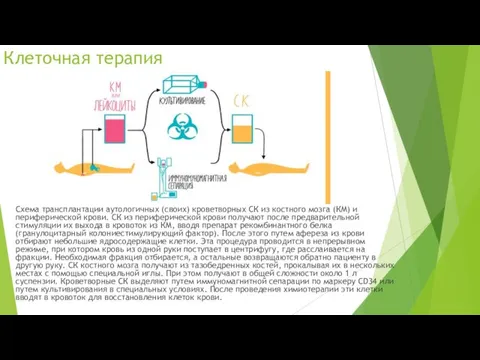
Клеточная терапия
Схема трансплантации аутологичных (своих) кроветворных СК из костного мозга (КМ)
Клеточная терапия
Схема трансплантации аутологичных (своих) кроветворных СК из костного мозга (КМ)
Среды для культивирования клеток
Метод культивирования клеток и тканей находит применение в
Среды для культивирования клеток
Метод культивирования клеток и тканей находит применение в
Среда для культивирования клеток состоит из определенного соотношения аминокислот, витаминов, солей, глюкозы, гормонов, факторов прикрепления, факторов роста; поддерживает буферную систему и осмотическое давление.
Основные компоненты культуральной среды
Компоненты, обеспечивающие буферную систему культуральной среды.
Культивируемые клетки сильно
Основные компоненты культуральной среды
Компоненты, обеспечивающие буферную систему культуральной среды.
Культивируемые клетки сильно
Соли
Неорганические соли поддерживают осмотическое давление в среде и помогают в регуляции мембранного потенциала, обеспечивая среду ионами натрия, калия и кальция. Осмоляльность среды так же важна, как уровень рН при культивировании клеток. Оптимальное значение осмоляльности лежит в пределах 260-340 мосмоль/кг в зависимости от типа культивируемых клеток.
Аминокислоты
Аминокислоты являются строительным материалом для белков; незаменимые аминокислоты всегда входят в состав культуральной среды. Особенно важен L-глутамин; обеспечивает азотом НАД, НАДФН и нуклеотиды, являясь вторичным источником энергии для метаболизма клетки. Заменимые аминокислоты также иногда добавляются в культуральную среду.
Углеводороды
Большинство сред включают в себя глюкозу и галактозу как источник энергии для клеток.
Белки и пептиды
Наиболее часто используемыми белками и пептидами является альбумин, трансферрин
Белки и пептиды
Наиболее часто используемыми белками и пептидами является альбумин, трансферрин
Жиры и жирные кислоты
Особенно важны при бессывороточном культивировании, так как сыворотка обычно содержит их.
Витамины
Многие витамины необходимы для клеточного роста и пролиферации. В культуральную среду обычно добавляют рибофлавин, тиамин и биотин.
Добавки
Наиболее важным компонентом культуральной среды является сыворотка; она добавляется перед применением, примерно 5-10 %. Сыворотка представляет собой смесь альбуминов, факторов роста и ингибиторов роста; является источником витаминов, аминокислот, белков, углеводородов, жиров, микроэлементов, факторов роста. Наиболее часто используют бычью и телячью эмбриональную сыворотку. Факторы роста, цитокины, гормоны добавляются в культуральную среду для пролиферации и активации клеток. Антибиотики добавляются для предотвращения контаминации культуральной среды бактериями и грибами; однако антибиотики не предотвращают заражение культуральной среды микоплазмой.
Среда MEM (Minimum Essential Medium), или среда Игла была разработана Гари
Среда MEM (Minimum Essential Medium), или среда Игла была разработана Гари
Среда DMEM (Dulbecco′s Modified Eagle′s Medium) является модификацией среды BME (Basal Medium Eagle) и содержит в четыре раза больше аминокислот и витаминов, а также различные добавки, улучшающие рост клеток. Изначально среда DMEM была с содержанием глюкозы 1г/л и применялась для культивирования эмбриональных клеток мыши. Затем появились модификации среды DMEM (с высоким и пониженным содержанием глюкозы, пирувата натрия, различных добавок) для культивирования клеток различных типов, в том числе нетрансформированных клеток и гибридом. Среда DMEM является наиболее распространенной средой для культивирования клеток наряду со средой MEM.
Среда DMEM/F-12 в соотношении 1:1 применяется для выращивания широкого спектра клеточных культур. Изначально среда F12 была разработана для бессывороточного культивирования СНО клеток, клеток легких и мышиных L-клеток. В связи с богатым содержанием питательных веществ в среду DMEM/F12 можно добавлять относительно небольшое количество эмбриональной бычьей сыворотки (FBS–fetal bovine serum), либо использовать без сыворотки, но тогда необходимо добавлять такие факторы, как инсулин, трансферин, эпидермиальный фактор роста и др..
Среда RPMI-1640 была разработана в Roswell Park Memorial Institute (откуда и берет свое название) в 1966 Муром и его коллегами для культивирования лейкоцитов. В настоящее время используется для широкого спектра клеточных культур.













 Эволюция выделительной системы
Эволюция выделительной системы Подсолнух – живой символ моей малой Родины
Подсолнух – живой символ моей малой Родины Отряд Аистообразные
Отряд Аистообразные Пищеварение в желудке и двенадцатиперстной кишке. Действие ферментов
Пищеварение в желудке и двенадцатиперстной кишке. Действие ферментов Статическая биохимия. Ферменты. Механизм действия. Регуляция. Классификация. (Лекция 2)
Статическая биохимия. Ферменты. Механизм действия. Регуляция. Классификация. (Лекция 2) Самые необычные животные мира
Самые необычные животные мира Питательные среды
Питательные среды Строение двудольного растения
Строение двудольного растения Проект Берегите птиц
Проект Берегите птиц Презентация на тему "Соцветия" - скачать презентации по Биологии
Презентация на тему "Соцветия" - скачать презентации по Биологии Презентация на тему "Эти загадочныЕ и интересныЕ Е" - скачать презентации по Биологии
Презентация на тему "Эти загадочныЕ и интересныЕ Е" - скачать презентации по Биологии Комнатные растения в загадках
Комнатные растения в загадках Многоклеточные животные. Беспозвоночные. Тип Губки
Многоклеточные животные. Беспозвоночные. Тип Губки Тип молюски
Тип молюски Какие биологические особенности насекомых дали им возможность широкого распространения в природе? Как вы думаете ,хорошо ли, что
Какие биологические особенности насекомых дали им возможность широкого распространения в природе? Как вы думаете ,хорошо ли, что  Сенсорика. Общая характеристика органов чувств
Сенсорика. Общая характеристика органов чувств Піпа звичайна
Піпа звичайна Разнообразен и прекрасен мир растений Мхи, водоросли, папоротники, плауны И семенные: сосны, туя, пихты, ели
Разнообразен и прекрасен мир растений Мхи, водоросли, папоротники, плауны И семенные: сосны, туя, пихты, ели  Соцветия 6 класс
Соцветия 6 класс Биотехнология
Биотехнология Кто ты, кислый лимон? выполнила: ученица 2 «А» класса МОУ СОШ №12 КУЛЫМАНОВА ИРИНА Руководитель: учитель начальных классов Б
Кто ты, кислый лимон? выполнила: ученица 2 «А» класса МОУ СОШ №12 КУЛЫМАНОВА ИРИНА Руководитель: учитель начальных классов Б Останки мамонтов, найденные на территории России
Останки мамонтов, найденные на территории России ПЛАСТИНЧАТЫЕ И ГУБКИ
ПЛАСТИНЧАТЫЕ И ГУБКИ Презентация на тему Весеннее пробуждение растений
Презентация на тему Весеннее пробуждение растений  Общая характеристика червей. Тип Плоские черви
Общая характеристика червей. Тип Плоские черви Автор Лазарева О. В.
Автор Лазарева О. В.  Органы чувств
Органы чувств Грибы. Общая характеристика грибов. Шляпочные грибы
Грибы. Общая характеристика грибов. Шляпочные грибы