Содержание
- 2. План лекции: Принципы классификации белков; Характеристика простых белков; Характеристика сложных белков;
- 3. Принципы классификации белков по форме белковых молекул глобулярные , фибриллярные по молекулярной массе низкомолекулярные, высокомолекулярные по
- 4. по структурным признакам и химическому составу: простые и сложные. по локализации в организме белки крови ,
- 5. Классификация белков по форме белковых молекул: Глобулярные Соотношение продольной и поперечной осей менее 1:10 (миоглобин, гемоглобин)
- 6. Классификация белков по выполняемым функциям : Ферменты – специализированные белки, ускоряющие течение химических реакций; Регуляторные белки
- 7. Семейства белков – группы белков, имеющие гомологичные последовательности аминокислот и выполняющие родственные функции Семейство сериновых протеаз;
- 8. Классификация белков по структурным признакам и химическому составу Простые белки представлены только полипептидной цепью, состоящей из
- 9. Простые белки гистоны протамины альбумины глобулины проламины и глютелины протеиноиды
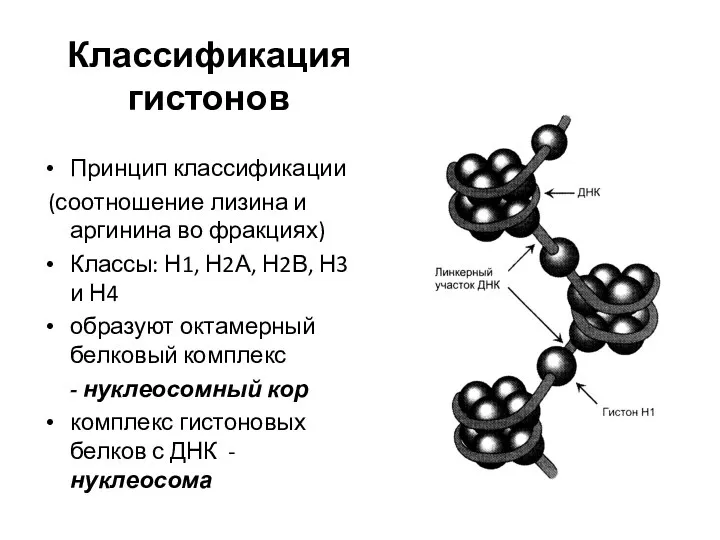
- 10. Гистоны - тканевые белки, связанные с ДНК хроматина. Признаки гистонов: небольшая молекулярная масса; поликатионные белки (pI
- 11. Классификация гистонов Принцип классификации (соотношение лизина и аргинина во фракциях) Классы: Н1, Н2А, Н2В, Н3 и
- 12. Функции гистонов Структурная (участвуют в стабилизации пространственной структуры ДНК); 2. Регуляторная (способность блокировать передачу генетической информации
- 13. Протамины - своеобразные биологические заменители гистонов, но отличаются от них составом и структурой. самые низкомолекулярные белки
- 14. Альбумины белки относительно небольшой молекулярной массы (15-70 тыс. Да); имеют отрицательный заряд и кислые свойства (ИЭТ
- 15. Функции альбуминов поддержание осмотического давления крови (около 75-80 % осмотического давления крови приходится на долю альбуминов)
- 16. Глобулины белки с большей, чем альбумины молекулярной массой слабокислые или нейтральные белки (ИЭТ = 6 –
- 17. Проламины и глютелины. группа растительных белков, которые содержатся исключительно в клейковине семян злаковых растений, где выполняют
- 18. Протеиноиды белки опорных тканей ( костей, хрящей, сухожилий, связок ) выделяют: кератины - белки производных кожи;
- 19. Группы сложных белков (в зависимости от химической природы небелковой части) хромопротеины углевод – белковые комплексы липид
- 20. Хромопротеины – это сложные белки, простетическая часть которых представлена окрашенным компонентом (от греч. Chromos – краска)
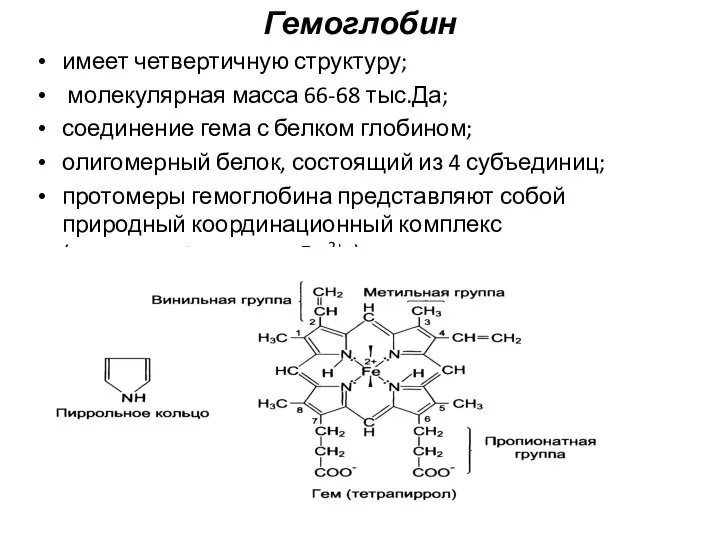
- 21. Гемоглобин имеет четвертичную структуру; молекулярная масса 66-68 тыс.Да; соединение гема с белком глобином; олигомерный белок, состоящий
- 22. Функция гемоглобина Транспорт газов Кислород (оксигемоглобин) Углекислый газ (карбгемоглобин) Угарный газ (карбоксигемоглобин)
- 23. Типы гемоглобинов Физиологические (отличаются друг от друга набором полипептидных цепей или субъединиц, образующихся на разных этапах
- 24. Миоглобин белок, имеющий третичную структуру. Функции: транспорт кислорода внутри клетки к митохондриям, запасание кислорода в тканях
- 25. УГЛЕВОД – БЕЛКОВЫЕ КОМПЛЕКСЫ комплексы белков с небелковой частью, представленной углеводными компонентами. Виды: ГЛИКОПРОТЕИНЫ ПРОТЕОГЛИКАНЫ
- 26. Гликопротеины - это сложные белки, содержащие олигосахаридные (гликановые) цепи, ковалентно связанные с белковой основой Короткие углеводные
- 27. Функции гликопротеинов : Рецепторная Транспортная осуществляют транспорт гидрофобных веществ и ионов металлов. функцию переносчика железа выполняет
- 28. ПРОТЕОГЛИКАНЫ Это углевод-белковые комплексы, углеводный компонент которых представлен гетерополисахаридами, построенными из большого числа повторяющихся единиц. Белки
- 29. Функции протеогликанов: являются структурными компонентами межклеточного матрикса; играют важную роль в межклеточных взаимодействиях - являясь полианионами
- 30. ЛИПИД – БЕЛКОВЫЕ КОМПЛЕКСЫ. Это комплексы белков с липидными компонентами, их условно подразделяют на: Свободные липопротеины
- 31. Нуклеопротеины – это сложные белки, небелковая часть которых представлена нуклеиновыми кислотами. нуклеопротеины делятся по составу на
- 32. Номенклатура наиболее распространенных нуклеотидов. РИБОНУКЛЕОЗИДМОНОФОСФАТЫ: Аденозинмонофосфат ( АМФ ), адениловая кислота. Гуанозинмонофосфат ( ГМФ ), гуаниловая
- 34. Фосфопротеины – это сложные белки, содержащие в своем составе в качестве простетической части фосфорную кислоту. Фосфорная
- 36. Скачать презентацию































 Гуморальная регуляция физиологических функций организма
Гуморальная регуляция физиологических функций организма Перелёты птиц. Презентация учителя биологии МБОУ СОШ села Ближнее Борисово Кстовского района Нижегородской области Телицыной Ел
Перелёты птиц. Презентация учителя биологии МБОУ СОШ села Ближнее Борисово Кстовского района Нижегородской области Телицыной Ел Земноводные - амфибии
Земноводные - амфибии  Органы чувств человека
Органы чувств человека Возникновение жизни или абиогенез
Возникновение жизни или абиогенез Презентация на тему Негативное влияние шума на здоровье человека
Презентация на тему Негативное влияние шума на здоровье человека Удивительные факты о пищеварительной системе человека
Удивительные факты о пищеварительной системе человека БИОЛОГИЧЕСКИ АКТИВНЫЕ ДОБАВКИ
БИОЛОГИЧЕСКИ АКТИВНЫЕ ДОБАВКИ Презентация на тему Животные. Брачные обряды
Презентация на тему Животные. Брачные обряды Полимеразная цепная реакция и ее использование в вирусологии
Полимеразная цепная реакция и ее использование в вирусологии Эмбриология. Периоды развития организма
Эмбриология. Периоды развития организма Молекулярная биология. Работа в лаборатории
Молекулярная биология. Работа в лаборатории Липиды. Углеводы. Витамины
Липиды. Углеводы. Витамины Птицы
Птицы  Зимующие птицы
Зимующие птицы Усложнения в Эволюции. Формы отбора. Помехоустойчивость. Искусственный отбор
Усложнения в Эволюции. Формы отбора. Помехоустойчивость. Искусственный отбор Обмен веществ. Обменные процессы в организме
Обмен веществ. Обменные процессы в организме Поведение животных
Поведение животных Гаметогенез. Виды и строение гамет
Гаметогенез. Виды и строение гамет Жители Инсектария
Жители Инсектария Ядовитые растения Нижегородской области
Ядовитые растения Нижегородской области Презентация на тему "Тип Кольчатые черви. Класс Малощетинковые" - скачать презентации по Биологии
Презентация на тему "Тип Кольчатые черви. Класс Малощетинковые" - скачать презентации по Биологии МОУ гимназия №56 Работа ученицы 3 класса «А» Касымовой Раи
МОУ гимназия №56 Работа ученицы 3 класса «А» Касымовой Раи Дән массасындағы жүретін микроорганизмдердің өмір тіршілігі
Дән массасындағы жүретін микроорганизмдердің өмір тіршілігі Tessuto osseo
Tessuto osseo Диффузия үрдісінде (сұйық пен газдың) қозғалуын зерттеу. Өсімдік жасушаларында осмос құбылысын зерттеу
Диффузия үрдісінде (сұйық пен газдың) қозғалуын зерттеу. Өсімдік жасушаларында осмос құбылысын зерттеу Презентация на тему "Мутагены" - скачать бесплатно презентации по Биологии
Презентация на тему "Мутагены" - скачать бесплатно презентации по Биологии Презентация на тему Экосистема болота
Презентация на тему Экосистема болота