Содержание
- 4. Основные характеристики метаболизма клеток млекопитающих Гетеротрофы Аэробы (факультативные или облигатные). Акцептором электронов являются органические вещества и
- 5. Функции метаболизма Аккумулирование энергии в макроэргических связях АТФ. Использование энергии АТФ для биосинтеза de novo молекул
- 6. Все механизмы регуляции направлены на поддержание гомеостаза и адаптацию к изменяющимся условиям внешней и внутренней среды
- 7. Взаимосвязь обменов: Углеводы – липиды: «Лишние» углеводы обеспечивают синтез липидов (образование глицерол-3- фосфата, ацетил-КоА, НАДФН) глицерин
- 8. Взаимосвязь обменов: Белки – липиды: Запас нейтральных липидов предотвращает использование белков на энергетические нужды. Аминокислоты ?
- 9. Взаимосвязь обменов Белки – углеводы: Гликогенные аминокислоты (кроме лиз и лей) Основной путь синтеза заменимых аминокислот
- 10. Роль нуклеотидов в обмене веществ Адениловые нуклеотиды обеспечивают энергетический потенциал клеток УТФ участвует в обмене углеводов
- 11. Этапы энергетического обмена 1. Крупные «пищевые» молекулы гидролизуются до мономеров: аминокислот, жирных кислот, моносахаров. 2. Специфические
- 12. Унификация клеточного «топлива» В процессе основных путей катаболизма - гликолиза, окислительного дезаминирования, β – окисления, ЦТК
- 13. Основные этапы адаптации организма к голоданию Суточная потребность в энергетических ресурсах в зависимости от физической нагрузки
- 14. Адаптация к голоданию Голодание (равно как любой стресс или диабет) приводит к повышению уровня катехоламинов, глюкагона,
- 15. 1- ая фаза голодания (1сутки) На начальном этапе уровень глюкозы крови (особенно важный для нейронов и
- 16. 2- ая фаза голодания (1 –ая неделя) Гормональная ситуация приводит к адаптивному переключению энергетического обмена с
- 17. 3 – я фаза голодания (1 – 3 месяца) Усиление кетогенеза предотвращает использование аминокислот (Но! метаболический
- 18. Биоэнергетика изучает процессы превращения энергии в живом организме. Биологическое окисление (тканевое дыхание) – процессы, протекающие с
- 19. История учения о биоокислении 18 век, А.Лавуазье: « Дыхание – медленное горение» 1920 - е г.,
- 20. История учения о биоокислении Биологическое окисление – отнятие водорода от субстратов и передача его через серию
- 21. Аккумулирование энергии в клетке: НАДН, ФАДН2, НАДФН АТФ (реже другие нуклеозидтрифосфаты) Внутренняя мембрана митохондрий, функционирующая как
- 22. НАДН, НАДФН, ФАДН2 Восстановленные эквиваленты образуются при окислении органических субстратов; НАДН и ФАДН2 реокисляются в дыхательной
- 23. Роль НАДФН в метаболизме 1. Восстановительные синтезы аминокислот, нуклеотидов, жирных кислот, холестерола, стероидов, желчных кислот. 2.
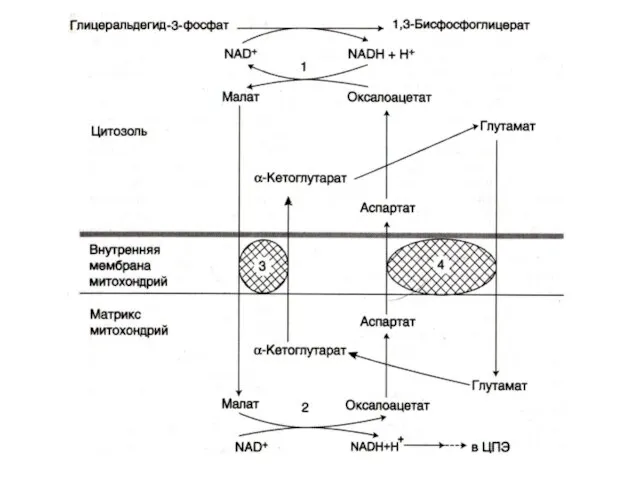
- 24. Челночные механизмы транспорта Восстановленные эквиваленты, образующиеся в цитозоле, например при окислении глицеральдегид- 3 фосфата попадают в
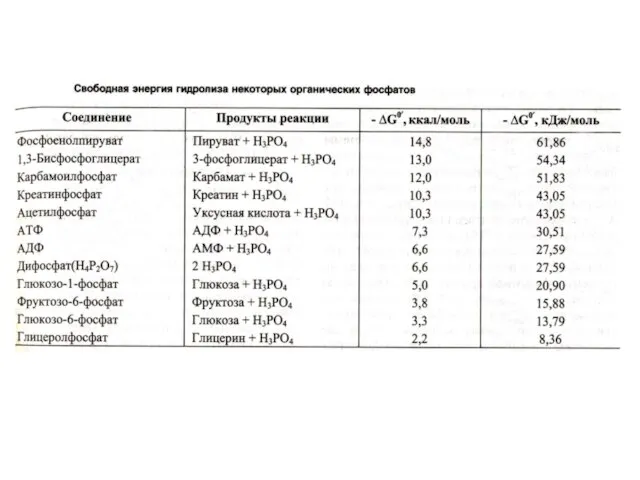
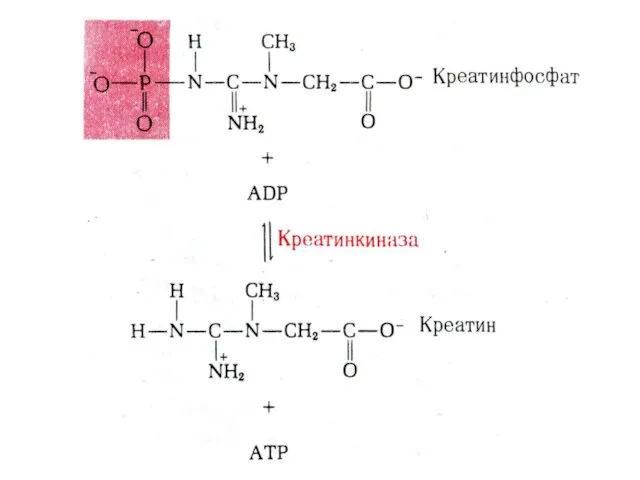
- 28. Почему именно адениловые нуклеотиды составляют энергетический потенциал клеток? Адениловые нуклеотиды более устойчивы к химическим и физическим
- 29. Содержание адениловых нуклеотидов к клетке АДФ + Ф? [АТФ]?АДФ + Фн (АМФ +ФФ) Синтез АТФ: субстратное
- 36. Гипотезы сопряжения окисления и фосфорилирования Липман, 1946г., Слэйтер, 1953г. Гипотеза химического сопряжения Перенос ē сопряжен с
- 37. Гипотеза химического сопряжения АН2 + В + Х ? А + ВН2 ∞Х ВН2 ∞ Х
- 38. Гипотеза конформационного сопряжения Бойер, 1964: Ленинджер, 1966; Грин, 1970г. Транспорт ē по внутренней мембране МХ вызывает
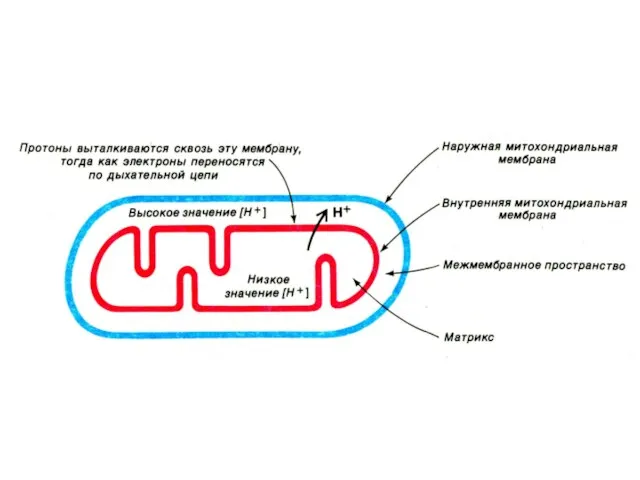
- 39. Хемиоосмотическая гипотеза Митчелл,1961 Перенос ē вдоль внутренней мембраны сопровождается выкачиванием Н+ из матрикса МХ в наружную
- 40. Доказательства хемиоосмотической гипотезы 1. В МХ нет высокоэнергетических посредников. связывающих перенос ē с биосинтезом АТФ. 2.
- 42. Дыхательная цепь ферментов осуществляет окислительно- восстановительные реакции, перенося ē от одной молекулы к другой и в
- 43. Структура дыхательной цепи МХ I комплекс: НАДН –КоQ дегидрогеназа: кофакторы FMN и Fe-S белки II комплекс:
- 44. Никотинамидные дегидрогеназы Более сотни субстратов окисляются через НАД. Основное количество НАДН образуется при окислении изоцитрата, малата,
- 45. Флавинзависимые дегидрогеназы Коферментную функцию выполняют ФМН или ФАД (производные рибофлавина) Прочно связаны с белковой частью ферментов.
- 46. Убихинон (КоQ) Повсеместно распространенное производное бензохинона. Гидрофобное, низкомолекулярное вещество, не связанное с белком (кофермент), способное мигрировать
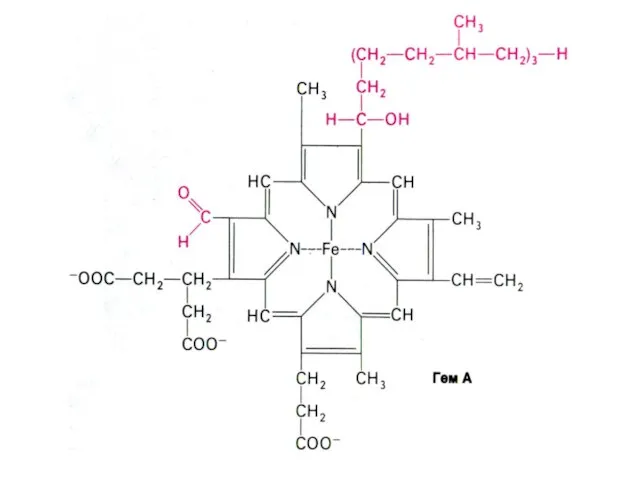
- 47. Цитохромы Гемсодержащие белки (15-45 кДа), простетические группы - гем b или a, отличающиеся строением боковых радикалов
- 48. Железосерные белки Низкомолекулярные белки, содержащие негемовое железо и неорганическую серу (2Fe -2S; 4Fe- 4S). Атом железа
- 49. Создание градиента ионов на внутренней мембране МХ Перенос ē по дыхательной цепи сопровождается закислением наружной среды
- 50. Дыхательная цепь ферментов Полная цепь системы МХ окисления: SH2 (изоцитрат, малат, гидроксиацилКоА, гидроксибутират, глутамат) ? никотинамидные
- 51. Транслоказы Кроме оксидоредуктаз дыхательной цепи во внутреннюю мембрану МХ встроена система переноса «клеточного топлива»: кетокислот, аминокислот.
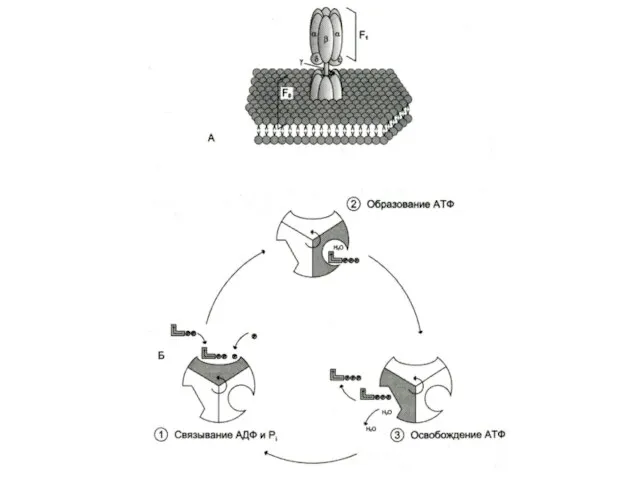
- 57. Строение АТФ – синтазы Н+ - АТФ –синтаза (АТФ-АЗА) V – комплекс дыхательной цепи Сложный белковый
- 59. Протонный градиент и пункты фосфорилирования Атомы водорода от окисляемых субстратов отдают ē в дыхательную цепь и
- 61. Соотношение дыхания и фосфорилирования 4ē + 4Н+ + О2 ? 2Н2О АДФ +Фн ? АТФ Эффективность
- 62. Дыхательный контроль ДК (дыхательный контроль) отражает зависимость интенсивности дыхания от концентрации АДФ. Измеряется полярографически по поглощению
- 63. Энергетический заряд клеток АТФ: АДФ:АМФ Энергетический заряд изменяется от 1 (если все адениловые нуклеотиды максимально фосфорилированы
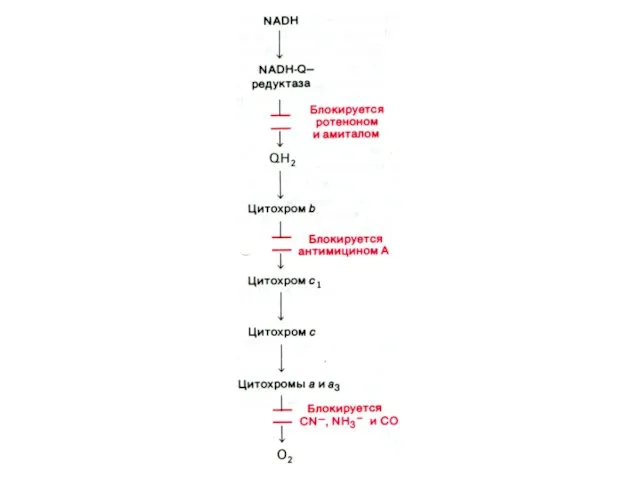
- 64. Ингибиторы дыхания На различных участках цепи передача ē блокируется специфическими веществами: барбитуратами, некоторыми гликозидами, антибиотиками, цианидами.
- 66. Ингибирование фосфорилирования Олигомицин блокирует Fo – субъединицу АТФ – синтетазы. Электрохимический градиент при этом не снижается,
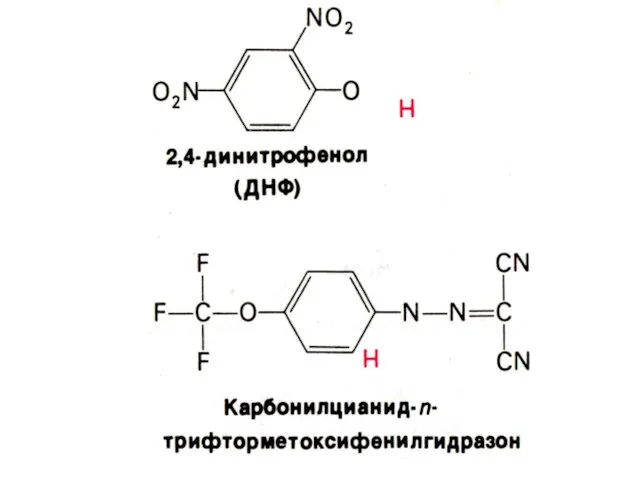
- 67. Разобщители дыхания и фосфорилирования Липофильные вещества, способные переносить протоны (протонофоры) и катионы (ионофоры) через внутреннюю мембрану,
- 69. Митохондриальная цепь окисления – источник активных форм кислорода 4Н+ + 4ē + О2 ? 2 Н2О
- 71. Скачать презентацию


























![Содержание адениловых нуклеотидов к клетке АДФ + Ф? [АТФ]?АДФ + Фн](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/512908/slide-28.jpg)

































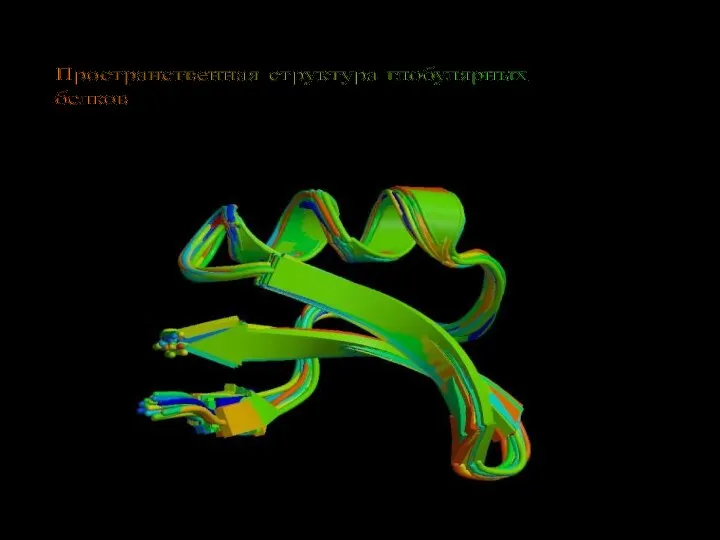 Пространственная структура глобулярных белков
Пространственная структура глобулярных белков Непрямое постэмбриональное развитие
Непрямое постэмбриональное развитие Аминокислоты и белки Строение и свойства.
Аминокислоты и белки Строение и свойства. Клеточное строение организма
Клеточное строение организма Переходные формы в эволюции Составила учитель биологии Логунцова Ю.В. Школа № 14 и гимназия № 2 г.Кимры, Тверская обл.
Переходные формы в эволюции Составила учитель биологии Логунцова Ю.В. Школа № 14 и гимназия № 2 г.Кимры, Тверская обл.  ТКАНИ И ОРГАНЫ ЧЕЛОВЕКА Урок по биологии 8 класс Учитель Жданова Оксана Викторовна
ТКАНИ И ОРГАНЫ ЧЕЛОВЕКА Урок по биологии 8 класс Учитель Жданова Оксана Викторовна  Ұлулар
Ұлулар Жираф
Жираф Млекопитающие. Летучая мышь
Млекопитающие. Летучая мышь Тепе - теңдік талдағышы. Тактильді талдағышы. Ауырсыну
Тепе - теңдік талдағышы. Тактильді талдағышы. Ауырсыну Презентация на тему "«ПИЩЕВАРЕНИЕ»" - скачать бесплатно презентации по Биологии
Презентация на тему "«ПИЩЕВАРЕНИЕ»" - скачать бесплатно презентации по Биологии «Овсяное «молочко» Мука овсяная для детского и диабетического питания.
«Овсяное «молочко» Мука овсяная для детского и диабетического питания. Презентация на тему Зимующие птицы
Презентация на тему Зимующие птицы  Сущность жизни и свойства живого вещества
Сущность жизни и свойства живого вещества Чувство кворума и альтруизм у бактерий
Чувство кворума и альтруизм у бактерий Тема: Редкие растения
Тема: Редкие растения  Общие представления о жизни
Общие представления о жизни Презентация на тему "Губки 7 класс" - скачать презентации по Биологии
Презентация на тему "Губки 7 класс" - скачать презентации по Биологии Генетическая безопасность агробиоценозов Выполнила студентка 4 курса Факультета естествознания Селянкина Юлия
Генетическая безопасность агробиоценозов Выполнила студентка 4 курса Факультета естествознания Селянкина Юлия  Биоценозы озер
Биоценозы озер АТФ и другие органические соединения клетки
АТФ и другие органические соединения клетки Рептилії. Чому плаче крокодил?
Рептилії. Чому плаче крокодил? Imunitātes veidi
Imunitātes veidi Презентация на тему "Отряд Воробьинообразные" - скачать бесплатно презентации по Биологии
Презентация на тему "Отряд Воробьинообразные" - скачать бесплатно презентации по Биологии Анализаторы. Органы чувств
Анализаторы. Органы чувств ВОЗНИКНОВЕНИЕ АДАПТАЦИЙ И ИХ ОТНОСИТЕЛЬНЫЙ ХАРАКТЕР ВЫПОЛНИЛА УЧИТЕЛЬ БИОЛОГИИ МОУ «МИРНЕНСКАЯ СОШ» УЙСКОГО РАЙОНА ЧЕЛЯБИНСКОЙ
ВОЗНИКНОВЕНИЕ АДАПТАЦИЙ И ИХ ОТНОСИТЕЛЬНЫЙ ХАРАКТЕР ВЫПОЛНИЛА УЧИТЕЛЬ БИОЛОГИИ МОУ «МИРНЕНСКАЯ СОШ» УЙСКОГО РАЙОНА ЧЕЛЯБИНСКОЙ Птички-синички
Птички-синички Презентация на тему
Презентация на тему