Содержание
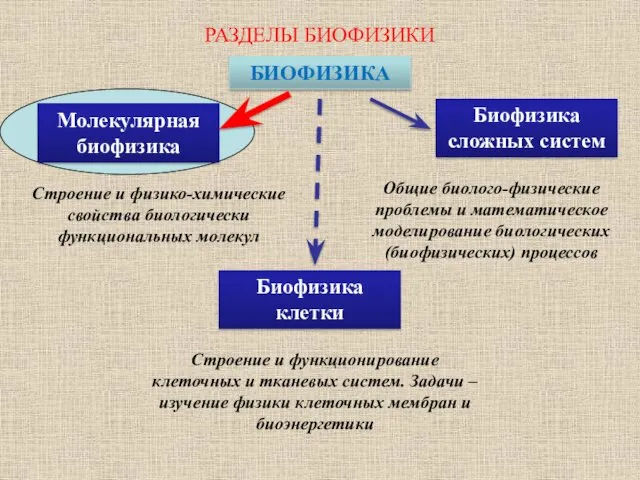
- 2. РАЗДЕЛЫ БИОФИЗИКИ БИОФИЗИКА Биофизика сложных систем Строение и физико-химические свойства биологически функциональных молекул Общие биолого-физические проблемы
- 3. Молекулярная биология (развитие генетики и цитологии) Объекты исследования: биологические молекулы (белки, нуклеиновые кислоты, углеводы), их строение
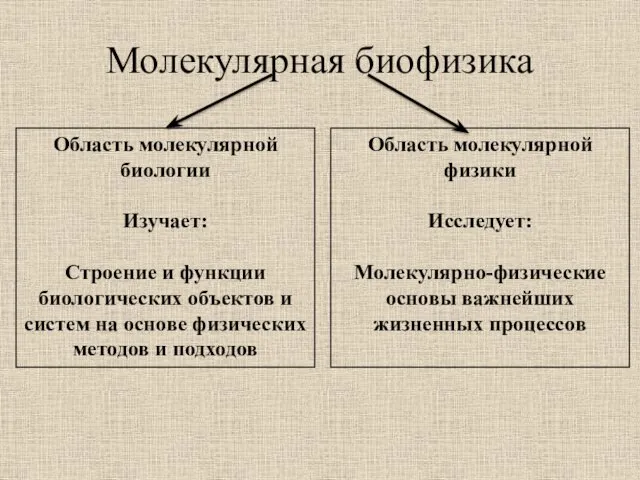
- 4. Молекулярная биофизика Область молекулярной биологии Изучает: Строение и функции биологических объектов и систем на основе физических
- 5. Биополимеры – это класс полимеров, встречающихся в природе в естественном виде и входящие в состав живых
- 6. Биополимеры обладают рядом особенностей: 1. Состоят из большого числа атомов 2. Имеют большое число функциональных групп
- 7. Подвижность полимеров может иметь статистический и детерминированный (механический) характер. Статистическая подвижность биополимера это варианты отдельных элементов
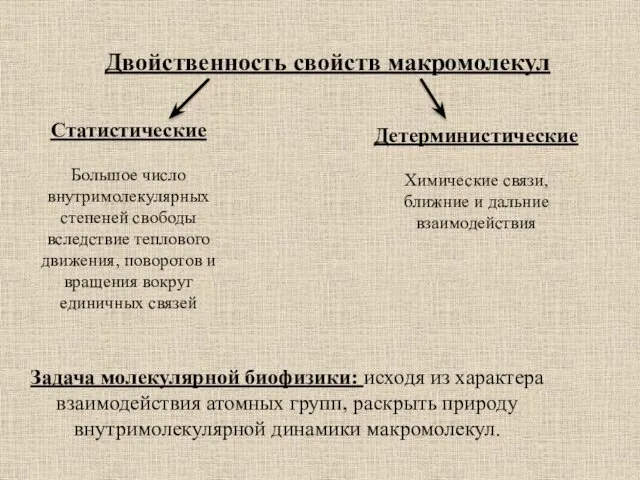
- 8. Двойственность свойств макромолекул Статистические Большое число внутримолекулярных степеней свободы вследствие теплового движения, поворотов и вращения вокруг
- 9. Гибкость полимерной цепи Прямолинейная конформация Конформация запутанного клубка Какова характерная форма молекулярной цепи в различных полимерных
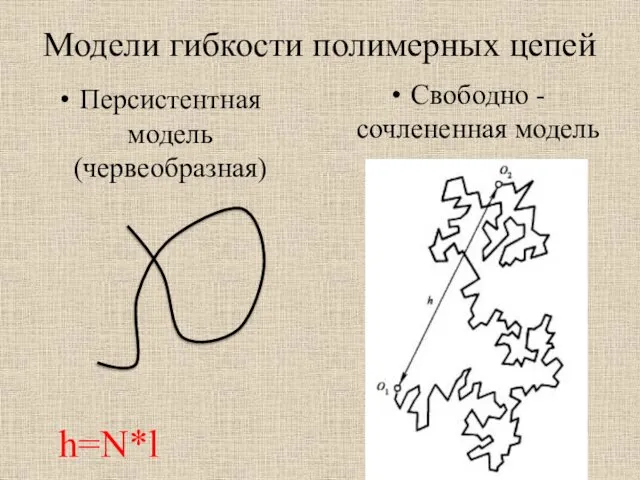
- 10. Модели гибкости полимерных цепей Персистентная модель (червеобразная) Свободно - сочлененная модель h=N*l
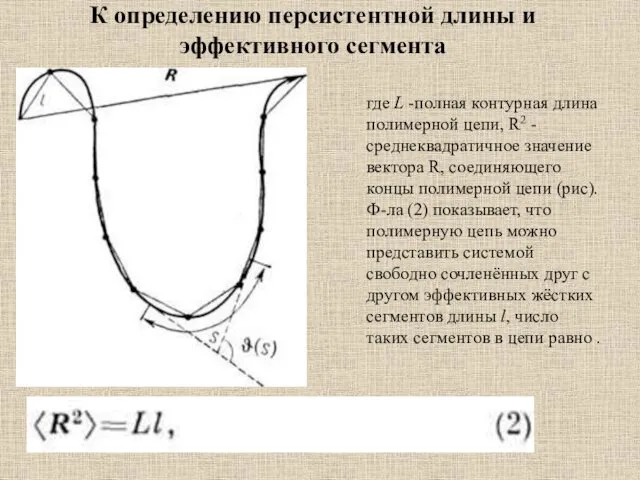
- 11. К определению персистентной длины и эффективного сегмента где L -полная контурная длина полимерной цепи, R2 -
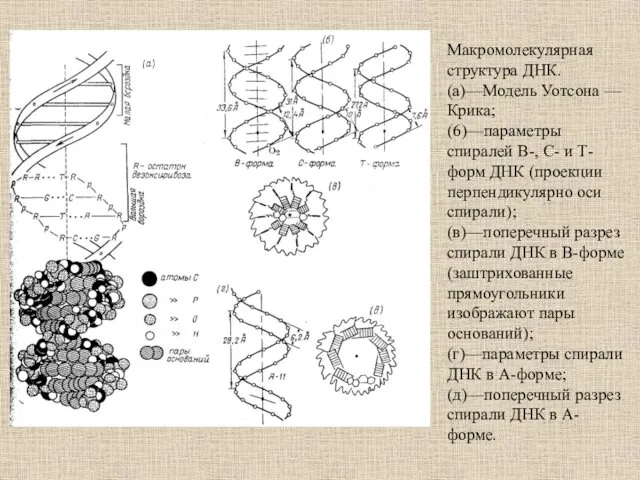
- 12. Макромолекулярная структура ДНК. (а)—Модель Уотсона — Крика; (6)—параметры спиралей В-, С- и Т-форм ДНК (проекции перпендикулярно
- 14. Полимерная цепь, где взаимодействуют только соседние звенья Клубок Свойства клубка Переход между конформациями в результате микроброуновского
- 15. Глобула с плотной сердцевиной Свойства глобулы Имеет структуру Сердцевина большой глобулы пространственно однородна с постоянной концентрацией
- 17. Переходы глобула-клубок (порядок-беспорядок) Происходят в относительно малом интервале температур – подобны фазовым переходам 1-го рода (напр.
- 18. Объёмные взаимодействия
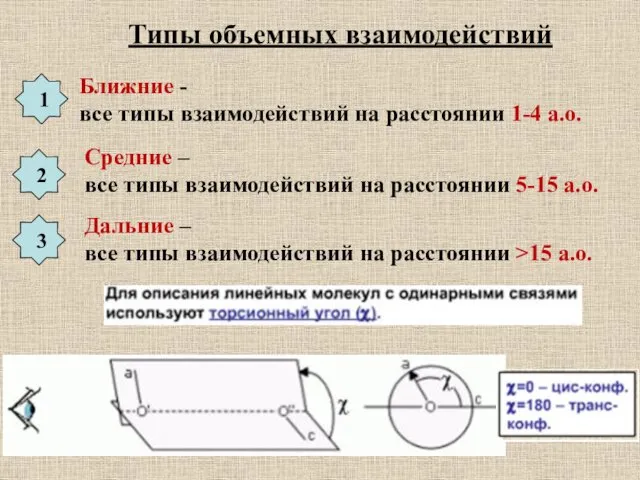
- 19. Типы объемных взаимодействий
- 21. Гидрофобные взаимодействия 4.
- 23. Водородная связь - разновидность донорно-акцепторной связи, невалентное взаимодействие между атомом водорода Н, ковалентно связанным с атомом
- 24. Особенностями водородной связи, по которым ее выделяют в отдельный вид, является: 1. Не очень высокая прочность
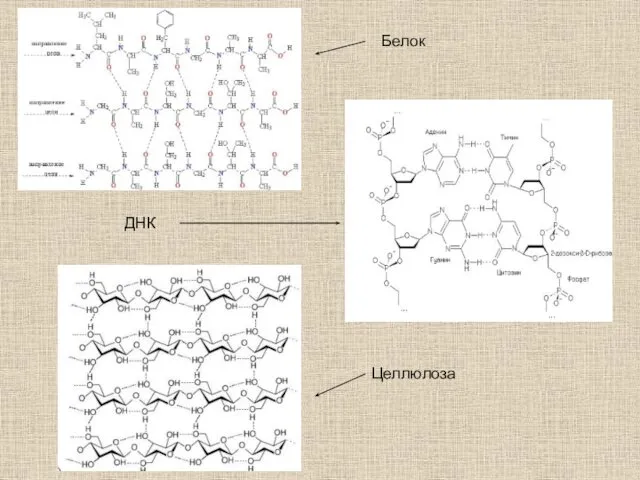
- 25. Белок ДНК Целлюлоза
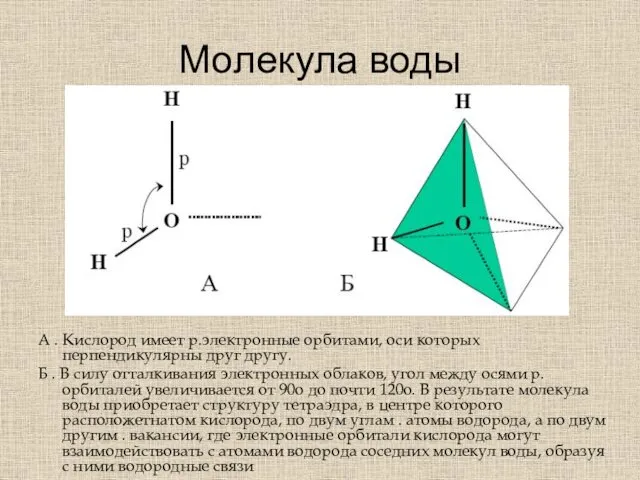
- 26. Молекула воды А . Кислород имеет р.электронные орбитами, оси которых перпендикулярны друг другу. Б . В
- 28. Свойства молекулы воды Полярная жидкость: значительный дипольный момент р~0,6*10-29 Клм; высокая диэлектрическая проницаемость ε~81 Между молекулами
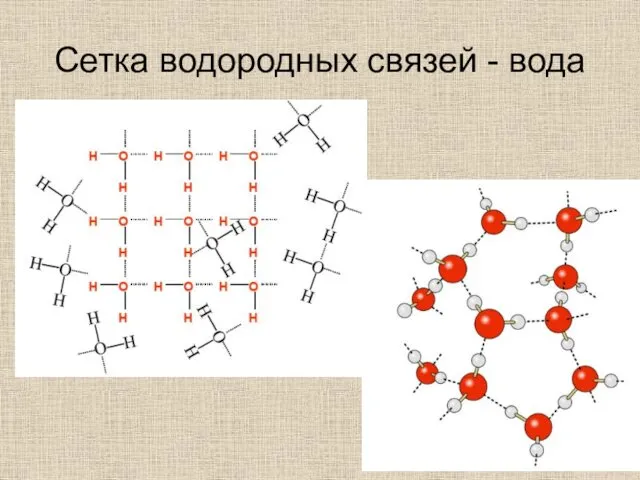
- 29. Сетка водородных связей - вода
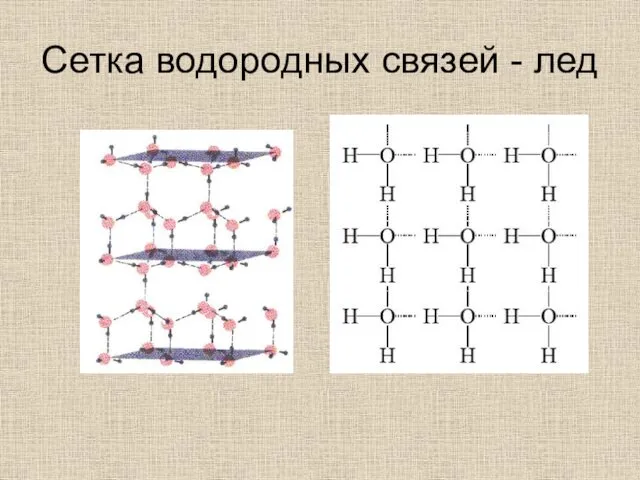
- 30. Сетка водородных связей - лед
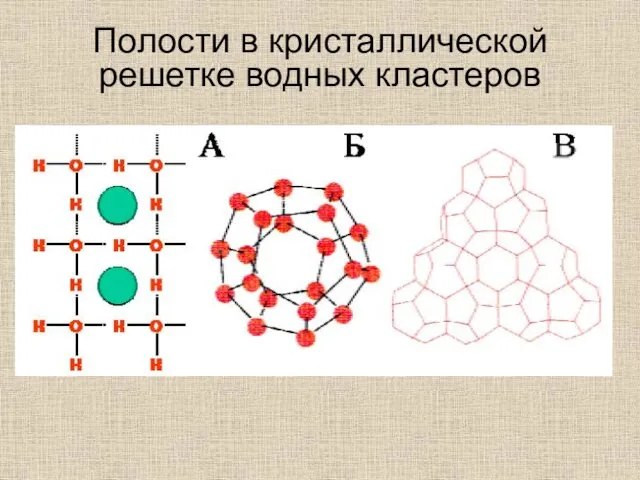
- 32. Полости в кристаллической решетке водных кластеров
- 33. Гидрофобные взаимодействия способствуют отталкиванию друг от друга неполярных незаряженных групп и молекул воды. Эти силы определяют
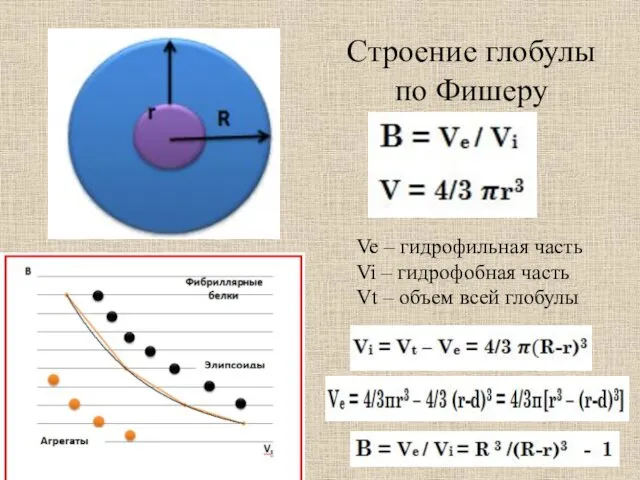
- 35. Строение глобулы по Фишеру Ve – гидрофильная часть Vi – гидрофобная часть Vt – объем всей
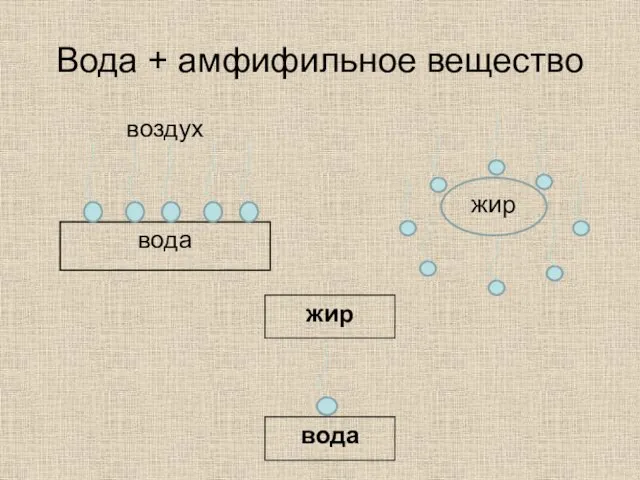
- 37. вещества Полярные= гидрофильные Неполярные = гидрофобные Амфифильные полярная «голова»+ неполярный «хвост»
- 38. вода-растворитель Полярное вещество →притяжение (диполь - дипольное взаимодействие) Неполярное вещество → отталкивание (искажения, разрыв Н-связей) Амфифильное
- 39. Вода + амфифильное вещество
- 40. Сферические мицеллы
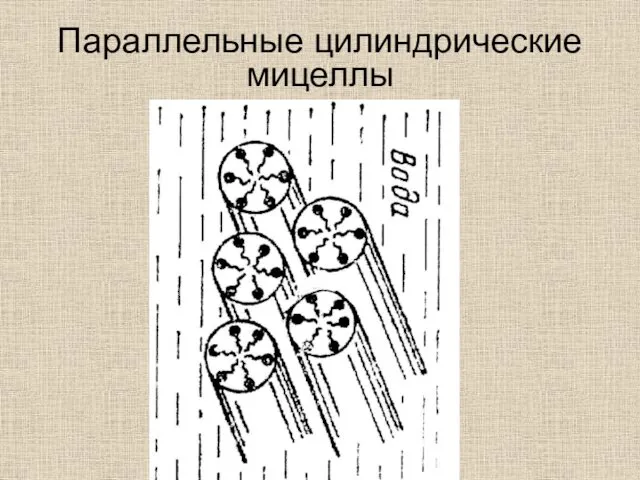
- 41. Параллельные цилиндрические мицеллы
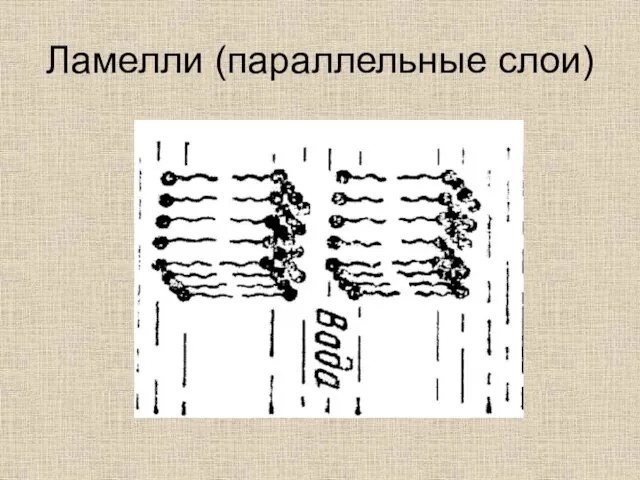
- 42. Ламелли (параллельные слои)
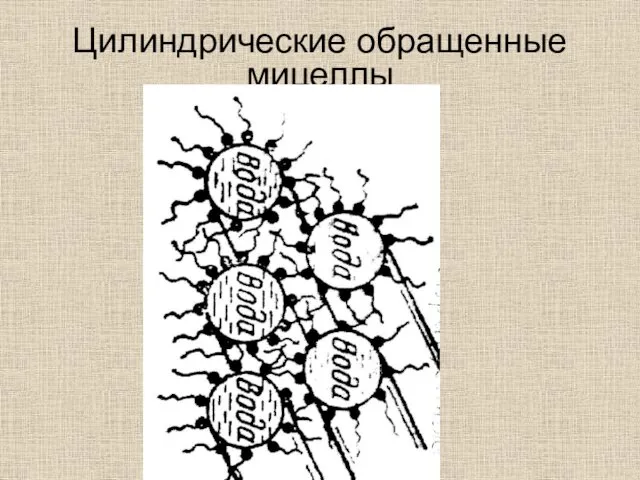
- 43. Цилиндрические обращенные мицеллы
- 44. Сферические мицеллы
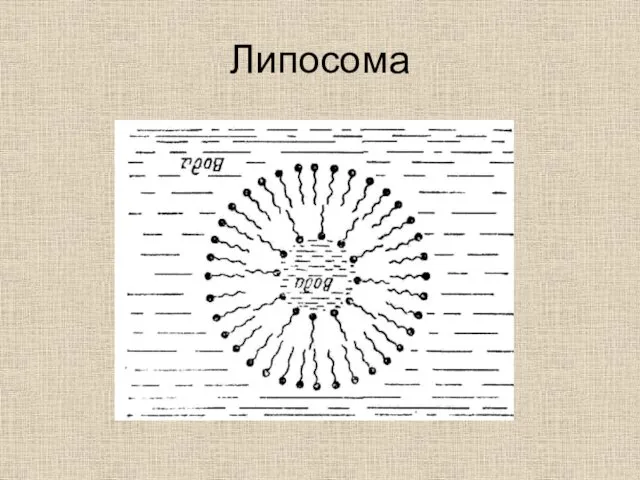
- 45. Липосома
- 46. Электростатические силы (разновидность – ионные взаимодействия) Электростатические взаимодействия образуются за счёт взаимодействия электростатически - заряженных групп
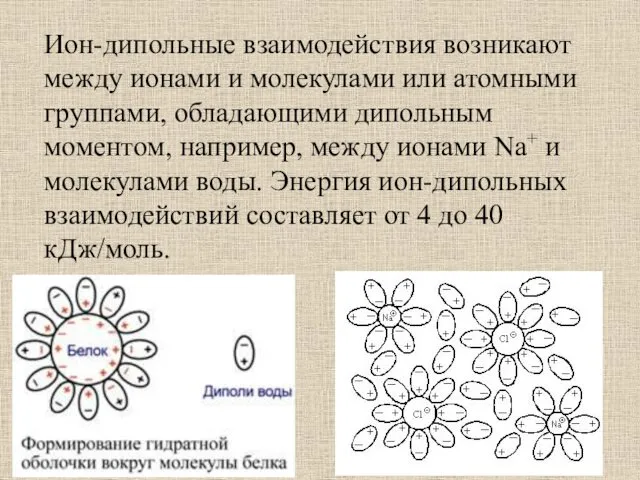
- 48. Ион-дипольные взаимодействия возникают между ионами и молекулами или атомными группами, обладающими дипольным моментом, например, между ионами
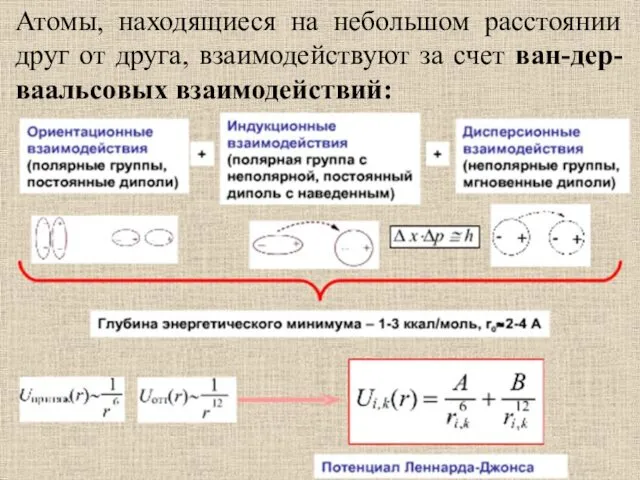
- 49. Атомы, находящиеся на небольшом расстоянии друг от друга, взаимодействуют за счет ван-дер-ваальсовых взаимодействий:
- 50. Ориентационные (диполь-дипольные) связи возникают между молекулами, обладающими дипольным моментом. Энергия диполь-дипольного взаимодействия равна:
- 51. Молекула, имеющая постоянный дипольный момент, способна индуцировать его в соседней молекуле. Энергия индукционного взаимодействия равна: Энергия
- 54. Конформация - такое распределение атомов в пространстве, которое можно изменить вращением вокруг одинарных связей (возможен разрыв
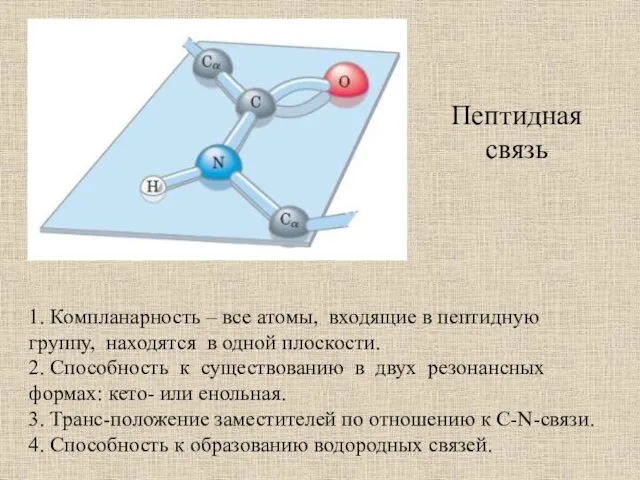
- 55. Пептидная связь 1. Компланарность – все атомы, входящие в пептидную группу, находятся в одной плоскости. 2.
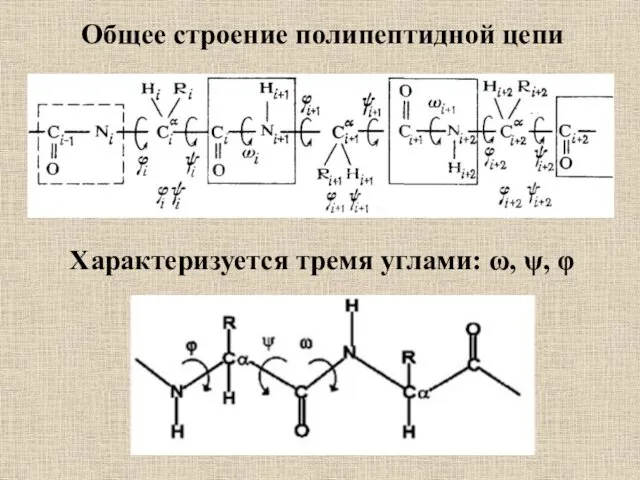
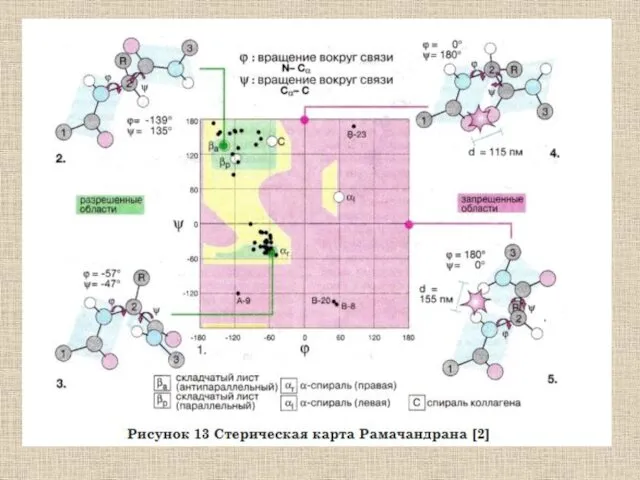
- 56. Общее строение полипептидной цепи Характеризуется тремя углами: ω, ψ, φ
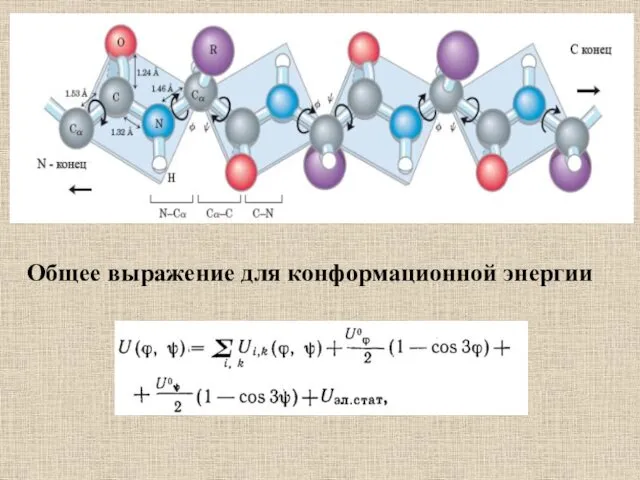
- 57. Общее выражение для конформационной энергии
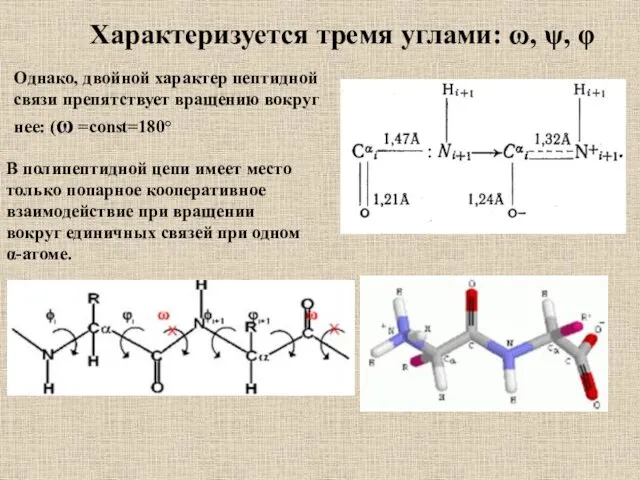
- 58. Характеризуется тремя углами: ω, ψ, φ Однако, двойной характер пептидной связи препятствует вращению вокруг нее: (ω
- 61. Скачать презентацию

































 Brain basics
Brain basics Снежный барс
Снежный барс Здоровое питание
Здоровое питание БИОЛОГИЧЕСКИЕ МЕМБРАНЫ
БИОЛОГИЧЕСКИЕ МЕМБРАНЫ Презентация на тему "Помогите мне увидеть мир" - скачать презентации по Биологии
Презентация на тему "Помогите мне увидеть мир" - скачать презентации по Биологии Физиология высшей нервной деятельности
Физиология высшей нервной деятельности Мутации Выполняла Нестерова Александра, ученица 10 «Б» класса МОУ СОШ №103
Мутации Выполняла Нестерова Александра, ученица 10 «Б» класса МОУ СОШ №103  Моно- полисинаптические рефлексы
Моно- полисинаптические рефлексы Главнейшие отряды насекомых. Отряд Жесткокрылые
Главнейшие отряды насекомых. Отряд Жесткокрылые Оомицеты Лутина Мария
Оомицеты Лутина Мария Презентация на тему "Биоэкология" - скачать презентации по Биологии
Презентация на тему "Биоэкология" - скачать презентации по Биологии Класс Млекопитающие (Звери)
Класс Млекопитающие (Звери) Тип Кольчатые черви
Тип Кольчатые черви Отдел Моховидные, особенности строения и жизнедеятельности. Значение мхов
Отдел Моховидные, особенности строения и жизнедеятельности. Значение мхов Можно ли жить без воды?
Можно ли жить без воды? Презентация к уроку в 11 классе Автор: Русак Ольга Петровна, учитель биологии Моу Сош № 5 г. Светлого у
Презентация к уроку в 11 классе Автор: Русак Ольга Петровна, учитель биологии Моу Сош № 5 г. Светлого у Өңдірістік практика есебі
Өңдірістік практика есебі Презентация на тему Еловый лес
Презентация на тему Еловый лес Презентация на тему "Кровь и деньги" - скачать презентации по Биологии
Презентация на тему "Кровь и деньги" - скачать презентации по Биологии Презентация на тему "Скелет" - скачать бесплатно презентации по Биологии
Презентация на тему "Скелет" - скачать бесплатно презентации по Биологии Центрально - черноземный государственный биосферный заповедник
Центрально - черноземный государственный биосферный заповедник Рослини червоної книги України
Рослини червоної книги України Кровь и кровообращение
Кровь и кровообращение Витамины. Основные признаки витаминов
Витамины. Основные признаки витаминов Экология организмов. (Лекция 3)
Экология организмов. (Лекция 3) Обмен веществ и превращение энергии Автор: Кошлай Галина Павловна Учитель биологии ГБОУ СОШ №3
Обмен веществ и превращение энергии Автор: Кошлай Галина Павловна Учитель биологии ГБОУ СОШ №3 Семейство паслёновые
Семейство паслёновые Зигмунд Фрейд основатель психоанализа
Зигмунд Фрейд основатель психоанализа