Содержание
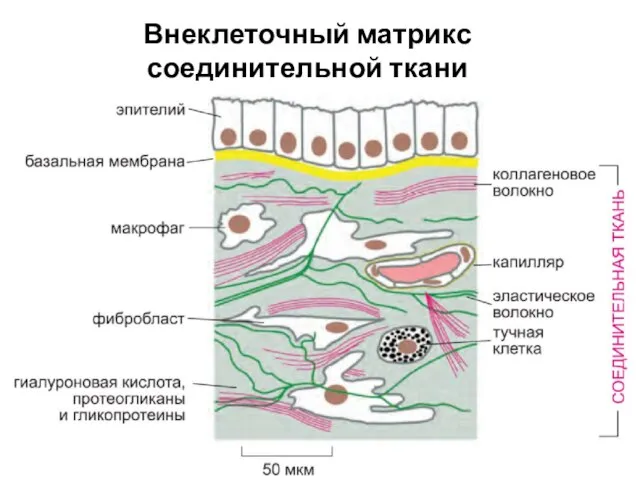
- 2. Внеклеточный матрикс соединительной ткани
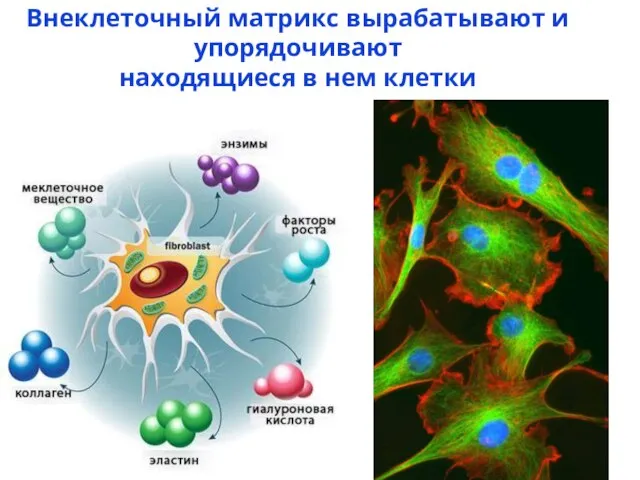
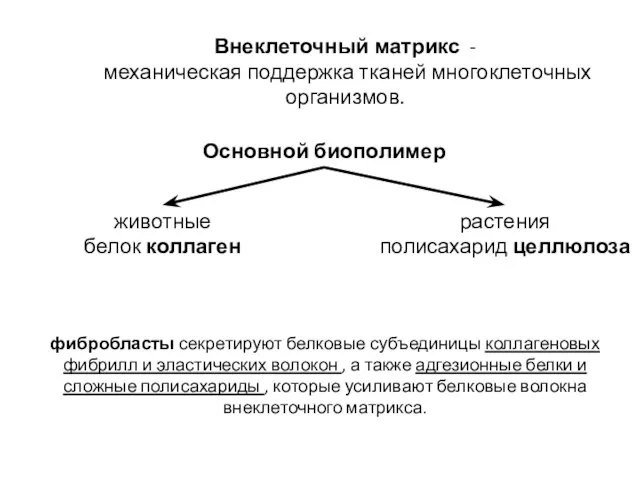
- 3. Внеклеточный матрикс вырабатывают и упорядочивают находящиеся в нем клетки
- 4. Внеклеточный матрикс -Среда, занимающая пространство между клетками, включает ряд макромолекул Повышает прочность и упругость ткани Объединяет
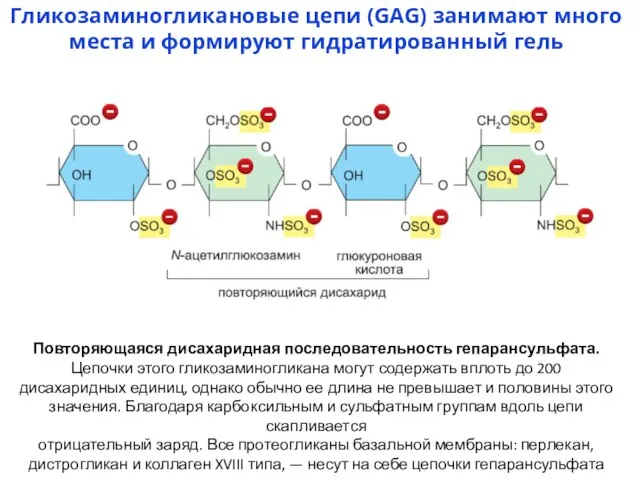
- 5. Гликозаминогликановые цепи (GAG) занимают много места и формируют гидратированный гель Повторяющаяся дисахаридная последовательность гепарансульфата. Цепочки этого
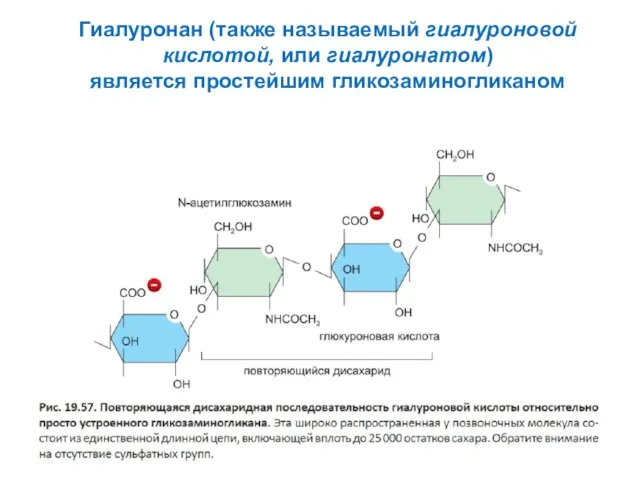
- 6. Гиалуронан (также называемый гиалуроновой кислотой, или гиалуронатом) является простейшим гликозаминогликаном
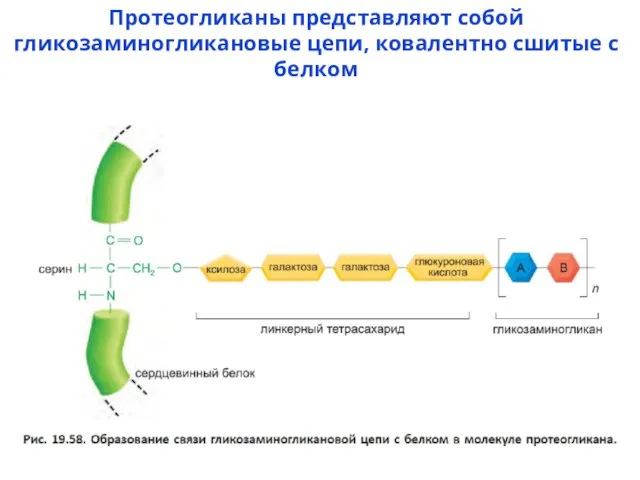
- 7. Протеогликаны представляют собой гликозаминогликановые цепи, ковалентно сшитые с белком
- 8. Протеогликан хрящевой ткани – аггрекан ( около100 цепей хондроитин-сульфатов и 30 цепей кератансульфатов). Гликозамингликаны - N-ацетилнейраминовая
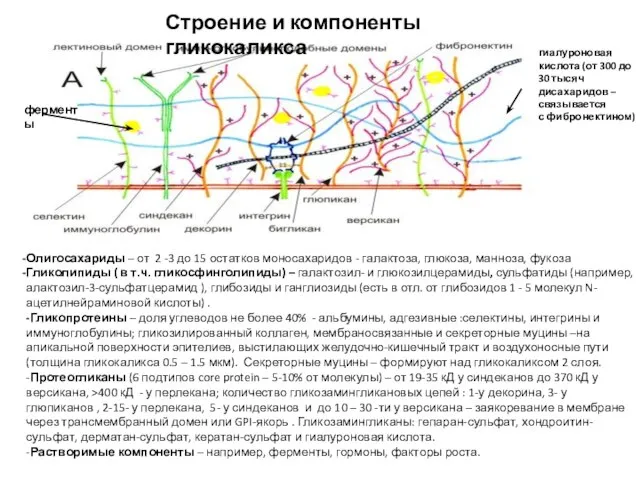
- 9. Строение и компоненты гликокаликса Олигосахариды – от 2 -3 до 15 остатков моносахаридов - галактоза, глюкоза,
- 10. Функциональная значимость гликокаликса Функции направлены на клеточную адгезию и межклеточные взаимодействия. Гликокаликс способен ограничить доступ определенных
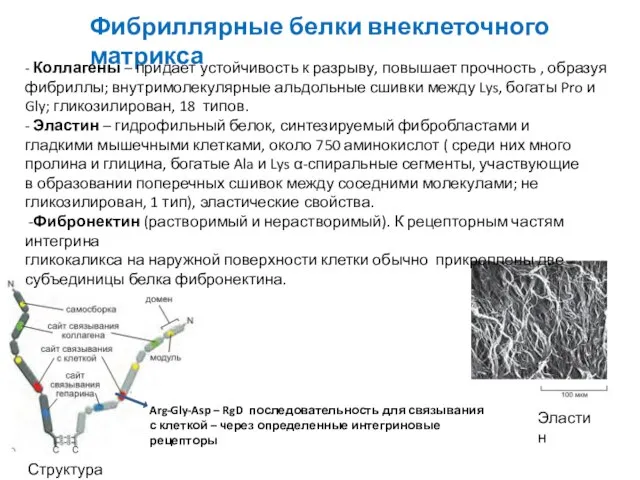
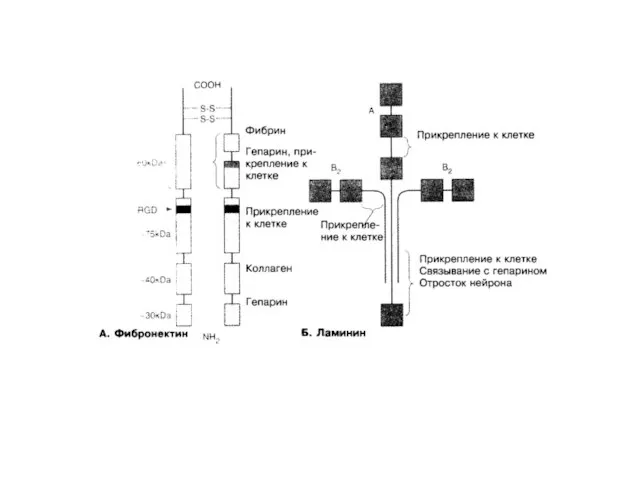
- 12. Фибриллярные белки внеклеточного матрикса Структура фибронектина Arg-Gly-Asp – RgD последовательность для связывания с клеткой – через
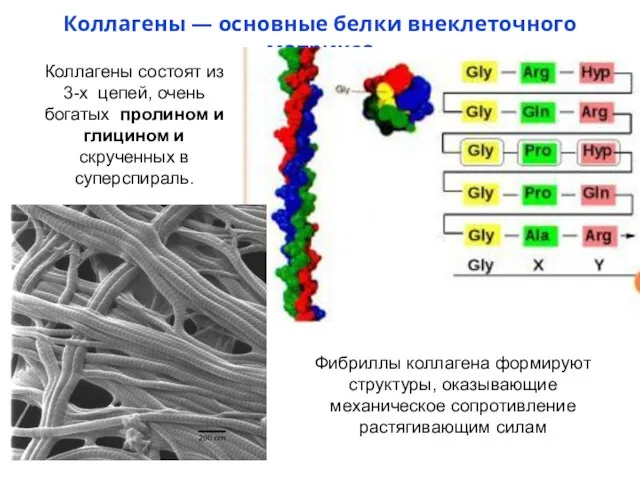
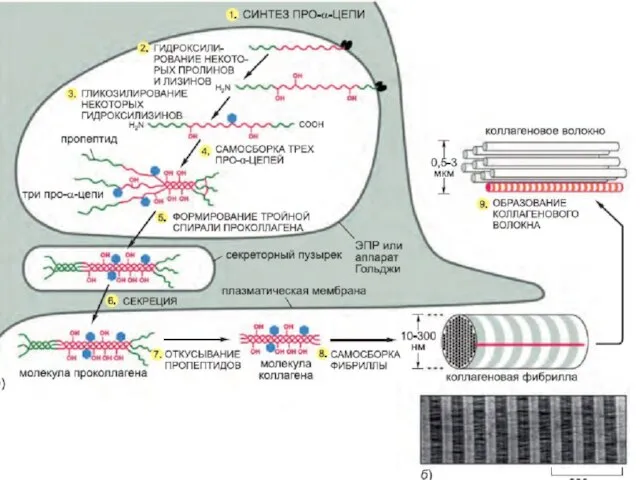
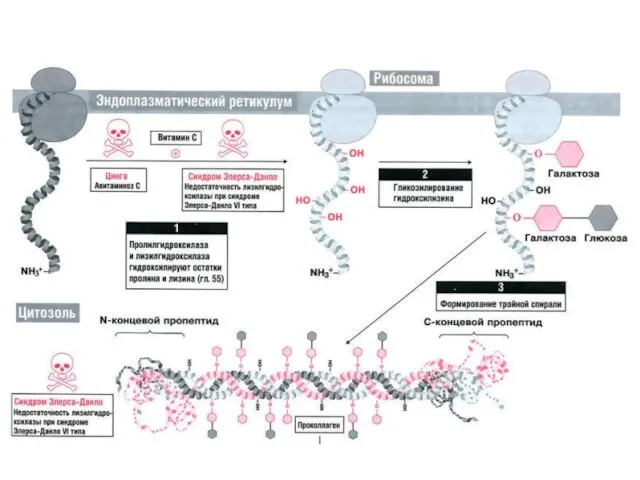
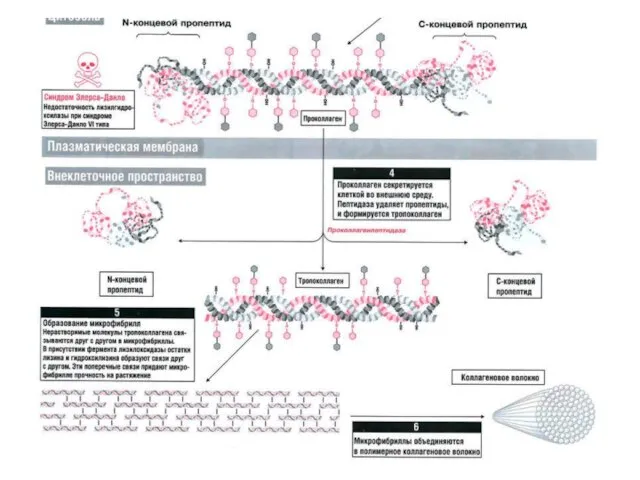
- 13. Коллагены — основные белки внеклеточного матрикса Коллагены состоят из 3-х цепей, очень богатых пролином и глицином
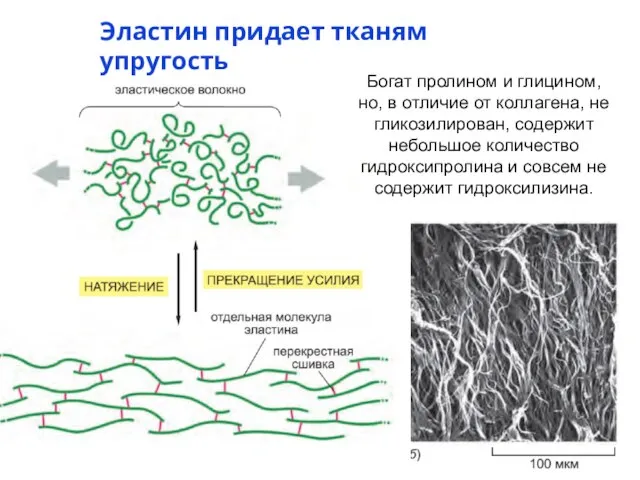
- 17. Эластин придает тканям упругость Богат пролином и глицином, но, в отличие от коллагена, не гликозилирован, содержит
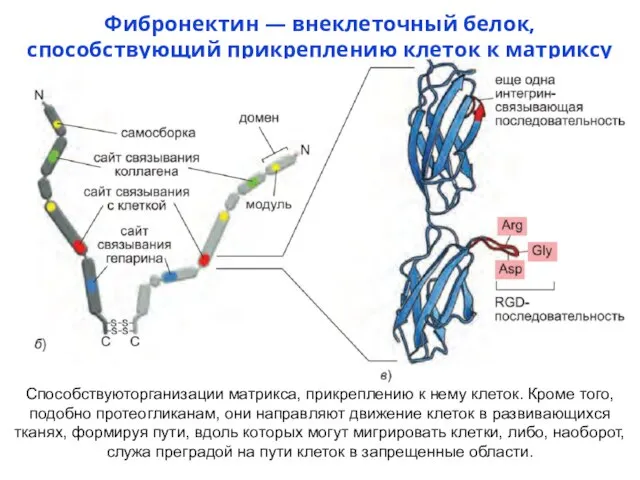
- 19. Фибронектин — внеклеточный белок, способствующий прикреплению клеток к матриксу Способствуюторганизации матрикса, прикреплению к нему клеток. Кроме
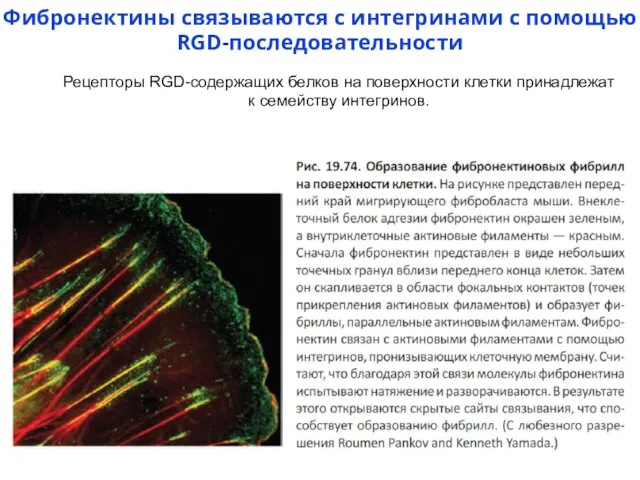
- 20. Фибронектины связываются с интегринами с помощью RGD-последовательности Рецепторы RGD-содержащих белков на поверхности клетки принадлежат к семейству
- 21. внеклеточный матрикс соединительных тканей занимает гораздо больший объем и принимает разнообразные формы Сухожилья, связки - из
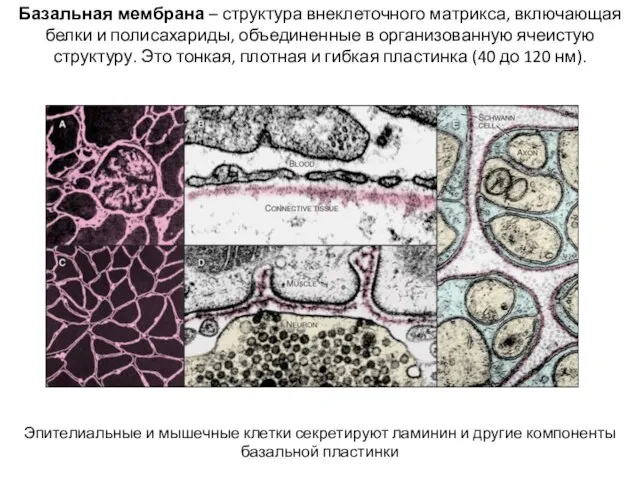
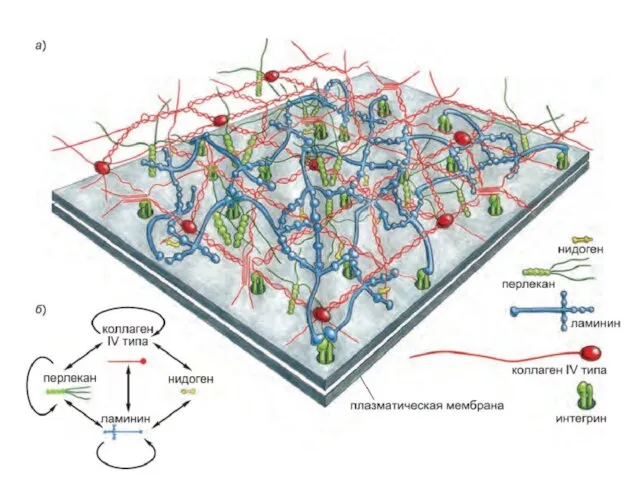
- 22. Базальная мембрана – структура внеклеточного матрикса, включающая белки и полисахариды, объединенные в организованную ячеистую структуру. Это
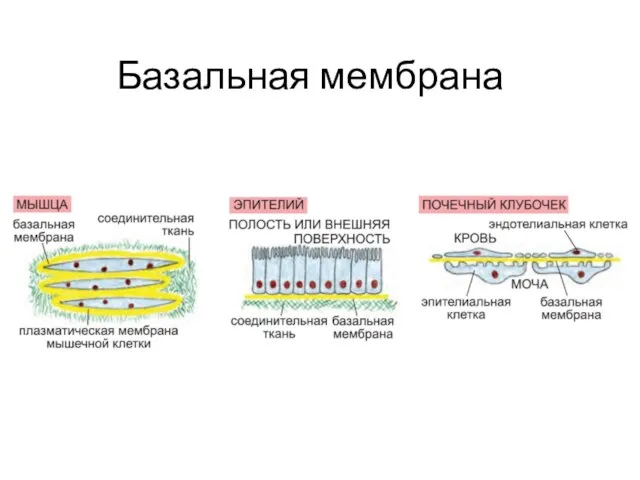
- 23. Базальная мембрана
- 24. Базальные мембраны служат : механической опорой; формируют границу между эпителием и соединительной тканью (структурная) способствуют их
- 25. (1) фибриллярных белков (как правило, гликопротеинов, связанных с короткими олигосахаридными цепочками) и (2) полисахаридных цепочек —
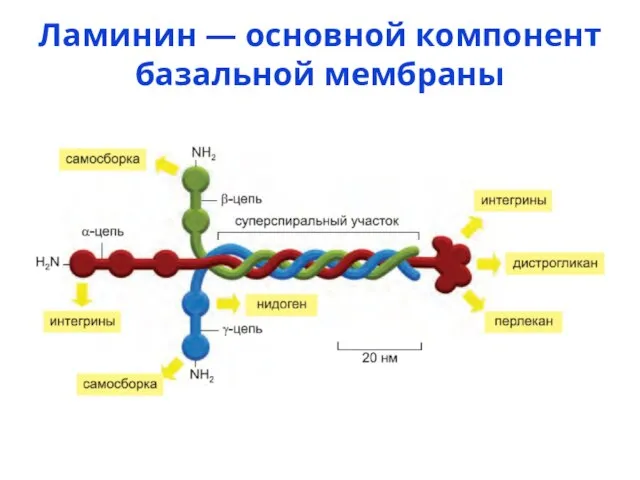
- 26. Ламинин — основной компонент базальной мембраны
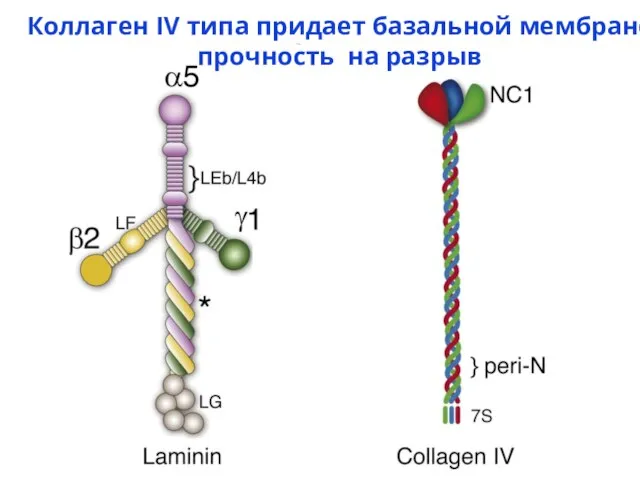
- 27. Коллаген IV типа придает базальной мембране прочность на разрыв
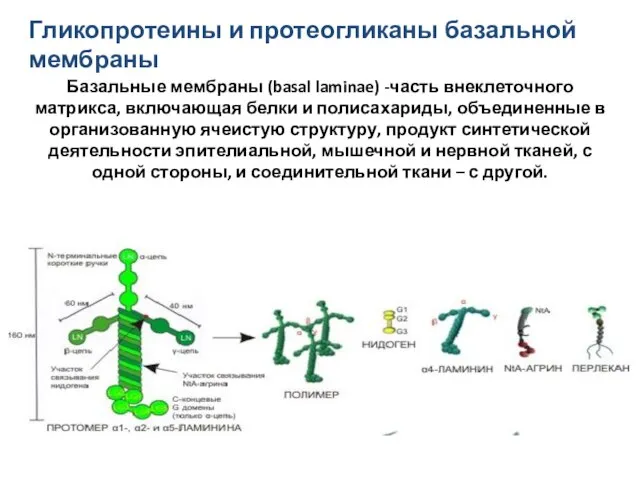
- 28. Гликопротеины и протеогликаны базальной мембраны Базальные мембраны (basal laminae) -часть внеклеточного матрикса, включающая белки и полисахариды,
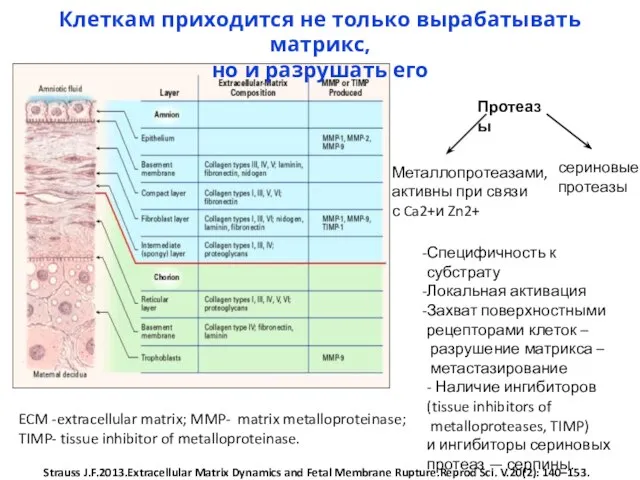
- 31. У людей с генетическими нарушениями, затрагивающими некоторые белки базальной мембраны либо особый тип коллагена, прикрепляющего базальную
- 32. ECM -extracellular matrix; MMP- matrix metalloproteinase; TIMP- tissue inhibitor of metalloproteinase. Strauss J.F.2013.Extracellular Matrix Dynamics and
- 33. Цитоскелет
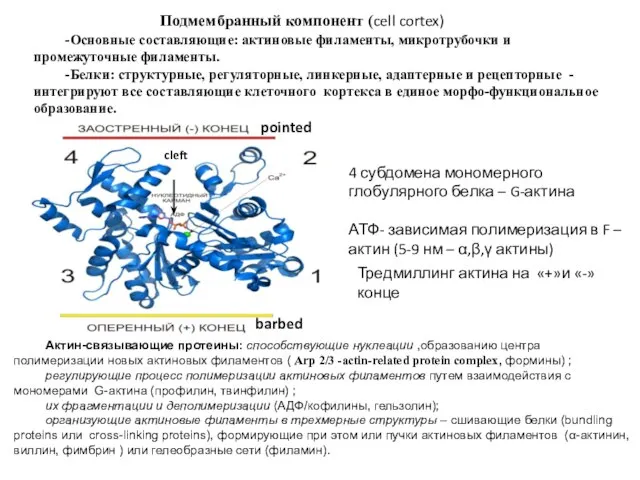
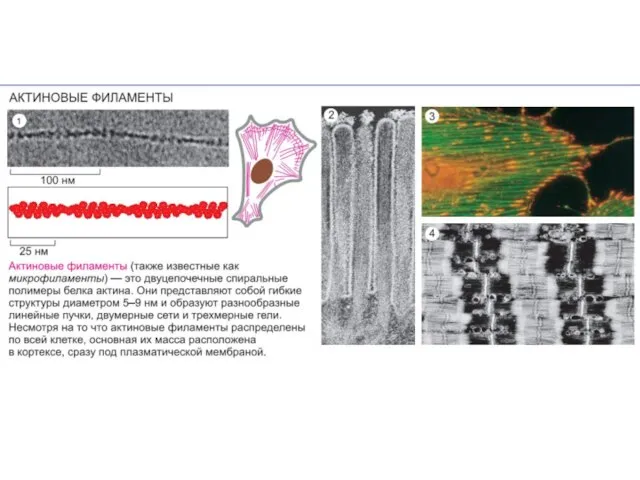
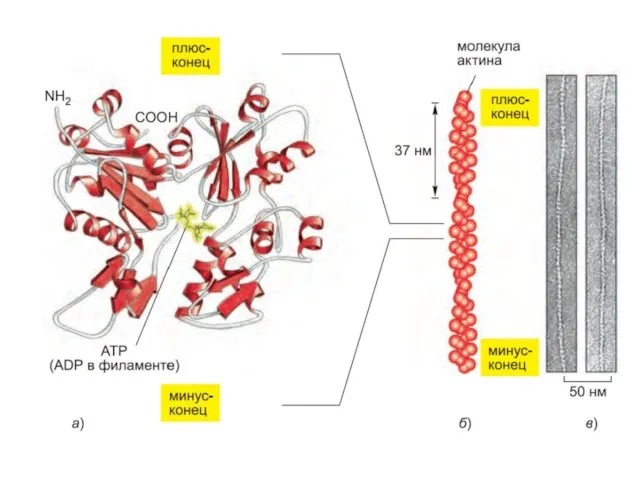
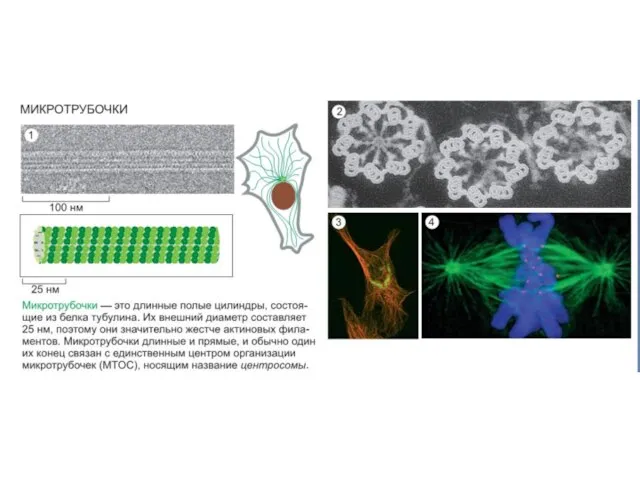
- 34. Подмембранный компонент (cell cortex) -Основные составляющие: актиновые филаменты, микротрубочки и промежуточные филаменты. -Белки: структурные, регуляторные, линкерные,
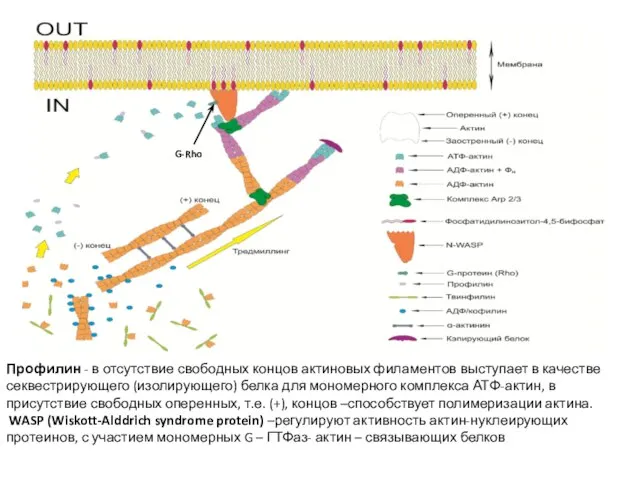
- 37. Профилин - в отсутствие свободных концов актиновых филаментов выступает в качестве секвестрирующего (изолирующего) белка для мономерного
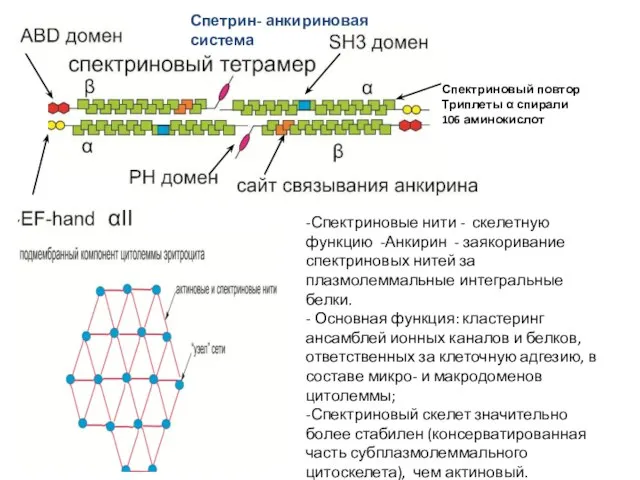
- 38. СПЕКРИН-АНКИРИНОВАЯ СИСТЕМА Второй (после актина) по представленности составляющей частью подмембранного компонента является система белков, основную роль
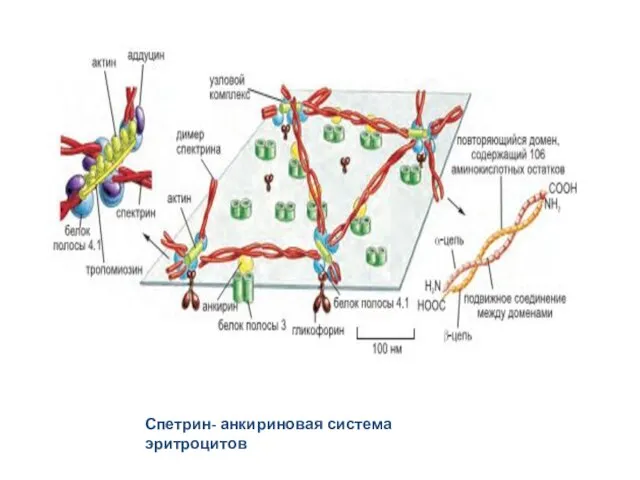
- 39. Спетрин- анкириновая система -Спектриновые нити - скелетную функцию -Анкирин - заякоривание спектриновых нитей за плазмолеммальные интегральные
- 40. Спетрин- анкириновая система эритроцитов
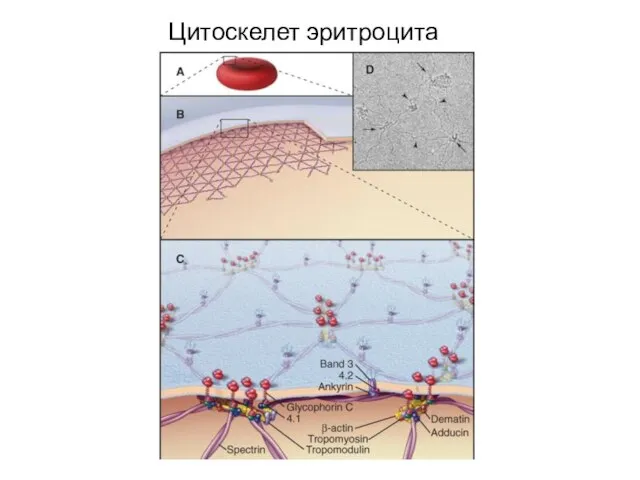
- 41. Цитоскелет эритроцита
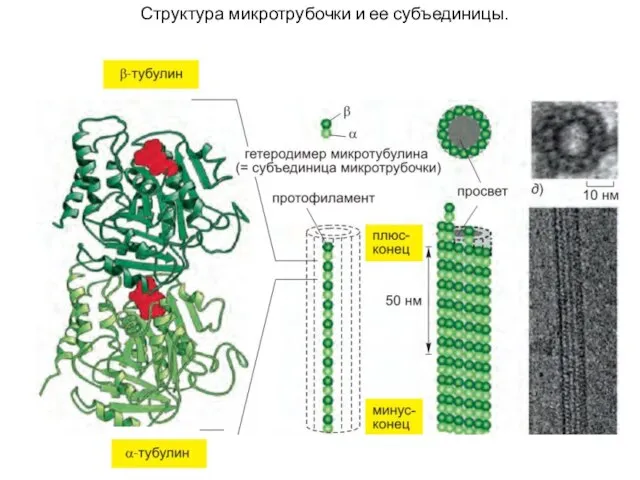
- 43. Структура микротрубочки и ее субъединицы.
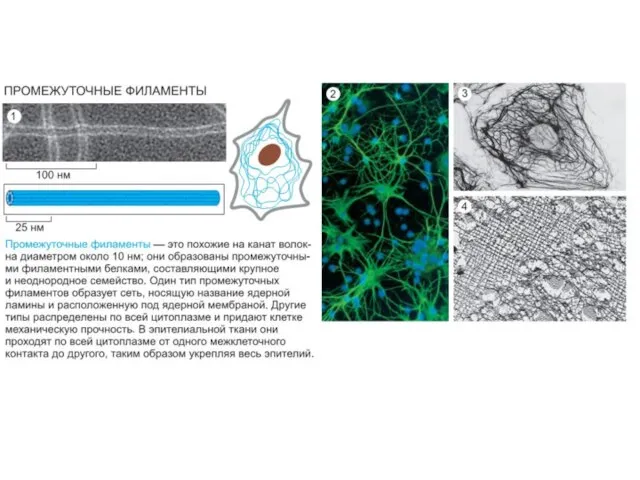
- 45. Intermediate filament, IF ( Промежуточные филаменты) компенсация внешних деформирующих воздействий на клетку (особенно, это касается покровных
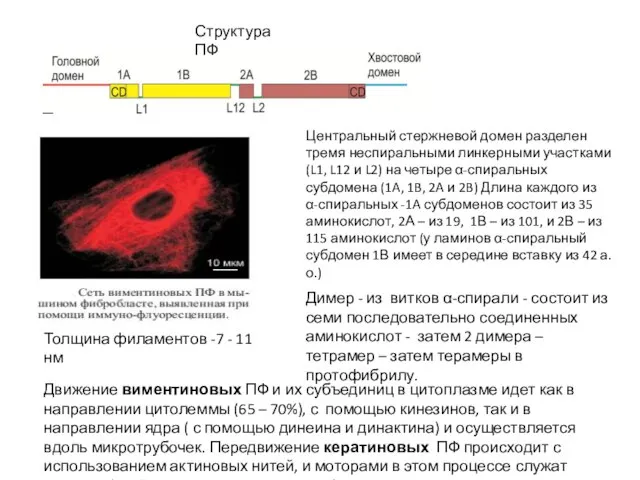
- 46. Структура ПФ Димер - из витков α-спирали - состоит из семи последовательно соединенных аминокислот - затем
- 47. Связывание сигнальных молекул -регуляция их концентрации и активности: гепарансульфатные цепочки протеогликанов связываются с факторами роста фибробластов
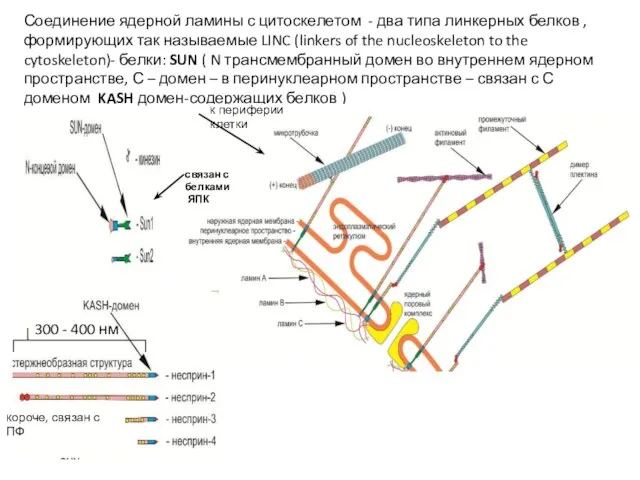
- 48. Соединение ядерной ламины с цитоскелетом - два типа линкерных белков , формирующих так называемые LINC (linkers
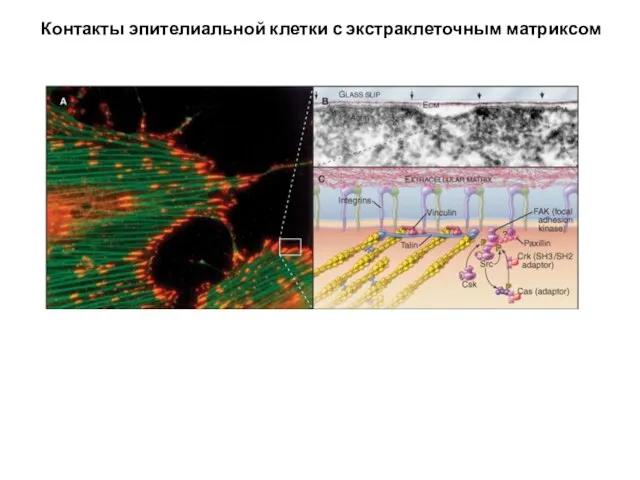
- 49. Контакты эпителиальной клетки с экстраклеточным матриксом
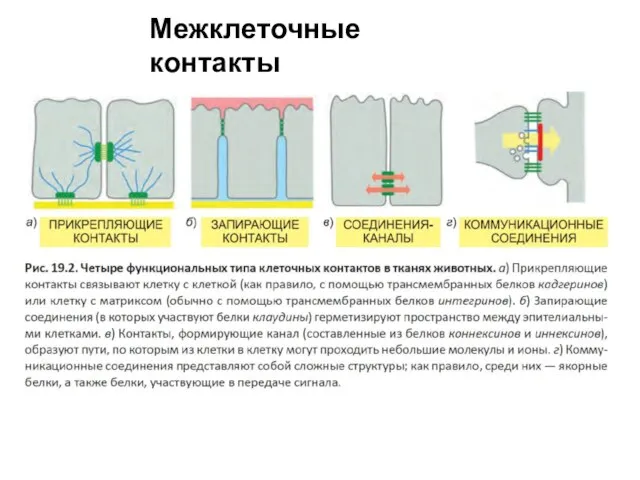
- 50. Межклеточные контакты Классификация на основе их функций и структуры Запирающие– белки клаудины и окклюдины Прикрепляющие -
- 51. Межклеточные контакты
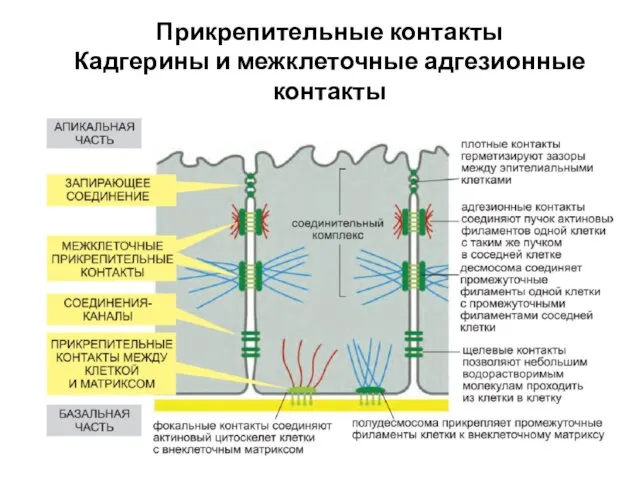
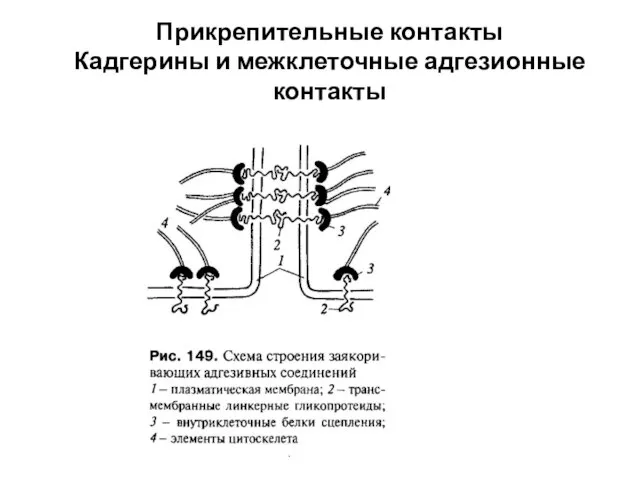
- 52. Прикрепительные контакты Кадгерины и межклеточные адгезионные контакты
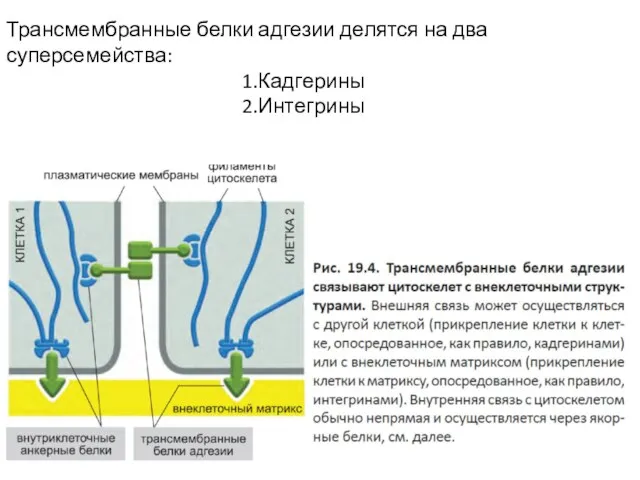
- 53. Трансмембранные белки адгезии делятся на два суперсемейства: Кадгерины Интегрины
- 54. Прикрепительные контакты Кадгерины и межклеточные адгезионные контакты
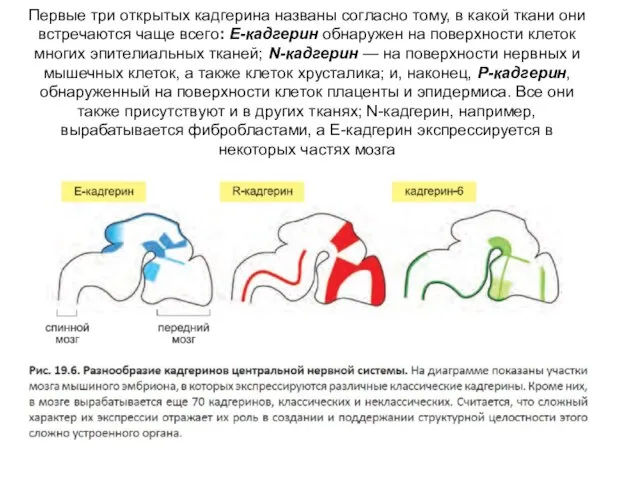
- 55. Первые три открытых кадгерина названы согласно тому, в какой ткани они встречаются чаще всего: E-кадгерин обнаружен
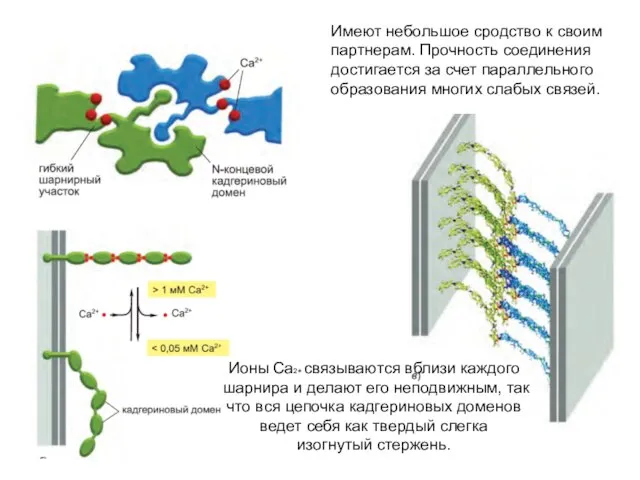
- 56. Имеют небольшое сродство к своим партнерам. Прочность соединения достигается за счет параллельного образования многих слабых связей.
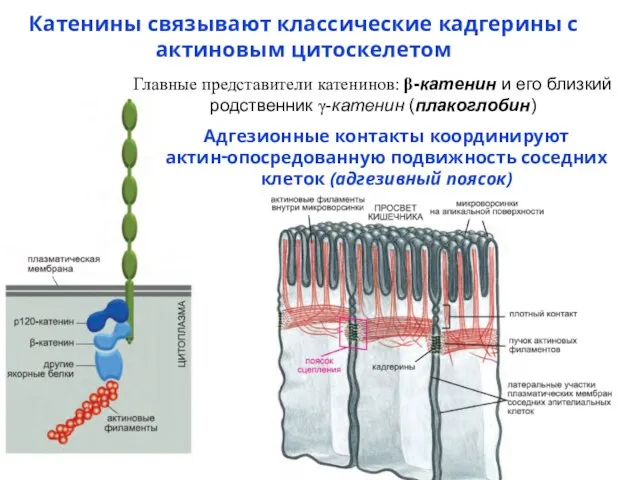
- 57. Катенины связывают классические кадгерины с актиновым цитоскелетом Главные представители катенинов: β-катенин и его близкий родственник γ-катенин
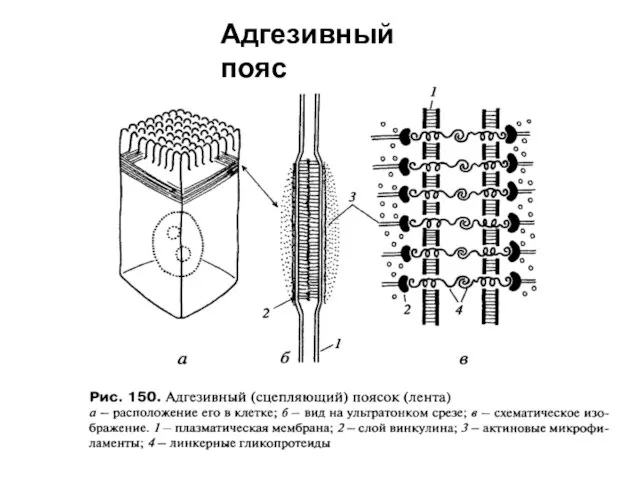
- 58. Адгезивный пояс
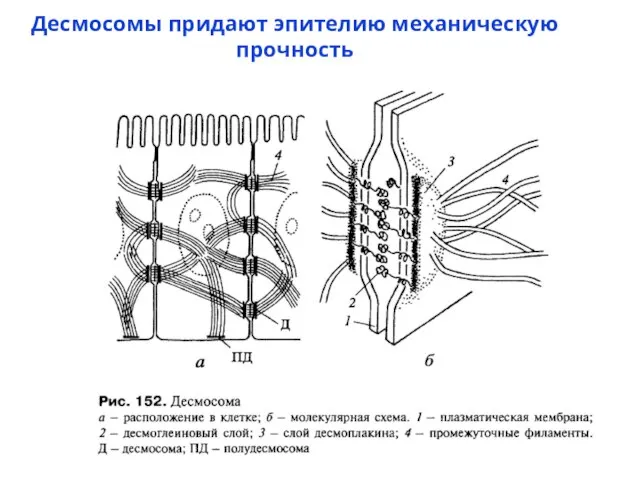
- 59. Десмосомы придают эпителию механическую прочность
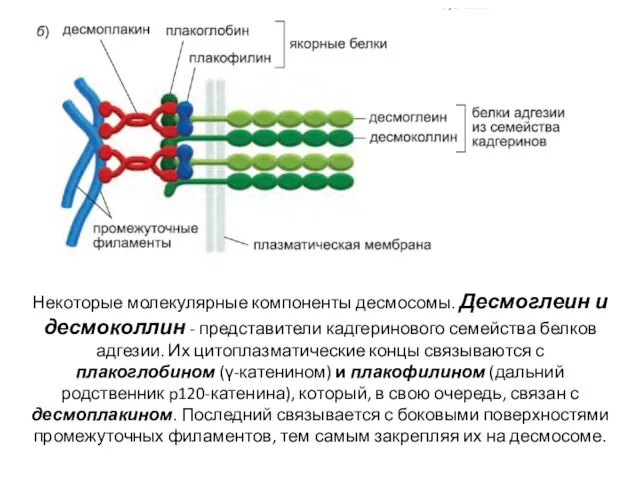
- 60. Некоторые молекулярные компоненты десмосомы. Десмоглеин и десмоколлин - представители кадгеринового семейства белков адгезии. Их цитоплазматические концы
- 61. Итоговая таблица по контактам
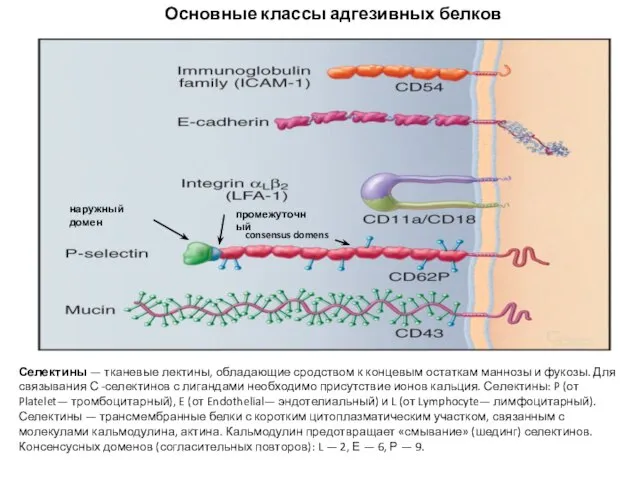
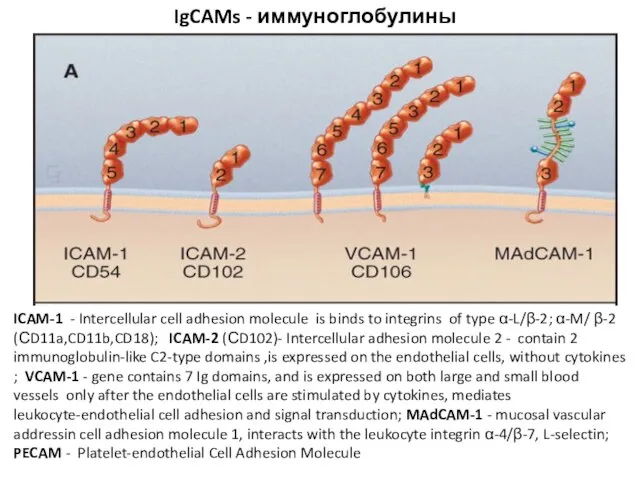
- 62. четыре семейства адгезивных белков IgCAMs , кадгерины , интегрины и селектины ,составляют большую часть клеточной адгезии
- 63. Селектины — тканевые лектины, обладающие сродством к концевым остаткам маннозы и фукозы. Для связывания С -селектинов
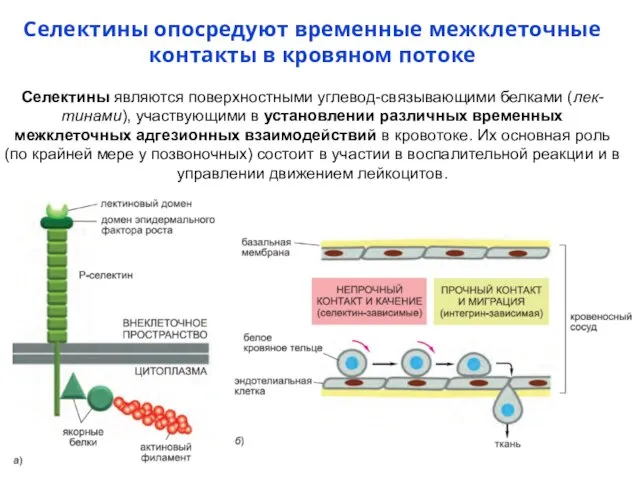
- 64. Селектины опосредуют временные межклеточные контакты в кровяном потоке Селектины являются поверхностными углевод-связывающими белками (лек- тинами), участвующими
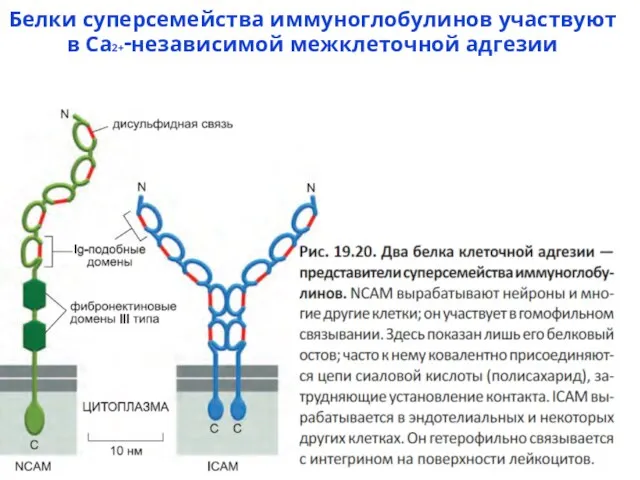
- 65. Белки суперсемейства иммуноглобулинов участвуют в Ca2+‑независимой межклеточной адгезии
- 66. IgCAMs - иммуноглобулины ICAM-1 - Intercellular cell adhesion molecule is binds to integrins of type α-L/β-2;
- 67. Интегрины – в отличие от кадгеринов участвуют не только в межклеточной , но и в клеточно-матриксной
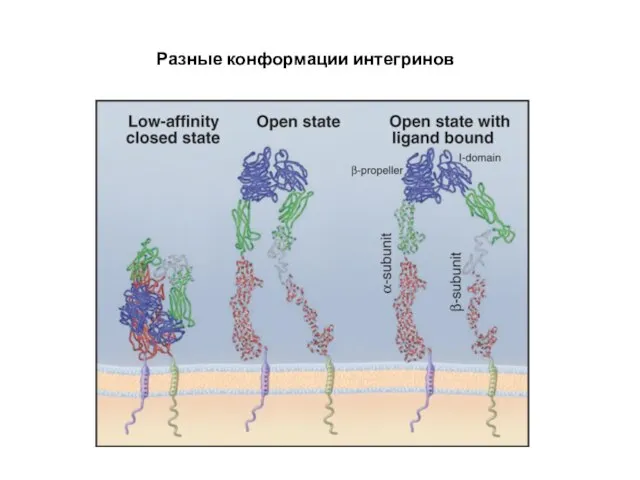
- 68. Разные конформации интегринов
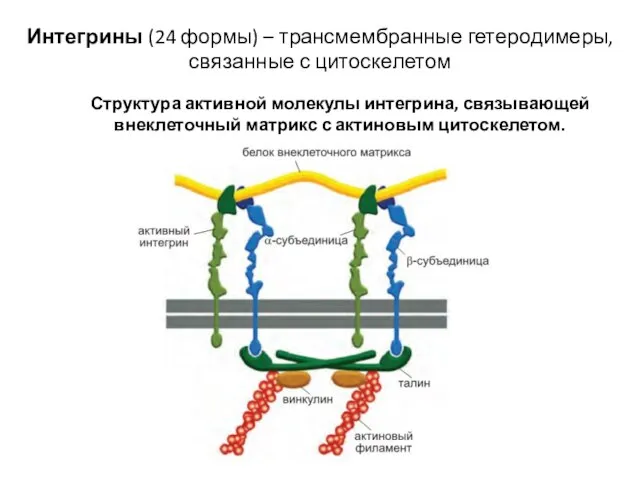
- 69. Структура активной молекулы интегрина, связывающей внеклеточный матрикс с актиновым цитоскелетом. Интегрины (24 формы) – трансмембранные гетеродимеры,
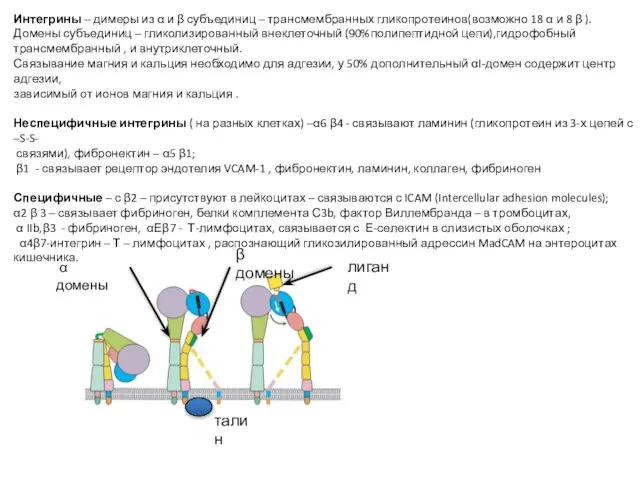
- 70. Интегрины – димеры из α и β субъединиц – трансмембранных гликопротеинов(возможно 18 α и 8 β
- 71. Адгезия и сигнализация с помощью интегринов Слабая адгезия - разбираются в течение минут, если не захватываются
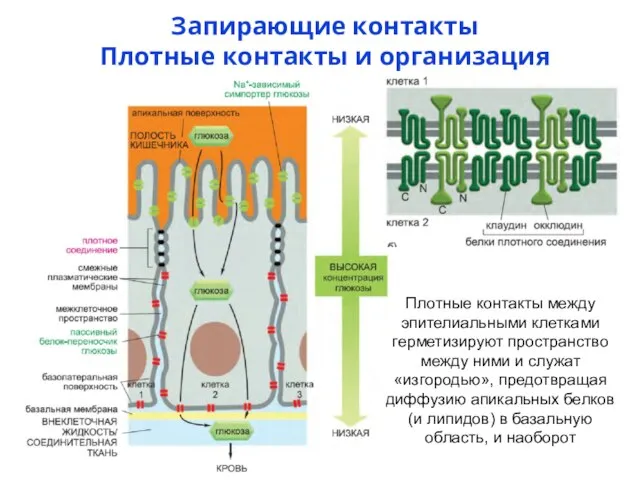
- 72. Запирающие контакты Плотные контакты и организация эпителия Плотные контакты между эпителиальными клетками герметизируют пространство между ними
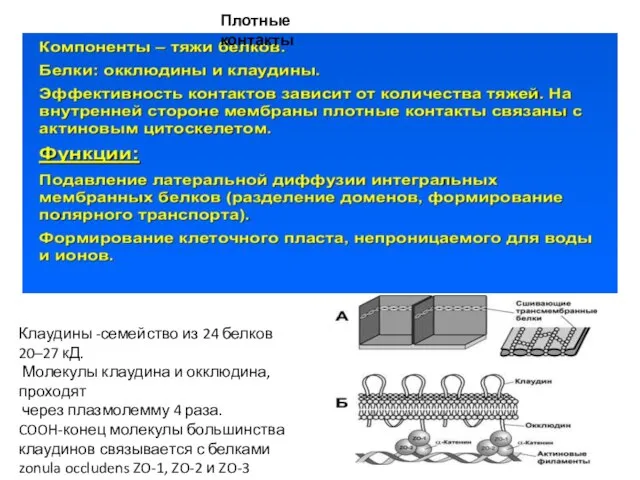
- 73. Плотные контакты Клаудины -семейство из 24 белков 20–27 кД. Молекулы клаудина и окклюдина, проходят через плазмолемму
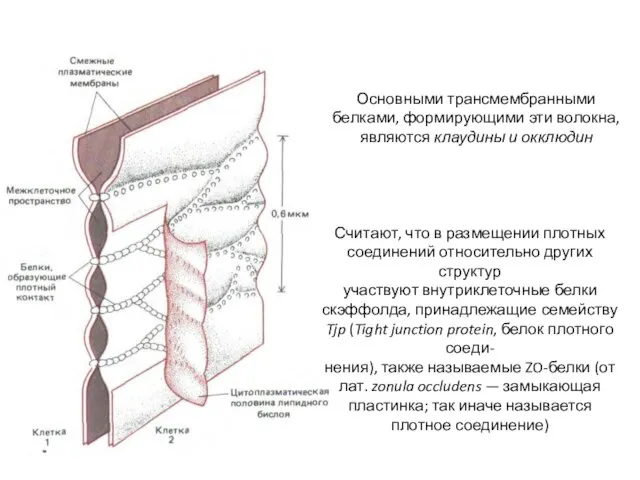
- 74. Считают, что в размещении плотных соединений относительно других структур участвуют внутриклеточные белки скэффолда, принадлежащие семейству Tjp
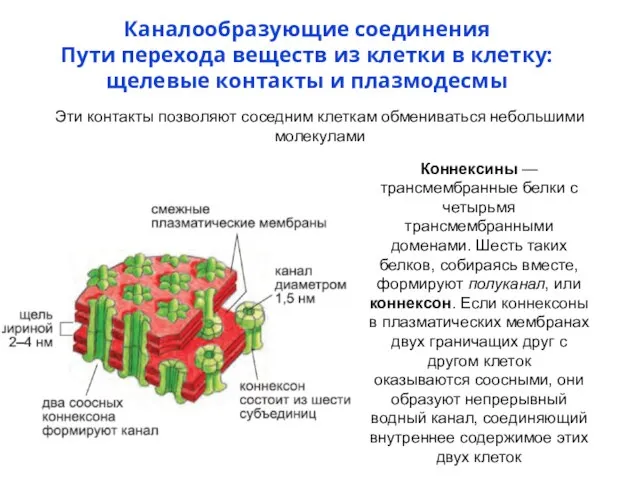
- 75. Каналообразующие соединения Пути перехода веществ из клетки в клетку: щелевые контакты и плазмодесмы Эти контакты позволяют
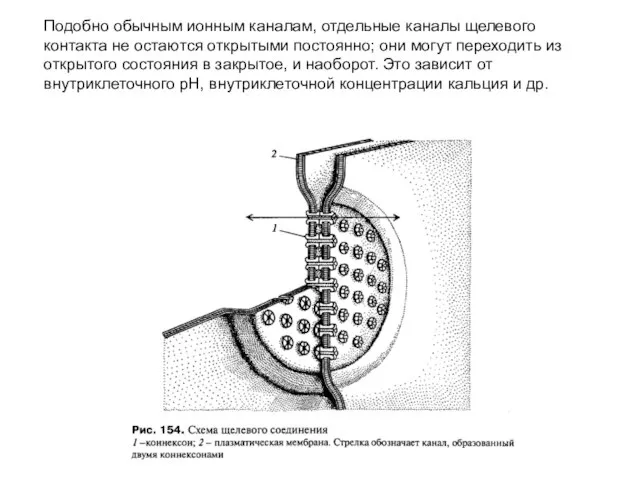
- 76. Подобно обычным ионным каналам, отдельные каналы щелевого контакта не остаются открытыми постоянно; они могут переходить из
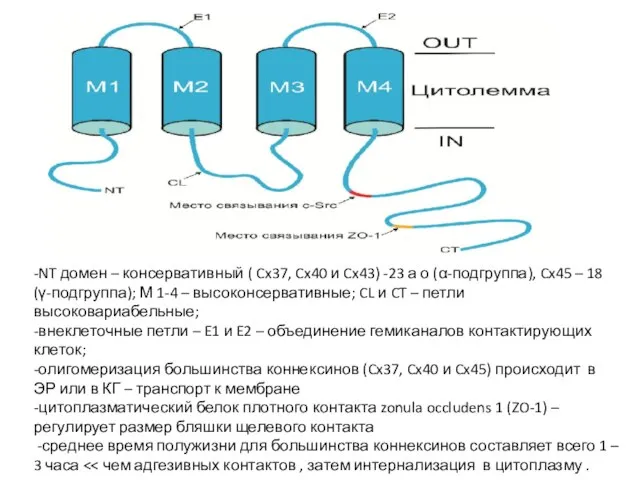
- 77. -NT домен – консервативный ( Cx37, Cx40 и Cx43) -23 а о (α-подгруппа), Cx45 – 18
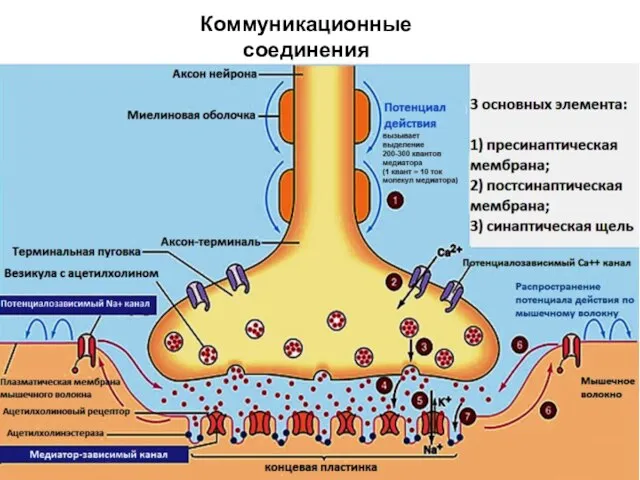
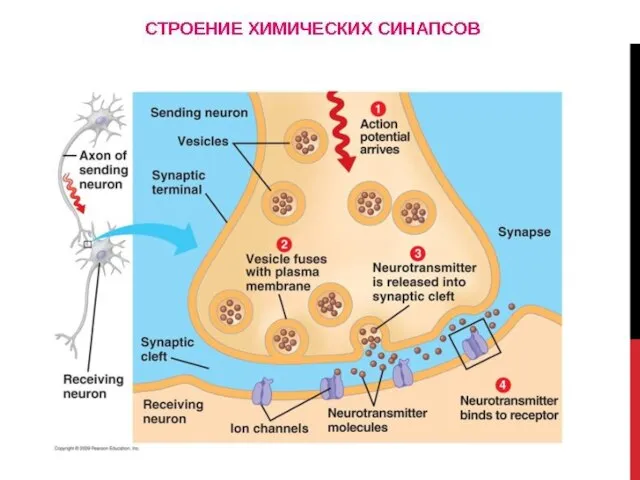
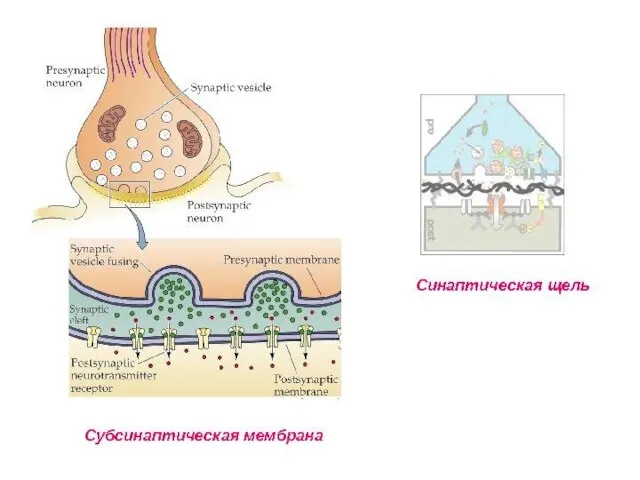
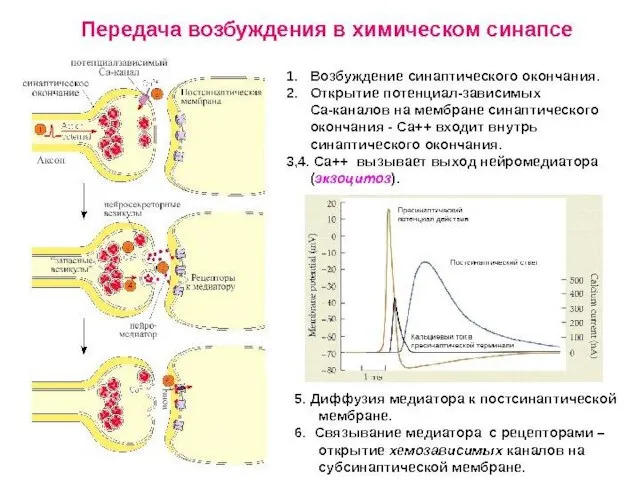
- 78. Коммуникационные соединения Химический синапс
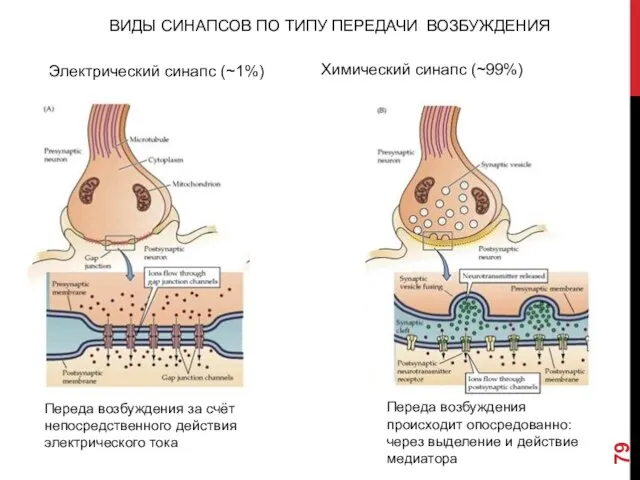
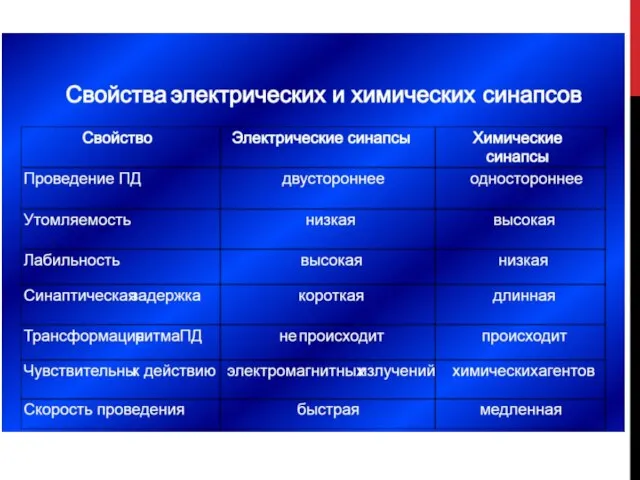
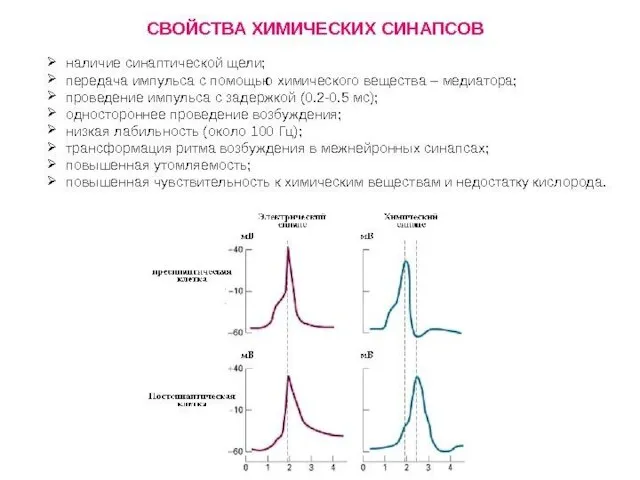
- 79. ВИДЫ СИНАПСОВ ПО ТИПУ ПЕРЕДАЧИ ВОЗБУЖДЕНИЯ Электрический синапс (~1%) Химический синапс (~99%) Переда возбуждения происходит опосредованно:
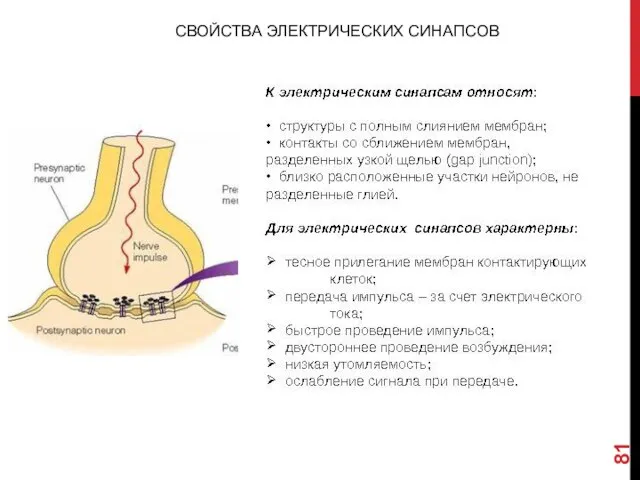
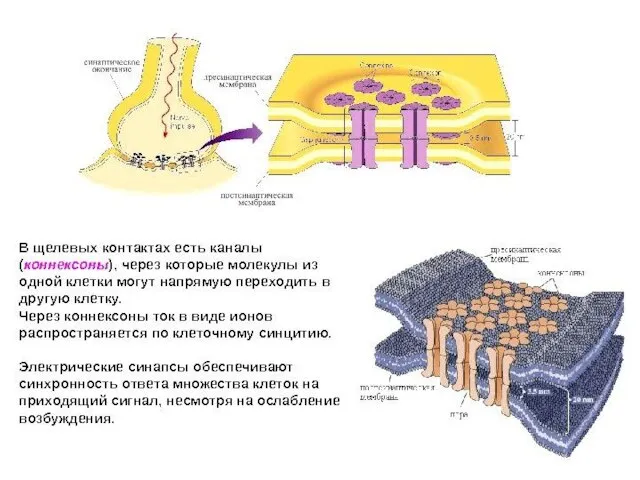
- 81. СВОЙСТВА ЭЛЕКТРИЧЕСКИХ СИНАПСОВ
- 90. Скачать презентацию

















 Презентация на тему "Лишайники" - скачать бесплатно презентации по Биологии_
Презентация на тему "Лишайники" - скачать бесплатно презентации по Биологии_ Полевые цветы
Полевые цветы Постэмбриональное развитие организмов
Постэмбриональное развитие организмов Особенности питания растений
Особенности питания растений Системи органів
Системи органів Альбом сорняков
Альбом сорняков Презентация на тему Осенние и зимние явления в жизни растений
Презентация на тему Осенние и зимние явления в жизни растений  Презентация на тему Особенности скелета человека связанные с прямохождением и трудовой деятельностью
Презентация на тему Особенности скелета человека связанные с прямохождением и трудовой деятельностью Закономерности наследования признаков при половом размножении
Закономерности наследования признаков при половом размножении Клубника. История, загадки
Клубника. История, загадки Family Pedigree of Walid and Nadia
Family Pedigree of Walid and Nadia Функции органов дыхания. Дыхательная система
Функции органов дыхания. Дыхательная система Строение и работа сердца. Круги кровообращения
Строение и работа сердца. Круги кровообращения Презентация на тему "Опорно – двигательная система" - скачать презентации по Биологии
Презентация на тему "Опорно – двигательная система" - скачать презентации по Биологии Предмет и задачи биохимии. Ферменты, энзимы. (Лекция 2)
Предмет и задачи биохимии. Ферменты, энзимы. (Лекция 2) Родина злаки Poaceae
Родина злаки Poaceae Тип Членистоногие
Тип Членистоногие
 Презентация на тему "Биологическая мембрана, строение, значение и функции. Одномембранные органоиды клетки" - скачать презен
Презентация на тему "Биологическая мембрана, строение, значение и функции. Одномембранные органоиды клетки" - скачать презен Цветок, его строение и значение
Цветок, его строение и значение Половое размножение растений
Половое размножение растений Концепция экосистемы
Концепция экосистемы Чем нельзя кормить кошек
Чем нельзя кормить кошек Генетика. Законы Г. Менделя Почему мы похожи на своих родителей? автор: Широченко Н. Н. Учитель биологии ГОУ ЦО 1456 Москва 2010
Генетика. Законы Г. Менделя Почему мы похожи на своих родителей? автор: Широченко Н. Н. Учитель биологии ГОУ ЦО 1456 Москва 2010 История представлений о возникновении жизни
История представлений о возникновении жизни Влияние фитонцидов на развитие гнилостных бактерий
Влияние фитонцидов на развитие гнилостных бактерий Эпителиальные ткани
Эпителиальные ткани Генетика пола. Сцепленное с полом наследование
Генетика пола. Сцепленное с полом наследование