Содержание
- 2. Значение ферментов для организма А. Ферменты - биокатализаторы –увеличивают скорость химических реакций Б. Обусловливают превращение веществ
- 3. Значение знаний о ферментах в медицине Раздел биохимии, изучающий ферменты – энзимология. Индивидуальность клетки во многом
- 4. Химическая природа, функционально-структурная организация ферментов Все Ферменты только белки – простые или сложные!!! ФЕРМЕНТЫ ПРОСТЫЕ БЕЛКИ-
- 5. Особенности структурно-функциональной организации Активный центр – участок ( совокупность остатков аминокислот) в трехмерной молекуле белка, с
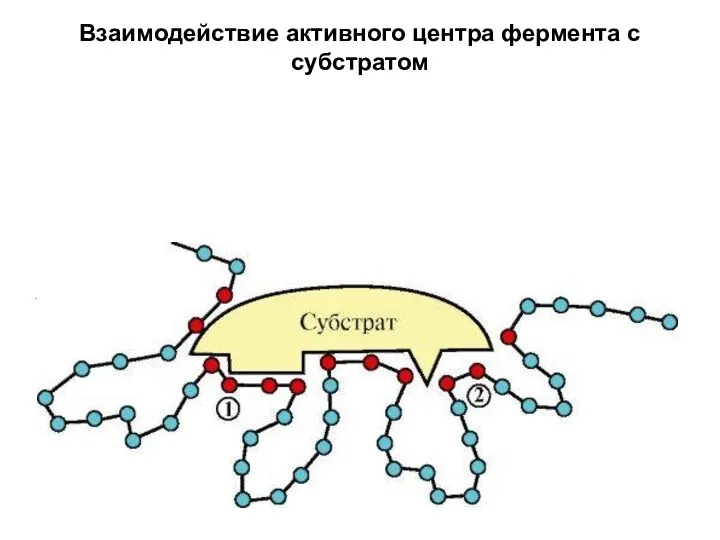
- 6. Активный центр Формируется на уровне третичной структуры белка. Выделяют субстратсвязывающий участок и катализирующий. Субстратсвязывающий участок представляет
- 7. Взаимодействие активного центра фермента с субстратом
- 8. Активный центр Активный центр – это структура конформационно лабильная. Это обеспечивает уникальное свойство фермента -регуляция активности
- 9. Основные признаки катализаторов, общие для ферментов и неорганических катализаторов Катализируют только энергетически возможные реакции; Увеличивают скорость
- 10. Уникальные свойства биокатализаторов- ферментов, отличающие их от неорганических Эти уникальные свойства обусловлены белковой природой, их трехмерной
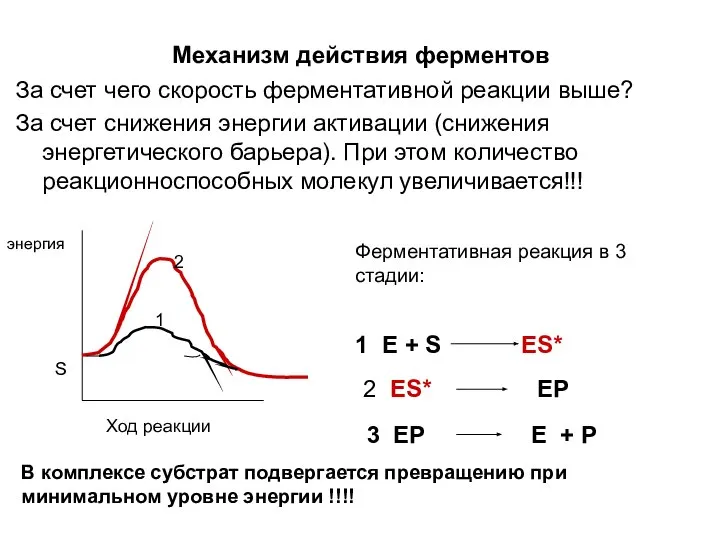
- 11. Механизм действия ферментов За счет чего скорость ферментативной реакции выше? За счет снижения энергии активации (снижения
- 12. Номенклатура ферментов Принято два типа названий ферментов: рабочее или рекомендуемое - название складывается - из названия
- 13. Классификация ферментов Принцип классификации – тип химической реакции Всего 6 классов ( 6 типов реакций) Классы
- 14. Активность фермента; определение активности фермента Мера активности фермента – скорость ферментативной реакции. Определить активность фермента (
- 15. Кинетика ферментативных реакций Ферментативная кинетика изучает зависимость скорости ферментативной реакции от различных факторов. Все они способствуют
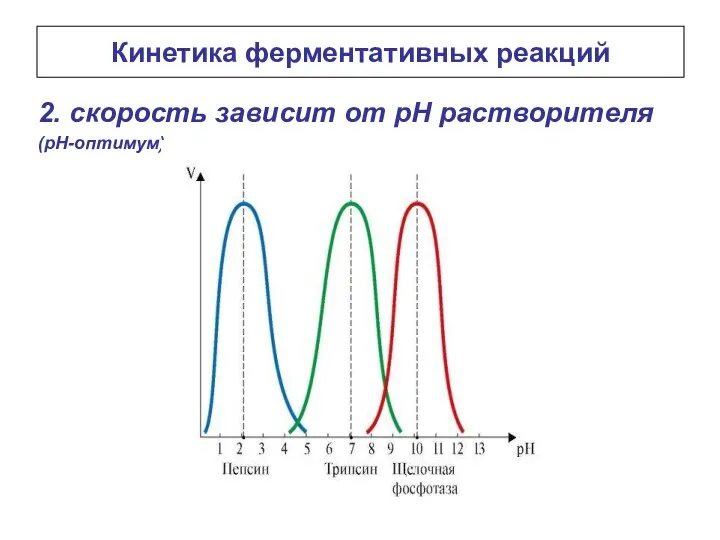
- 16. Кинетика ферментативных реакций 2. скорость зависит от рН растворителя (рН-оптимум)
- 17. Ферментативная кинетика 3.От концентрации фермента ( при постоянной избыточной концентрации субстрата) [E] V
- 18. Кинетика ферментативной реакций 4. Скорость реакции от концентрации субстрата ( при постоянной концентрации фермента) Кm (константа
- 19. Кинетические параметры Константа Михаэлиса - количественно выражается концентрацией субстрата, при которой скорость реакции равна половине максимальной
- 21. Скачать презентацию












![Ферментативная кинетика 3.От концентрации фермента ( при постоянной избыточной концентрации субстрата) [E] V](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/636257/slide-16.jpg)


 Эндокринные железы
Эндокринные железы  Индивидуальное развитие человека, или онтогенез Презентация по биологии
Индивидуальное развитие человека, или онтогенез Презентация по биологии  Селекция – эволюция, направляемая человеком
Селекция – эволюция, направляемая человеком Комнатные растения в интерьере жилого дома
Комнатные растения в интерьере жилого дома Неорганические вещества клетки
Неорганические вещества клетки Свойства и биологические функции углеводов и липидов
Свойства и биологические функции углеводов и липидов Исследование генетических особенностей наследования групп крови по системе АВО Работу выполнила: Тихонова Екатерина, ученица 11
Исследование генетических особенностей наследования групп крови по системе АВО Работу выполнила: Тихонова Екатерина, ученица 11  Краткая история развития биологии, как науки. Методы исследования в биологии
Краткая история развития биологии, как науки. Методы исследования в биологии А.ш.қолданылатын гербицидтер
А.ш.қолданылатын гербицидтер СТРУКТУРА ЭКОСИСТЕМЫ Биология 11 класс Выполнил Архипкин Виктор
СТРУКТУРА ЭКОСИСТЕМЫ Биология 11 класс Выполнил Архипкин Виктор Мой питомец. Кошки
Мой питомец. Кошки Клеточные органеллы. Часть 1
Клеточные органеллы. Часть 1 Презентацию выполнила учитель высшей категории Севостьянова Г.А. МБОУ «СОШ № 1 им. Б.Н.Куликова» Г. Семикаракорск
Презентацию выполнила учитель высшей категории Севостьянова Г.А. МБОУ «СОШ № 1 им. Б.Н.Куликова» Г. Семикаракорск  презентация к задачи Пыпин 249
презентация к задачи Пыпин 249 Уравнение Вейса – Лапика
Уравнение Вейса – Лапика Внешнее строение листа. Многообразие листьев
Внешнее строение листа. Многообразие листьев Химический состав клетки. Рибонуклеиновые кислоты, АТФ
Химический состав клетки. Рибонуклеиновые кислоты, АТФ Водоросли в косметике: свойства и особенности применения
Водоросли в косметике: свойства и особенности применения Кровь Кровообращение
Кровь Кровообращение  Презентация на тему Просто и сложно
Презентация на тему Просто и сложно  Развитие представлений о возникновении жизни
Развитие представлений о возникновении жизни Примитивные организмы
Примитивные организмы Красная книга Республики Башкортостан
Красная книга Республики Башкортостан Фауна. Царство животные
Фауна. Царство животные Презентация на тему РАСТЕНИЯ – БАРОМЕТРЫ
Презентация на тему РАСТЕНИЯ – БАРОМЕТРЫ Презентация на тему "Механизм действия вирусов" - скачать презентации по Биологии
Презентация на тему "Механизм действия вирусов" - скачать презентации по Биологии Современный урок ботаники в условиях внедрения ФГОС
Современный урок ботаники в условиях внедрения ФГОС Презентация на тему Вещества вырабатываемые растениями
Презентация на тему Вещества вырабатываемые растениями