Содержание
- 2. Специфические свойства ферментов Ферменты-белки и рибозимы работают в мягких условиях (Т = 40–50°С; нейтральный pH, атмосферное
- 3. Номенклатура и классификация ферментов
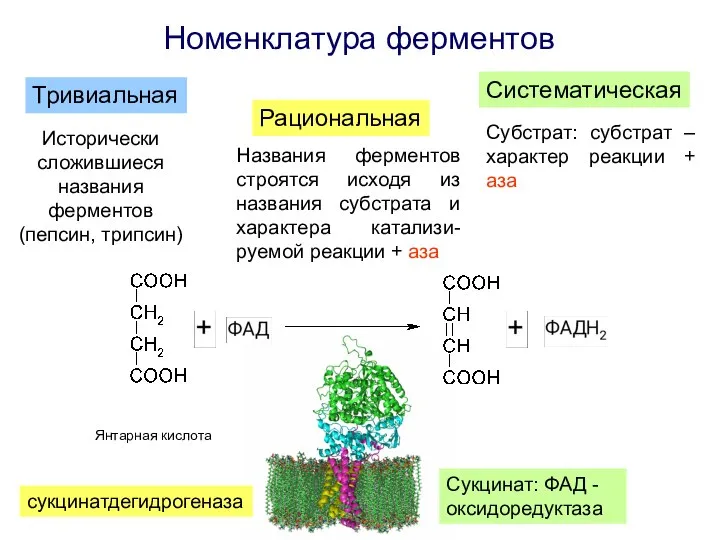
- 4. Номенклатура ферментов Тривиальная Рациональная Систематическая Исторически сложившиеся названия ферментов (пепсин, трипсин) Названия ферментов строятся исходя из
- 5. Оксидоредуктазы Трансферазы Гидролазы Лиазы Изомеразы Лигазы Международная классификация ферментов по типу катализируемой реакции
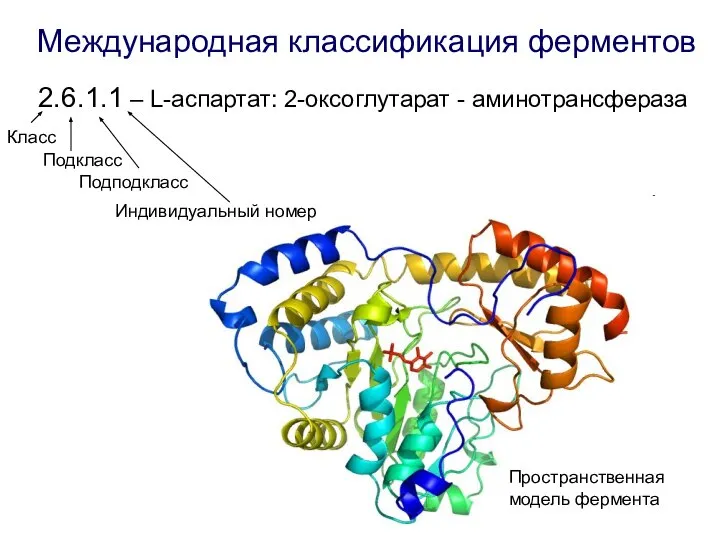
- 6. Международная классификация ферментов 2.6.1.1 – L-аспартат: 2-оксоглутарат - аминотрансфераза Пространственная модель фермента Класс Подкласс Подподкласс Индивидуальный
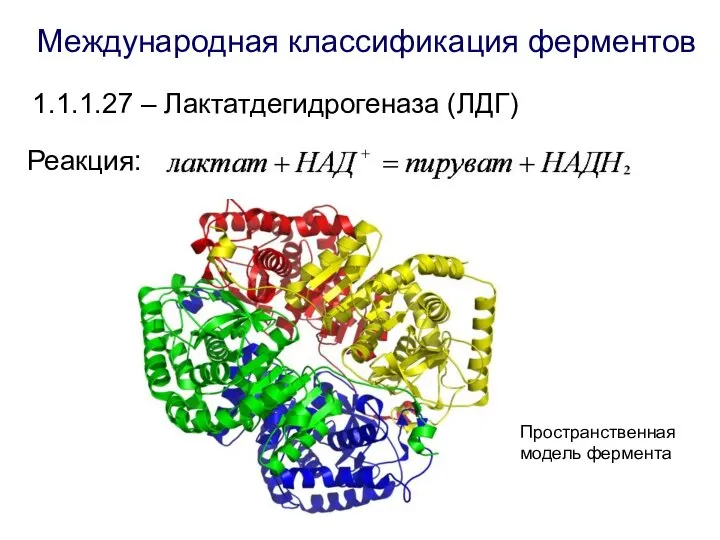
- 7. 1.1.1.27 – Лактатдегидрогеназа (ЛДГ) Реакция: Пространственная модель фермента Международная классификация ферментов
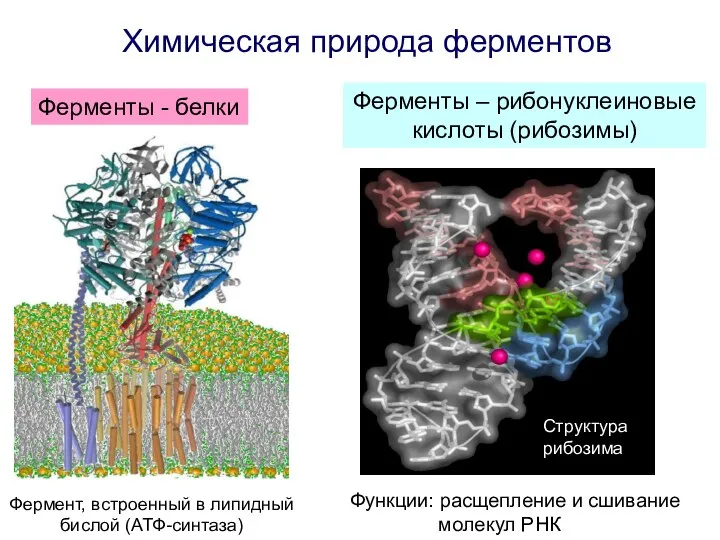
- 8. Химическая природа ферментов Ферменты - белки Ферменты – рибонуклеиновые кислоты (рибозимы) Функции: расщепление и сшивание молекул
- 9. Ферменты Простые Сложные Белковые вещества Кофактор (ацетил-КоА) Ацетилтрансфераза
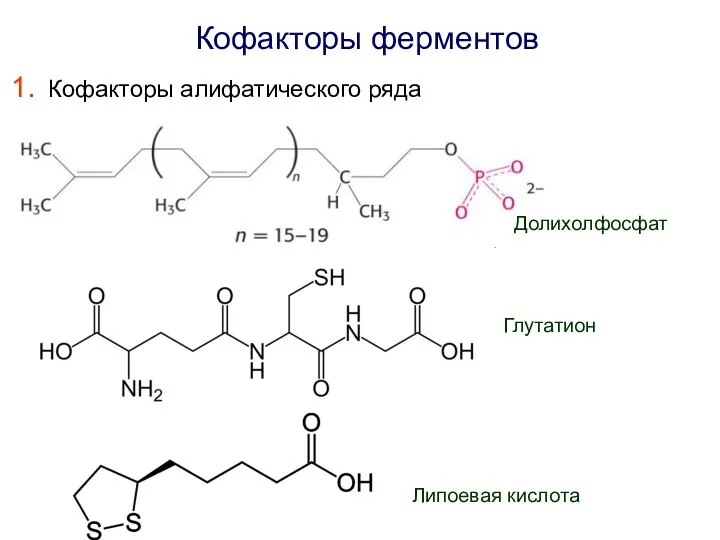
- 10. Кофакторы ферментов Кофакторы алифатического ряда Липоевая кислота Глутатион Долихолфосфат
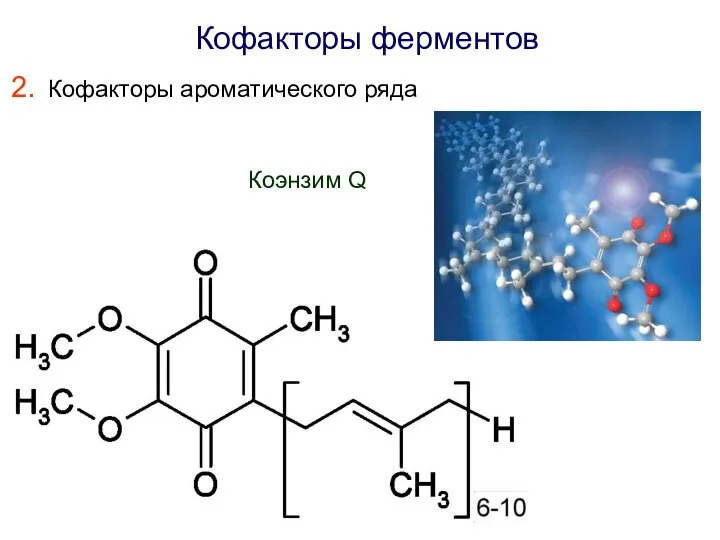
- 11. Кофакторы ферментов Кофакторы ароматического ряда Коэнзим Q
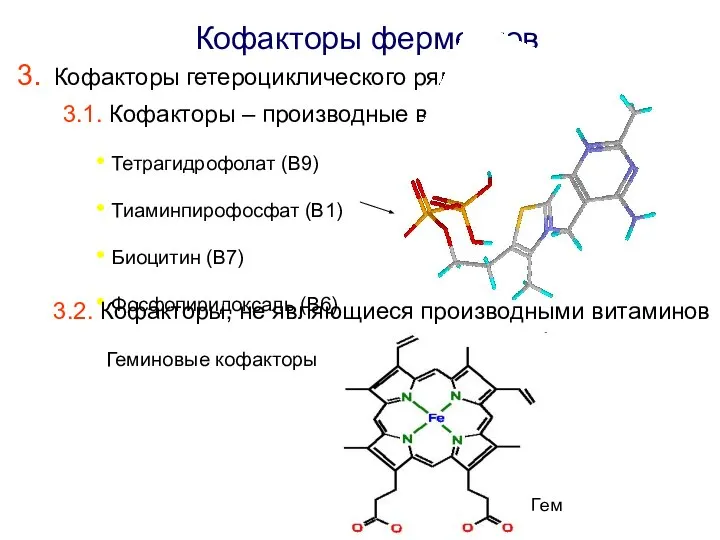
- 12. Кофакторы ферментов Кофакторы гетероциклического ряда 3.1. Кофакторы – производные витаминов Тетрагидрофолат (В9) Тиаминпирофосфат (В1) Биоцитин (В7)
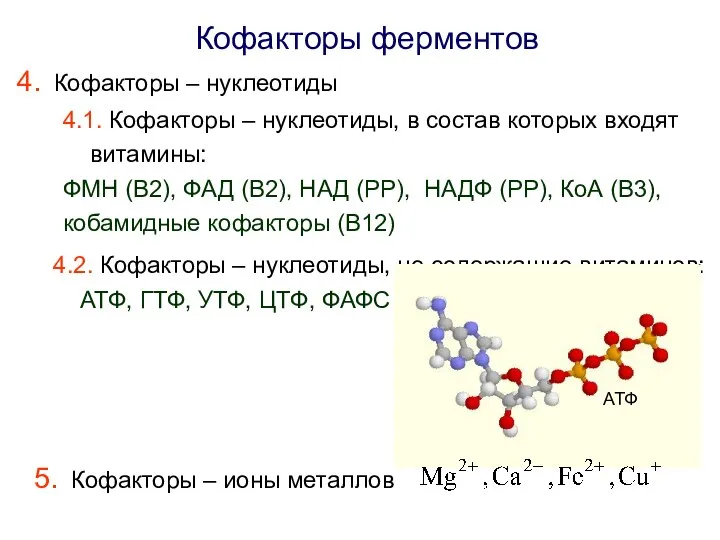
- 13. Кофакторы ферментов Кофакторы – нуклеотиды 4.1. Кофакторы – нуклеотиды, в состав которых входят витамины: ФМН (В2),
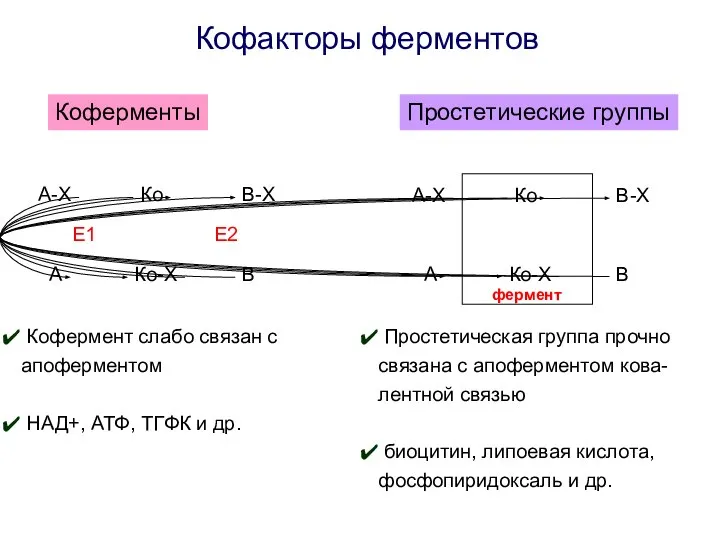
- 14. Кофакторы ферментов Коферменты Простетические группы Кофермент слабо связан с апоферментом НАД+, АТФ, ТГФК и др. фермент
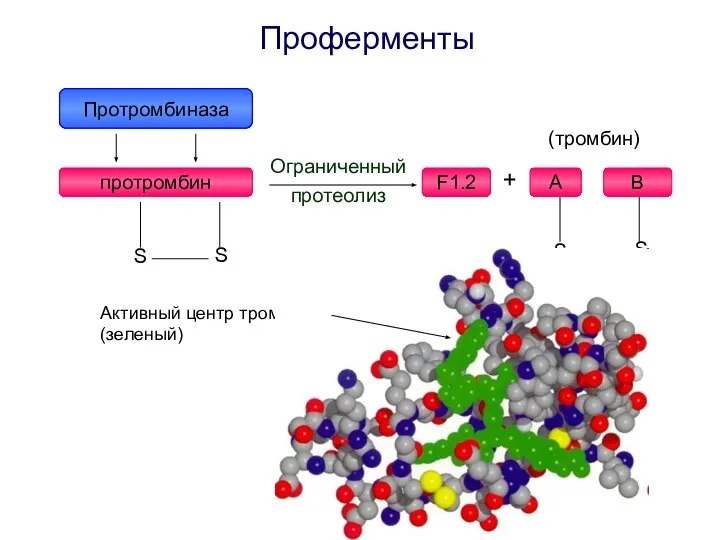
- 15. Проферменты Активный центр тромбина (зеленый)
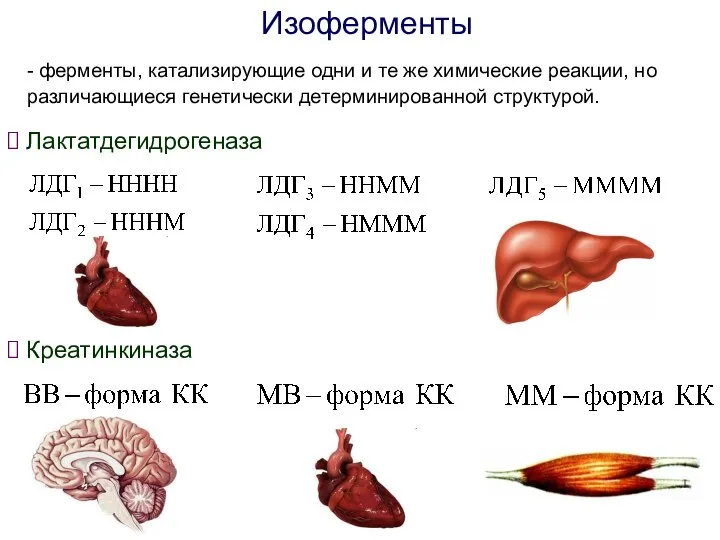
- 16. Изоферменты - ферменты, катализирующие одни и те же химические реакции, но различающиеся генетически детерминированной структурой. Лактатдегидрогеназа
- 17. Реакция с участием фермента E – фермент S – субстрат P – продукт реакции ES и
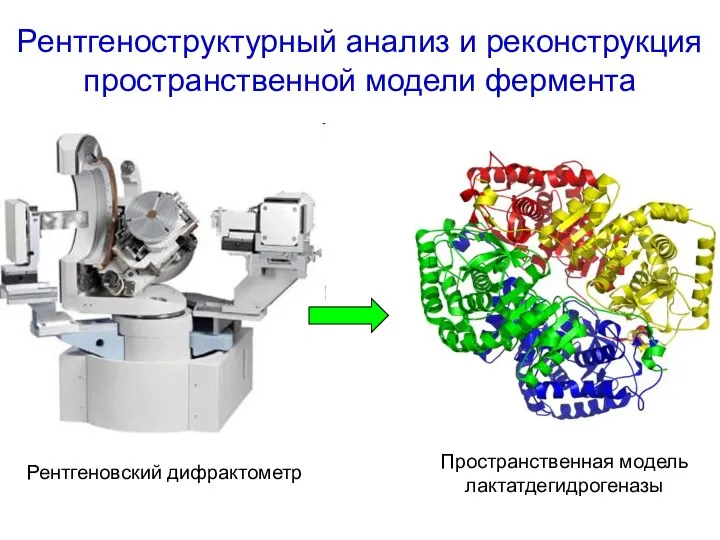
- 18. Рентгеноструктурный анализ и реконструкция пространственной модели фермента Рентгеновский дифрактометр Пространственная модель лактатдегидрогеназы
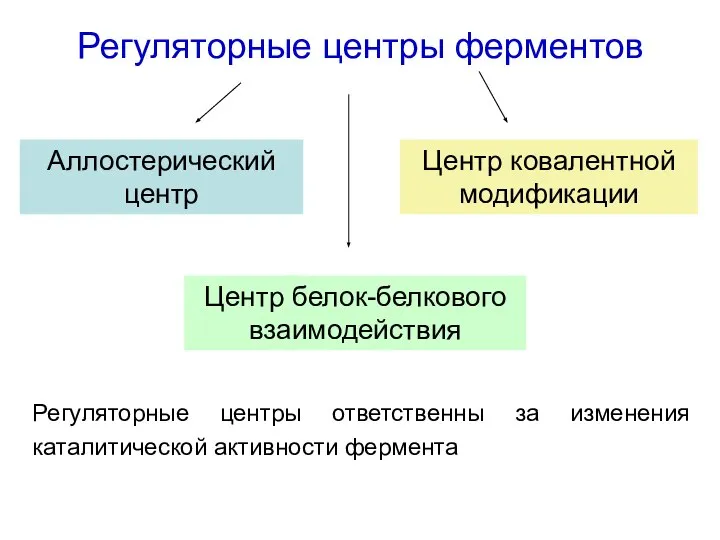
- 19. Функциональные центры ферментов Активный центр субстратный центр каталитический центр Регуляторные центры аллостерический центр центр ковалентной модификации
- 20. Активный центр Субстрат Активный центр химотрипсина со связанным субстратом. Активный центр – участок поверхности фермента, ответствен-ный
- 21. Специфическое связывание субстрата Осуществление химической реакции Высвобождение продуктов реакции Взаимодействие фермента с субстратом
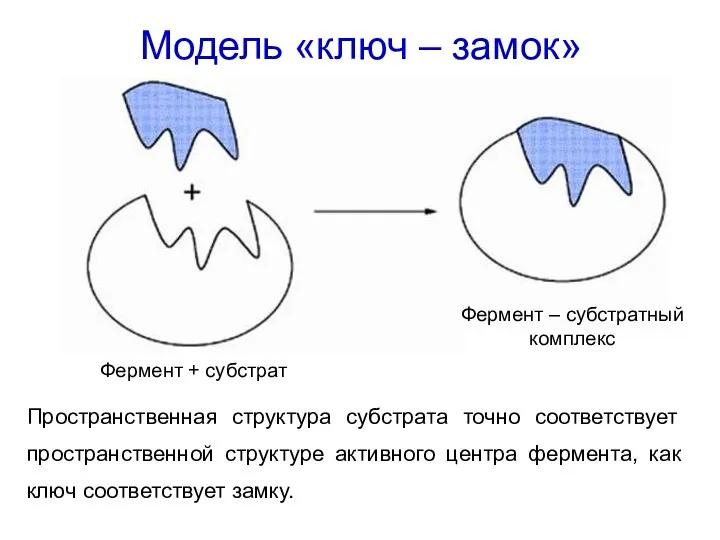
- 22. Модель «ключ – замок» Пространственная структура субстрата точно соответствует пространственной структуре активного центра фермента, как ключ
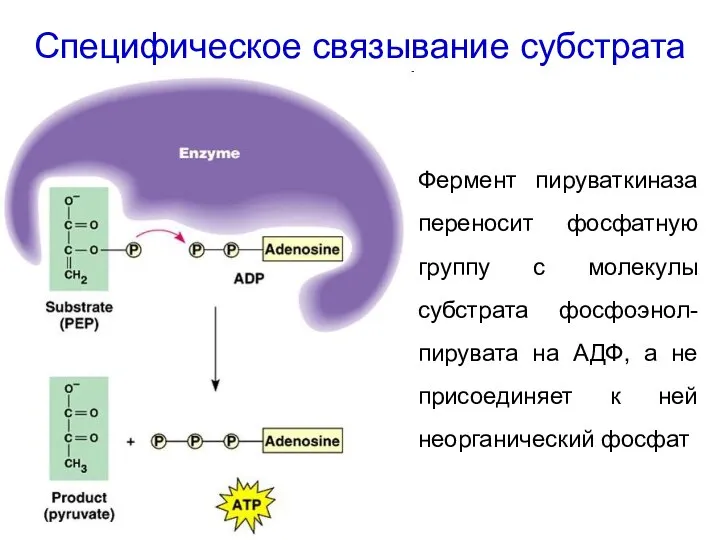
- 23. Специфическое связывание субстрата Фермент пируваткиназа переносит фосфатную группу с молекулы субстрата фосфоэнол-пирувата на АДФ, а не
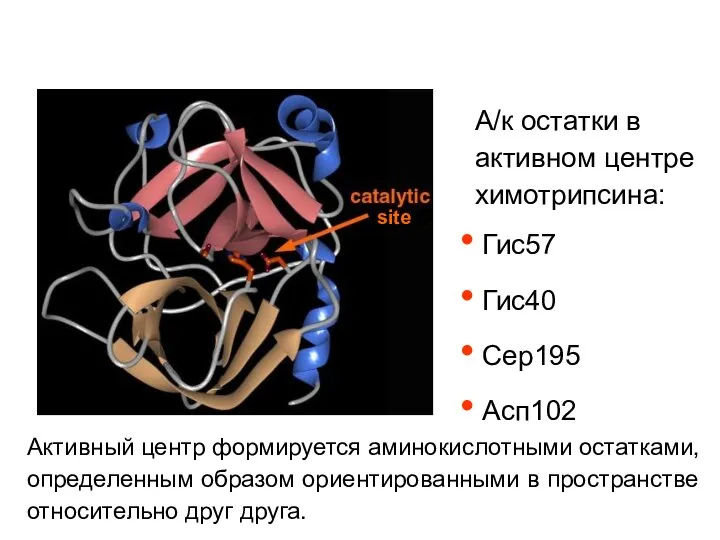
- 24. А/к остатки в активном центре химотрипсина: Гис57 Гис40 Сер195 Асп102 Активный центр формируется аминокислотными остатками, определенным
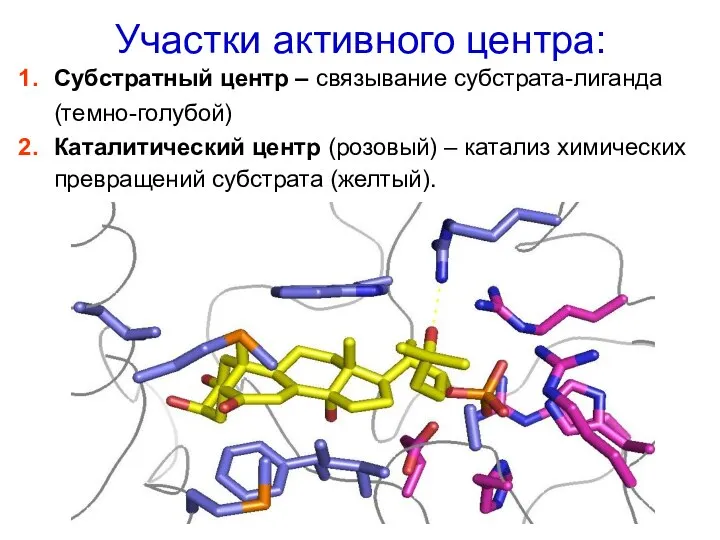
- 25. Участки активного центра: Субстратный центр – связывание субстрата-лиганда (темно-голубой) Каталитический центр (розовый) – катализ химических превращений
- 26. Функциональные группы, играющие важную роль в связывании субстрата и катализе Сер – OH Тир – OH
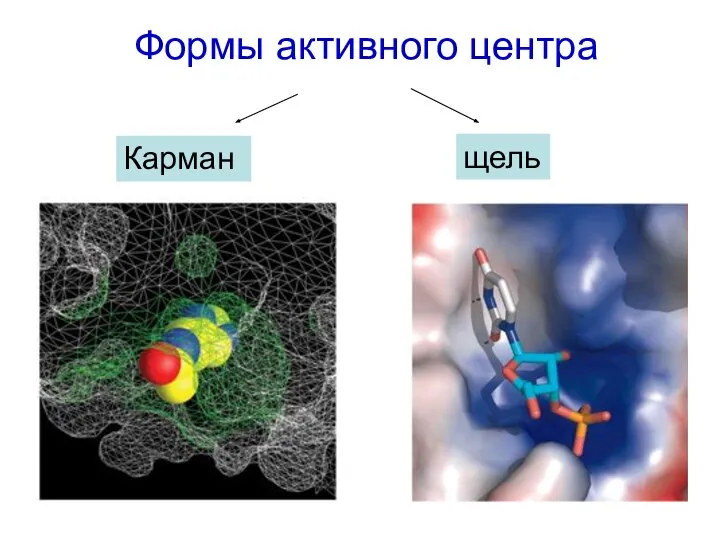
- 27. Формы активного центра Карман щель
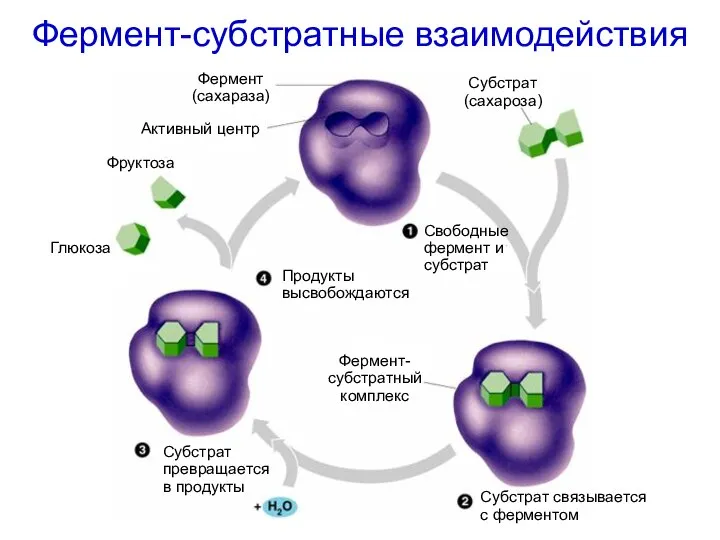
- 28. Фермент-субстратные взаимодействия Фермент (сахараза) Активный центр Субстрат (сахароза) Фруктоза Глюкоза Фермент-субстратный комплекс Свободные фермент и субстрат
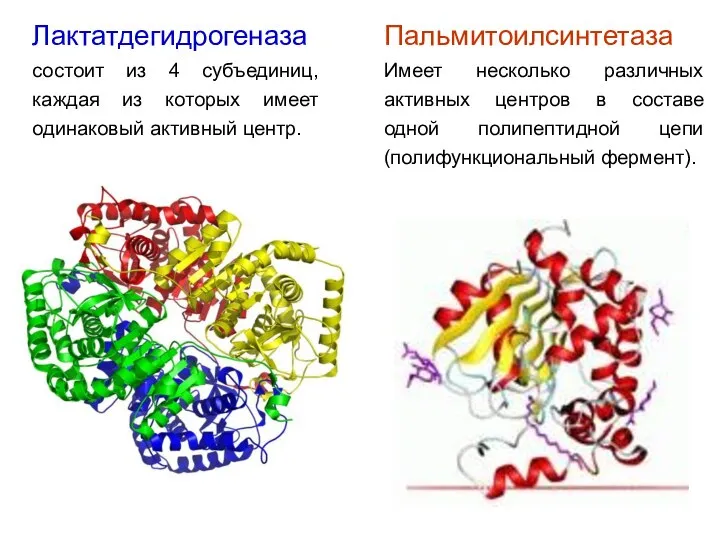
- 29. Лактатдегидрогеназа состоит из 4 субъединиц, каждая из которых имеет одинаковый активный центр. Пальмитоилсинтетаза Имеет несколько различных
- 30. Регуляторные центры ферментов Аллостерический центр Центр ковалентной модификации Центр белок-белкового взаимодействия Регуляторные центры ответственны за изменения
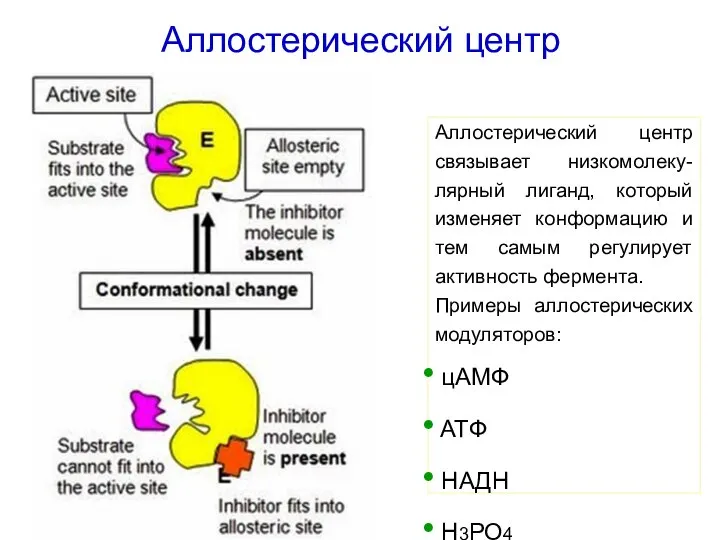
- 31. Аллостерический центр Аллостерический центр связывает низкомолеку-лярный лиганд, который изменяет конформацию и тем самым регулирует активность фермента.
- 32. Аллостерические модуляторы Аллостерический активатор – повышает каталитическую активность фермента. Аллостерический ингибитор – снижает каталитическую активность фермента.
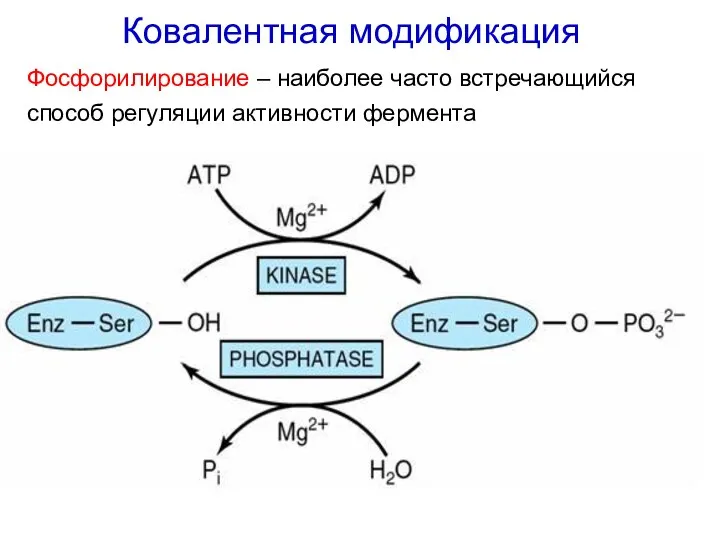
- 33. Ковалентная модификация Фосфорилирование – наиболее часто встречающийся способ регуляции активности фермента
- 34. Центр белок-белкового взаимодейсвия Регуляторный центр, в котором белок-регулятор (красный, A) взаимодействует с ферментом (зеленый, B). Например,
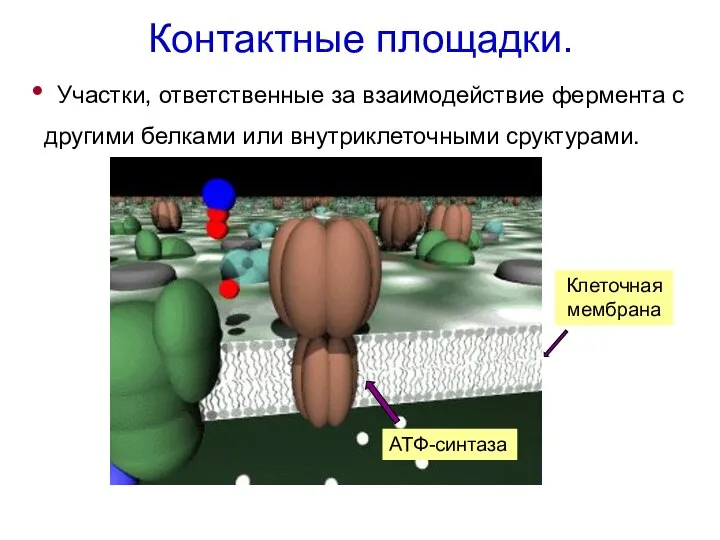
- 35. Контактные площадки. Участки, ответственные за взаимодействие фермента с другими белками или внутриклеточными сруктурами. Клеточная мембрана ATФ-синтаза
- 36. Механизм действия ферментов Евнутр Направление реакции Энергетический профиль катализируемой реакции Энергетический профиль прямой реакции Евнутр Энергетический
- 37. Ферменты – наиболее эффективные катализаторы Энергия активации
- 38. Каталитическая активность ферментов Единица количества фермента (Е) Скорость ферментативной реакции Катал (СИ) Катал – количество фермента,
- 39. Молекулярная активность (число оборотов) Молекулярная активность – это число молекул субстрата, превращаемых ферментом за 1 минуту
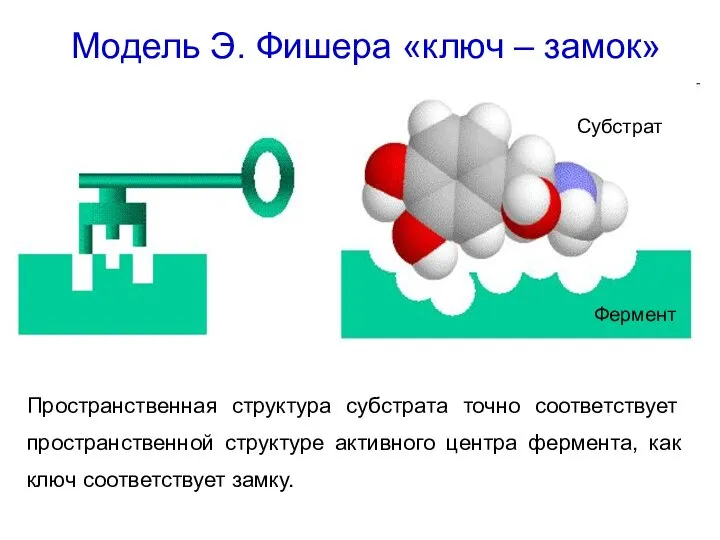
- 40. Модель Э. Фишера «ключ – замок» Пространственная структура субстрата точно соответствует пространственной структуре активного центра фермента,
- 41. Теория индуцированного соответствия Кошланда Пространственная структура активного центра лишь приблизительно комплементарна структуре субстрата, а их полная
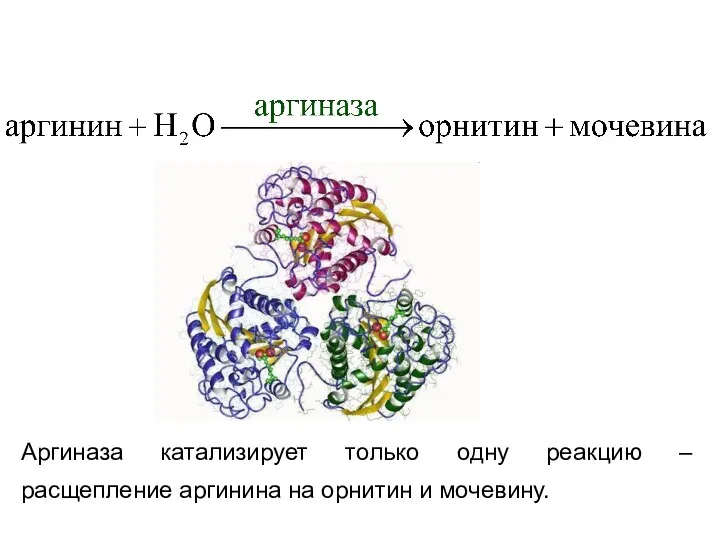
- 42. Аргиназа катализирует только одну реакцию – расщепление аргинина на орнитин и мочевину.
- 43. Трипсин гидролитически расщепляет пептидную связь, образованную с C-концевой аминокислотой (Лиз или Арг), только если она не
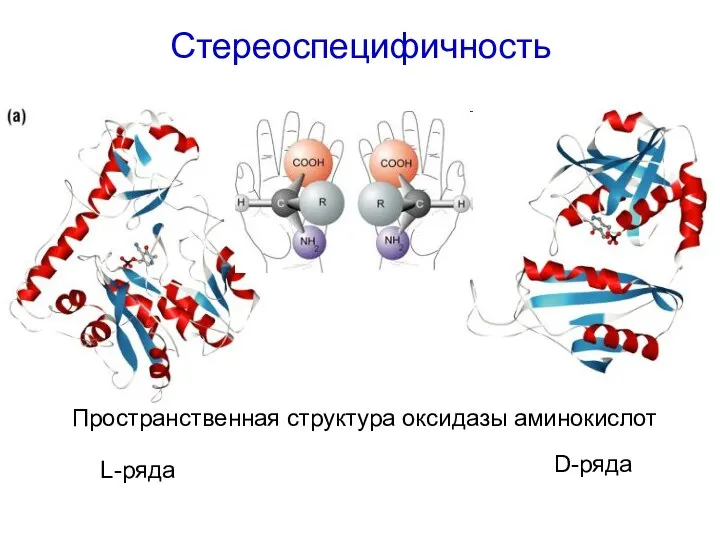
- 44. Стереоспецифичность L-ряда D-ряда Пространственная структура оксидазы аминокислот
- 45. Зависимость активности ферментов от температуры
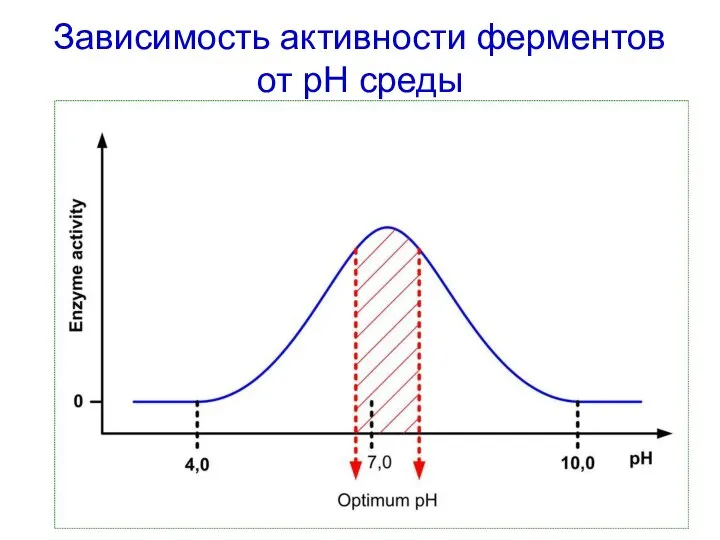
- 46. Зависимость активности ферментов от pH среды
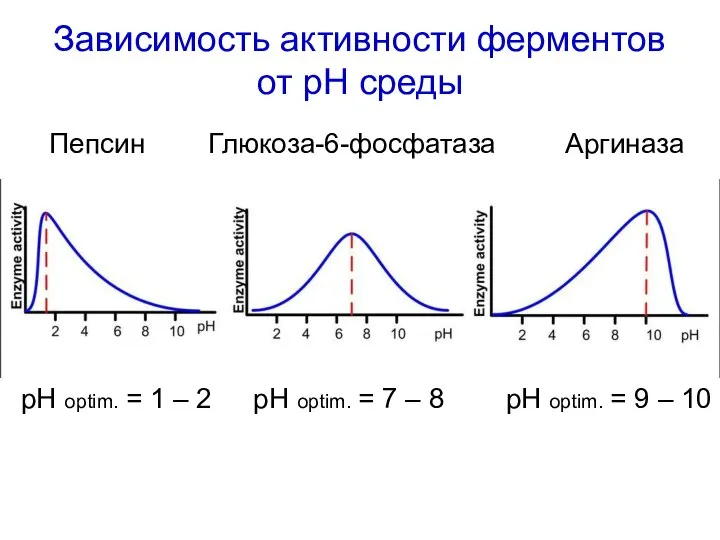
- 47. Пепсин Глюкоза-6-фосфатаза Аргиназа pH optim. = 1 – 2 pH optim. = 7 – 8 pH
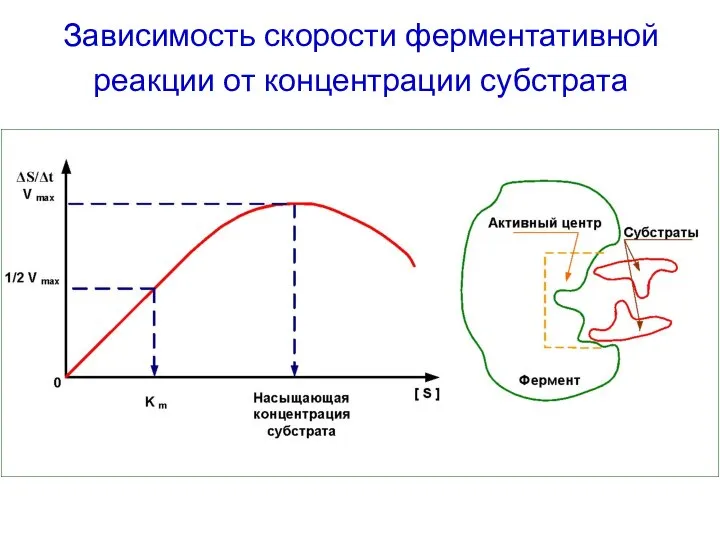
- 48. Зависимость скорости ферментативной реакции от концентрации субстрата В
- 49. Уравнение Михаэлиса-Ментен Km (константа Михаэлиса) характеризует сродство фермента к субстрату; она численно равна концентрации субстрата, при
- 50. Зависимость скорости ферментативной реакции от концентрации субстрата
- 51. Механизмы действия активаторов Активатор может вытеснять ингибитор или отщеплять его от фермента. Активатор может способствовать присоединению
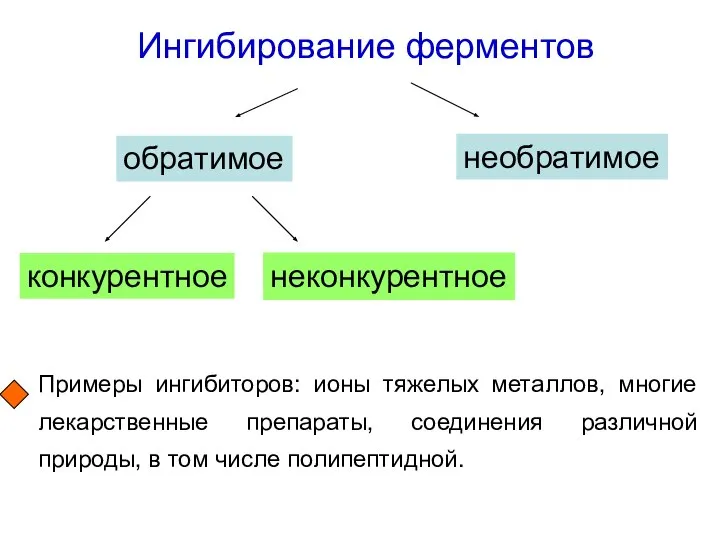
- 52. Ингибирование ферментов обратимое необратимое конкурентное неконкурентное Примеры ингибиторов: ионы тяжелых металлов, многие лекарственные препараты, соединения различной
- 53. Необратимое ингибирование Необратимый ингибитор ковалентно связывается с функциональной группой в активном центре фермента. Структура активного центра
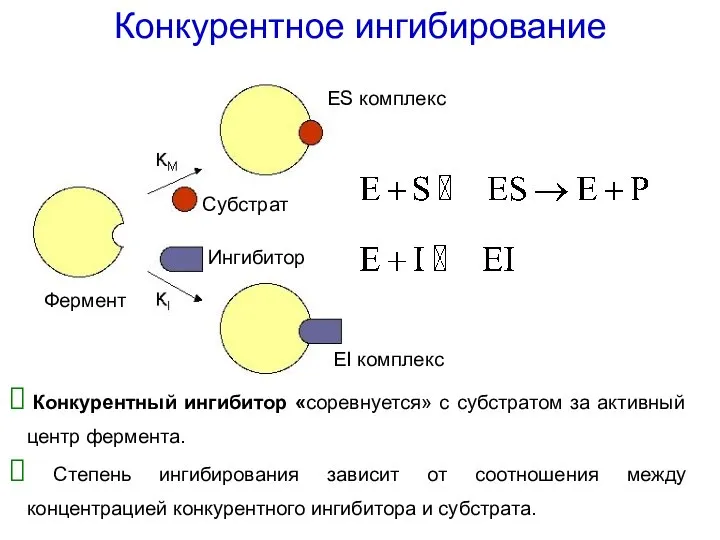
- 54. Конкурентное ингибирование Конкурентный ингибитор «соревнуется» с субстратом за активный центр фермента. Степень ингибирования зависит от соотношения
- 55. Конкурентное ингибирование Конкурентные ингибиторы сукцинатдегидрогеназы: малонат оксалоацетат
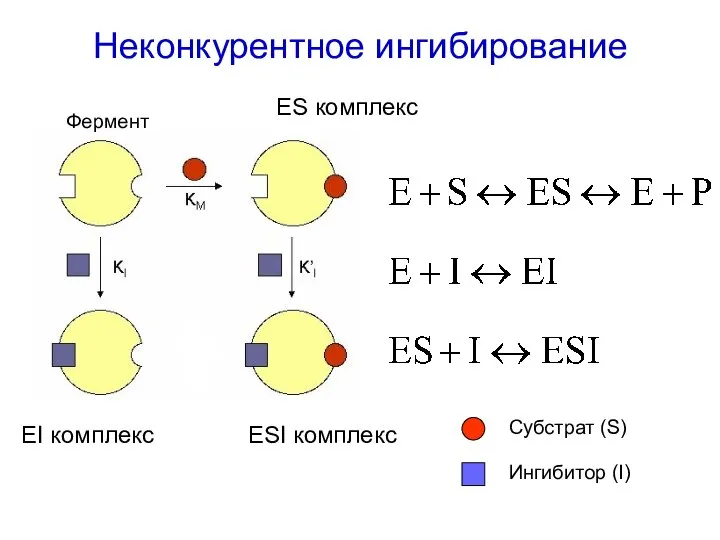
- 56. Неконкурентное ингибирование ES комплекс EI комплекс ESI комплекс Фермент Субстрат (S) Ингибитор (I)
- 57. Регуляция активности ферментов в клетках Срочное регулирование Длительное регулирование образование ферментов из их предшественников; аллостерическое ингибирование
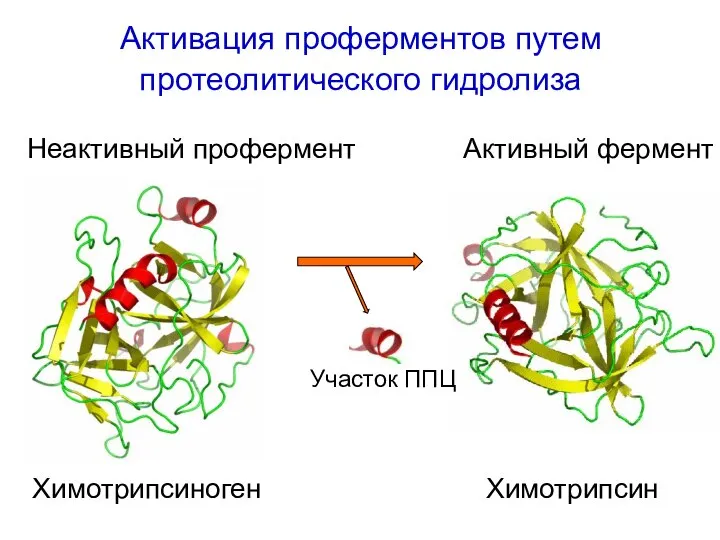
- 58. Активация проферментов путем протеолитического гидролиза Химотрипсиноген Химотрипсин Неактивный профермент Активный фермент Участок ППЦ
- 59. Аллостерическое модулирование работы ферментов
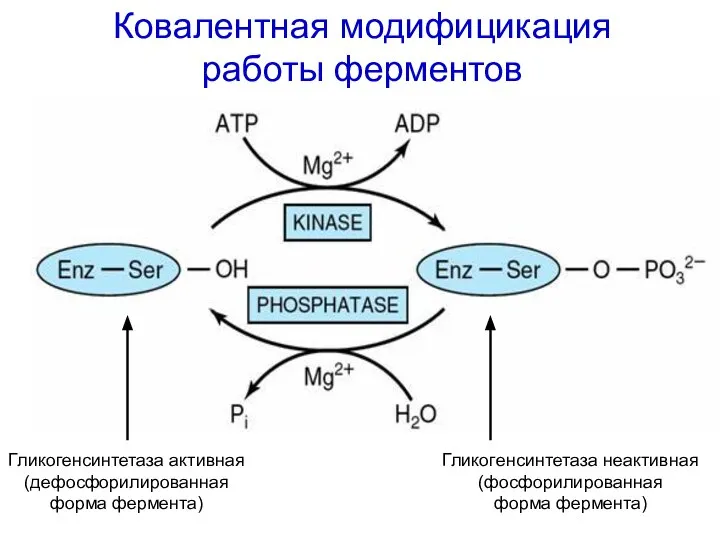
- 60. Ковалентная модифицикация работы ферментов Гликогенсинтетаза активная (дефосфорилированная форма фермента) Гликогенсинтетаза неактивная (фосфорилированная форма фермента)
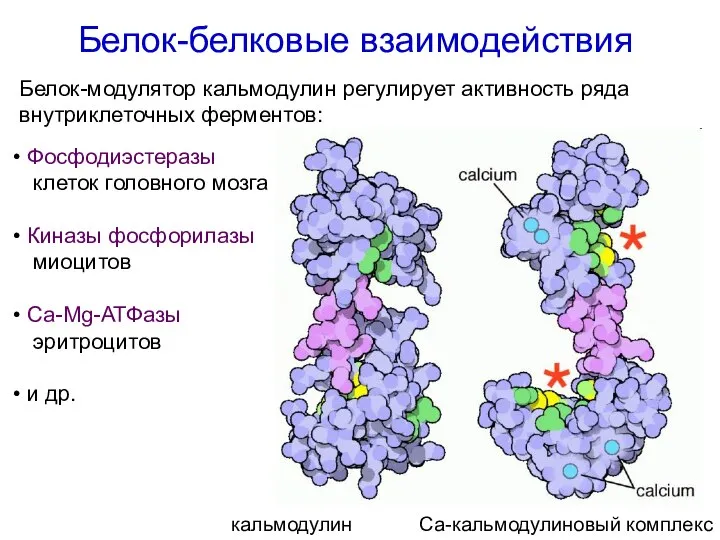
- 61. Белок-белковые взаимодействия кальмодулин Са-кальмодулиновый комплекс Белок-модулятор кальмодулин регулирует активность ряда внутриклеточных ферментов: Фосфодиэстеразы клеток головного мозга
- 63. Скачать презентацию

























 Біоінформатика та інформатика
Біоінформатика та інформатика Чудесные цветники весной
Чудесные цветники весной Царство Животные
Царство Животные Сцепленное наследование признаков – – Закон Томаса Моргана Курс «Общая биология» 9 класс Москва - 2009
Сцепленное наследование признаков – – Закон Томаса Моргана Курс «Общая биология» 9 класс Москва - 2009 Презентация на тему "В мире природы" - скачать бесплатно презентации по Биологии
Презентация на тему "В мире природы" - скачать бесплатно презентации по Биологии Автор Долгорукова С.В. учитель биологии и географии высшей категории МОУ гимназия № 2 г.Екатеринбурга
Автор Долгорукова С.В. учитель биологии и географии высшей категории МОУ гимназия № 2 г.Екатеринбурга  Генетика развития растений. Ауксины
Генетика развития растений. Ауксины Презентация на тему "Как живут животные" - скачать презентации по Биологии
Презентация на тему "Как живут животные" - скачать презентации по Биологии Астық тұқымдастар - бағалы азықтық өсімдіктер
Астық тұқымдастар - бағалы азықтық өсімдіктер Травы. Задание 37
Травы. Задание 37 Клеточная теория. Химический состав клетки. Углеводы. Липиды
Клеточная теория. Химический состав клетки. Углеводы. Липиды Хромосомная теория наследственности. Генетика пола
Хромосомная теория наследственности. Генетика пола Презентация на тему "Стебель,его строение и значение" - презентации по Биологии
Презентация на тему "Стебель,его строение и значение" - презентации по Биологии В гостях у леса. Экологическая игра
В гостях у леса. Экологическая игра Развитие Критического Мышления через Чтение и Письмо
Развитие Критического Мышления через Чтение и Письмо Скелет конечностей
Скелет конечностей Психофизиология стресса
Психофизиология стресса Морфология печени и поджелудочной желез
Морфология печени и поджелудочной желез Эмбриология. Периоды развития организма
Эмбриология. Периоды развития организма Урок 7. Корни и корневые системы Разработал: Лебедев С. Н., учитель биологии высшей категории
Урок 7. Корни и корневые системы Разработал: Лебедев С. Н., учитель биологии высшей категории Голонасінні рослини
Голонасінні рослини Метаболизм азотсодержащих соединений. Аминокислоты, аммиак, нуклеотиды, амины
Метаболизм азотсодержащих соединений. Аминокислоты, аммиак, нуклеотиды, амины Генетически-модифицированные организмы
Генетически-модифицированные организмы Возрастные особенности кровеносных сосудов
Возрастные особенности кровеносных сосудов Тварини Рекордсмени
Тварини Рекордсмени Презентация на тему "Особенности внутреннего строения птиц. Черты приспособленности птицё к полёту" - скачать презентации по
Презентация на тему "Особенности внутреннего строения птиц. Черты приспособленности птицё к полёту" - скачать презентации по Растения Южного Урала
Растения Южного Урала Органогенні елементи. Хімія в організмах
Органогенні елементи. Хімія в організмах