Содержание
- 2. ОСНОВНЫЕ ТЕРМИНЫ Ферменты - обычно сложные белковые соединения, РНК (рибозимы) или их комплексы, ускоряющие химические реакции
- 3. Ферменты синтезируются в виде линейной цепочки аминокислот, которая сворачивается определённым образом, и получающаяся молекула (белковая глобула)
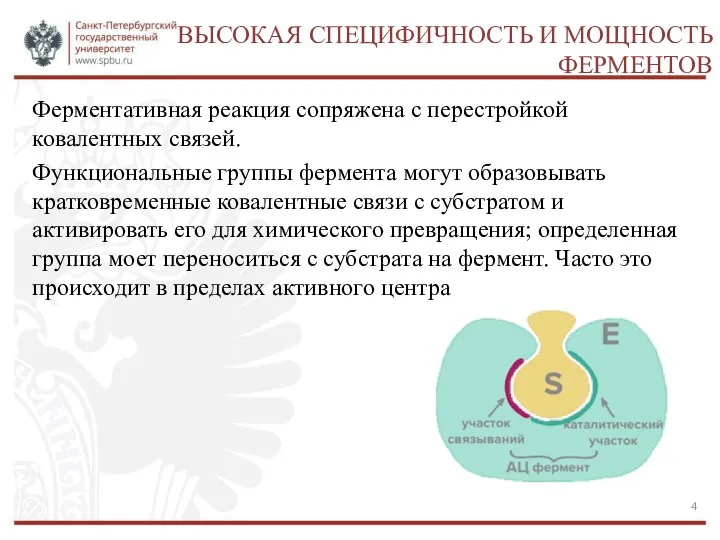
- 4. ВЫСОКАЯ СПЕЦИФИЧНОСТЬ И МОЩНОСТЬ ФЕРМЕНТОВ Ферментативная реакция сопряжена с перестройкой ковалентных связей. Функциональные группы фермента могут
- 5. По строению ферменты могут быть однокомпонентными, простыми белками, и двухкомпонентными, сложными белками. Во втором случае в
- 6. КОФАКТОРЫ – ИОНЫ МЕТАЛЛОВ Роль металлов в присоединении субстрата в активном центре фермента. Ионы металла выполняют
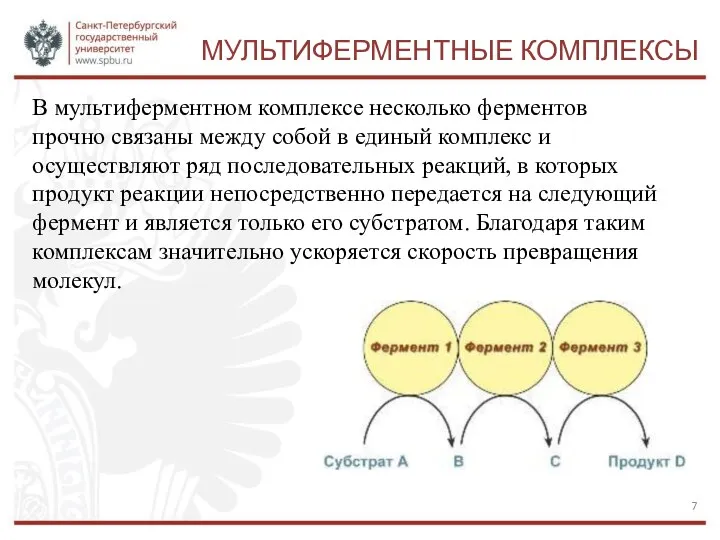
- 7. МУЛЬТИФЕРМЕНТНЫЕ КОМПЛЕКСЫ В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют
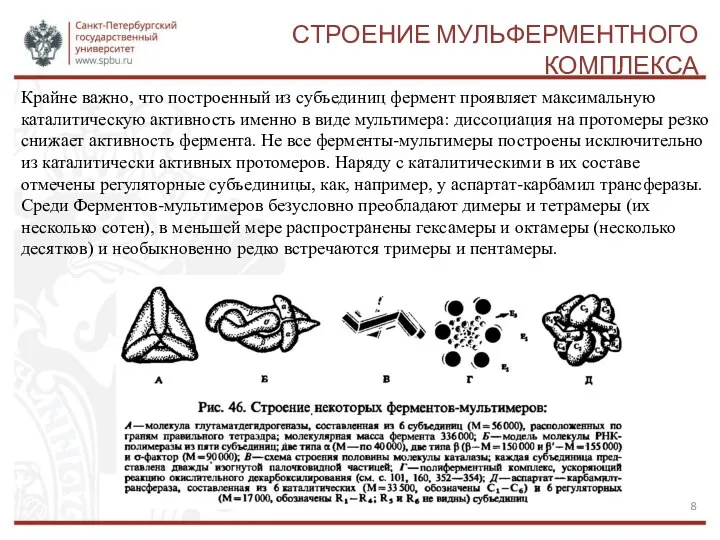
- 8. СТРОЕНИЕ МУЛЬФЕРМЕНТНОГО КОМПЛЕКСА Крайне важно, что построенный из субъединиц фермент проявляет максимальную каталитическую активность именно в
- 9. СТРОЕНИЕ МУЛЬФЕРМЕНТНОГО КОМПЛЕКСА Молекулы Ферментов-мультимеров в ряде случаев составлены из субъединиц двух типов, обозначаемых условно как
- 10. СПИСОК ЛИТЕРАТУРЫ https://studfile.net/preview/6659418/page:34/ Филиппович – Основы биохимии https://www.brsu.by/sites/default/files/e_editions/aab.pdf
- 12. Скачать презентацию






 Презентация на тему Ядовитая эволюция
Презентация на тему Ядовитая эволюция  Критерии вида
Критерии вида Презентация на тему Семейство Зонтичные
Презентация на тему Семейство Зонтичные  Биохимия печени
Биохимия печени Биология. 6 класс. Рабочая тетрадь
Биология. 6 класс. Рабочая тетрадь Что такое Красная книга? Красная книга - название списков редких и находящихся под угрозой исчезновения видов растений и живо
Что такое Красная книга? Красная книга - название списков редких и находящихся под угрозой исчезновения видов растений и живо К. Бэр, Р. Броун. Идеи и открытия
К. Бэр, Р. Броун. Идеи и открытия Генетика микроорганизмов
Генетика микроорганизмов Многообразие червей
Многообразие червей Лишайники
Лишайники Презентация на тему Генетика пола Генетика пола
Презентация на тему Генетика пола Генетика пола Обонятельный и вкусовой и кожный анализаторы
Обонятельный и вкусовой и кожный анализаторы Цитология. Методы изучения клетки
Цитология. Методы изучения клетки Микроскоп и его строение. Работа с микроскопом
Микроскоп и его строение. Работа с микроскопом Вид. Критерии вида. Популяция
Вид. Критерии вида. Популяция Проверочная работа по теме Семейства покрытосеменных растений
Проверочная работа по теме Семейства покрытосеменных растений Водоросли. Разнообразие водорослей
Водоросли. Разнообразие водорослей Эволюции организмов. Антропогенез. (Лекция 12)
Эволюции организмов. Антропогенез. (Лекция 12) Обмен и роль белков, жиров, углеводов
Обмен и роль белков, жиров, углеводов Гаметофиты и спорофиты
Гаметофиты и спорофиты Аттестационная работа. Огурчики дома
Аттестационная работа. Огурчики дома Презентация на тему "Бурые водоросли" - скачать презентации по Биологии
Презентация на тему "Бурые водоросли" - скачать презентации по Биологии Обмен энергии
Обмен энергии Природное и общественное в человеке (Человек как результат биологической и социокультурной эволюции)
Природное и общественное в человеке (Человек как результат биологической и социокультурной эволюции) Тритоны. Среда обитания
Тритоны. Среда обитания Введение в общую биологию
Введение в общую биологию Презентация на тему "Папоротники. Особенности строения и жизнедеятельности" - скачать презентации по Биологии
Презентация на тему "Папоротники. Особенности строения и жизнедеятельности" - скачать презентации по Биологии Pseudomonas and Nonfermenters
Pseudomonas and Nonfermenters