Содержание
- 3. Процесс убиквитинирования идет в 4 стадии 1 4 3 2
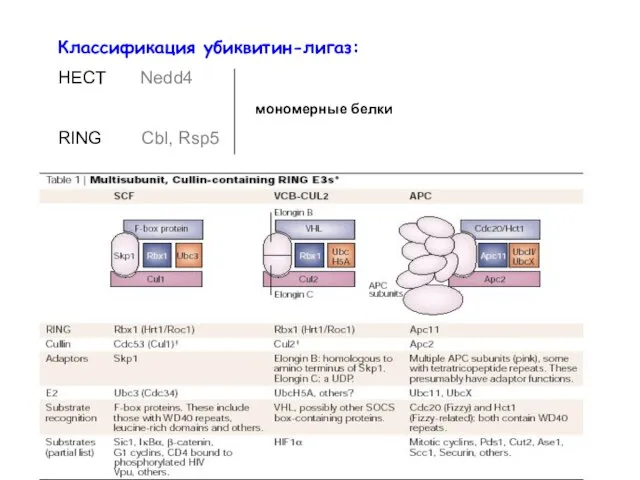
- 4. Классификация убиквитин-лигаз: HECT Nedd4 мономерные белки RING Cbl, Rsp5
- 5. Существует также ряд деубиквитинирующих ферментов (DUBs), как свободных, так и ассоциированных с протеасомами и эндосомами
- 6. Первоначально считали, что убиквитинирование служит сигналом деградации цитоплазматических белков на протеасомах 26S-протеасома Отдельные аминокислоты, пептиды и
- 7. В дальнейшем оказалось, что роль убиквитинирования гораздо шире
- 8. Убиквитин способен образовывать цепи с использованием различных лизиновых остатков Тип цепи определяет реакции, в которых участвует
- 9. Типы убиквитинирования белков Cargo proteins
- 10. Предположения о полиубиквитинировании тирозинкиназных рецепторов были основаны на том факте, что их деградация блокируется ингибиторами протеасом
- 11. Возможный механизм участия протеасом в регуляции сортировки рецепторов ЭФР на путь лизосомальной деградации
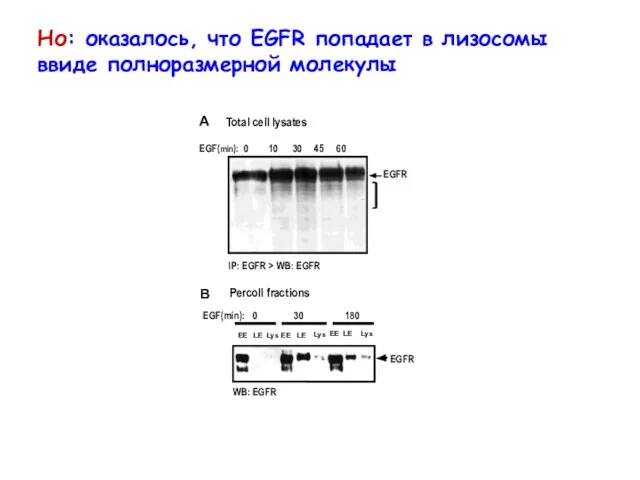
- 12. Но: оказалось, что EGFR попадает в лизосомы ввиде полноразмерной молекулы
- 13. Во-вторых, действие ингибиторов протеасом имеет два следствия: 1. В результате ингибирования функций протеасом в клетке накапливаются
- 14. Таким образом, протеасомы напрямую не участвуют в регуляции эндоцитоза В дальнейшем было показано, что рецепторы (также
- 16. Многие мембранные белки, подвергающиеся эндоцитозу, и белки, регулирующие разные стадии эндоцитозного пути, либо сами убиквитинированы, либо
- 17. Белки с доменами, узнающими убиквитин, участвующие в регуляции эндоцитозного пути EGFR Убиквитин-лигаза, убиквитинирует рецептор Регулирует рекрутирование
- 18. Белки с этими доменами сами моноубиквитинируются
- 19. Какова же роль убиквитинирования трансмембранных белков в их эндоцитозе?
- 20. Мультиубиквитинирование мембранного белка необходимо для доставки его во внутренние везикулы МВТ, что ведет к его деградации
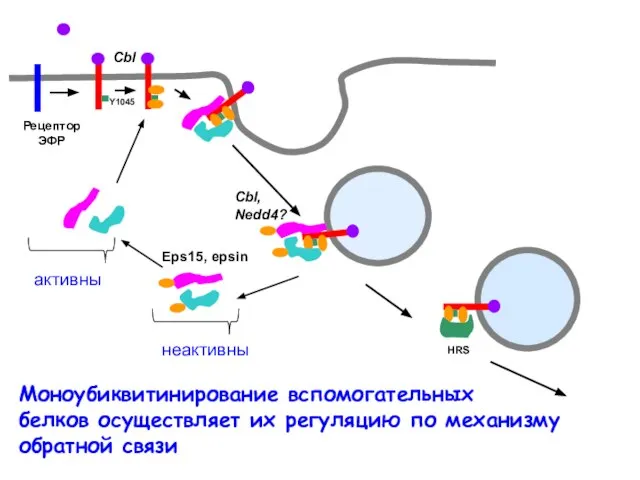
- 21. Cbl Cbl, Nedd4? Eps15, epsin Рецептор ЭФР Моноубиквитинирование вспомогательных белков осуществляет их регуляцию по механизму обратной
- 22. Убиквитин-зависимые механизмы, по всей видимости, вовлечены в образование «in-out» инвагинаций, поскольку компоненты той же системы, которая
- 23. c-Cbl и его партнеры Убиквитин-лигазы подвержены множественной регуляции Убиквитин-лигаза Nedd4 полиубиквитинирует с-Cbl и инициирует его протеасомную
- 24. Существуют и другие убиквитин-подобные системы (UBLs): Sumo1,2 Nedd8 – Ubl в этом случае может быть и
- 25. Аутофагия – цитопротекторный процесс, активируется при голодании (недостатке аминокислот), окислительном стрессе, накоплении неправильно упакованных белков При
- 26. Atg1-Atg13 + Atg11, 20, 24 > Ctv, путь лизосомной деградации + Atg17, 29, 31 > аутофагия
- 27. Atg8s {LC3 (microtubule-associated protein 1 light chain 3)} и GATE-16 (Golgi-associated ATPase enhancer)] рекрутируются и конъюгируются
- 28. Селекция груза в аутофагосому происходит с помощью аутофагических адапторов, узнающих убиквитинированные мишени. Неправильно свернутые убиквитинированные белки
- 29. Но: Возможен и убиквитин-независимый механизм доставки белков в лизосомы: в дрожжах найдено несколько белков, которые деградируют
- 30. Вопросы без ответа 1. Каковы молекулярные механизмы, с помощью которых клетка «чувствует « недостаток аминокислот, индуцирующий
- 31. АДФ-рибозилирование
- 32. Brefeldin A – fungal macrocyclic lactone Приводит к полной разборке аппарата Гольджи за счет растворения его
- 33. Дальнейшие исследования эффекта BFA показали: эндосомы и транс-Гольджи коллапсируют в области ЦОМТ Лизосомы медленно (в течение
- 35. Скачать презентацию





























 Презентация на тему "Класс паукообразных" - скачать презентации по Биологии
Презентация на тему "Класс паукообразных" - скачать презентации по Биологии Презентация____
Презентация____ Классификация пресмыкающихся
Классификация пресмыкающихся Химический состав клеток
Химический состав клеток Строение, функции и свойства мембраны
Строение, функции и свойства мембраны Физиология мозжечка
Физиология мозжечка Общие признаки хордовых животных. Подтип бесчерепные
Общие признаки хордовых животных. Подтип бесчерепные Нормована годівля коней
Нормована годівля коней Культурные растения
Культурные растения  Презентация на тему "Воробьинообразные" - скачать бесплатно презентации по Биологии
Презентация на тему "Воробьинообразные" - скачать бесплатно презентации по Биологии Биохимия ферментов
Биохимия ферментов Роль биологии в космических исследованиях Чтобы понять какова роль биологии в космических исследованиях мы должны обратиться
Роль биологии в космических исследованиях Чтобы понять какова роль биологии в космических исследованиях мы должны обратиться Филиал МБОУ Бейской ОШИ Новониколаевская ООШ Учитель химии и биологии Годлевская Л.А
Филиал МБОУ Бейской ОШИ Новониколаевская ООШ Учитель химии и биологии Годлевская Л.А Безвременник весёлый
Безвременник весёлый Презентация на тему "МНОГООБРАЗИЕ ПРОСТЕЙШИХ. ПАРАЗИТИЧЕСКИЕ" - скачать бесплатно презентации по Биологии
Презентация на тему "МНОГООБРАЗИЕ ПРОСТЕЙШИХ. ПАРАЗИТИЧЕСКИЕ" - скачать бесплатно презентации по Биологии Мухи и меры борьбы с ними
Мухи и меры борьбы с ними Презентация на тему Строение и многообразие лишайников
Презентация на тему Строение и многообразие лишайников  Мир растений. Наука о растениях
Мир растений. Наука о растениях Великий учёный и хирург Николай Иванович Пирогов
Великий учёный и хирург Николай Иванович Пирогов Презентация на тему "Строение кожи" - скачать презентации по Биологии
Презентация на тему "Строение кожи" - скачать презентации по Биологии Собака - лучший друг человека
Собака - лучший друг человека Презентация на тему Тип Кольчатые черви
Презентация на тему Тип Кольчатые черви  Пути достижения биологического прогресса (главные направления прогрессивной эволюции) Составитель Большаков С. В.
Пути достижения биологического прогресса (главные направления прогрессивной эволюции) Составитель Большаков С. В.  Энергетический обмен в клетке
Энергетический обмен в клетке Гаметогенез у растений и животных. Спорогенез и гаметогенез у растений. Стадии гаметогенеза человека
Гаметогенез у растений и животных. Спорогенез и гаметогенез у растений. Стадии гаметогенеза человека Органы чувств
Органы чувств Когнитивное обучение
Когнитивное обучение Презентация на тему ЦВЕТОК .
Презентация на тему ЦВЕТОК .