История возникновения GMP
История GMP начинается с 1963 года в США, где
были разработаны специальные правила, регламентирующие условия качественного и безопасного производства лекарств - стандарт Good Manufacturing Practice (GMP), в которые впоследствии вносились дополнения (в 1965, 1971, 1978, 1987, 1992 годах).
А первый международный документ по GMP, разработанный специалистами ВОЗ, появился в 1968 году. Чуть позже - в 1969 году была принята резолюция ВОЗ, которая предписывала применять правила GMP всем странам.







 Социально-трудовые отношения как система
Социально-трудовые отношения как система Система планів, які діють у лісогосподарському виробництві
Система планів, які діють у лісогосподарському виробництві Проектирование придорожной СТО легковых автомобилей
Проектирование придорожной СТО легковых автомобилей Макроэкономика после Дж.М. Кейнса
Макроэкономика после Дж.М. Кейнса Факторы производства
Факторы производства Научно-техническая безопасность и экономический рост
Научно-техническая безопасность и экономический рост Свободные экономические зоны в мировой экономике Филиппины и Тайланд
Свободные экономические зоны в мировой экономике Филиппины и Тайланд Инфляция. Основные источники инфляции:
Инфляция. Основные источники инфляции: Анализ развития города Тюмень
Анализ развития города Тюмень Издержки и производительность ресурсов
Издержки и производительность ресурсов Ефективна податкова система і оптимізація податкової політики в Україні
Ефективна податкова система і оптимізація податкової політики в Україні Суть логистического подхода
Суть логистического подхода Якість як об'єкт управління. Чинники, що впливають на якість харчових продуктів
Якість як об'єкт управління. Чинники, що впливають на якість харчових продуктів Экономика предприятия. Нормирование труда. (Лекция 10)
Экономика предприятия. Нормирование труда. (Лекция 10) Фирма и труд. Производный спрос. Спрос фирмы на труд
Фирма и труд. Производный спрос. Спрос фирмы на труд Россия и мир в XXI веке
Россия и мир в XXI веке Міграційні процеси в Україні
Міграційні процеси в Україні Основные понятия и сущность бестарифной системы оплаты труда
Основные понятия и сущность бестарифной системы оплаты труда Продовольственная проблема
Продовольственная проблема Презентация Культура Эпохи Просвещения. Романтизм.
Презентация Культура Эпохи Просвещения. Романтизм. Анализ ситуации на рынке энергоресурсов
Анализ ситуации на рынке энергоресурсов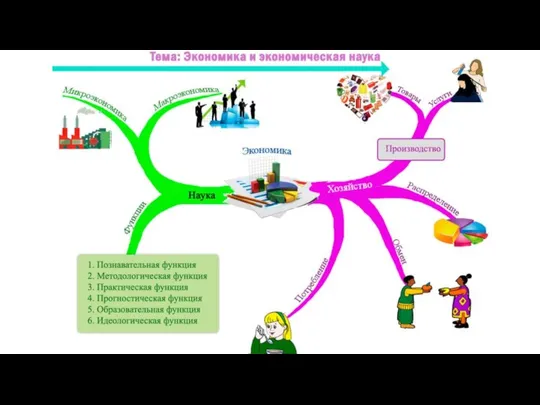 Экономика и экономическая наука
Экономика и экономическая наука Торгово-экономические отношения между Россией и Аргентиной
Торгово-экономические отношения между Россией и Аргентиной Мировая экономика и международная торговля
Мировая экономика и международная торговля Политические риски. Понятие и способы оценки. Модель пропорциональных рисков Кокса
Политические риски. Понятие и способы оценки. Модель пропорциональных рисков Кокса Экономическое развитие и инновационная экономика
Экономическое развитие и инновационная экономика Облік і контроль за центрами відповідальності. (Тема 11)
Облік і контроль за центрами відповідальності. (Тема 11) FairTrade
FairTrade