Содержание
- 2. Будова атома
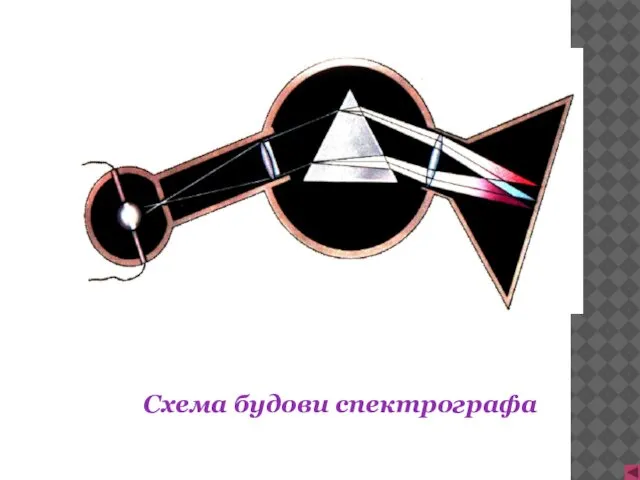
- 3. Схема будови спектрографа
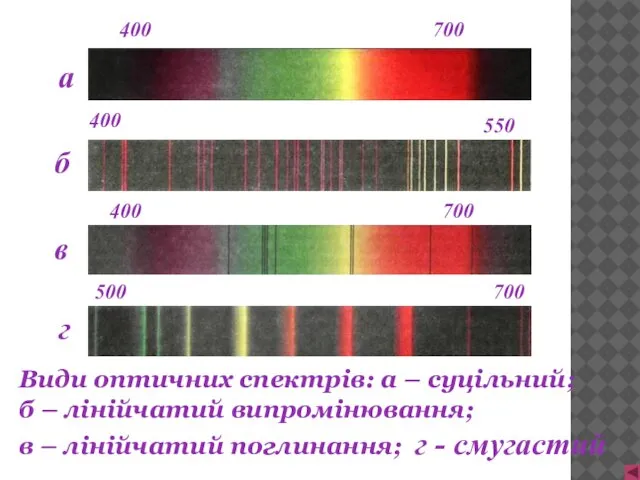
- 4. Види оптичних спектрів: а – суцільний; б – лінійчатий випромінювання; в – лінійчатий поглинання; г -
- 5. Закономірності в атомному спектрі водню 1885 р. Я. Бальмер – частоти видимої частини спектра де m
- 6. 1908 р. Пашен – частоти в інфрачервоній частині спектра де m може бути 4, 5, 6,…∞
- 7. 1 – мікроскоп, 2 – екран, 3 – свинцевий контейнер з радіоактивним препаратом, 4 – мішень
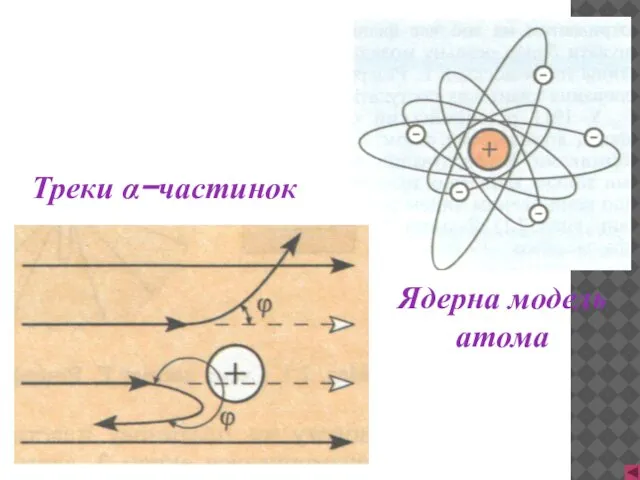
- 8. Треки α−частинок Ядерна модель атома
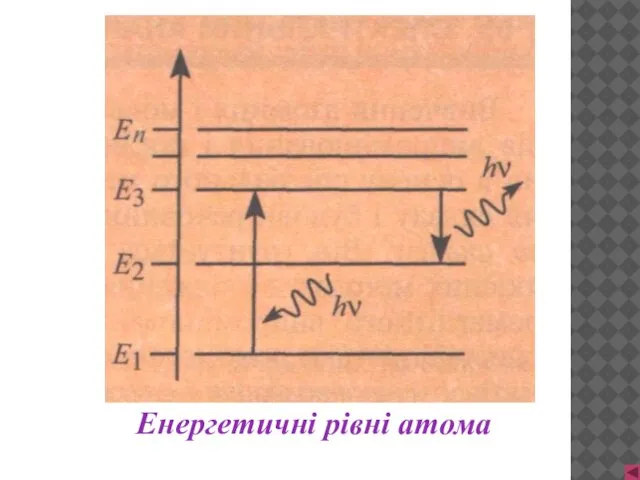
- 9. Енергетичні рівні атома
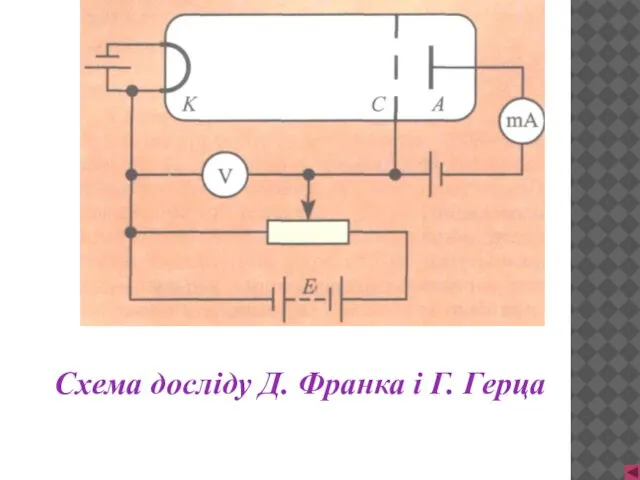
- 10. Схема досліду Д. Франка і Г. Герца
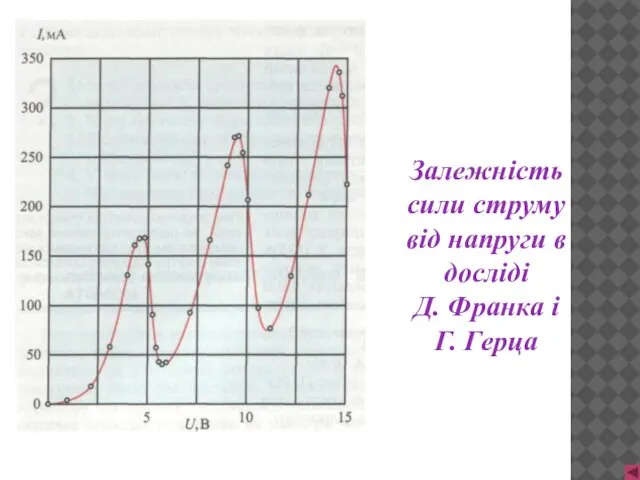
- 11. Залежність сили струму від напруги в досліді Д. Франка і Г. Герца
- 12. Склад атомного ядра
- 13. 1919 рік. Е. Резерфорд H 1 1 + → + – протон
- 14. 1932 рік. Д. Чедвік n 1 0 + → + – нейтрон
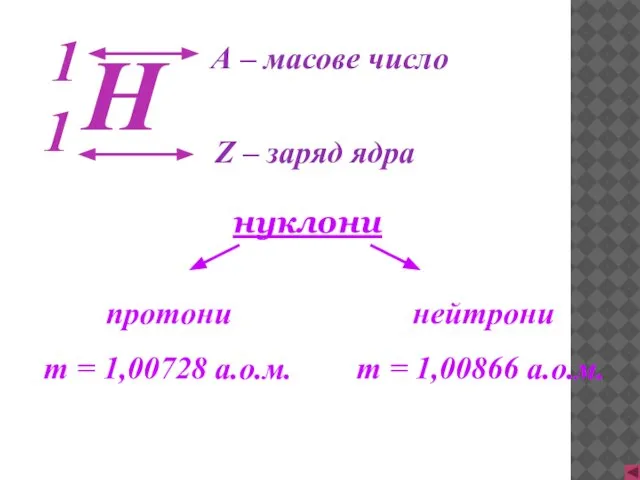
- 15. Z – заряд ядра А – масове число нуклони протони m = 1,00728 а.о.м. нейтрони m
- 16. кількість протонів у ядрі – Z кількість нейтронів – N = A – Z ізотопи Z
- 18. Скачать презентацию





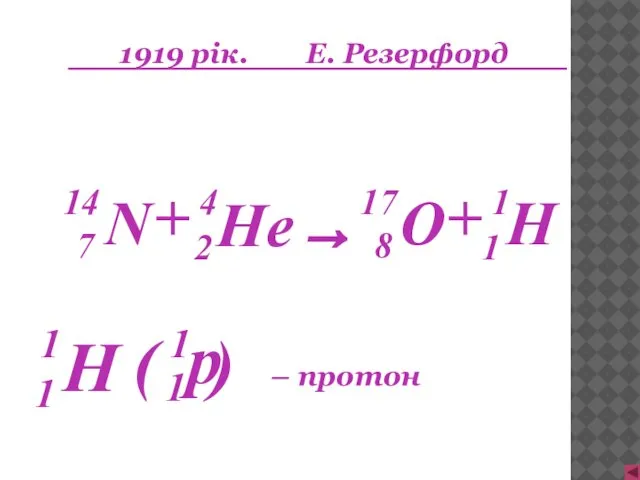
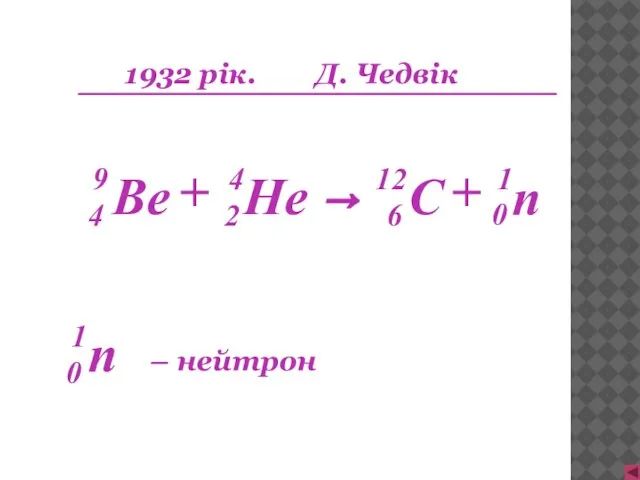

 План трассы. Вписывание круговых кривых с переходными кривыми
План трассы. Вписывание круговых кривых с переходными кривыми Електричний струм у різних середовищах
Електричний струм у різних середовищах Ускорение. Единица ускорения
Ускорение. Единица ускорения Устройство карданной передачи, разработка технологической карты
Устройство карданной передачи, разработка технологической карты Пути повышения качества физической подготовки обучающихся на уроках физической культуры и во внеурочное время
Пути повышения качества физической подготовки обучающихся на уроках физической культуры и во внеурочное время Lektsia_II_03_MekhMat_2022
Lektsia_II_03_MekhMat_2022 Особенности химии, связанные с её физикализацией. Дифференциация и интеграция науки
Особенности химии, связанные с её физикализацией. Дифференциация и интеграция науки Модель строения твердых тел. Аморфные тела и кристаллы
Модель строения твердых тел. Аморфные тела и кристаллы Механические колебания. Гармонические колебания
Механические колебания. Гармонические колебания Передача энергии посредством электромагнитной индукции
Передача энергии посредством электромагнитной индукции Количественный хроматографический анализ
Количественный хроматографический анализ Законы термодинамики. Работа в термодинамике. Работа газа при бесконечно малом перемещении поршня:
Законы термодинамики. Работа в термодинамике. Работа газа при бесконечно малом перемещении поршня: Постоянный электрический ток. Электрический ток, сила и плотность тока
Постоянный электрический ток. Электрический ток, сила и плотность тока КПД тепловой машины
КПД тепловой машины Пьезоэлектрический преобразователь с оптическим управлением
Пьезоэлектрический преобразователь с оптическим управлением Профессия автомеханик
Профессия автомеханик Путь к познанию человеческого организма
Путь к познанию человеческого организма Экзамен по электротехнике
Экзамен по электротехнике Презентация по физике Силы в природе
Презентация по физике Силы в природе  Самоиндукция. Индуктивность
Самоиндукция. Индуктивность Потенциальная и кинетическая энергия
Потенциальная и кинетическая энергия 01-естествознание (1)
01-естествознание (1) История развития электрического освещения
История развития электрического освещения Решение задач на равновесие плоской произвольной системы сил. Практическое занятие
Решение задач на равновесие плоской произвольной системы сил. Практическое занятие Меры времени, длины, тяжести
Меры времени, длины, тяжести Катодные лучи. Открытие электрона. Экспериментальное определение удельного заряда электрона. АФ1.2
Катодные лучи. Открытие электрона. Экспериментальное определение удельного заряда электрона. АФ1.2 Магнетизм. ЭМ колебания и волны
Магнетизм. ЭМ колебания и волны Техническое обслуживание автомобильной техники
Техническое обслуживание автомобильной техники